修回日期: 2014-11-30
接受日期: 2014-12-18
在线出版日期: 2015-02-18
目的: 探讨Sirtinol联合K-ras基因RNA干扰对胰腺癌PANC-1细胞增殖和凋亡的影响.
方法: 用50 μmol/mL的Sirtinol和50 nmol K-ras siRNA处理胰腺癌PANC-1细胞48 h, 分为C组(无加药处理), K组(加K-ras siRNA处理), S组(加Sirtinol处理), (K+S)组(加K-ras siRNA和Sirtinol处理); Western blot检测SIRT1蛋白的表达情况, Q-PCR检测K-ras mRNA水平和周期蛋白Cyclin D1 mRNA水平, MTT检测细胞的增殖活力, 流式细胞仪检测细胞的凋亡情况.
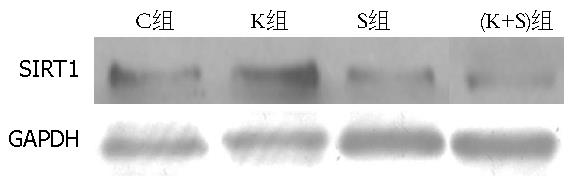
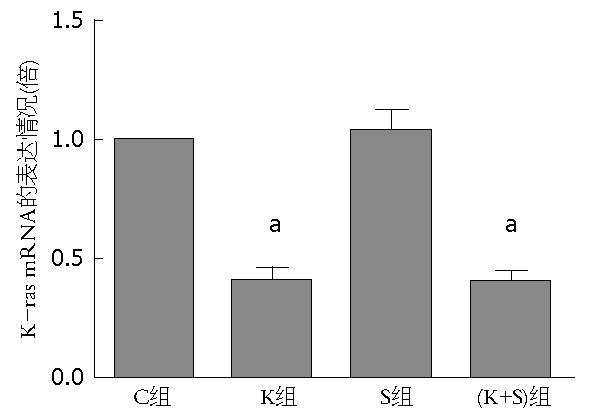
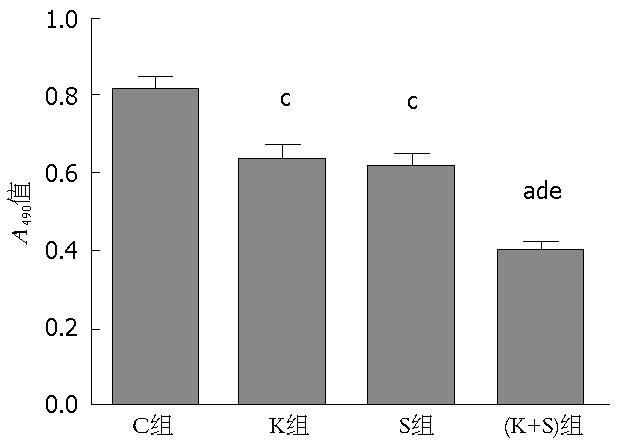
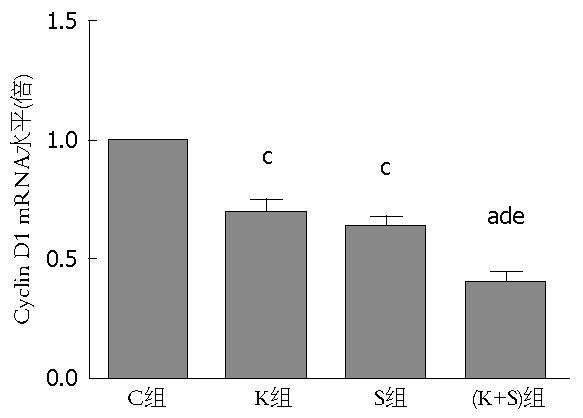
结果: Western blot结果显示相对于C组和K组, S组和(K+S)组中的SIRT1蛋白的表达明显下降; Q-PCR结果显示K组和(K+S)组中的K-ras mRNA水平分别是C组的0.454±0.037、0.413±0.032倍, 差异具有统计意义; MTT结果显示C组、K组、S组和(K+S)组的A值分别是0.814±0.025、0.634±0.038、0.613±0.036、0.401±0.019, 相对于C组, K组、S组和(K+S)组的A值明显下降, 其中(K+S)组最明显; Q-PCR结果显示K组、S组和(K+S)组中的Cyclin D1 mRNA水平分别是C组的0.693倍±0.046倍、0.634倍±0.032倍、0.400倍±0.034倍, 差异具有统计学意义, 其中(K+S)组下降最明显; 流式细胞仪显示C组、K组、S组和(K+S)组的凋亡率分别是4.29%±0.246%、7.469%±0.457%、8.206%±0.490%、12.272%±0.675%, 相对于C组, K组、S组和(K+S)组的凋亡率明显上升, 其中(K+S)组最明显.
结论: Sirtinol联合K-ras siRNA可以更明显的抑制胰腺癌PANC-1细胞的增殖和促进其凋亡.
核心提示: 本研究通过Western blot结果显示相对于无加药处理组(C组)和加K-ras siRNA处理组(K组), 加Sirtinol处理(S组)和(K+S)组中的SIRT1蛋白的表达明显下降, 说明Sirtinol可以明显抑制SIRT1蛋白的表达; Q-PCR结果显示K组和(K+S)组中的K-ras mRNA水平分别是C组的0.454倍±0.037倍、0.413倍±0.032倍, 差异具有统计意义, 说明K-ras siRNA可以明显抑制K-ras mRNA的表达.
引文著录: 许进军, 甘宁. Sirtinol联合K-ras基因RNA干扰对胰腺癌PANC-1细胞增殖和凋亡的影响. 世界华人消化杂志 2015; 23(5): 767-771
Revised: November 30, 2014
Accepted: December 18, 2014
Published online: February 18, 2015
AIM: To investigate the effect of simultaneous Sirtinol and K-ras knockdown on the proliferation and apoptosis of pancreatic cancer PANC-1 cells.
METHODS: PANC-1 cells were divided into three groups and treated with 50 μmol/L Sirtinol (S), 50 nmol K-ras siRNA (K), and 50 μmol/L Sirtinol plus 50 nmol K-ras siRNA (K + S) for 48 h, respectively. Non-treated cells were used as a normal control (C). The expression level of SIRT1 protein was measured by Western blot. The expression levels of K-ras and Cyclin D1 mRNAs were measured by Q-PCR. Cell proliferation was detected by MTT assay. Cell apoptosis was detected by flow cytometry.
RESULTS: Western blot analysis showed that the expression of SIRT1 decreased significantly in the S group and K + S group, compared with the C group and K group. Q-PCR showed that the K-ras mRNA level in the K group and K + S group was 0.454 ± 0.037 and 0.413 ± 0.032 times of that in the C group. MTT results showed that the A values in the K group, S group and K + S group were significantly decreased compared with the C group, with the K + S group decreasing most obviously. Q-PCR results showed that the Cyclin D1 mRNA level in the K group, S group and K + S group was 0.693 ± 0.046, 0.634 ± 0.032, and 0.400 ± 0.034 times of group C and the K + S group had the greatest reduction. Flow cytometry analysis showed that the apoptosis rates in the K group, S group and K + S group increased significantly compared with the C group (4.290% ± 0.246% vs 7.469% ± 0.457%, 8.206% ± 0.490% and 12.272% ± 0.675%), and the increase was most obvious in the K + S group.
CONCLUSION: Simultaneous Sirtinol and K-ras knockdown could induce cell proliferation inhibition and apoptosis in PANC-1 cells.
- Citation: Xu JJ, Gan N. Effect of simultaneous Sirtinol and K-ras knockdown on proliferation and apoptosis of pancreatic cancer PANC-1 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(5): 767-771
- URL: https://www.wjgnet.com/1009-3079/full/v23/i5/767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i5.767
胰腺癌是目前已知恶性程度最高的肿瘤之一, 他生长迅速, 据统计5年生存率不到5%, 并且难以早期诊断、早期转移率高, 目前唯一证实有效的治疗方法是手术切除[1,2]. 然而, 由于发现多为晚期, 只有少数患者有手术机会. 因此, 化疗是治疗胰腺癌最主要的辅助手段之一, 但不论是单药化疗还是联合化疗, 肿瘤对化疗药物的反应率都不高, 寻找新的靶点进行干预是胰腺癌治疗的研究热点[3-5]. 沉默信息调节因子-1(silent information regulator 1, SIRT1)是一种依赖于NAD+的Ⅲ型组蛋白去乙酰化酶, 作为代谢应激感受因子, 在细胞对抗衰老及凋亡中发挥重要作用[6,7]. 最近研究[8]发现SIRT1抑制剂Sirtinol可以通过下调SIRT1表达可抑制胰腺细胞的增殖和促进其凋亡. 另外, 有报道称K-ras基因是胰腺癌发生发展中最为重要的原癌基因, 可以激活下游信号通路, 调控细胞生长、增殖[9]. 对胰腺癌细胞株瞬时转染特异性siRNA可特异性干扰K-ras突变序列, 使细胞增殖受到抑制, 凋亡增加, 细胞周期停滞[10]. 那么Sirtinol联合K-ras基因RNA干扰是否可以进一步抑制胰腺癌细胞的增殖和促进其凋亡, 目前尚无相关报道.
Sirtinol购自Sigma公司; 胎牛血清、RPMI 1640购自美国Gibco公司; 胰腺细胞系PANC-1购自中国科学院上海细胞库; CCK-8细胞增殖检测试剂盒购自日本同仁化学研究所; siRNA Oligo及PCR引物均由上海吉玛制药技术有限公司合成.
1.2.1 细胞培养及处理: 胰腺癌PANC-1细胞培养于含10%胎牛血清的RPMI 1640培养液, 常规置于37 ℃、50 mL/L CO2培养箱中. 用50 μmol/mL的Sirtinol和50 nmol K-ras siRNA处理胰腺癌PANC-1细胞48 h, 分为C组(无加药处理)、K组(加K-ras siRNA处理)、S组(加Sirtinol处理)、(K+S)组(加K-ras siRNA和Sirtinol处理).
1.2.2 Western blot检测SIRT1蛋白的表达情况: 提取总蛋白, 用BCA法进行蛋白定量后, 加入5×SDS凝胶加样缓冲液, 沸水浴5 min, 按照蛋白定量结果进行加样, 行120 g/L SDS-聚丙烯酰胺凝胶电泳, 采用半干法将蛋白转移至硝酸纤维素膜上, 然后, 硝酸纤维素膜用脱脂奶封闭1 h, 加入一抗, 4 ℃过夜, 二抗于室温下孵育1 h, 用ECL发光, 胶片显色, 分析结果. 以β-actin作为内参照, 并设立对照组.
1.2.3 Q-PCR检测K-ras mRNA的表达情况: 用TRIzol提取细胞的总RNA, 逆转录获得cDNA, 荧光定量PCR过程使用SYBR® Premix Ex Taq™ Ⅱ (Perfect Real Time)试剂盒. 各引物序列如表1.
| 基因 | 引物(5'-3') | 产物大小(bp) |
| GAPDH | 5'-CAACTCCTCAAGTTGTACAA-3' | 118 |
| 5'-GGCATGACTGTGGTCATGA-3' | ||
| K-ras | 5'-GAGTACAGTGCAATGAGGGAC-3' | 208 |
| 5'-CCTGAGCCTGTTTTGTGTCTAC-3' | ||
| Cyclin D1 | 5'-CTGGCCATGAACTACCTAGA-3' | 213 |
| 5'-GTCACACTTGATCACTCTGG-3' |
1.2.4 MTT法检测细胞增殖情况: 取对数生长期细胞, 按每孔5×103个接种于96孔培养板中贴壁生长后, 给予不同处理, 48 h后加入MTT, 37 ℃孵育4 h后吸除培养液加入DMSO, 混匀后用酶标仪吸收度(A)值.
1.2.5 流式细胞术细胞: 以每孔4×105个接种于6孔板中, 各组处理细胞48 h后, 收集细胞, 用带有荧光素FITC的Annexin V和PI同时染色后, 2 h内用流式细胞仪检测, 根据结合量的变化可反映凋亡细胞的百分率.
统计学处理 用SPSS19.0统计软件进行分析. 数据均采用mean±SD表示, 多组间比较采用单因素方差分析(ANOVA), 组间两两比较采用最小显著性差异法(LSD法). P<0.05为差异有统计学意义.
Western blot结果显示相对于C组和K组, S组和(K+S)组中的SIRT1蛋白的表达明显下降(图1), 说明Sirtinol可以明显抑制SIRT1蛋白的表达.
Q-PCR结果显示K组和(K+S)组中的K-ras mRNA水平分别是C组的0.454倍±0.037倍、0.413倍±0.032倍, 差异具有统计意义(图2), 说明K-ras siRNA可以明显抑制K-ras mRNA的表达.
MTT结果显示C组、K组、S组和(K+S)组的A值分别是0.814±0.025、0.634±0.038、0.613±0.036、0.401±0.019, 相对于C组, K组、S组和(K+S)组的A值明显下降, 其中(K+S)组最明显(图3), 说明Sirtinol联合K-ras siRNA可以更明显的抑制胰腺癌PANC-1细胞的增殖.
Q-PCR结果显示K组、S组和(K+S)组中的Cyclin D1 mRNA水平分别是C组的0.693倍±0.046倍、0.634倍±0.032倍、0.400倍±0.034倍, 差异具有统计学意义, 其中(K+S)组下降最明显(图4), 说明Sirtinol联合K-ras siRNA可以更明显的抑制胰腺癌PANC-1细胞进入的增殖周期.
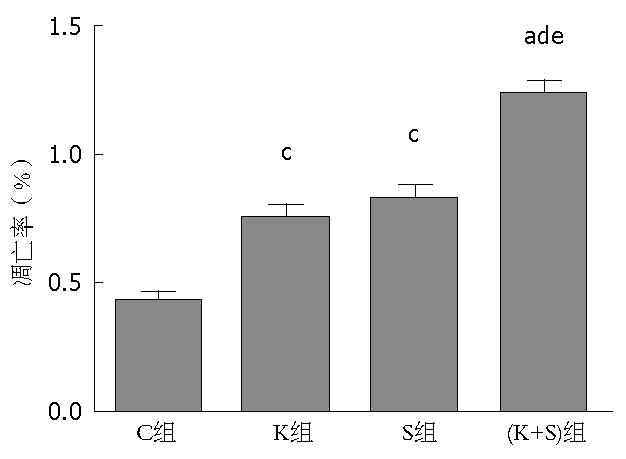
流式细胞仪显示C组、K组、S组和(K+S)组的凋亡率分别是4.290%±0.246%、7.469%±0.457%、8.206%±0.490%、12.272%±0.675%, 相对于C组, K组、S组和(K+S)组的凋亡率明显上升, 其中(K+S)组最明显(图5), 说明Sirtinol联合K-ras siRNA可以更明显的促进胰腺癌PANC-1细胞的凋亡.
胰腺癌, 作为一个多基因疾病和恶性程度极高的肿瘤, 众多的细胞毒性药物和分子靶向药物单独治疗胰腺癌并没有带来光明的前景[11]. 值得注意的是, 近来的癌症治疗进展开始致力于多重分子靶向治疗领域的研究[12]. 最近研究[8,10]发现SIRT1抑制剂Sirtinol可以通过下调SIRT1表达可抑制胰腺细胞的增殖和促进其凋亡, K-ras siRNA可特异性干扰K-ras mRNA水平从而激活下游信号通路抑制细胞生长和增殖. 本研究发现相对于单纯Sirtinol和K-ras siRNA作用, 联合Sirtinol和K-ras siRNA可以更加明显抑制胰腺癌PANC-1细胞的增殖和促进其凋亡.
在本研究中, 我们通过Western blot结果显示相对于C组和K组, S组和(K+S)组中的SIRT1蛋白的表达明显下降, 说明Sirtinol可以明显抑制SIRT1蛋白的表达; Q-PCR结果显示K组和(K+S)组中的K-ras mRNA水平分别是C组的0.454倍±0.037倍、0.413倍±0.032倍, 差异具有统计学意义, 说明K-ras siRNA可以明显抑制K-ras mRNA的表达; MTT结果显示C组、K组、S组和(K+S)组的A值分别是0.814±0.025、0.634±0.038、0.613±0.036、0.401±0.019, 相对于C组和K组、S组和(K+S)组的A值明显下降, 其中(K+S)组最明显, 说明Sirtinol联合K-ras siRNA可以更明显的抑制胰腺癌PANC-1细胞的增殖; Q-PCR结果显示K组、S组和(K+S)组中的Cyclin D1 mRNA水平分别是C组的0.693倍±0.046倍、0.634倍±0.032倍、0.400倍±0.034倍, 差异具有统计学意义, 其中(K+S)组下降最明显, 说明Sirtinol联合K-ras siRNA可以更明显的抑制胰腺癌PANC-1细胞进入的增殖周期; 流式细胞仪显示C组、K组、S组和(K+S)组的凋亡率分别是4.290%±0.246%、7.469%±0.457%、8.206%±0.490%、12.272%±0.675%, 相对于C组, K组、S组和(K+S)组的凋亡率明显上升, 其中(K+S)组最明显, 说明Sirtinol联合K-ras siRNA可以更明显的促进胰腺癌PANC-1细胞的凋亡.
先前有研究[13]表明SIRT1是与酵母菌长寿基因SIR2(silent information regulator 2)同源的基因, 主要分布在细胞核中, SIRT1通过P53的去乙酰化来阻止DNA损伤后P53依赖的CDKN1A(编码P21)和BAX的反式激活, 对调控细胞增殖和凋亡起关键的作用. 另外, 在所有的人类恶性肿瘤中, 胰腺癌的K-ras突变率是最高的, 多为12编码子的点突变. K-ras突变往往发生在胰腺癌的早期, 当K-ras突变时, 构型改变, 始终处于被激活的"锁定"状态, 不需外界生长信号就可以持续激活下游信号分子, 导致细胞无节制地异常增殖, 最终发生肿瘤[14,15]. 由此, 人们也希望将该位点作为胰腺癌早期治疗的新的靶点.
总之, 我们的研究结果证实了Sirtinol联合K-ras siRNA可以更明显地促进胰腺癌PANC-1细胞的凋亡、抑制其增殖. 这一研究为治疗胰腺癌提供了新的思路.
胰腺癌是目前已知恶性程度最高的肿瘤之一, 寻找新的靶点进行干预是胰腺癌治疗的研究热点. 最近研究发现沉默信息调节因子-1(silent information regulator 1, SIRT1)抑制剂可以通过下调SIRT1表达抑制胰腺细胞的增殖和促进其凋亡, 另外, 对胰腺癌细胞株瞬时转染特异性siRNA可特异性干扰K-ras突变序列, 使细胞增殖受到抑制, 凋亡增加, 细胞周期停滞.
崔云甫, 教授, 哈尔滨医科大学第二附属医院普外一科
分子生物的发展为肿瘤的治疗提供了新的策略, 相关分子抑制剂和相关基因的RNA干扰是目前研究的热点.
Sirtinol联合K-ras基因RNA干扰是否可以进一步抑制胰腺癌细胞的增殖和促进其凋亡, 目前尚未相关报道.
本研究设计合理, 结果可靠, 联合Sirtinol和K-ras siRNA为胰腺癌的治疗提供了新的思路.
编辑: 郭鹏 电编:都珍珍
| 1. | Pierantoni C, Pagliacci A, Scartozzi M, Berardi R, Bianconi M, Cascinu S. Pancreatic cancer: progress in cancer therapy. Crit Rev Oncol Hematol. 2008;67:27-38. [PubMed] [DOI] |
| 2. | Falasca M, Selvaggi F, Buus R, Sulpizio S, Edling CE. Targeting phosphoinositide 3-kinase pathways in pancreatic cancer--from molecular signalling to clinical trials. Anticancer Agents Med Chem. 2011;11:455-463. [PubMed] |
| 3. | Cunningham D, Chau I, Stocken DD, Valle JW, Smith D, Steward W, Harper PG, Dunn J, Tudur-Smith C, West J. Phase III randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer. J Clin Oncol. 2009;27:5513-5518. [PubMed] [DOI] |
| 4. | Gaglio D, Metallo CM, Gameiro PA, Hiller K, Danna LS, Balestrieri C, Alberghina L, Stephanopoulos G, Chiaradonna F. Oncogenic K-Ras decouples glucose and glutamine metabolism to support cancer cell growth. Mol Syst Biol. 2011;7:523. [PubMed] [DOI] |
| 5. | Jung-Hynes B, Nihal M, Zhong W, Ahmad N. Role of sirtuin histone deacetylase SIRT1 in prostate cancer. A target for prostate cancer management via its inhibition? J Biol Chem. 2009;284:3823-3832. [PubMed] [DOI] |
| 6. | Portmann S, Fahrner R, Lechleiter A, Keogh A, Overney S, Laemmle A, Mikami K, Montani M, Tschan MP, Candinas D. Antitumor effect of SIRT1 inhibition in human HCC tumor models in vitro and in vivo. Mol Cancer Ther. 2013;12:499-508. [PubMed] [DOI] |
| 7. | Wang J, Kim TH, Ahn MY, Lee J, Jung JH, Choi WS, Lee BM, Yoon KS, Yoon S, Kim HS. Sirtinol, a class III HDAC inhibitor, induces apoptotic and autophagic cell death in MCF-7 human breast cancer cells. Int J Oncol. 2012;41:1101-1109. [PubMed] [DOI] |
| 9. | Fleming JB, Shen GL, Holloway SE, Davis M, Brekken RA. Molecular consequences of silencing mutant K-ras in pancreatic cancer cells: justification for K-ras-directed therapy. Mol Cancer Res. 2005;3:413-423. [PubMed] |
| 10. | Zhao G, Cui J, Zhang JG, Qin Q, Chen Q, Yin T, Deng SC, Liu Y, Liu L, Wang B. SIRT1 RNAi knockdown induces apoptosis and senescence, inhibits invasion and enhances chemosensitivity in pancreatic cancer cells. Gene Ther. 2011;18:920-928. [PubMed] [DOI] |
| 11. | Wang RH, Sengupta K, Li C, Kim HS, Cao L, Xiao C, Kim S, Xu X, Zheng Y, Chilton B. Impaired DNA damage response, genome instability, and tumorigenesis in SIRT1 mutant mice. Cancer Cell. 2008;14:312-323. [PubMed] [DOI] |
| 13. | Aresu L, Giantin M, Morello E, Vascellari M, Castagnaro M, Lopparelli R, Zancanella V, Granato A, Garbisa S, Aricò A. Matrix metalloproteinases and their inhibitors in canine mammary tumors. BMC Vet Res. 2011;7:33. [PubMed] [DOI] |
| 14. | Ji B, Tsou L, Wang H, Gaiser S, Chang DZ, Daniluk J, Bi Y, Grote T, Longnecker DS, Logsdon CD. Ras activity levels control the development of pancreatic diseases. Gastroenterology. 2009;137:1072-1082, 1082.e1-6. [PubMed] [DOI] |