修回日期: 2014-12-23
接受日期: 2015-01-09
在线出版日期: 2015-02-18
目的: 观察氧化苦参碱(oxymatrine, OM)对脂多糖(lipopolysaccharide, LPS)诱导胰腺星状细胞(LTC-14细胞株)中核因子-κB(nuclear factor κB, NF-κB)表达和核易位的影响.
方法: 体外培养LTC-14细胞, 分别用相应浓度的LPS和/或OM刺激后, 检测NF-κB的表达. 用MTT法检测细胞增殖活性, 免疫细胞化学技术检测LTC-14细胞胞浆和胞核内NF-κB的表达, 实时荧光定量PCR检测细胞内NF-κB mRNA的表达, Western blot法检测NF-κB蛋白含量.
结果: OM呈时间-剂量依赖性地抑制LTC-14细胞增殖, LPS(10 μg/mL)刺激LTC-14细胞引起NF-κB mRNA及其蛋白表达量增高, NF-κB核内易位量明显增加, OM干预后可以下调NF-κB mRNA和蛋白表达, 抑制NF-κB核内易位.
结论: 对LPS诱导的LTC-14细胞NF-κB mRNA、蛋白表达及NF-κB向核内易位抑制作用可能是OM治疗胰腺纤维化的机制之一.
核心提示: 氧化苦参碱(oxymatrine)在脂多糖(lipopolysaccharide)诱导的胰腺星状细胞活化、胰腺纤维化中通过减少核因子-κB(nuclear factor κB, NF-κB) mRNA和蛋白的表达, 以及抑制NF-κB向核内易位, 来发挥抗纤维化的作用.
引文著录: 荣亚梅, 夏时海, 向晓辉, 陈凯, 张志广. 氧化苦参碱对胰腺星状细胞中脂多糖诱导的NF-κB表达的影响. 世界华人消化杂志 2015; 23(5): 761-766
Revised: December 23, 2014
Accepted: January 9, 2015
Published online: February 18, 2015
AIM: To investigate the effect of oxymatrine (OM) on lipopolysaccharide (LPS) induced expression of nuclear factor κB (NF-κB) in pancreatic stellate cells (LTC-14).
METHODS: LTC-14 cells were cultured with suitable concentrations of LPS as well as the corresponding concentrations of OM. Cell proliferation was detected by MTT assay. The expression of cytoplasmic and nuclear NF-κB was detected by immunohistochemistry. The expression of NF-κB mRNA was evaluated by Q-PCR. The protein expression of NF-κB was measured by Western blot.
RESULTS: OM inhibited the proliferation of LTC-14 cells in a time- and dose-dependent manner. The expression of NF-κB mRNA and protein was significantly increased in LTC-14 cells incubated with LPS (10 μg/mL), which could be down-regulated by OM. The nuclear translocation of NF-κB could also be inhibited by OM.
CONCLUSION: The reduction of NF-κB mRNA and protein as well as the inhibition of NF-κB nuclear translocation might be involved in the therapeutic effects of OM on pancreatic fibrosis.
- Citation: Rong YM, Xia SH, Xiang XH, Chen K, Zhang ZG. Effect of oxymatrine on lipopolysaccharide induced expression of NF-κB in pancreatic stellate cells. Shijie Huaren Xiaohua Zazhi 2015; 23(5): 761-766
- URL: https://www.wjgnet.com/1009-3079/full/v23/i5/761.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i5.761
慢性胰腺炎(chronic pancreatitis, CP)是由多种原因造成胰腺结构和功能持续损害, 临床表现多样, 不易早期诊断, 缺乏有效的治疗方法. 各种理化因素造成的肠黏膜屏障受损, 发生细菌易位, 是CP的重要病因, 其中细菌细胞壁的成分脂多糖(lipopolysaccharide, LPS)是主要的致病因素. LPS进入体内后, 激活核因子-κB(nuclear factor κB, NF-κB), 启动一系列免疫炎症反应, 激活胰腺星状细胞(pancreatic stellate cell, PSC), 使细胞外基质(extracellular matrix, ECM)的合成增加, 降解减少, 形成胰腺纤维化. 胰腺纤维化是CP的主要病理特征[1], 目前尚无特异并有效的治疗手段. 本课题组前期研究证实氧化苦参碱(oxymatrine, OM)具有抗胰腺纤维化的作用[2], 但其分子机制尚不明确, 本实验通过观察OM对LPS刺激胰腺星状细胞(LTC-14细胞株)NF-κB的表达和/或向核内易位的影响, 进一步探讨OM减轻胰腺纤维化的分子机制 .
胎牛血清购自Gibco公司; 青链霉素混合液购自Solarbio公司; IMDM培养基购自HyClone公司; LPS购自Sigma公司; OM购自Sigma公司; 胰酶消化液购自北京鼎国昌盛生物技术有限责任公司; TRIzol购自Invitrogen公司; 750 mL/L乙醇(分析纯)、氯仿(分析纯)、异丙醇(分析纯)、DEPC水均购自北京鼎国昌盛生物技术有限责任公司; 实时荧光定量PCR扩增试剂盒和逆转录试剂盒购自北京全式金生物技术有限公司; 通用型SP检测试剂盒和DAB显色试剂盒均购自中杉金桥公司. NF-κB、β-actin单克隆一抗购自Proteintech公司; DMSO购自Sigma公司; BCA蛋白定量试剂盒购自北京鼎国昌盛生物技术有限责任公司.
1.2.1 细胞培养: LTC-14细胞株是由德国Rostock大学医院的Robert Jaster教授友情惠赠[3]. 细胞在含10%胎牛血清的IMDM培养基中, 放置于37 ℃、50 mL/L CO2的孵育箱(相对湿度为95%)中培养.
1.2.2 分组: 将细胞随机分为4个组, Control组、LPS组、OM+LPS组、OM组. (1)Control组: 加入无血清无双抗IMDM培养基; (2)LPS组: 加入含浓度为10 μg/mL LPS(参照Gu等[4]人大鼠胰腺腺泡细胞AR42J实验中LPS浓度和时间)的培养基刺激3 h; (3)OM+LPS组: 预加入含适量OM(根据MTT试验结果提供)培养基1 mL, 30 min后加入浓度为10 μg/mL的LPS刺激3 h; (4)OM组: 加入含适量OM(根据MTT结果提供)培养基1 mL.
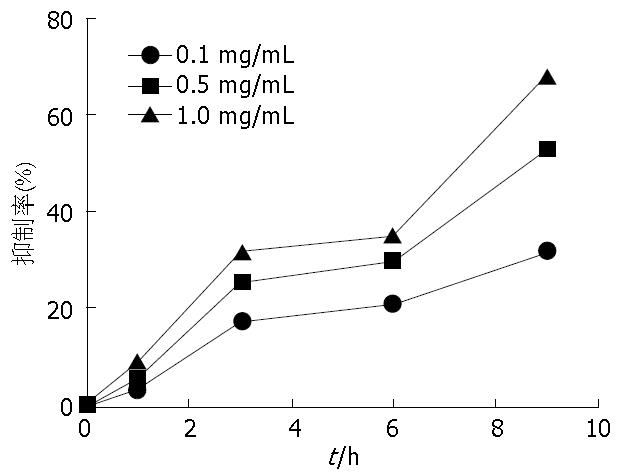
1.2.3 细胞增殖试验(MTT法): 参考Ling等[5]PANC-1细胞试验中OM浓度, 按照倍比稀释原则将OM分为3组(0.1、0.5、1.0 mg/mL), 每组按照培养时间分为0、1、3、6、9 h这5个小组, 每组设3个重复孔. 将传代培养的LTC-14细胞株用胰酶消化液消化之后, 稀释成1×103个/L的细胞悬液, 并接种于96孔细胞板, 每孔加入100 μL, 培养24 h后, 换入100 μL无血清无双抗的IMDM培养基饥饿4 h, 然后各个孔分别加入含相应浓度OM继续培养, 此时计时0 h. 分别于相应时间点取出96孔板, 加入含0.5%浓度的MTT(5 mg/mL)的培养基100 μL, 4 h后终止培养, 弃去培养基, 每个孔中加入150 μL DMSO, 置于摇床上低速振荡10 min, 在酶联免疫检测仪测定各孔吸光值(A570 nm), 通过吸光值计算OM各组的细胞增殖抑制率.
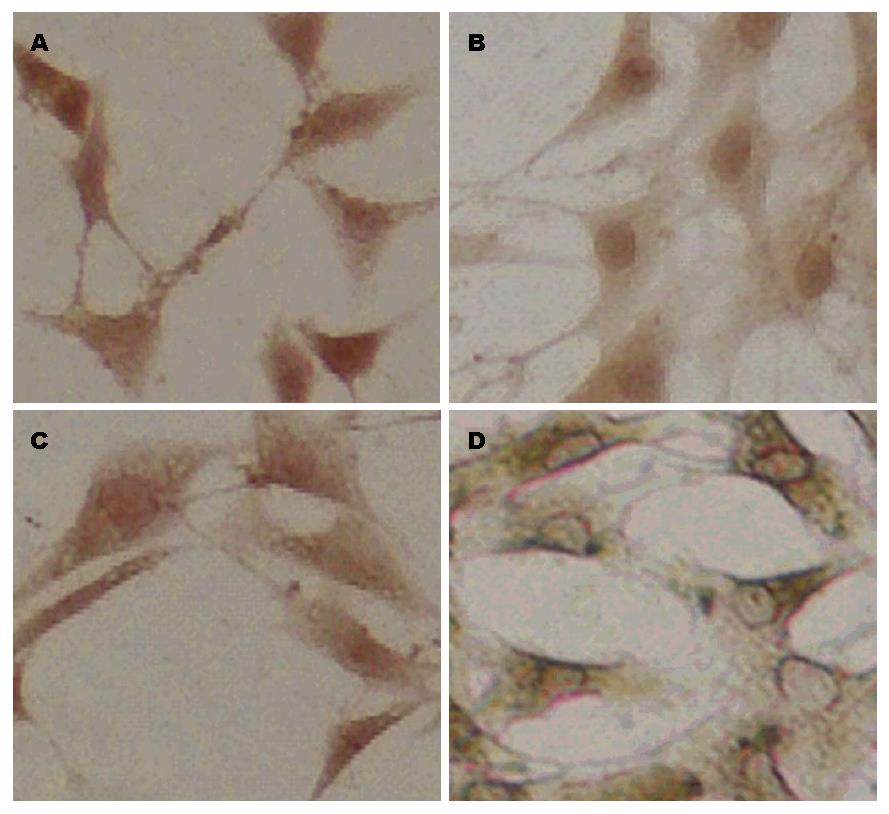
1.2.4 免疫细胞化学技术: 将已消毒的22 mm细胞爬片置于6孔板中, 按照每孔1×104个的密度将细胞接种于6孔板中进行细胞爬片, 培养24 h之后, 加入无血清无双抗的IMDM培养基饥饿4 h, 每个组加入相应浓度的药物, 待刺激时间结束后, 将细胞从孵育箱中取出, 用PBS清洗3次. 4%多聚甲醛固定, 再次PBS清洗3次. 依照中杉金桥免疫组织化学检测试剂盒说明书进行免疫组织化学染色, 染色结束DAB显色, 自来水充分冲洗, 二甲苯透明, 封片.
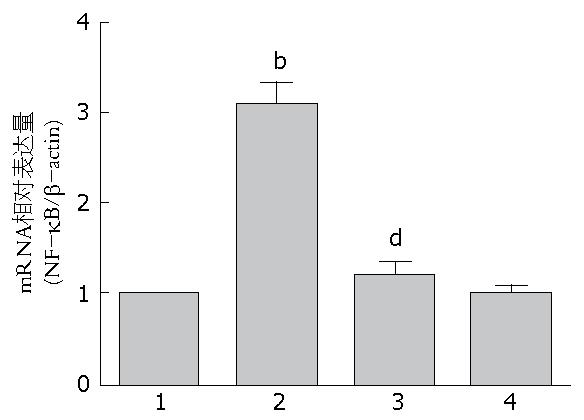
1.2.5 NF-κB mRNA的提取与测定: NF-κB mRNA的提取及cDNA的合成: 取对数生长期的LTC-14细胞接种于6孔板中, 24 h后加药刺激, 4组分别为Control组、LPS组、OM+LPS组、OM组, 加药浓度和作用时间同上. 作用3 h后, 弃上清, 用PBS清洗1次. 每孔中加入1 mL TRIzol, 按照试剂盒说明提取总RNA. 之后使用北京全式金公司的反转录试剂盒进行cDNA的合成, 用20 μL反应体系, 于25 ℃孵育10 min, 42 ℃孵育30 min, 85 ℃加热5 min. 所得产物作为荧光实时定量PCR(Q-PCR)的模板. 根据NCBI基因库查询到的基因mRNA序列, 用Primer-BLAST设计引物, NF-κB上游引物: 5'-AACGCGTCCAACCTGAAGAT-3', 下游引物: 5'-TGTCTGTGAACATCCGTGGG-3', 经由NCBI在线BLAST检测其特异性; 使用TransSTART Top Green qPCR SuperMix试剂盒, 采用25 μL反应体系, β-actin作为内参, 用ABI 7500 Real-Time PCR System进行检测.
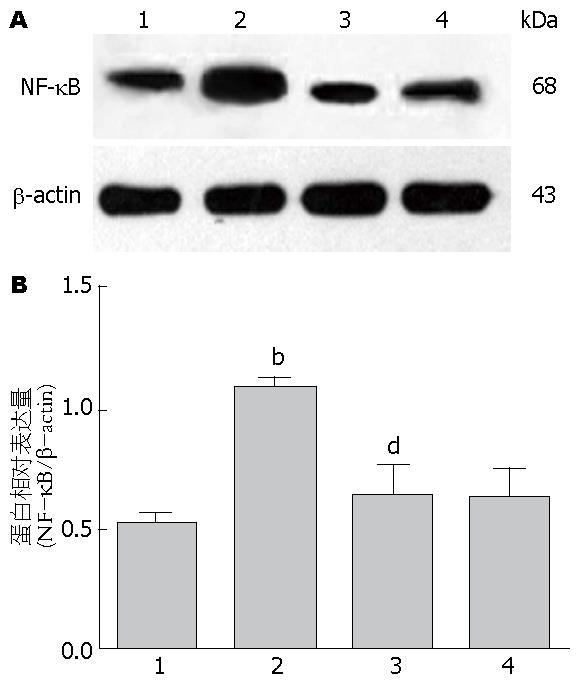
1.2.6 NF-κB蛋白含量测定: 提取各组LTC-14细胞的总蛋白, BCA蛋白定量, 稀释到蛋白浓度为5 g/L, 用聚丙烯酰胺凝胶电泳法进行分离, 积层胶电泳电压为80 V, 持续20 min, 分离胶电泳电压为120 V, 持续40 min, 电泳结束后以90 mA电流在冰浴下将蛋白转至PVDF膜上, 置于含5%脱脂奶粉的TBST中封闭1 h, 加入浓度为1∶1000的一抗稀释液, 4 ℃过夜, TBST洗膜3次, 然后加入HRP标记的二抗稀释液室温中孵育2 h, TBST洗膜3次, 最后用ECL化学发光显影. 以β-actin作为内参.
统计学处理 使用GraphPad Prism 6统计学软件分析处理数据, 数据用mean±SD表示, 组间比较用单因素方差分析. P<0.05为差异具有统计学意义.
OM可以抑制LTC-14细胞增殖, 且呈时间和剂量依赖关系. 随着OM药物浓度和时间的增加, 对细胞的增殖抑制作用也逐渐增高(图1).
细胞免疫化学技术结果显示: Control组(图2A): NF-κB在LTC-14细胞内均质表达; LPS组(图2B): NF-κB表达细胞核内明显, 包浆内表达量明显减少; OM+LPS组(图2C): 细胞浆中NF-κB均质表达, 较Control组差异无统计学意义; OM组(图2D): NF-κB在细胞核内表达量很少, 仅在胞浆中大量表达.
Q-PCR结果显示, LPS组较Control组NF-κB mRNA表达显著升高(P<0.0001), 而OM+LPS组NF-κB mRNA的表达量与LPS组相比显著降低(P<0.0001)(图3). OM组和Control组相比较差异无统计学意义.
总蛋白的表达 在蛋白水平上, LPS刺激后NF-κB表达量明显升高, 当加入OM+LPS共同干预后, NF-κB 表达量明显下降(P<0.01)(图4).
CP是以胰腺纤维化为主要病理特征. 研究[6]已经证实PSC的活化是胰腺纤维化发生的关键. 当胰腺组织损伤后, 激活处于静止状态的PSC, 大量生成ECM[7,8], 当ECM的生成大于降解, 就会导致胰腺纤维化, 进而影响胰腺的结构和功能, 出现胰腺内外分泌功能障碍[9].
胰腺炎肠道细菌易位学说认为: 肠道黏膜屏障完整性遭到破坏, 使得肠道内细菌内毒素(LPS)易位, 激活NF-κB表达, 使得炎症因子的释放增加, 这些炎症信号活化处于静止状态的PSC, 激活的PSC又释放大量炎症因子, 再次作用于NF-κB信号通路, 形成正反馈, PSC持续激活, ECM的大量生成, 纤维化发生.
NF-κB是一种多功能核转录因子, 是一组结构类似转录蛋白组成的复合物[10], 生物活性多样. 当受到细胞外信号刺激时, NF-κB激活, 调控多种趋化因子、细胞因子和黏附因子等的基因表达, 参与机体炎症、肿瘤、免疫的发生发展过程. 一般情况下, 大部分的NF-κB二聚体与细胞质中抑制因子结合以无活性的状态存在[11]. 当受到LPS等刺激时, 可以诱导NF-κB表达增加, 激活的NF-κB引起大量炎症介质的释放(如TNF-α、IL-6等), 这些炎症信号作用于PSC, 导致PSC激活, 释放大量炎症物质, 反过来作用于NF-κB, 形成正反馈, 导致PSC持续活化状态, 生成ECM增多, 导致胰腺纤维化形成. NF-κB在胰腺慢性纤维化的发生发展中起重要作用.
OM是我国的一种传统中药, 具有广泛的抗器官纤维化的作用. 多项研究[12-15]已经证实, 在肝脏、肾脏、肺组织、肠黏膜中, OM可以通过抑制NF-κB的表达, 来达到减轻器官纤维化的作用. 王昱良等[2]证实OM具有抗胰腺纤维化的作用. 基于以上研究, 我们推测通过调控NF-κB的表达来达到抗胰腺纤维化的作用. 在此猜想的基础上, 证实OM抗胰腺纤维化的分子机制, 为该药物的临床应用提供理论基础.
本实验中, 通过免疫细胞化学技术可以明显观察到, LPS组较Control组发生显著的NF-κB核内易位(图2B). OM+LPS组较LPS组, 核内易位明显减少(图2C). 单纯OM处理组, 观察到NF-κB大部分存在于胞浆内, 细胞核内仅少量表达(图2D). 说明OM可以显著抑制NF-κB在LTC-14细胞核内的易位. 通过Q-PCR和Western blot实验结果显示, LPS组NF-κB mRNA和蛋白表达量明显增加, OM+LPS组较LPS组, NF-κB mRNA(P<0.0001)(图3)和蛋白表达量(P<0.01)(图4)显著下降, 差异有统计学意义. Q-PCR和Western blot检测结果, 表明在基因和蛋白水平上, OM对LPS刺激的LTC-14细胞NF-κB有显著的抑制作用. 通过实验结果, 我们证实OM可以使NF-κB mRNA量和蛋白表达量下降以及减少NF-κB核易位, 通过调控NF-κB通路的信号转导来减轻胰腺纤维化的作用.
当使用OM干预后, 可以抑制产生炎症关键因子NF-κB的表达, 使得PSC活化减少, 纤维化得到抑制. 张红等[16]用LPS刺激大鼠星状胶质细胞, TLR4表达迅速增加, 通过激活NF-κB, 诱导其他炎症因子和细胞因子的转录和表达. 由此我们推断, OM可以通过调控NF-κB表达以及减少NF-κB核易位, 来减轻胰腺纤维化的作用, 是否也是通过TLR4/NF-κB信号通路来发挥作用, 需要下一步实验证实.
感谢香港浸会大学卞兆祥教授和天津中医药大学商洪才教授对本工作的帮助.
慢性胰腺炎(chronic pancreatitis, CP)胰腺纤维化缺乏有效的治疗药物, 氧化苦参碱(oxymatrine, OM)作为传统中药, 具有广泛的抗器官纤维化的作用. 核因子-κB(nuclear factor κB, NF-κB)在该疾病进程中的相关作用越来越引起关注, OM是否可以通过NF-κB来发挥抗纤维化的作用亟待研究证实.
周翔宇, 副主任医师, 泸州医学院附属医院血管甲状腺外科
胰腺星状细胞(pancreatic stellate cell, PSC)在胰腺纤维化进程中的核心地位已被越来越多的研究者证实, OM治疗胰腺纤维化的作用机制受到越来越多的重视, 其作用靶点及与PSC的相关性成为近年来研究的热点
杨华等研究发现, OM组与模型组大鼠比较, 大鼠肝纤维化水平明显减轻(P<0.01), 肝组织NF-κB表达明显降低(P<0.01).
本实验通过研究OM对LPS诱导的胰腺星状细胞(LTC-14)NF-κB信号通路的影响, 来探讨OM治疗CP的分子机制, 为OM的进一步开发利用提供理论依据.
OM能够减少NF-κB mRNA和蛋白在PSC中的表达, 抑制NF-κB核易位. 该机制对减轻CP组织的炎症反应, 治疗CP起到积极作用; 并使以NF-κB作为靶点, 利用OM来延缓胰腺纤维化的发展、治疗CP提供新的思路.
本文从细胞角度探讨OM治疗胰腺纤维化的可能机制. 立题较新, 数据较可靠, 图表较规范, 具有一定的创新性和临床价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Masamune A, Shimosegawa T. Signal transduction in pancreatic stellate cells. J Gastroenterol. 2009;44:249-260. [PubMed] [DOI] |
| 3. | Tsang SW, Zhang H, Lin C, Xiao H, Wong M, Shang H, Yang ZJ, Lu A, Yung KK, Bian Z. Rhein, a natural anthraquinone derivative, attenuates the activation of pancreatic stellate cells and ameliorates pancreatic fibrosis in mice with experimental chronic pancreatitis. PLoS One. 2013;8:e82201. [PubMed] [DOI] |
| 4. | Gu H, Werner J, Bergmann F, Whitcomb DC, Büchler MW, Fortunato F. Necro-inflammatory response of pancreatic acinar cells in the pathogenesis of acute alcoholic pancreatitis. Cell Death Dis. 2013;4:e816. [PubMed] [DOI] |
| 5. | Ling Q, Xu X, Wei X, Wang W, Zhou B, Wang B, Zheng S. Oxymatrine induces human pancreatic cancer PANC-1 cells apoptosis via regulating expression of Bcl-2 and IAP families, and releasing of cytochrome c. J Exp Clin Cancer Res. 2011;30:66. [PubMed] [DOI] |
| 6. | Marzoq AJ, Giese N, Hoheisel JD, Alhamdani MS. Proteome variations in pancreatic stellate cells upon stimulation with proinflammatory factors. J Biol Chem. 2013;288:32517-32527. [PubMed] [DOI] |
| 7. | Means AL. Pancreatic stellate cells: small cells with a big role in tissue homeostasis. Lab Invest. 2013;93:4-7. [PubMed] [DOI] |
| 8. | Treiber M, Neuhöfer P, Anetsberger E, Einwächter H, Lesina M, Rickmann M, Liang S, Kehl T, Nakhai H, Schmid RM. Myeloid, but not pancreatic, RelA/p65 is required for fibrosis in a mouse model of chronic pancreatitis. Gastroenterology. 2011;141:1473-1485, 1485.e1-7. [PubMed] [DOI] |
| 9. | Talukdar R, Tandon RK. Pancreatic stellate cells: new target in the treatment of chronic pancreatitis. J Gastroenterol Hepatol. 2008;23:34-41. [PubMed] [DOI] |
| 10. | Karin M, Delhase M. The I kappa B kinase (IKK) and NF-kappa B: key elements of proinflammatory signalling. Semin Immunol. 2000;12:85-98. [PubMed] [DOI] |
| 11. | Diamant G, Dikstein R. Transcriptional control by NF-κB: elongation in focus. Biochim Biophys Acta. 2013;1829:937-945. [PubMed] [DOI] |