修回日期: 2014-12-14
接受日期: 2014-12-18
在线出版日期: 2015-02-08
目的: 探讨食管鳞癌中肿瘤出芽与D2-40标记淋巴管浸润(lymphatic vessel invasion, LVI)及淋巴结转移的相关关系.
方法: 参照Ueno标准, 通过HE染色观察并判断70例食管鳞癌肿瘤出芽情况, 采用免疫组织化学(SP法)技术检测D2-40表达并观察肿瘤细胞浸润淋巴管情况, 分析肿瘤出芽、LVI与临床病理指标间的关系.
结果: 70例食管鳞癌的高级别肿瘤出芽率和LVI阳性率分别为30%和40%, 二者均与淋巴结转移、临床分期呈正相关(P<0.01). LVI与肿瘤分化程度呈负相关(P<0.05). 肿瘤出芽与LVI符合率为72.86%.
结论: 联合检测肿瘤出芽和LVI可作为食管鳞癌判断淋巴结转移的预测因子.
核心提示: 区域淋巴结转移是食管鳞癌的主要转移方式, 术后病理检查常常因淋巴结取材限制或早期和隐形转移灶不易发现而出现漏诊. 本实验发现食管鳞癌的高级别肿瘤出芽和淋巴管浸润(lymphatic vessel invasion, LVI)均与淋巴结转移和临床分期呈正相关, 提示联合检测肿瘤出芽和LVI可作为食管鳞癌判断淋巴结转移的预测因子.
引文著录: 杨成万, 陶明珠, 周铁军. 食管鳞癌肿瘤出芽与D2-40标记淋巴管浸润及淋巴结转移的相关性. 世界华人消化杂志 2015; 23(4): 613-617
Revised: December 14, 2014
Accepted: December 18, 2014
Published online: February 8, 2015
AIM: To investigate the relationship among tumor budding, D2-40 monoclonal antibody-labeled lymphatic vessel invasion (LVI) and lymph node metastasis in esophageal squamous cell carcinoma (ESCC).
METHODS: According to the Ueno criteria, we assessed tumor budding by HE staining and examined the expression of D2-40 and LVI by immunohistochemistry in 70 ESCC cases.
RESULTS: The positive rates of high-grade tumor budding and LVI were 30% and 40%, respectively. Both tumor budding and LVI was positively correlated with lymph node metastasis and clinical stage (P < 0.01). LVI was negatively correlated with tumor differentiation (P < 0.05). The coincidence rate between tumor budding and LVI was 72.86%.
CONCLUSION: The joint detection of tumor budding and LVI will be useful for forecasting lymph node metastasis in ESCC.
- Citation: Yang CW, Tao MZ, Zhou TJ. Relationship among tumor budding, D2-40 monoclonal antibody-labeled lymphatic vessel invasion and lymph node metastasis in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 613-617
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/613.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.613
食管鳞癌是消化管常见的恶性肿瘤, 以老年人多见, 临床上多为中晚期患者, 因其容易发生区域淋巴结转移, 即使完整手术切除和广泛淋巴结清扫, 局部和全身复发仍然常见[1]. 因此, 术后及时准确判断淋巴结转移情况对于制定辅助治疗方案及判断患者预后具有重要意义. 虽然清扫淋巴结的病理检查有助于判断淋巴结转移情况, 但一些早期或隐性转移灶容易漏诊. 近年来有研究[2,3]表明, 肿瘤出芽与结直肠癌、胃癌等淋巴结转移率具有显著相关性, 并可作为预测淋巴结转移的独立因子, 而其在食管鳞癌的研究较少. 本研究通过HE染色观察食管鳞癌肿瘤出芽情况, 免疫组织化学检测D2-40表达并观察肿瘤细胞浸润淋巴管(lymphatic vessel invasion, LVI)情况, 分析肿瘤出芽、LVI与淋巴结转移的相关关系, 旨在积极寻找简单、快捷、准确判断淋巴结转移的方法.
收集2011-01/2013-12泸州医学院附属医院手术切除具有完整资料的食管鳞癌标本70例. 所有标本经病理证实, 术前均未进行放化疗. 其中男64例, 女6例; 年龄46-75岁, 平均65.2岁. 组织类型均为鳞状细胞癌, 其中高分化32例, 中-低分化38例; 淋巴结转移40例, 无转移30例; 临床分期根据2002年国际癌症防治联合会(Universal Integrated Circuit Card, UICC)制定的标准进行TNM分期, 其中T1+T2期28例, T3+T4期42例.
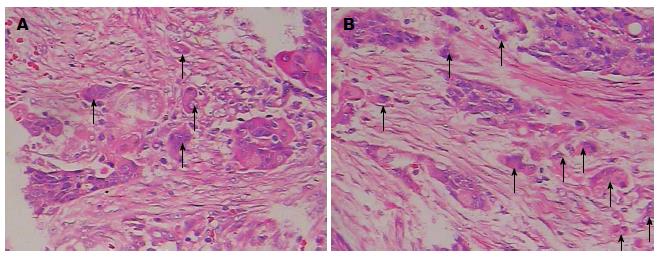
HE染色判断肿瘤出芽, 判断标准参照Ueno等[4]的研究: 在肿瘤浸润前沿见孤立单个的癌细胞或少于5个癌细胞群, 判断为肿瘤出芽; 当肿瘤浸润前沿未见单个或少于5个癌细胞群则判断为无肿瘤出芽. 参照贺健祥等[5]的研究, 选取3张病理切片, 每张切片选取5个芽孢最多的视野, 在高倍镜(×400)视野下计数每个视野的芽孢数, 将芽孢总数除以计数视野总数, 得出芽孢平均值. 参照Roh等[6]的研究, 依据肿瘤芽孢平均值分为低级别肿瘤出芽组(芽孢平均值<5)和高级别肿瘤出芽组(芽孢平均值≥5).
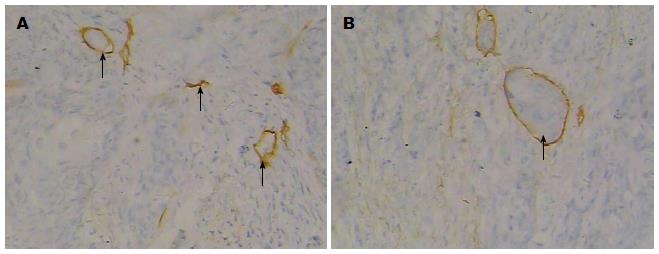
使用SP法免疫组织化学染色, D2-40抗体和SP抗体检测试剂盒均购自福州迈新生物技术开发有限公司生产. D2-40标记的肿瘤淋巴管浸润的阳性判定标准[7]: 首先低倍镜(×100)下观察切片, 肿瘤组织中染成棕黄色或者棕褐色的单个内皮细胞或内皮细胞簇作为D2-40的阳性表达, D2-40阳性表达的淋巴管腔内发现食管鳞癌细胞初步判定为LVI阳性, 再在高倍镜(×400)下确认.
统计学处理 应用SPSS19.0软件对数据进行统计学分析. 比较食管鳞癌肿瘤出芽和LVI与淋巴结转移等临床病理因素之间的关系, 计数资料用百分数表示, 用χ2检验、Fisher确切概率法、Pearson相关分析等方法, P<0.05为差异有统计学意义.
HE染色观察肿瘤出芽的癌细胞呈多角形或梭形, 胞质丰富呈嗜酸性, 核深染, 有明显异型性(图1). 70例食管鳞癌中高级别肿瘤出芽率为30%(21/70), 其中高出芽组21例中有17例淋巴结转移阳性, 灵敏度为80.95%(17/21). 免疫组织化学检测在食管鳞癌内和癌旁均可见到D2-40表达阳性的淋巴管, 其形态特点是管腔状、条索状、管壁薄、且腔内无红细胞填充, 部分D2-40表达阳性的淋巴管内可见到单个、数个或者成团的癌细胞(图2), LVI阳性者共有28例, 阳性率为40%, 判断淋巴结转移的灵敏度为78.57%(22/28). 肿瘤出芽、LVI均与淋巴结转移和临床分期密切相关, 且LVI阳性与食管鳞癌分化程度呈负相关(P<0.05). 而与患者年龄、性别、肿瘤大小、浸润深度无明显相关性(P>0.05 )(表1).
| 临床病理指标 | n | 肿瘤出芽 | LVI | ||||
| 高级别 | 低级别 | P值 | 阳性 | 阴性 | P值 | ||
| 性别 | 0.062 | 0.209 | |||||
| 男 | 64 | 17 | 47 | 24 | 40 | ||
| 女 | 6 | 4 | 2 | 4 | 2 | ||
| 年龄(岁) | 0.914 | 0.84 | |||||
| <60 | 44 | 13 | 31 | 18 | 26 | ||
| ≥60 | 26 | 8 | 18 | 10 | 16 | ||
| 肿瘤大小(cm) | 0.432 | 0.528 | |||||
| <4 | 48 | 13 | 35 | 18 | 30 | ||
| ≥4 | 22 | 8 | 14 | 10 | 12 | ||
| 分化程度 | 0.753 | 0.019 | |||||
| 高分化 | 32 | 9 | 23 | 8 | 24 | ||
| 中低分化 | 38 | 12 | 26 | 20 | 18 | ||
| 浸润深度 | 0.564 | 0.28 | |||||
| 黏膜及肌层 | 20 | 7 | 13 | 10 | 10 | ||
| 浆膜及全层 | 50 | 14 | 36 | 18 | 32 | ||
| 淋巴结转移 | 0.008 | 0.003 | |||||
| 无转移 | 30 | 4 | 26 | 6 | 24 | ||
| 有转移 | 40 | 17 | 23 | 22 | 18 | ||
| 临床分期 | 0.004 | 0.01 | |||||
| Ⅰ+Ⅱ | 28 | 3 | 25 | 6 | 22 | ||
| Ⅲ+Ⅳ | 42 | 18 | 24 | 22 | 20 | ||
区域淋巴结转移是食管鳞癌的主要转移方式, 其在食管鳞癌临床分期、治疗方案的制定及预后判断中具有重要作用. 而广泛的淋巴结清扫及详细的淋巴结病理常规检查是确定淋巴结转移的主要方法, 但病理检查时常常因淋巴结取材限制或早期和隐形转移灶不易发现而出现漏诊, 寻找简单、实用、准确的协助判断淋巴结转移的方法十分必要.
肿瘤出芽被认为是一种可反映肿瘤侵袭力及预后的独立危险因子[4]. 大量研究提示消化管癌的肿瘤出芽是一种很精确的预后指标, 有研究[3,5]认为肿瘤出芽可用于判断胃癌、食管癌的淋巴结转移. Roh等[6]研究了56例食管鳞癌, 发现高级别肿瘤出芽组与低级别肿瘤出芽组在肿瘤大小、PT分期、淋巴血管侵犯、神经侵犯和美国癌症联合委员会(American Joint Committee on Cancer, AJCC)分期有显著差异, 认为食管鳞癌的高级别肿瘤出芽提示具有高恶性潜能. 但其对淋巴结转移的预测价值尚不清楚. 本研究发现高级别肿瘤出芽与食管鳞癌的淋巴结转移和临床TNM分期密切相关, 高级别肿瘤出芽组21例中有17例淋巴结转移阳性, 判断淋巴结转移灵敏度为80.95%(17/21), 高级别肿瘤出芽可作为食管鳞癌淋巴结转移和预后判断的指标之一.
Roh等[6]发现食管鳞癌高级别肿瘤出芽组比低级别肿瘤出芽组更易发生淋巴管侵犯. 但利用传统的光学显微镜下观察HE染色的标本判断LVI是很困难的, 原因是HE切片下淋巴管壁薄且易被压缩而不易观察、淋巴管腔被成团的肿瘤细胞填满难与小的癌巢相鉴别以及肿瘤组织固定被压缩而形成的孤立肿瘤细胞簇容易与淋巴管中的癌栓混淆[8], 而且LVI也与肿瘤出芽不易区别. D2-40是一种IgG抗体, 是一种相对分子量为40 kDa的唾液酸黏蛋白, 分布于细胞膜上, 其可以通过识别由淋巴管内皮细胞表达的糖蛋白M2A中的一个固定抗原决定簇而与之进行特异性结合, 从而标记淋巴管内皮细胞, 具有很强的特异度和灵敏度[9,10]. 本研究采用单克隆抗体D2-40标记淋巴管, D2-40表达阳性的淋巴管内见到单个、数个或者成团的癌细胞视为LVI阳性, 使LVI的判定更加准确、可靠. 本研究应用D2-40检测LVI阳性率为40%, 并且LVI与食管鳞癌患者淋巴结转移和TNM分期密切相关, 这与其他的研究结果一致[11-13]. 因此, LVI阳性可作为食管鳞癌淋巴结转移的判断指标之一. 研究还发现, LVI与食管鳞癌的分化程度密切相关, 中低分化组LVI阳性率明显高于高分化组, 说明分化程度越低的肿瘤细胞具有更强的淋巴管浸润能力.
肿瘤浸润和转移的第一步是肿瘤细胞的去分化和肿瘤浸润前沿肿瘤细胞的分离, 分离出的单个癌细胞或<5个癌细胞的癌细胞群即肿瘤出芽. 本研究中发现食管鳞癌高级别肿瘤出芽组LVI阳性率明显高于低级别肿瘤出芽组, 肿瘤出芽与LVI呈显著正相关关系, 二者一致符合率72.86%. 推测肿瘤芽孢迁徙时, 肿瘤侵袭前沿的此种去分化动态过程即上皮间质转化(epithelial-mesenehymal transition, EMT)[14], EMT可以通过肿瘤芽孢的存在而在组织学上被识别, 这种独特的肿瘤特征显示肿瘤的生长方式呈侵袭性[15]. 因此, 结合高级别肿瘤出芽和LVI阳性可准确预测食管鳞癌的淋巴结转移, 对于制定术后辅助治疗方案和预后估计具有重要意义.
食管鳞癌是消化管常见的恶性肿瘤, 术后对清扫淋巴结的病理检查有助于判断淋巴结转移情况, 但一些早期或隐性转移灶容易漏诊, 从而影响进一步辅助治疗方案的制定及预后的判断. 肿瘤出芽或D2-40标记肿瘤浸润淋巴管(lymphatic vessel invasion, LVI)对预测食管鳞癌淋巴结转移的价值研究较少. 收集食管鳞癌的临床和病理资料,分析肿瘤出芽、LVI与食管鳞癌淋巴结转移的相关关系, 旨在寻找简单、快捷、准确判断淋巴结转移的方法.
茅爱武, 教授, 上海同仁医院介入中心
目前对肿瘤出芽或LVI预测胃癌、结直肠癌等淋巴结转移的研究较多, 其在预测食管鳞癌淋巴结转移的研究很少, 尤其是二者联合检测的价值尚不明确, 其与各临床病理指标间的关系也有待于进一步证实.
在56例食管鳞癌的研究中, 显示高级别和低级别肿瘤出芽组在肿瘤大小、PT分期、淋巴血管侵犯、神经侵犯等方面有显著差异, 认为食管鳞癌的高级别肿瘤出芽提示具有高恶性潜能, 未分析其对淋巴结转移的预测价值. 对107例食管鳞癌的研究中, 显示D2-40标记的LVI可以作为肿瘤淋巴结转移预测因子, 文章未分析LVI的可能机制.
联合检测肿瘤出芽和D2-40标记的LVI预测淋巴结转移的研究国内相关报道少见. 本实验发现食管鳞癌的高级别肿瘤出芽率和LVI阳性率分别为30%和40%, 二者均与淋巴结转移、临床分期呈正相关, 提示联合检测肿瘤出芽和LVI可作为食管鳞癌判断淋巴结转移的预测因子.
通过对食管鳞癌患者肿瘤出芽和D2-40标记的LVI的检测和综合分析认为二者可作为食管鳞癌判断淋巴结转移的预测因子, 高级别肿瘤出芽和LVI阳性有可能成为手术清扫淋巴结转移阴性的食管鳞癌患者进一步放化疗的依据.
本文题目基本反映了研究工作的科学问题, 国内相关报道少见, 立意尚可.
编辑: 郭鹏 电编:闫晋利
| 1. | Kranzfelder M, Büchler P, Friess H. Surgery within multimodal therapy concepts for esophageal squamous cell carcinoma (ESCC): the MRI approach and review of the literature. Adv Med Sci. 2009;54:158-169. [PubMed] [DOI] |
| 2. | Wang LM, Kevans D, Mulcahy H, O'Sullivan J, Fennelly D, Hyland J, O'Donoghue D, Sheahan K. Tumor budding is a strong and reproducible prognostic marker in T3N0 colorectal cancer. Am J Surg Pathol. 2009;33:134-141. [PubMed] [DOI] |
| 4. | Ueno H, Murphy J, Jass JR, Mochizuki H, Talbot IC. Tumour 'budding' as an index to estimate the potential of aggressiveness in rectal cancer. Histopathology. 2002;40:127-132. [PubMed] |
| 6. | Roh MS, Lee JI, Choi PJ. Tumor budding as a useful prognostic marker in esophageal squamous cell carcinoma. Dis Esophagus. 2004;17:333-337. [PubMed] |
| 7. | 白 冰, 马 伟, 王 凯, 哈 斯塔, 王 建波, 谭 炳煦, 王 娜娜, 杨 圣思, 贾 亦斌, 程 玉峰. D2-40标记食管鳞癌淋巴管浸润的检测及其临床病理意义. 中国肿瘤临床. 2013;40:543-546. |
| 8. | Imamura Y, Watanabe M, Nagai Y, Baba Y, Hirashima K, Karashima R, Iwatsuki M, Yoshida N, Kinoshita K, Kurashige J. Lymphatic vessel invasion detected by the D2-40 monoclonal antibody is an independent prognostic factor in node-negative esophageal squamous cell carcinoma. J Surg Oncol. 2012;105:277-283. [PubMed] [DOI] |
| 9. | Kaiserling E. [Immunohistochemical identification of lymph vessels with D2-40 in diagnostic pathology]. Pathologe. 2004;25:362-374. [PubMed] |
| 10. | Braun M, Wardelmann E, Debald M, Walgenbach-Bruenagel G, Höller T, Wolfgarten M, Sauerwald A, Rudlowski C, Büttner R, Kuhn W. Detection of lymphovascular invasion in vulvar cancer by D2-40 (podoplanin) as a predictor for inguinal lymph node metastases. Onkologie. 2009;32:732-738. [PubMed] [DOI] |
| 11. | Kozłowski M, Naumnik W, Nikliński J, Milewski R, Lapuć G, Laudański J. Lymphatic vessel invasion detected by the endothelial lymphatic marker D2-40 (podoplanin) is predictive of regional lymph node status and an independent prognostic factor in patients with resected esophageal cancer. Folia Histochem Cytobiol. 2011;49:90-97. [PubMed] [DOI] |
| 12. | Mori D, Yamasaki F, Shibaki M, Tokunaga O. Lateral peritumoral lymphatic vessel invasion can predict lymph node metastasis in esophageal squamous cell carcinoma. Mod Pathol. 2007;20:694-700. [PubMed] |
| 13. | Inoue A, Moriya H, Katada N, Tanabe S, Kobayashi N, Watanabe M, Okayasu I, Ohbu M. Intratumoral lymphangiogenesis of esophageal squamous cell carcinoma and relationship with regulatory factors and prognosis. Pathol Int. 2008;58:611-619. [PubMed] [DOI] |
| 14. | Natalwala A, Spychal R, Tselepis C. Epithelial-mesenchymal transition mediated tumourigenesis in the gastrointestinal tract. World J Gastroenterol. 2008;14:3792-3797. [PubMed] |
| 15. | Prall F. Tumour budding in colorectal carcinoma. Histopathology. 2007;50:151-162. [PubMed] [DOI] |