修回日期: 2014-12-15
接受日期: 2014-12-18
在线出版日期: 2015-02-08
目的: 探讨内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗早期食管癌及癌前病变的临床疗效及安全性评价.
方法: 收集2007-07/2010-06经胃镜检查、病理证实并行ESD治疗的44例早期食管癌或癌前病变患者, 对其临床病理特征进行总结, 并对疗效、并发症及生存率进行评估.
结果: 44例患者均成功地接受ESD, 所有剥离标本全部得到病理确诊, 基底和切缘未见病变累及. 共出现出血2例, 穿孔2例, 食管狭窄3例. 术后仅1例患者出现复发, 行第2次ESD.
结论: ESD治疗早期食管癌及癌前病变安全、有效, 值得推广.
核心提示: 内镜黏膜下剥离术(endoscopic submucosal dissection)治疗早期食管癌, 不仅可以彻底剥离病灶, 而且术中创伤小、术后并发症少、身体机能恢复快、生活质量高. 因此, 该方法安全、有效, 值得推广应用.
引文著录: 金海林, 韩树堂, 肖君, 张其德, 孙仁虎. 内镜黏膜下剥离术治疗早期食管癌及癌前病变44例. 世界华人消化杂志 2015; 23(4): 608-612
Revised: December 15, 2014
Accepted: December 18, 2014
Published online: February 8, 2015
AIM: To explore the efficacy and safety of endoscopic submucosal dissection (ESD) for early esophageal cancer and precancerous lesions.
METHODS: Forty-four patients with histologically proved early esophageal cancer or precancerous lesions who were treated by ESD at our hospital between July 2007 and June 2010 were included. The curative effects and complications were evaluated.
RESULTS: ESD was successful in all 44 cases. All lesions were resected with lateral and basal resection margins free of tumor. Massive bleeding occurred in two patients, one occurring during ESD and the other occurring 3 d after ESD. The bleeding rate was 4.5% (2/44). Perforation occurred in two patients, both of whom recovered after several days of conservative treatment. The perforation rate was 4.5% (2/44). Esophageal stricture occurred in two patients 2 to 4 wk after ESD. Only one case developed recurrence 3 mo after ESD and received a second ESD. Of all the 44 patients, 43 are still alive.
CONCLUSION: ESD for early esophageal cancer and precancerous lesions is safe and effective.
- Citation: Jin HL, Han ST, Xiao J, Zhang QD, Sun RH. Endoscopic submucosal dissection for early esophageal cancer and precancerous lesions. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 608-612
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/608.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.608
食管癌在我国是常见病, 随着内镜技术的发展, 早期食管癌的检出率逐渐提高. 一直以来, 手术治疗是食管癌治疗的基础. 然而, 围手术期的风险及术后的低生存质量一直困扰着外科医生和食管癌患者. 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是近十余年在日本兴起的一项内镜治疗技术. 相对于外科手术, 其优越性主要是创伤小、愈合快、风险低及术后生存质量高, 近年来已在不少国家应用于临床. 本文对江苏省中医院消化病诊疗暨内镜中心44例接受ESD的早期食管癌及癌前病变患者的临床病理特征、并发症及术后生存率进行总结.
收集2007-07/2010-06在江苏省中医院内镜中心进行胃镜及组织病理检查确诊为早期食管癌或食管癌前病变并行ESD的患者44例. 日本Olympus GIF-Q260电子胃镜, Olympus KD-620LR Hook knife、KD-611L IT knife、ERBE 200S高频电切装置、氩离子凝固术(argon plasma coagulation, APC)2氩离子凝固器及FD-610LR电凝活检钳等.
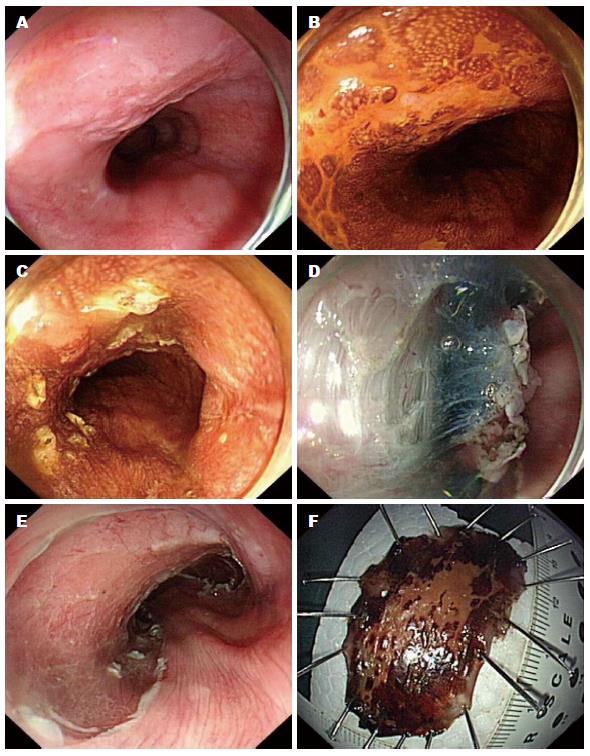
1.2.1 内镜治疗: 用卢戈氏碘液行食管染色后, 明确病变范围, 予APC沿病变约0.5 cm标记后, 用1:10000的肾上腺素玻璃酸钠美蓝生理盐水溶液沿标记处行黏膜下注射将病变隆起后, 用钩刀实施玻璃, 剥离过程中, 反复行黏膜下注射, 遇有出血或小血管予APC或热活检钳止血. 创面需仔细观察, 必要时用钛夹或止血夹止血. 内镜治疗过程如图1. 切除标本送病理检查.
1.2.2 术后处理: 术后三腔喂养管或鼻胃管, 常规禁食、禁水, 抑算、止血、抗感染及补液营养支持等治疗, 根据情况3-5 d后予流质饮食, 术后1 wk-1 mo内予无渣半流质饮食.
1.2.3 随访: 术后1、3、12、24、36 mo(此后每年1次)复查胃镜并进行病理学检查.
统计学处理 用SPSS16.0软件包进行统计分析, 相对数用率、比表示, 资料间的比较采用确切概率法, P<0.05为差异有统计学意义.
早期食管癌及癌前病变患者44例, 其中男29例, 女15例, 男女比例为1.93:1, 年龄45-76岁, 平均年龄60.4岁±7.3岁, 年龄分布为40-49岁2例, 50-59岁21例, 60-69岁16例, 70-79岁5例. 治疗前表现为进食停滞感17例(38.6%), 胸骨后不适14例(31.8%), 反酸6例(13.6%), 吞咽不适感2例(4.5%), 剑突下不适2例(4.5%), 消瘦、进食呛咳、上腹胀痛各1例(6.8%).
发生部位: 中段25例(56.8%)、下段7例(15.9%)、上段7例(15.9%)、中上段1例(6.8%)、中下段4例(9.1%). 病理形态分型: 隐伏型(3/44)、糜烂型(30/44)、斑块型(9/44)、乳头型(2/44). 表浅瘤变的巴黎内镜分型: Ⅰ型2例(4.5%)、Ⅱa型7例(15.9%)、Ⅱb型16例(36.5%)、Ⅱc型13例(29.5%)、Ⅱa+Ⅱc型4例(9.1%)、Ⅱb+Ⅱc型2例(4.5%).
所有44例患者接受内镜下黏膜下剥离术后, 出现出快速房颤1例, 出血2例, 穿孔2例, 肺部感染1例, 食管狭窄3例.
中度异型增生2例, 中度异型增生伴局灶重度异型增生18例, 重度异型增生14例, 重度异型增生伴局灶癌变3例, 鳞状细胞癌7例.
17例进食停滞感患者中15例症状消失, 14例胸骨后不适患者中12例症状明显缓解, 6例反酸患者中仅1例改善, 余7例患者症状有不同程度缓解. 不同症状(超过5例)的治疗缓解率, 经确切概率法计算后发现进食停滞感与胸骨后不适两症状缓解率均较高(分别为88.24%和85.71%), 且两者间差异无统计学意义(P = 1.000); 反酸患者症状缓解率较低, 仅16.67%, 显著低于进食停滞感(P = 0.003)及胸骨后不适(P = 0.007). 1例患者术后3 mo复查胃镜时仍提示存在食管黏膜病变, 病理示中重度异型, 再次行内镜下黏膜下剥离术. 1例患者接受ESD术5 mo后发现胃癌, 并行胃大部切除术. 2007-07/2014-11, 所有接受ESD术的早期食管癌患者中仅1例死于其他疾病, 无死于食管癌复发.
早期食管癌的概念在东西方一直存在争议, 日本学者认为重度异型和黏膜内癌均属于早期食管癌, 而欧美学者认为细胞异型性侵及基底膜才算早癌. 2002年包括日本、欧美等国家在巴黎制定了消化系表浅性新生物性病变的巴黎内镜分型, 最终达成一致, 即浅表性新生物包含未侵及基底膜的新生物性病变和侵袭基底膜但深度仅限于黏膜层(食管和胃)或黏膜下层(结肠)的癌. 一直以来, 手术被认为是食管癌(甚至包括高级别上皮内瘤变或黏膜内癌)的首选方法, 但手术的风险极大, 而且术后生存质量差, 其死亡率(术后30 d内)和并发症发生率分别为3%-10%和40%-50%, 5年生存率仅15%-25%[1-3]. 近5年来, ESD术开始在国内多家医院开展, 且技术日臻成熟.
本研究中共收集44例早期食管癌及癌前病变患者, 男女比例为1.93:1, 大部分患者年龄都集中在50-70岁, 其中50-59岁占47.7%, 0-69岁占36.4%, 而且早期食管癌发生的部位以食管中段为主(56.8%). 上述结果符合我国食管癌发病的特征[4-6].
在所有患者的病理分型中, 糜烂型最为常见(68.2%), 斑块型次之(20.5%), 隐伏型和乳头型均较少, 分别占6.8%和4.5%. 日本国内多中心研究显示食管浅表性新生物性病变中约80%为Ⅱ型病变. 而0-Ⅰ、0-Ⅱ和0-Ⅲ病变的黏膜下层累及率分别为79%、84%和15%[7]. 本研究中0-Ⅱ型病变占有绝对的优势, 占95.5%, 高出日本约15%, 可能与本研究样本含量相对较少有关. Ⅰ型病变较易识别, Ⅱ型特别是Ⅱb型往往不易发现, 但由于内镜技术, 如染色内镜、放大内镜、窄带光谱及共聚焦激光显微镜等技术的发展使该类病变发现率得到了极大的提高. 其中卢戈氏碘液染色是最基本、最实用、亦是性价比最高的措施, 当然这也需要内镜医师敏锐的洞察力.
对于ESD适应证, 日本学者认为当食管病变局限于m1和m2时, 几乎无淋巴结转移, 因此此类患者是行ESD的绝对指征. 当病变浸润m3和sm1时, 可根据情况选择外科手术或内镜下治疗. 当病变浸润达sm2和sm3时, 淋巴结转移率40%, 必须外科治疗. 国内早期食管癌ESD适应证为: (1)>15 mm的食管高级别上皮内瘤变; (2)早期食管癌: 结合染色、放大和超声内镜(EUS)等检查, 确定病变的范围和浸润深度, 局限于m1、m2、m3或sm1且临床没有血管和淋巴管侵犯证据的高、中分化鳞癌; (3)伴有不典型增生和癌变的Barrett食管; (4)姑息性治疗, 适于侵犯深度超过sm1、低分化食管癌、心肺功能较差不能耐受手术的高龄患者及拒绝手术者, 并需结合放疗[8]. 可见, 两者都认为病变浸润深度不可超过sm1. 然而, 术前对于病变深度的判定仍存在一定难度, 目前主要依赖于超声胃镜. 报道认为EUS对T1a食管癌的敏感性为85%-90%, 特异性87%-90%[9,10], 对隆起型病灶的诊断准确性相对高于凹陷性病变. 低频(7.5-12 MHz)超声探头探查时, 食管壁仅能显示5-7层, 因此, 若要鉴别sm1和sm2, 必须使用高频(15-30 MHz)探头进行扫查. 日本学者认为黏膜肌层以深200 μ拉唑m1, 但由于此微细的距离很难把握, 因此并不太适用于临床. 诸琦等认为对sm1和sm2的鉴别的关键是食管壁超声9层结构中内侧第3层(黏膜肌层)是否完整, 若完整则为sm1, 反之为sm2、sm3. 荟萃分析发现日本学者报道的检查准确率要明显高于欧美学者的结果, 说明操作者的经验对检查结果有影响[10]. 本组44例患者术前均行超声胃镜检查, 病变侵及m1+m2、m3和sm1层分别为19、18和5例, 仅2例患者为sm2浸润, 但患者强烈要求行内镜下治疗. 术前均行胸部CT检查, 并无周围淋巴结转移的证据, 符合食管ESD的适应证.
食管ESD术后并发症主要是出血、穿孔和狭窄, 周平红等[11]报道20例食管ESD患者出血和穿孔率均为5%, Fujishiro等[12]43例食管ESD术后穿孔和狭窄的发生率分别为6.9%和16%. 本研究中出血、穿孔和狭窄发生率分别为4.5%(2/44)、4.5%(2/44)和6.8%(3/44). 2例出血其中1例是术中出血, 出血量较大, 行内镜下止血后择期重新行ESD术. 另1例为糖尿病患者术后第3天出血, 亦经内镜下成功止血, 考虑可能与糖尿病患者创面修复缓慢有关. 2例穿孔均在术中发现, 予钛夹闭合创面后, 予禁食、持续胃肠减压、抗感染等治疗后痊愈. 3例术后狭窄发生于术后0.5-1.0 mo, 这3例患者均为环周型病变, 其中最长一例达7 cm, 历时约7 h完成剥离. 术后患者多次行食管气囊扩张术或予放置食管支架, 生活质量下降, 医疗费用显著增加. 术后食管狭窄是ESD治疗的远期并发症之一, 既往治疗方法主要是反复内镜下扩张或支架植入, 不仅加重了患者患者的痛苦, 而且经济负担较大. 目前, 已有学者致力于研究预防ESD术后食管的狭窄, 主要包括术中糖皮质激素或抗肿瘤药物(如丝裂霉素)内镜下注射治疗[13-15], 与对照组比较, 狭窄率明显减低, 为缓解食管ESD术后狭窄提供了新思路. Fujishiro等[12]随访43例食管ESD患者17 mo, 术后复发率为2.3%. 而本组44例患者随访48-72 mo不等, 1例术后3 mo复发, 复发率亦为2.3%(1/44). 所有患者仅1例死亡, 且并非死于食管癌本身.
随着内镜技术的进步, ESD成功率明显提高. 本研究中成功率达100%, 早期食管癌及癌前病变患者接受ESD治疗后生存质量和术后生存率都较高, 且随访4-6年后, 有病变残留或复发者比例极少, 表明ESD 治疗早期食管癌及癌前病变安全有效, 且复发率低, 值得临床推广.
一直以来, 手术被认为是食管癌(甚至包括高级别上皮内瘤变或黏膜内癌)的首选方法, 但手术的风险极大, 而且术后生存质量差, 其死亡率和并发症发生率较高, 5年生存率相对较低. 近年来, 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)术开始在国内多家医院开展, 并探索应用于消化系早癌的治疗.
樊晓明, 教授, 主任医师, 复旦大学附属金山医院消化科
ESD治疗早期食管癌, 能否达到根治的效果? 是否易残留、复发? 这些疑虑不仅困扰着患者, 消化科医生亦不能断言. 因此, 内镜治疗后的并发症发生率、术后患者生存质量、生存时间等问题是本文关注的焦点.
文献报道, 国内外内镜专家(周平红及Fujishiro等)ESD治疗早期食管癌的临床并发症主要包括出血、穿孔和术后食管狭窄. 我科ESD治疗后并发症发生率并不高于国内外平均水平, 提示本研究中内镜技术成熟, 研究结果可信, 无偏倚.
本文应用内镜微创的方法治疗早期食管癌, 达到了临床症状缓解率高、并发症发生率低及复发率低的良好疗效. 与外科手术治疗相比, 内镜治疗后的患者创伤小、愈合快、术后生活质量高. 提示对于早期食管癌, 内镜治疗可以代替传统外科手术治疗.
本文通过回顾性研究, 使用ESD治疗早期食管癌, 取得了良好的临床疗效, 且并发症少、复发率低, 为内镜治疗早期食管癌提供了有力的循证医学的证据.
早期食管癌: 食管浅表性新生物包含未侵及基底膜的新生物性病变和侵袭基底膜但深度仅限于黏膜层的癌.
本文探讨了ESD治疗早期食管癌及癌前病变的临床疗效及安全性, 为早期食管癌的内镜下治疗提供了经验.
编辑: 郭鹏 电编:闫晋利
| 1. | Pennathur A, Gibson MK, Jobe BA, Luketich JD. Oesophageal carcinoma. Lancet. 2013;381:400-412. [PubMed] [DOI] |
| 2. | Thomas P, Doddoli C, Neville P, Pons J, Lienne P, Giudicelli R, Giovannini M, Seitz JF, Fuentes P. Esophageal cancer resection in the elderly. Eur J Cardiothorac Surg. 1996;10:941-946. [PubMed] |
| 3. | Herbella FA, Patti MG. Minimally invasive esophagectomy. World J Gastroenterol. 2010;16:3811-3815. [PubMed] |
| 5. | Zhang Y. Epidemiology of esophageal cancer. World J Gastroenterol. 2013;19:5598-5606. [PubMed] [DOI] |
| 6. | Lin Y, Totsuka Y, He Y, Kikuchi S, Qiao Y, Ueda J, Wei W, Inoue M, Tanaka H. Epidemiology of esophageal cancer in Japan and China. J Epidemiol. 2013;23:233-242. [PubMed] |
| 7. | Inoue H, Kumagai Y, Yoshida T, Kawano T, Endo M, Iwai T. High-magnification endoscopic diagnosis of the superficial esophageal cancer. Digest Endosc. 2000;12:32-35. [DOI] |
| 9. | Pech O, Günter E, Dusemund F, Origer J, Lorenz D, Ell C. Accuracy of endoscopic ultrasound in preoperative staging of esophageal cancer: results from a referral center for early esophageal cancer. Endoscopy. 2010;42:456-461. [PubMed] [DOI] |
| 10. | Thosani N, Singh H, Kapadia A, Ochi N, Lee JH, Ajani J, Swisher SG, Hofstetter WL, Guha S, Bhutani MS. Diagnostic accuracy of EUS in differentiating mucosal versus submucosal invasion of superficial esophageal cancers: a systematic review and meta-analysis. Gastrointest Endosc. 2012;75:242-253. [PubMed] [DOI] |
| 12. | Fujishiro M, Yahagi N, Kakushima N, Kodashima S, Muraki Y, Ono S, Yamamichi N, Tateishi A, Shimizu Y, Oka M. Endoscopic submucosal dissection of esophageal squamous cell neoplasms. Clin Gastroenterol Hepatol. 2006;4:688-694. [PubMed] |
| 13. | Hanaoka N, Ishihara R, Takeuchi Y, Uedo N, Higashino K, Ohta T, Kanzaki H, Hanafusa M, Nagai K, Matsui F. Intralesional steroid injection to prevent stricture after endoscopic submucosal dissection for esophageal cancer: a controlled prospective study. Endoscopy. 2012;44:1007-1011. [PubMed] [DOI] |
| 14. | Hashimoto S, Kobayashi M, Takeuchi M, Sato Y, Narisawa R, Aoyagi Y. The efficacy of endoscopic triamcinolone injection for the prevention of esophageal stricture after endoscopic submucosal dissection. Gastrointest Endosc. 2011;74:1389-1393. [PubMed] [DOI] |