修回日期: 2014-12-26
接受日期: 2014-12-31
在线出版日期: 2015-02-08
目的: 观察在大鼠急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)时胰腺组织中硫氧还蛋白-2(thioredoxin-2, Trx-2)的表达, 探讨褪黑素对胰腺保护作用与Trx-2表达的关系.
方法: 72只♂SD大鼠随机分为ANP组(A组)、褪黑素干预组(M组)、对照组(C组), 每组24只. A组、M组腹腔注射6%左旋精氨基酸25 mL/kg体质量3次, 诱发ANP; M组在首次注射左旋精氨基酸前0.5 h腹腔注射0.25%褪黑素20 mL/kg体质量, 而A组首次注射左旋精氨基酸前0.5 h腹腔注射生理盐水20 mL/kg体质量; C组同法注射等量生理盐水. 各组大鼠在末次腹腔注射后6、12、24 h分批处死. 光镜下观察胰腺病理改变并进行评分. RT-PCR检测胰腺Trx-2 mRNA水平, 并检测胰腺组织中丙二醛(malondialdehyde, MDA)和髓过氧化物酶(myeloperoxidase, MPO)含量.
结果: A组各时点胰腺病理评分显著高于C组, 而Trx-2 mRNA表达较C组显著降低(均P<0.05), MPO和MDA较C组显著升高(均P<0.05). M组各时点胰腺病理评分较A组降低, Trx-2 mRNA较A组显著升高(P<0.05). MPO和MDA较A组显著降低(均P<0.05).
结论: Trx-2在ANP时的表达显著降低; 外源性褪黑素可通过促进Trx-2的表达, 减轻胰腺组织的损伤.
核心提示: 硫氧还蛋白-2(thioredoxin-2, Trx-2)是一种主要存在于线粒体的强效抗氧化剂, 在防止线粒体氧化应激方面, 比Trx-1更具重要作用. 褪黑素可通过提高Trx-2的表达水平, 减轻胰腺组织的损伤.
引文著录: 赵晖, 黄滟添, 钟卫一, 梁金仙, 唐国都. 褪黑素干预对硫氧还蛋白-2表达的影响及胰腺组织的保护作用. 世界华人消化杂志 2015; 23(4): 596-601
Revised: December 26, 2014
Accepted: December 31, 2014
Published online: February 8, 2015
AIM: To assess the effect of melatonin pre-intervention on the expression of thioredoxin-2 (Trx-2) and to explore the relationship between the protective effects of melatonin on the pancreas and the expression of Trx-2 in rats with acute necrotizing pancreatitis (ANP).
METHODS: Male Spraque-Dawley rats (n = 72) were randomly divided into an ANP group (group A), a melatonin pre-intervention (group M), and a control group (group C), with 24 rats in each group. The rats in group A received three intraperitoneal injections of 6% L-arginine at 25 mL/kg body weight with an interval of 1 h to induce ANP. The rats in group M received intraperitoneal injections of 0.25% melatonin at 20 mL/kg body weight 30 min before ANP induction. The rats in groups A and C received intraperitoneal injections of the same amount of saline. Rats were sacrificed 6, 12 and 24 h after ANP induction. The pathological evaluation of pancreatic tissues was performed. The concentrations of malondialdehyde (MDA) and myeloperoxidase (MPO) were measured and the expression of Trx-2 mRNA in pancreatic tissues was determined by RT-PCR.
RESULTS: In group A, the pathologic score and the concentrations of MDA and MPO in pancreatic tissues were significantly higher, and the expression of Trx-2 mRNA was significantly lower than those in group C (P < 0.05). In group M, the pathologic score and the concentrations of MDA and MPO in pancreatic tissues were significantly lower, and the expression of Trx-2 mRNA was significantly higher than those in group A (P < 0.05).
CONCLUSION: The expression of Trx-2 mRNA in pancreatic tissues is significantly decreased in rats with ANP. Melatonin pre-intervention can promote pancreatic tissues to express Trx-2 mRNA and thus exert a protective effect against pancreatic tissue injury.
- Citation: Zhao H, Huang YT, Zhong WY, Liang JX, Tang GD. Effect of melatonin pre-intervention on expression of thioredoxin-2 in pancreatic tissue of rats with acute necrotizing pancreatitis: Implications for protective effects of melatonin. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 596-601
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/596.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.596
急性胰腺炎发病机制与氧化应激有关, 抗氧化剂的应用可能改善急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)的预后. 硫氧还蛋白-2(thioredoxin-2, Trx-2)是存在于细胞线粒体一种氧化还原蛋白[1], 研究[2,3]揭示, Trx-2在防止线粒体氧化应激方面, 比Trx-1更具重要作用. 本文通过应用外源性褪黑素干预ANP大鼠, 观察胰腺组织Trx-2 mRNA表达及胰腺组织病理损伤、氧化应激相关指标的变化, 探讨Trx-2在ANP的表达与及褪黑索对胰腺组织保护作用的相关机制.
健康♂SD大鼠72只, 清洁级, 体质量200-250 g(由广西医科大学实验动物中心提供); 左旋精氨基酸(Sigma公司); 褪黑素(Sigma公司); RNA simple Total RNA Kit (Tiangen公司); RevertAidTM First Strand cDNA Synthesis Kit(Fermentas公司); SYBR Premix Ex TaqTM(TaKaRa公司).
1.2.1 分组及造模: 72只大鼠按随机表法分成ANP组(A组)、褪黑素组(M组)和对照组(C组), 每组24只. 模型建立: 各组大鼠实验前禁食12 h. 自由饮水; A组和M组腹腔注射6%左旋精氨基酸25 mL/kg体质量3次, 诱发ANP; M组在首次注射左旋精氨基酸前0.5 h腹腔注射0.25%褪黑素20 mL/kg体质量, 而A组首次注射左旋精氨基酸前0.5 h腹腔注射生理盐水20 mL/kg体质量; C组则腹腔注射等容积的生理盐水. 末次腹腔注射后6、12、24 h按时点分批处死大鼠. 留取动脉血和胰腺组织标本.
1.2.2 胰腺病理学检查: 胰腺组织常规固定、石蜡包埋、切片及HE染色. 光镜下观察大鼠胰腺病理改变, 参考Kusske等[4]的标准评分.
1.2.3 胰腺组织丙二醛和髓过氧化物酶的测定: 先制备胰腺组织匀浆, 采用微量丙二醛(malondialdehyde, MDA)试剂盒和髓过氧化物酶(myeloperoxidase, MPO)试剂盒(南京建成生物工程研究所), 按操作说明书, 使用紫外分光光度仪进行.
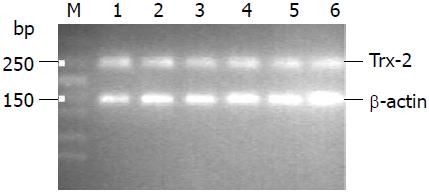
1.2.4 RT-PCR检测胰腺组织Trx-2 mRNA的表达: 取胰腺组织各约50 mg, 用RNA simple Total RNA Kit提取总RNA, 以RevertAidTM First Strand cDNA Synthesis Kit逆转录成cDNA, 采用SYBR Premix Ex TaqTM荧光实时定量PCR扩增目的片段. 据GenBank中的基因序列自行设计引物, 由上海生工生物工程公司合成. Trx-2 mRNA引物, Sense: 5'-TGGGCTTCCCTCACCTCTAC-3', Anti-Sense: 5'-GCTGTTTGGCTACCATCTTC-3', 产物长度253 bp; β-actin引物, Sense: 5'-CCCATCTATGAGGGTTACGC-3', Anti-Sense: 5'-TTTAATGTCACGCACGATTTC-3', 产物长度150 bp. 反应条件为: 94 ℃ 30 s; 94 ℃ 30 s, 56 ℃ 30 s ,72 ℃ 30 s, 40个循环; 最后72 ℃ 2 min最后融解曲线分析从56 ℃起, 每增0.5 ℃进行读板, 直到94 ℃. 每次扩增设无cDNA的阴性对照. 在I-Cycler IQ型实时荧光定量PCR仪(Bio-Rad公司)上扩增并分析结果(样品的Trx-2 mRNA表达值 = Trx-2 mRNA起始拷贝数/β-actin起始拷贝数).
统计学处理 应用SPSS16.0统计分析软件处理, 各组计量资料以mean±SD表示, 行单因素方差分析, P<0.05为差异有统计学意义.
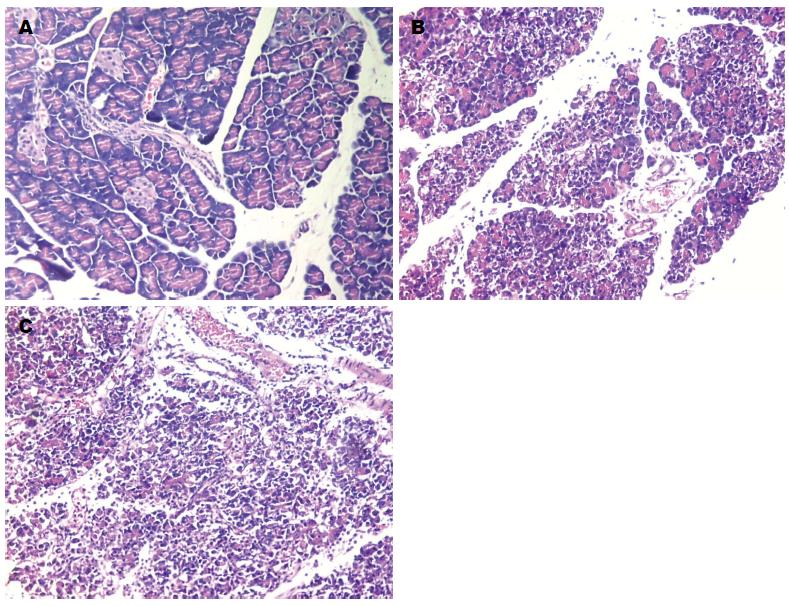
C组大鼠肉眼观无变化; 镜下见胰腺腺泡结构完整, 腺小叶清晰, 偶见水肿或少量炎性细胞浸润. A组大鼠胰腺外观为灰白或暗紫色, 腹腔内有淡黄色或血性腹水, 可见部分腹腔脏器黏连、脂肪皂化; 镜下见胰腺腺泡水肿, 炎性细胞浸润, 组织坏死出血, 腺小叶结构消失, 偶见灶状或大片凝固性坏死. 病理变化随时间延长而加重, 符合ANP的病理改变; M组大鼠胰腺的病理学变化较ANP组显著减轻. 各组胰腺病理分值(表1). 镜下观察情况如图1.
| 分组 | 时间(h) | 病理分值 | MDA(nmol/mg prot) | MPO(nmol/mg prot) | Trx-2 mRNA |
| C组 | 6 | 0.14±0.37 | 1.68±0.57 | 2.11±0.36 | 2.24±0.39 |
| 12 | 0.14±0.37 | 1.63±0.32 | 2.79±0.64 | 2.18±0.16 | |
| 24 | 0.33±0.51 | 1.64±0.34 | 3.13±1.09 | 1.94±0.25 | |
| A组 | 6 | 4.50±1.19 | 3.22±1.21a | 5.90±1.18a | 1.45±0.26a |
| 12 | 5.75±1.49a | 4.13±1.85a | 7.45±1.26a | 1.62±0.14a | |
| 24 | 8.43±1.39 | 5.07±1.97a | 9.09±1.56a | 1.29±0.18a | |
| M组 | 6 | 3.50±0.75 | 2.56±0.65ac | 4.002±0.709ac | 2.88±0.62a |
| 12 | 4.12±2.35 | 3.47±1.35ac | 5.319±1.060ac | 2.21±0.08a | |
| 24 | 7.12±1.55 | 4.12±0.93ac | 5.893±1.135ac | 2.43±0.11a |
A组胰腺组织MDA及MPO水平均较对照组显著升高, 而M组较A组显著降低, 但仍显著高于C组(表1).
A 组胰腺组织Trx-2 mRNA的表达量均较M组和C组显著减少, M组和C组间差异无统计学意义. 3组内各时点比较差异无统计学意义(表1, 图2-4) .
Trx一个广泛分布的氧化还原蛋白, 通过二硫化物活性中心可逆地催化许多氧化还原反应, 参与机体多种生物学活动, 其中最为重要是参与氧化应激的调节机制[5]. Trx通过与氧化还原活性中心(Cys-Gly-Pro-Cys)Trx形成巯基, 还原含半胱氨酸的氧化型蛋白质, 反过来又被Trx还原酶和二氢烟酰胺腺嘌呤二核苷酸磷酸盐还原, 还原型Trx过氧化物酶清除活性氧[6]. 目前发现的硫氧还蛋白有Trx-1、Trx-2、TRP14[7]和Trx80[8]. 与人类Trx-1结构比较, 人类Trx-2多了一个N-末端结构域, 他包含两个高度保守的CXXC结构, 被15-16残基所分离[9]. 这两个CXXC结构紧密协调一个锌原子, 被确定为第一个锌结合Trx, 在体外通过H2O2处理锌结合半胱氨酸, 氧化CXXC结构释放释放锌, 造成蛋白质的重大构象变化, 自由锌蛋白保存他的还原酶活性, 研究显示, 锌中心可能发挥氧化还原开关的作用, 改变一个尚未确定的活动[9]. Trx-2锌结合蛋白的特点是锌极端的亲和力, 他远远高于已报告任何锌结合蛋白的亲和常数, 因此, 这种锌结合蛋白显得更加稳定[10]. Ritz等[11]认为, Trx-2可相当于Trx-1, 在氧化应激条件下, 可以作为一个备份系统. 研究[12,13]表明, Trx-1和Trx-2过量表达协同阻止多种炎性因子(肿瘤坏死因子、活性氧、凋亡信号调节激酶1)诱导的细胞死亡. 最近研究[3]揭示, 线粒体在细胞凋亡信号转导中发挥关键作用, 而Trx-2在参与线粒体介导的凋亡途径和防止线粒体氧化应激方面, 比Trx-1更具重要作用.
褪黑素是松果体分泌的主要激素, 他广泛存在于机体的许多组织中, 具有调节睡眠、生殖、免疫、情绪、抗氧化、抗衰老等多种生理功能. 近年来, 研究的重点向其抗氧化作用倾斜, 越来越多的研究表明他能保护细胞核DNA、膜脂质、胞浆蛋白等生物大分子免受氧化损伤[14], 是目前已知抗氧化作用最强的自由基清除剂, 他能有效地清除羟自由基、过氧烷自由基、过氧亚硝基、超氧阴离子及单线态氧[15]. 目前认为其抗氧化作用的机制主要包括两方面: 一方面, 他能以电子供体的形式直接中和大量的自由基、活性氧和一氧化氮; 另一方面, 通过激活若干抗氧化酶类的活性, 起间接地抗氧化作用[16]. 大多数分子的抗氧化作用受特定细胞间的分布限制, 而褪黑素能跨越任何形态的屏障进入任何细胞[15,16]. 实验表明褪黑素能减轻多种物质诱导的多种组织的氧化应激反应. 在雨蛙素诱导的大鼠ANP模型, 褪黑素能降低胰腺及肝脏组织的MDA的含量, 提高过氧化氢酶、谷胱甘肽过氧化物酶的含量, 从而减轻胰腺及肝脏组织的病理损伤[17]. 褪黑素提高Mn-SOD、Cu/Zn-SOD在胰腺及Cu/Zn-SOD在肝脏组织的活性. 褪黑素前干预ANP能显著的减轻胰腺组织的脂质过氧化反应、减少MPO及IL-6的含量[18]. 在大鼠免疫性结肠炎动物模型, 褪黑素可明显改善大鼠结肠炎的症状, 减轻结肠黏膜的损伤和炎症程度, 实验发现褪黑素可显著降低大鼠结肠中IL-1、IL-2、IL-8和TNF-α的含量; 可显著抑制结肠核因子-κB(nuclear factor-κB, NF-κB)的表达, 促进IκB表达, 推测褪黑素可能通过清除活性氧及抑制NF-κB激活水平, 下调炎性细胞因子的表达, 在一定程度上纠正结肠局部免疫功能紊乱的状态, 阻断炎性肠病免疫紊乱过程的发生, 达到了抗结肠炎的作用[19].
本实验结果显示, ANP大鼠胰腺组织的Trx-2 mRNA的表达较对照组显著降低, 可能与胰腺损伤有关, 外源性给予褪黑素干预可将Trx-2 mRNA的表达水平提高到正常水平, 从而提高胰腺组织的抗氧化能力. 本实验给予褪黑素干预可显著降低ANP大鼠胰腺组织的MDA、MPO水平, 减轻胰腺的病理改变, 表明外源性褪黑素对胰腺组织的损伤有保护作用.
急性胰腺炎发病机制与氧化应激有关, 氧化应激时产生大量氧化物造成胰腺细胞的损伤, 是急性胰腺炎发病的重要机制之一, 褪黑素和硫氧还蛋白都有抗氧化剂作用, 褪黑素干预对硫氧还蛋白-2(thioredoxin-2, Trx-2)表达造成何种影响, 至今尚无两者相互作用的研究报道.
刘超, 教授, 主任医师, 中山大学孙逸仙纪念医院(附属第二医院)肝胆胰外科; 蔡全才, 副教授, 中国人民解放军第二军医大学附属长海医院临床流行病学与循证医学中心
褪黑素是松果体分泌的主要激素, 具有多种生理功能. 近年来, 研究的重点向其抗氧化作用倾斜. 目前认为其抗氧化作用的机制主要包括两方面: 一方面, 他能以电子供体的形式直接中和大量的自由基、活性氧和一氧化氮; 另一方面, 通过激活若干抗氧化酶类的活性, 起间接地抗氧化作用.
Eriko等检测细胞活力、细胞死亡的动力学等指标来评估Trx-2对视网膜色素上皮细胞株氧化应激的保护作用, 结果提示在使用低浓度的氧化应激诱导剂时, Trx-2过表达的细胞死亡的显著减少. 在诱导氧化应激的早期后Trx-2在维持细胞活力方面起的关键作用.
本研究立题新颖, 试验设计合理, 数据真实, 结论可靠.
编辑: 郭鹏 电编:闫晋利
广西壮族自治区卫生厅自筹经费科研基金资助项目, No. Z2012-225
广西科学基金资助项目, No. 桂科自0728107
| 1. | Smeets A, Evrard C, Landtmeters M, Marchand C, Knoops B, Declercq JP. Crystal structures of oxidized and reduced forms of human mitochondrial thioredoxin 2. Protein Sci. 2005;14:2610-2621. [PubMed] [DOI] |
| 2. | Weichsel A, Gasdaska JR, Powis G, Montfort WR. Crystal structures of reduced, oxidized, and mutated human thioredoxins: evidence for a regulatory homodimer. Structure. 1996;4:735-751. [PubMed] [DOI] |
| 3. | Sugano E, Murayama N, Takahashi M, Tabata K, Tamai M, Tomita H. Essential role of thioredoxin 2 in mitigating oxidative stress in retinal epithelial cells. J Ophthalmol. 2013;2013:185825. [PubMed] |
| 4. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] [DOI] |
| 5. | Andoh T, Chiueh CC, Chock PB. Cyclic GMP-dependent protein kinase regulates the expression of thioredoxin and thioredoxin peroxidase-1 during hormesis in response to oxidative stress-induced apoptosis. J Biol Chem. 2003;278:885-890. [PubMed] [DOI] |
| 6. | Powis G, Briehl M, Oblong J. Redox signalling and the control of cell growth and death. Pharmacol Ther. 1995;68:149-173. [PubMed] [DOI] |
| 7. | Wei J, Ji H, Guo M, Yan Y, Qin Q. Identification and characterization of TRP14, a thioredoxin-related protein of 14 kDa from orange-spotted grouper, Epinephelus coioides. Fish Shellfish Immunol. 2013;35:1670-1676. [PubMed] [DOI] |
| 8. | Lemarechal H, Anract P, Beaudeux JL, Bonnefont-Rousselot D, Ekindjian OG, Borderie D. Expression and extracellular release of Trx80, the truncated form of thioredoxin, by TNF-alpha- and IL-1beta-stimulated human synoviocytes from patients with rheumatoid arthritis. Clin Sci (Lond). 2007;113:149-155. [PubMed] [DOI] |
| 9. | Collet JF, D'Souza JC, Jakob U, Bardwell JC. Thioredoxin 2, an oxidative stress-induced protein, contains a high affinity zinc binding site. J Biol Chem. 2003;278:45325-45332. [PubMed] [DOI] |
| 10. | Hunt JA, Fierke CA. Selection of carbonic anhydrase variants displayed on phage. Aromatic residues in zinc binding site enhance metal affinity and equilibration kinetics. J Biol Chem. 1997;272:20364-20372. [PubMed] [DOI] |
| 11. | Ritz D, Patel H, Doan B, Zheng M, Aslund F, Storz G, Beckwith J. Thioredoxin 2 is involved in the oxidative stress response in Escherichia coli. J Biol Chem. 2000;275:2505-2512. [PubMed] [DOI] |
| 12. | Tournier C, Hess P, Yang DD, Xu J, Turner TK, Nimnual A, Bar-Sagi D, Jones SN, Flavell RA, Davis RJ. Requirement of JNK for stress-induced activation of the cytochrome c-mediated death pathway. Science. 2000;288:870-874. [PubMed] [DOI] |
| 13. | Deng Y, Ren X, Yang L, Lin Y, Wu X. A JNK-dependent pathway is required for TNFalpha-induced apoptosis. Cell. 2003;115:61-70. [PubMed] [DOI] |
| 14. | Reiter RJ, Tan DX, Cabrera J, D'Arpa D. Melatonin and tryptophan derivatives as free radical scavengers and antioxidants. Adv Exp Med Biol. 1999;467:379-387. [PubMed] [DOI] |
| 15. | Poeggeler B, Saarela S, Reiter RJ, Tan DX, Chen LD, Manchester LC, Barlow-Walden LR. Melatonin--a highly potent endogenous radical scavenger and electron donor: new aspects of the oxidation chemistry of this indole accessed in vitro. Ann N Y Acad Sci. 1994;738:419-420. [PubMed] |
| 16. | Reiter RJ, Tan DX, Allegra M. Melatonin: reducing molecular pathology and dysfunction due to free radicals and associated reactants. Neuro Endocrinol Lett. 2002;23 Suppl 1:3-8. [PubMed] |
| 17. | Eşrefoğlu M, Gül M, Ates B, Batçioğlu K, Selimoğlu MA. Antioxidative effect of melatonin, ascorbic acid and N-acetylcysteine on caerulein-induced pancreatitis and associated liver injury in rats. World J Gastroenterol. 2006;12:259-264. [PubMed] |
| 18. | Szabolcs A, Reiter RJ, Letoha T, Hegyi P, Papai G, Varga I, Jarmay K, Kaszaki J, Sari R, Rakonczay Z. Effect of melatonin on the severity of L-arginine-induced experimental acute pancreatitis in rats. World J Gastroenterol. 2006;12:251-258. [PubMed] |
| 19. | 梅 俏, 许 建明, 赵 宗豪, 吴 军, 胡 咏梅, 徐 新华. 褪黑素影响免疫性结肠炎的几种炎性细胞因子表达检测. 中华微生物学和免疫学杂志. 2004;24:711-714. |