修回日期: 2014-12-18
接受日期: 2014-12-30
在线出版日期: 2015-02-08
目的: 探讨蒿甲醚(artemether, ART)在体外以及荷瘤小鼠体内对于人胃癌SGC-7901细胞的杀伤作用及增殖抑制作用及具体机制.
方法: 采用MTT法检测不同浓度ART在体外环境下对于人胃癌细胞株SGC-7901的抑制作用, 采用流式细胞术对经过不同浓度的ART处理后的人胃癌SGC-7901细胞进行细胞周期分析, 检测凋亡情况. 建立人胃癌裸鼠移植瘤模型, 通过计算肿瘤体积和抑瘤率探讨ART在荷瘤裸鼠体内的抗肿瘤作用. 利用Western blot方法探讨ART抑制肿瘤细胞生长增殖的具体机制.
结果: MTT结果显示, 相比于对照组ART对该株肿瘤细胞具有显著的杀伤作用(P<0.05), 分析应用的ART变化、作用时间和细胞不良反应变化关系发现, ART对于人胃癌细胞株SGC-7901杀伤作用呈现时间依赖和剂量依赖特性(P<0.05); FCM检测结果表明, ART抑制癌细胞增殖的机制主要是在于阻滞细胞周期进程, 使其细胞周期停滞于G0/G1期和诱导细胞凋亡; 与对照组比较, 中、高剂量ART组对人胃癌SGC-7901细胞裸鼠移植瘤的生长抑制效果最明显(P<0.05), 抑瘤率分别为34.5%和41.0%. Western blot法检测发现ART处理后细胞增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)蛋白表达量下降, Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)蛋白表达量上升(P<0.05).
结论: ART对人胃癌细胞株SGC-7901有较明显的细胞毒效应, 且具有时间依赖性和剂量依赖性; 其抑制作用与阻滞细胞周期进程和诱导细胞凋亡有关. ART对人胃癌SGC-7901细胞裸鼠移植瘤的生长具有明显的抑制作用, ART阻滞细胞周期进程和诱导细胞凋亡可能与抑制PCNA、Bcl-2蛋白表达, 促进Bax蛋白表达相关.
核心提示: 蒿甲醚(artemether, ART)在抑制荷鼠瘤的肿瘤生长的同时并不影响其生活状态, 其对肿瘤组织的抑制作用表现为剂量依赖性, 高、中、低不同剂量的ART的抑瘤率分别为41.0%、34.5%、16.9%. 说明ART具有抑制肿瘤生长的作用且随剂量的增加而增加.
引文著录: 李遐方, 刘萍霞. 蒿甲醚在体外及荷瘤小鼠体内条件下抑制人胃癌SGC-7901细胞增殖的机制. 世界华人消化杂志 2015; 23(4): 590-595
Revised: December 18, 2014
Accepted: December 30, 2014
Published online: February 8, 2015
AIM: To investigate the inhibitory effect of artemether (ART) on cell proliferation and apoptosis in human gastric adenocarcinoma cell line and tumor growth in tumor bearing mice.
METHODS: The inhibitory effect of ART on cell proliferation in human gastric cancer cell line SGC-7901 was detected by MTT assays, and the effects on cell cycle and apoptosis were evaluated by flow cytometry. The anti-tumor effect of ART was observed in tumor bearing nude mice by measuring mice weight and diameter and calculating tumor volume and tumor growth inhibition rate. The mechanism underlying the effects of ART on cell proliferation and apoptosis was explored by Western blot.
RESULTS: MTT assays showed that ART inhibited SGC-7901 cell growth in a time- and dosage-dependent manner (P < 0.05). The results of flow cytometry demonstrated that ART treatment induced cell arrest at G0/G1 phase and cell apoptosis. Medium- and high-dose ART had significant anti-tumor effects in human gastric cancer cell bearing mice, and the inhibition rates were 34.5% and 41.0%, respectively. ART treatment up-regulated proliferating cell nuclear antigen (PCNA) and B-cell lymphoma-2 (Bcl-2) expression, and down-regulated Bcl-2 associated X protein (Bax) expression (P < 0.05).
CONCLUSION: ART can inhibit proliferation and induce arrest cell cycle and apoptosis in SGC-7901 cells in vitro as well as tumor growth in vivo.
- Citation: Li XF, Liu PX. Artemether inhibits human gastric cancer cell proliferation in vitro and tumor growth in tumor bearing mice. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 590-595
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/590.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.590
胃癌是消化系最常见的恶性肿瘤之一, 在我国其发病率居各种肿瘤的首位[1-3]. 由于胃癌在早期极难发现, 只能采取放化疗治疗, 所以找到一种能够有效抑制胃癌细胞增殖的药物显得十分重要[4,5]. 青蒿素是从菊科植物黄花蒿叶中提取分离得到的一种具有内过氧桥基团的倍半萜内酯类化合物, 蒿甲醚(artemether, ART)是青蒿素的衍生物之一, 目前主要用于临床抗疟治疗[6]. 近年来的研究[7]进一步发现青蒿类药物具有抗肿瘤活性作用. 最近一些研究提示ART抗癌作用主要是在于其可以抑制肿瘤细胞增殖, 诱导肿瘤细胞凋亡, 抑制血管生成的方面. 本文研究分析了ART对体外培养的人胃癌细胞SGC-7901细胞周期和凋亡的影响; 并采用人胃癌细胞SGC-7901建立裸鼠移植瘤模型, 观察ART对移植瘤生长的抑制作用.
胃癌细胞株SGC-7901购自中国科学院上海细胞生物学研究所, 用含10%胎牛血清的RPMI 1640培养基培养. 为抑制血清中的氨基氧化酶, 向培养液中加入终浓度为1 mmol/L的氨基胍. RPMI 1640为美国Gibco公司产品; 青蒿素、胰蛋白酶(trypsin)、噻唑蓝(MTT)均购自美国Sigma公司; 二甲基亚砜(DMSO)购自天津市化学试剂厂; 细胞周期检测试剂盒(Thermo公司); 细胞增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2)及Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)抗体均购自美国Santa Cruz公司.
1.2.1 MTT法检测: ART对SGC-7901细胞增殖的抑制作用取对数生长的SGC-7901细胞, 用完全培养基制成1×105/mL细胞悬液, 加入96孔板中, 每孔100 μL. 培养24 h后, 分别加入10 μL不同浓度的ART, 终浓度分别为1.0、2.0、4.0、8.0 mg/mL, 阴性对照组加入培养基. 每组设5个平行孔, 细胞分别培养24、36、48 h, 实验终止前每孔加入MTT(5 mg/mL)10 μL, 继续培养4 h, 弃去培养液, 加入150 μL DMSO, 震荡15 min, 酶标仪490 nm测定(参考波长620 nm)每孔吸光度(A)值, 计算ART对细胞的抑制率. 抑制率(%) = (1-实验组A值/对照组A值)×100%.
1.2.2 细胞周期分布和凋亡率的检测: 用不同浓度(1.0、2.0、4.0、8.0 mg/mL)的ART作用SGC-7901细胞48 h后, 收集细胞并制成1×106/mL的细胞悬液, 离心1000 r/min×5 min. 弃上清液, 磷酸盐缓冲液(PBS)洗2次, 再将细胞调整为1×106/mL. 加入4 ℃预冷的700 mL/L乙醇1.5 mL, 充分混匀, 待检. 4 ℃冷藏过夜后上机检测, 使用Triton X-100在细胞膜上打孔, 然后以0.5 mL碘化吡啶(PI)(50 mg/L)染液, 闭光染色30 min, 使用流式细胞仪检测, 实验重复3次. 我们所使用的流式细胞仪为FAC Star型FCM, 使用氩离子激光为光源, 分析DNA组方图各时相细胞分布的百分比, 计数G0/G1期、S期、G2/M期细胞百分比例, 并计算细胞凋亡率.
1.2.3 Western blot分析: 用不同浓度(0.0、1.0、2.0、4.0、8.0 mg/mL)的ART作用于SGC-7901细胞48 h后收集细胞, 裂解细胞30 min, 于4 ℃、12000 g离心10 min, 取上清液提取蛋白, 采用改良酚试剂法(Lowry法)定量测定蛋白浓度. 配制5%的浓缩胶及10%的分离胶, 上样前注意防止气泡进入, 并在拔除梳子后, 用ddH2O冲洗2遍, 去除残胶, 并用0.1%SDS封胶, 30 min后上样. 以每孔50 μg蛋白上样, 95 ℃变性10 min. 12%聚丙烯酰胺-SDS凝胶电泳后, 电转移至硝酸纤维素膜上, 5%脱脂奶粉封闭后依次加入一抗和二抗, 室温孵育2 h, TBST缓冲液洗涤5次, 每次10 min. 最后用化学发光法检测膜上的抗原抗体结合区带后放入暗盒中压片并依次显影、定影、拍照, 实验重复3次[8].
1.2.4 Annexin V-PI双染法检测细胞凋亡: 取对数生长的SGC-7901细胞1×106置于培养皿中培养24 h, 贴壁后, 分别加入终浓度为1.0和4.0 mg/mL的ART; 培养48 h后, 胰酶消化后, 离心后弃上清, 加缓冲液200 μL, 分出100 μL作为参照. 各管中分别加入Annexin V 4 μL和PI 5 μL, 加缓冲液至终体积250 μL, 冰浴, 上机检测.
1.2.5 胃癌动物模型的建立: 用颈椎脱臼法处死Balb/c SGC-7901荷瘤裸鼠, 剥离荷瘤鼠的肿瘤组织, 尽量去除坏死瘤组织, 筋膜和结缔组织. 将瘤组织剪成1 mm3大小的组织块, 20号穿刺针塞入瘤组织, 接种到25只Balb/c裸鼠的右腋下, 约15 d肿瘤长至0.7 cm后, 测量肿瘤的大小并把20只荷瘤鼠随机分成4组, 每组5只, N组为乙腈(溶解ART溶剂)组(阴性对照组), L组为低剂量ART组(30 mg/kg), M组中剂量ART组(50 mg/kg), H组为高剂量ART组(60 mg/kg). 所有的实验组动物均隔天行瘤内注射1次, 每次0.2 mL, 共处理4次, 观察荷瘤鼠的生长状态, 并在最后1次用药后2 d用颈椎脱臼法处死荷瘤鼠, 取出肿瘤组织, 应用电子天平称质量, 计算抑瘤率[抑瘤率(%) = (对照组平均瘤质量-实验组平均瘤质量)/对照组平均瘤质量×100%].
统计学处理 采用SPSS13.0统计软件进行数据处理, 结果以mean±SD表示, 各药物处理组均数与对照组比较用LSD-t检验. P<0.05为差异有统计学意义.
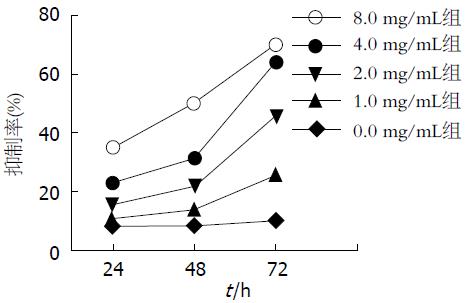
与0.0 mg/mL比较, 1.0和2.0 mg/mL组的ART在48 h时显示了一定得抑制作用, 在72 h的抑制作用更加明显(P<0.05); 当ART的浓度增至4.0和8.0 mg/mL时, 在24 h时就显示了一定的抑制作用, 明显>0.0 mg/mL(P<0.05), 当作用时间延长至48和72 h时, 抑制作用更加明显(P<0.001). 同时由于作用时间的增加我们发现实验组在作用72 h后抑制率明显高于作用24 h(P<0.05)(表1, 图1).
| 蒿甲醚(mg/mL) | 24 h | 48 h | 72 h |
| 0.0 | 8.12±2.10 | 8.51±2.31 | 10.14±2.18 |
| 1.0 | 10.75±2.89 | 14.11±3.75 | 25.63±8.79 |
| 2.0 | 15.33±4.85 | 22.16±7.14 | 45.86±9.25 |
| 4.0 | 23.01±8.25 | 31.47±7.68 | 64.23±6.81 |
| 8.0 | 35.15±9.66 | 50.18±6.02 | 70.24±6.09 |
与对照组比较, 4.0 mg/mL组的ART诱导SGC-7901细胞凋亡的作用较明显, 凋亡率为37.5%±2.1%(P<0.05)(表2).
与对照组比较, 4.0 mg/mL的ART作用与SGC-7901细胞株, 细胞周期变化主要为G0/G1期增加, S期减少, 差异有统计学意义(P<0.01)(表3).
整个实验过程中无一裸鼠死亡, ART组动物状态良好, 进食良好, 活动灵活, 说明ART对荷瘤鼠毒性表现不明显. 对照组出现消瘦, 但活动尚好. 从表4中我们可以看出高剂量组的小鼠最后提取的瘤体组织最少, 而随着药物浓度减少小鼠瘤体组织呈现出增加的趋势, 并且与对照组相比, 实验组小鼠瘤体组织明显减少(P<0.05), 高剂量组P<0.01(表4).
| 分组 | 瘤质量(g) | 平均抑瘤率(%) |
| N组 | 3.618±0.882 | - |
| H组 | 2.133±0.461 | 41.0 |
| M组 | 2.371±0.328 | 34.5 |
| L组 | 3.006±0.217 | 16.9 |
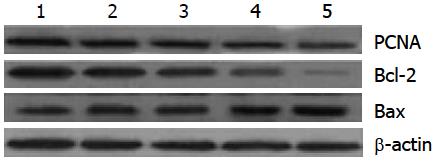
从表5与图2中我们可以发现随着处理的ART浓度增加, 细胞表达的PCNA蛋白量下降而且还出现了浓度依赖关系, 同时Bcl-2蛋白也出现了类似的情况, 但是, Bax蛋白出现了相反的情况, 其表达量随着ART浓度增加而增加也出现了浓度依赖性(图中β-actin为内参)(表5, 图2).
| 蒿甲醚(mg/mL) | PCNA/β-actin | Bax/Bcl-2 |
| 0.0 | 0.98±0.15 | 0.25±0.01 |
| 1.0 | 0.78±0.09 | 0.49±0.02 |
| 2.0 | 0.75±0.10 | 0.92±0.05 |
| 4.0 | 0.42±0.09 | 4.49±0.90 |
| 8.0 | 0.19±0.03 | 7.45±1.14 |
青蒿素类药物是菊科植物黄花蒿叶中提取分离的, 自1971年发现青蒿素是一种具有全新抗疟机制的新药以来, 又相继开发出一系列衍生物, 如二氢青蒿素、青蒿琥酯、ART、蒿乙醚等[9-11], 近年来的研究[8,12,13]进一步发现青蒿类药物除了具有抗疟作用外, 还具有其他多种药理作用. 另有一些研究[14,15]亦表明青蒿素类药物在体内, 体外对消化系、乳腺癌等恶性肿瘤有很好的抑瘤效应.
进来一些研究提示ART在体外试验中对于肿瘤细胞具有较强的抑制作用, 比如对于人急性淋巴细胞白血病CCRF-CEM细胞、人慢性粒细胞白血病细胞株K562等细胞作用较好, 研究提示其作用机理主要在于促进细胞凋亡, 抑制细胞增殖, 为了进一步研究其治疗肿瘤的潜在价值, 本文通过体外研究了ART对人胃癌SGC-7901细胞株的抗肿瘤作用及其对肿瘤细胞周期和凋亡的影响; 并通过建立裸鼠肿瘤模型, 观察ART的体内抗肿瘤效应. 我们的体外研究结果表明, ART对人胃癌细胞SGC-7901具有明显的抑制增殖作用, 且抑制作用与剂量和时间相关, 随着剂量的增加, 作用时间的延长, 对该细胞的抑制率也明显增加. 流式细胞仪检测结果提示1.0 mg/mL和4.0 mg/mL的ART作用该细胞48 h后, 细胞周期被阻滞于G0/G1期, 随着药物浓度的增加, 阻滞作用更加明显, 使得肿瘤细胞无法进入分裂期, 延缓了肿瘤细胞分裂. 凋亡实验表明, 4.0 mg/mL的ART诱导该细胞凋亡的作用比较明显. 相比较于对照组, 经过ART处理后的肿瘤细胞凋亡率明显提高.
体内实验显示, ART在抑制荷鼠瘤体内对于肿瘤组织有抑制其增殖的作用. 对肿瘤组织的抑制作用表现为剂量依赖性, 高、中、低不同剂量的ART的抑瘤率分别为41.0%、34.5%、16.9%. 说明ART具有抑制肿瘤生长的作用且随剂量的增加而增加. 不仅如此, 阴性对照组和实验组的小鼠在接受注射后依然活泼好动, 没有出现厌食厌水, 活动能力下降等情况, 提示我们的药物及其溶剂对于小鼠不良反应不明显.
为了进一步探究ART抑制肿瘤细胞的具体蛋白机制, 我们做了Western blot. 主要针对以往已经被证实在细胞凋亡及细胞增殖中调控中起到重要的几个蛋白, PCNA、Bax及Bcl-2. PCNA蛋白是只有在细胞增殖时才表达的一种核内蛋白. 他的表达情况已经被广泛用于评估细胞增殖状态. 我们在研究中发现, 随着受到ART处理浓度的升高, 在受到处理48 h时, 我们发现肿瘤细胞中PCNA表达量出现了较为明显的下降, 并且还呈现出明显的剂量依赖性. 这表明ART极有可能是通过抑制肿瘤细胞中PCNA表达来阻滞肿瘤细胞细胞周期进程, 使之停滞在G0/G1期.
肿瘤细胞的无序增殖正是由于其凋亡信号出现异常. 在细胞凋亡过程中, Bcl-2的作用显得尤为重要. Bcl-2是一种原癌基因. 他的主要作用是抑制细胞色素C的表达. Bcl-2还可以引起细胞核谷胱甘肽的积聚. 他的过度表达可以让Caspase这种在细胞凋亡过程中起到关键作用基因的活性受到影响. Bax也是Bcl-2家族中的一个基因, 他常以与Bcl-2形成二聚体的形式存在, 具有促进细胞凋亡的作用. Bax有两种存在方式, 一种是与Bcl-2形成二聚体, 第二种是与自身形成二聚体. 当细胞内的Bax增多时, Bax-Bax二聚体增加, 细胞呈现出明显的凋亡趋势. 反之, 胞浆中的Bax-Bcl-2二聚体增多, 细胞凋亡趋势减弱. 因此Bax和Bcl-2比值有着提示细胞凋亡的作用. 我们发现, SGC-7901细胞在接受ART作用48 h后, 肿瘤细胞中Bcl-2的表达出现下降, Bax表达出现增高, 两者变化程度随着ART浓度增加而显著, 从而提高了Bax/Bcl-2比值. 这提示ART抑制肿瘤细胞增殖的途径除了通过下调PCNA蛋白, 阻滞细胞周期进程, 还可以通过上调Bax/Bcl-2比值, 促进肿瘤细胞凋亡.
青蒿类药物的抗肿瘤作用还具有作用靶点多, 选择性杀伤肿瘤细胞, 对正常组织细胞毒性较低、可以逆转肿瘤细胞的多药耐药现象等特点, 但是其作用机制还需要更加深入的探讨.
胃癌是消化系最常见的恶性肿瘤之一, 在我国其发病率居各种肿瘤的首位. 早期胃癌多无症状或仅有轻微症状, 大多数患者就诊时病变已属晚期, 失去了治疗的最佳时期.
郑鹏远, 教授, 主任医师, 博士生导师, 副院长, 郑州大学第二附属医院消化科
胃癌在不同的国家发病率的明显差异说明与环境因素有关, 其中最主要的是不合理的饮食结构、不良的生活习惯导致的. 我国是胃癌的高发国家, 虽然整体发病率呈现下降趋势, 但是死亡率仍然居高不下, 胃癌的治疗仍然是肿瘤治疗的难点.
青蒿素是从菊科植物黄花蒿叶中提取分离得到的一种具有内过氧桥基团的倍半萜内酯类化合物, 蒿甲醚(artemether, ART)是青蒿素的衍生物之一, 目前主要用于临床抗疟治疗. 近年来的研究进一步发现青蒿类药物具有抗肿瘤活性作用.
本文分析了ART对体外培养的人胃癌细胞SGC-7901细胞周期和凋亡的影响; 并采用人胃癌细胞SGC-7901建立裸鼠移植瘤模型, 观察ART对移植瘤生长的抑制作用.
青蒿类药物的抗肿瘤作用还具有作用靶点多, 选择性杀伤肿瘤细胞, 对正常组织细胞毒性较低、可以逆转肿瘤细胞的多药耐药现象等特点.
青蒿素: 从菊科植物黄花蒿叶中提取分离得到的一种具有内过氧桥基团的倍半萜内酯类化合物, ART是青蒿素的衍生物之一, 目前主要用于临床抗疟治疗.
本研究采用体外和体内实验研究不同浓度的ART对胃癌细胞的影响, 具有一定的创新性.
编辑: 韦元涛 电编:闫晋利
| 1. | Narahara H, Iishi H, Imamura H, Tsuburaya A, Chin K, Imamoto H, Esaki T, Furukawa H, Hamada C, Sakata Y. Randomized phase III study comparing the efficacy and safety of irinotecan plus S-1 with S-1 alone as first-line treatment for advanced gastric cancer (study GC0301/TOP-002). Gastric Cancer. 2011;14:72-80. [PubMed] [DOI] |
| 2. | de Martel C, Forman D, Plummer M. Gastric cancer: epidemiology and risk factors. Gastroenterol Clin North Am. 2013;42:219-240. [PubMed] [DOI] |
| 3. | Fock KM. Review article: the epidemiology and prevention of gastric cancer. Aliment Pharmacol Ther. 2014;40:250-260. [PubMed] [DOI] |
| 4. | Camargo MC, Freedman ND, Hollenbeck AR, Abnet CC, Rabkin CS. Height, weight, and body mass index associations with gastric cancer subsites. Gastric Cancer. 2014;17:463-468. [PubMed] [DOI] |
| 5. | Lin Y, Ueda J, Kikuchi S, Totsuka Y, Wei WQ, Qiao YL, Inoue M. Comparative epidemiology of gastric cancer between Japan and China. World J Gastroenterol. 2011;17:4421-4428. [PubMed] [DOI] |
| 6. | Kangwana BP, Kedenge SV, Noor AM, Alegana VA, Nyandigisi AJ, Pandit J, Fegan GW, Todd JE, Brooker S, Snow RW. The impact of retail-sector delivery of artemether-lumefantrine on malaria treatment of children under five in Kenya: a cluster randomized controlled trial. PLoS Med. 2011;8:e1000437. [PubMed] [DOI] |
| 7. | Alcântara DD, Ribeiro HF, Cardoso PC, Araújo TM, Burbano RR, Guimarães AC, Khayat AS, de Oliveira Bahia M. In vitro evaluation of the cytotoxic and genotoxic effects of artemether, an antimalarial drug, in a gastric cancer cell line (PG100). J Appl Toxicol. 2013;33:151-156. [PubMed] [DOI] |
| 8. | Wu ZP, Gao CW, Wu YG, Zhu QS. Inhibitive effect of artemether on tumor growth and angiogenesis in the rat C6 orthotopic brain gliomas model. Integr Cancer Ther. 2009;8:88-92. [PubMed] [DOI] |
| 9. | Pfeil J, Borrmann S, Tozan Y. Dihydroartemisinin-piperaquine vs. artemether-lumefantrine for first-line treatment of uncomplicated malaria in African children: a cost-effectiveness analysis. PLoS One. 2014;9:e95681. [PubMed] [DOI] |
| 10. | Lepore R, Simeoni S, Raimondo D, Caroli A, Tramontano A, Via A. Identification of the Schistosoma mansoni molecular target for the antimalarial drug artemether. J Chem Inf Model. 2011;51:3005-3016. [PubMed] [DOI] |
| 11. | Phu NH, Tuan PQ, Day N, Mai NT, Chau TT, Chuong LV, Sinh DX, White NJ, Farrar J, Hien TT. Randomized controlled trial of artesunate or artemether in Vietnamese adults with severe falciparum malaria. Malar J. 2010;9:97. [PubMed] [DOI] |
| 12. | Chaturvedi D, Goswami A, Saikia PP, Barua NC, Rao PG. Artemisinin and its derivatives: a novel class of anti-malarial and anti-cancer agents. Chem Soc Rev. 2010;39:435-454. [PubMed] [DOI] |
| 14. | Firestone GL, Sundar SN. Anticancer activities of artemisinin and its bioactive derivatives. Expert Rev Mol Med. 2009;11:e32. [PubMed] [DOI] |
| 15. | Efferth T, Dunstan H, Sauerbrey A, Miyachi H, Chitambar CR. The anti-malarial artesunate is also active against cancer. Int J Oncol. 2001;18:767-773. [PubMed] |