修回日期: 2014-12-15
接受日期: 2014-12-25
在线出版日期: 2015-02-08
目的: 通过对本实验室中已收集的云南省遗传性大肠癌标本库中的家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)家系标本进行FAP常见致突变基因APC(adenomatous polyposis coli)基因的筛查, 对APC基因筛查为阴性的标本则进一步行MYH(MutY Homologue)基因及轴抑制蛋白(axis inhibition protein 2, AXIN2)基因检测, 探讨FAP家系患者的致病基因及其突变位点.
方法: 利用已建立的云南省遗传性大肠癌标本库中家系标本进行DNA的提取, PCR特异性扩增APC基因所有外显子和启动子区域, 分析APC基因及其启动子是否存在点突变; 对于APC基因筛查未见突变者, 继续行MYH和AXIN2基因全外显子检测.
结果: 在所选的5个FAP家系成员的DNA中, 1个家系中的1例患者检测出APC基因新的突变(100025_100028het_ dupAGAA), 其余4个家系患者未检测到APC基因致病性突变; 而对于APC基因突变阴性者进行的MYH基因突变筛查中, 其中一个家系中的1例患者发现了新的突变(11198_11200het_delTGT); 而在AXIN2基因检测中, 检出4个同义突变, 其中, 同义突变c.2062C>T(p.L688L)为已报道的致病性突变.
结论: 相较于国内外同类研究报道, 云南省FAP家系成员APC基因突变检出率较低, 针对MYH及AXIN2基因检测同时也应作为FAP致病基因筛查的靶点.
核心提示: 既往研究认为, 家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)的发生与APC(adenomatous polyposis coli)基因突变有直接关系, 随着研究深入, 研究者逐渐发现, 除了APC基因突变以外, 还有包括MYH(MutY Homologue)基因及轴抑制蛋白(axis inhibition protein 2, AXIN2)基因等基因的突变也可能导致FAP的发生, 因此, 针对FAP患者进行致病基因筛查时, 除了常规进行APC基因突变检测以外, 为避免遗漏, 针对APC(-)的FAP患者, 进行MYH基因及AXIN2基因的常规筛查是FAP致病基因筛查的重要补充.
引文著录: 杨军, 刘为青, 李文亮, 陈诚, 珠珠, 王志强, 董坚. APC、MYH及AXIN2基因突变检测在家族性腺瘤性息肉病胚系突变筛查中的应用. 世界华人消化杂志 2015; 23(4): 556-562
Revised: December 15, 2014
Accepted: December 25, 2014
Published online: February 8, 2015
AIM: To investigate the significance of detection of APC, MYH and AXIN2 gene mutations in familial adenomatous polyposis (FAP) patients for screening germline mutations predisposing to FAP.
METHODS: Potential APC gene mutations were detected in 5 FAP patients from Yunnan Province, China, by exon-specific DNA sequencing. For samples without already-known APC gene mutations predisposing to FAP, whole-gene sequencing of the MYH and AXIN2 genes was performed.
RESULTS: One novel heterozygous duplication (11198_11200het_delTGT) of the APC gene was observed. One novel heterozygous deletion (11198_11200het_delTGT) was detected in the MYH gene. Four synonymous mutations were found in the AXIN2 gene, of which c.2062C>T(p.L688L) was reported to be a pathogenic mutation.
CONCLUSION: Compared with similar research reports, the positive rate of germline mutation of the APC gene is relatively low in Yunnan Province. To get the full picture of germline mutations predisposing to FAP, MYH and AXIN2 genes should also be tested for FAP pathogenic gene screening.
- Citation: Yang J, Liu WQ, Li WL, Chen C, Zhu Z, Wang ZQ, Dong J. Detection of APC, MYH and AXIN2 gene mutations for screening germline mutations predisposing to familial adenomatous polyposis. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 556-562
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/556.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.556
家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)是一类特殊的遗传性大肠癌, 其临床表现为消化系黏膜遍布成百上千的腺瘤性息肉, 最终都将转变为结直肠癌, 患者早期多无临床症状, 但因出现消化系症状就诊时多已为疾病中晚期, 多数自然生存时间不超过40岁, 预后极差[1,2]. 既往研究[3,4]证实, FAP的发病与Wnt信号通路中的APC(adenomatous polyposis coli)基因胚系突变有关, 但是, 国内外同类研究[5-7]提示, 在对FAP进行APC基因突变筛查后, 仍有一大部分患者是APC基因突变阴性的患者. 在已知的基因中, 最新的研究[8]数据显示MYH(MutY Homologue)基因的突变能够解释大约25%左右的APC(-)的FAP, 还有另外一部分FAP家系的致病基因可能是目前检测范围以外的基因导致, 如轴抑制蛋白(axis inhibition protein 2, AXIN2)基因突变[9,10]及内含子突变[11]等. 本课题前期研究[12]显示, 云南省FAP患者的APC基因突变检出率相对较低, 因此, 本项目组选择云南省遗传性大肠癌组织标本库[13]中的5例典型的FAP患者进行了APC、MYH以及AXIN2基因的筛查, 以探索可能的致病原因.
从本实验室建立的云南省遗传性大肠癌组织标本库中随机选择5例FAP患者. 对其手术取材所得的肿瘤组织标本进行研究, 5例患者分别来自不同的FAP家系, 均符合FAP临床诊断并接受了全结肠切除手术, 5例患者中, 最小年龄为22岁, 最大者为36岁, 其中女2例, 男3例.
1.2.1 组织DNA提取: 按Invitrogen DNA提取试剂盒说明书提取组织样本DNA.
1.2.2 APC基因扩增: 采用引物[14]通过PCR特异性扩增APC基因的启动子区域. 反应条件: 预变性: 95 ℃ 4 min; 变性: 95 ℃ 30 s; 55 ℃复性30 s, 72 ℃延伸60 s; 终延伸: 95 ℃ 5 min, 25个循环. 4 ℃保存. 采用引物[13]特异性扩增APC基因1-15号外显子(引物设计时包含外显子区域前后约200 bp的内含子区域). 反应条件: 预变性: 94 ℃ 5 min; 变性: 94 ℃ 30 s, 58 ℃复性30 s, 72 ℃延伸45 s; 终延伸: 72 ℃ 10 min, 30个循环. 4 ℃保存.
1.2.3 MYH基因扩增: 采用引物[15]特异性扩增MYH基因1-16号外显子. 反应条件: 预变性: 95 ℃, 5 min; 变性: 95 ℃ 30 s, 57 ℃复性1 min, 72 ℃延伸90 s; 终延伸: 72 ℃ 8 min, 30个循环. 4 ℃保存.
1.2.4 AXIN2基因扩增: 采用引物[9]特异性扩增AXIN2基因1-11号外显子. 预变性: 95 ℃ 5 min; 变性: 95 ℃ 30 s, 55 ℃复性30 s, 72 ℃延伸45 s; 终延伸: 72 ℃ 5 min, 30个循环. 4 ℃保存.
1.2.5 PCR产物测序: 采用TaKaRa MiniBEST DNA Fragment Purification Kit Ver.4.0将上述PCR产物进行纯化, 将纯化产物送宝生物公司进行测序.
1.2.6 基因突变分析: 对于所有PCR产物测序结果, 首先采用Mutation surveyor软件(http://www.softgenetics.com/)进行分析寻找突变位点, 随后, 分别对各个基因筛查得到的突变位点进行比对分析. 对于APC基因突变位点分析, 我们使用包括来自UMD的APC基因突变数据库(http://www.umd.be/APC/), APC数据库(http://www.LOVD.nl/APC), 浙江大学基因和基因组学中心APC基因数据库[16,17](http://www.genomed.org/lovd2/home.php?select_db=APC)以及APC突变数据库(http://fap.taenzer.me)进行已报道突变位点的比对及新突变位点初筛. 而对于MYH基因突变筛查, 我们参考MYH基因突变数据库(http://www.LOVD.nl/MYH)进行突变位点比对分析. 对于AXIN2基因突变位点筛查, 采用浙江大学基因和基因组学中心AXIN2基因数据库(http://www.genomed.org/lovd2/home.php?select_db=AXIN2)数据进行比对分析[16,17]. 除了利用上述的数据库和网站资源进行相应的突变基因位点比对分析以外, 人类基因突变数据库(http://www.hgmd.org/), 国际HapMap项目(http://www.hapmap.org/), 核苷酸变异和突变数据库(http://www.mutationdiscovery.com/md/MD.com/home_page.jsp), dbSNP数据库[18](http://www.ncbi.nlm.nih.gov/SNP/), 1000人基因组计划(http://www.1000genomes.org/), 以及Ensembl数据库[19](http://www.ensembl.org/)也同样进行比对分析.
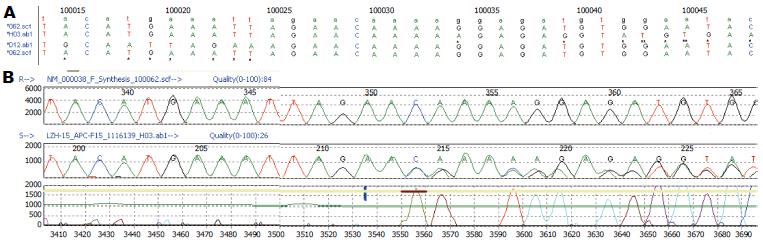
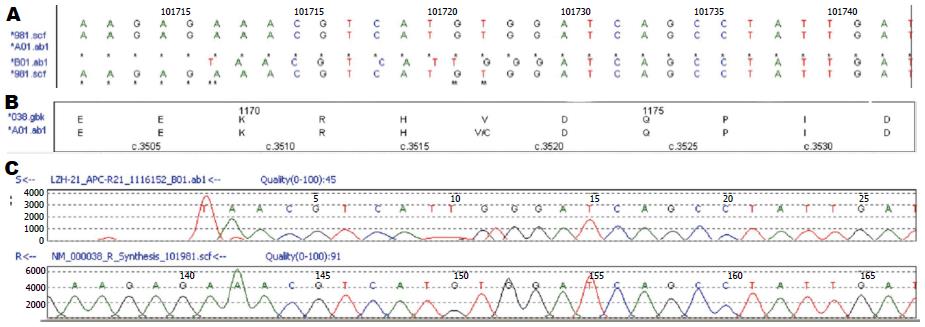
在5个FAP家系患者中, 1个家系中的1例患者检测出APC基因新的突变, 此突变存在于APC基因第15外显子100025_100028het_dupAGAA(图1), 以及发现该外显子新的错义突变c.3519T>G(p.V1173G)(图2), 其他家系患者中我们未能发现APC基因的致病性突变, APC基因突变检出率较国内外同类报道低.
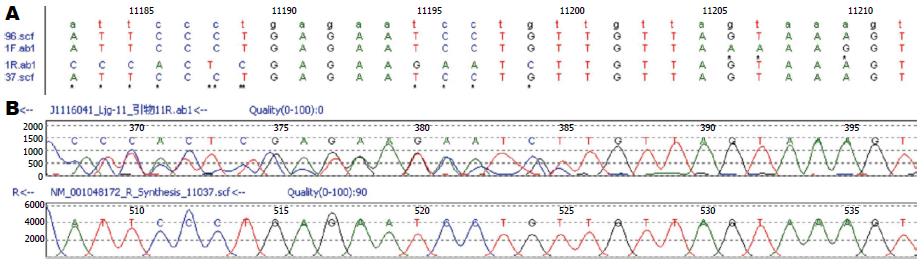
对APC突变基因筛查阴性的4例患者中, 其中一个家系患者发现了新的突变, 此突变为位于第11外显子的杂合性重复11198_11200het_delTGT(图3).
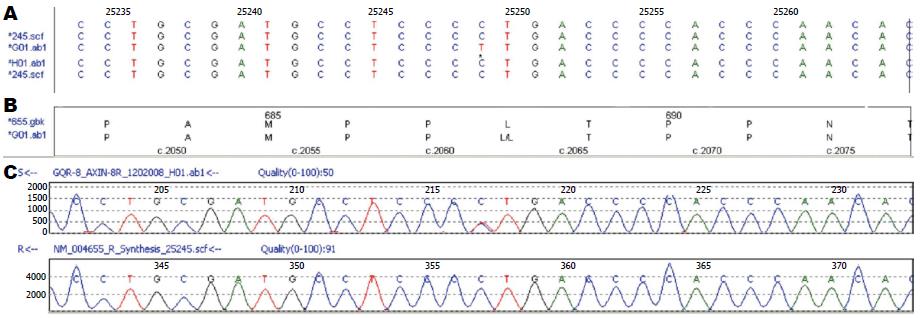
而在AXIN2基因检测中, 发现了4个同义突变(表1). 既往研究认为同义突变多为沉默突变, 但有报道证实, 其中位于第8外显子c.2062C>T(p.L688L)为已报道的致病性突变, 该同义突变在mRNA水平干扰剪接增强子的作用导致APC蛋白的移码并最终导致APC蛋白的截短[20](图4).
| 基因 | 外显子 | 突变位点 | dbSNP ID | 功能分类 |
| AXIN2 | 2 | c.432T>C(p.I144I) | rs2240307 | 同义突变 |
| AXIN2 | 6 | c.1365A>G(p.P455P) | rs9915936 | 同义突变 |
| AXIN2 | 6 | c.1386C>T9(p.P462P) | rs1133683 | 同义突变 |
| AXIN2 | 8 | c.2062C>T(p.L688L) | rs35415678 | 同义突变 |
FAP为常染色体显性遗传病, 按其发病类型可分为经典型家族性腺瘤性息肉病(classic familial adenomous polyposis, CFAP)和衰减型家族性腺瘤性息肉病(attenuated familial adenomatous polyposis, AFAP)[21]. 既往研究[22]认为FAP的发病主要是由位于人类染色体5q21的APC基因突变所致. 近年来, MYH基因相关性息肉病(MYH-associated polyposis, MAP)作为FAP的另外一个亚型开始逐渐被研究者所关注, 而MAP作为一种常染色体隐性遗传病[23], 其发生与MYH基因的突变有关[24,25].
由于FAP患者在早期多无临床症状, 但因出现消化系症状就诊时多已为疾病中晚期, 预后极差. 由于FAP为常染色体显性遗传疾病, 家系内先证者致病基因结果对家系内高危成员的筛查及遗传咨询至关重要. 既往国内外同类研究中, 针对APC基因突变筛查的检出率差异较大, 从30%到60%, 且在同一种族不同区域的FAP患者其APC突变检出率也存在差异[26-31], 因此, 仍有许多FAP患者其真正的致病基因尚未被发现. 随着MAP的被认识及其致病基因MYH基因的阐明, 大约有25%左右的APC(-)的FAP患者是由于MYH基因突变所导致. 但是, 除此以外, 仍有一大部分APC(-)及MYH(-)的FAP患者存在.
对于APC(-)及MYH(-)的FAP患者, 一个可能的解释是APC和MYH基因异常突变的存在, 如内含子和启动子的点突变, 存在表突变或遗传嵌合体. 另一种可能性是其他易感基因的存在[8]. 针对第一种情况, 研究者逐渐开始针对异常突变的检测, 如Kadiyska等[32]对常规筛查手段认为APC(-)的FAP患者筛查发现了APC启区子区域的致病性点突变; Spier等[11]对APC基因的内含子突变进行检测, 并证实内含子突变对于FAP的致病性; 但Romero-Gimenez等[33]对APC表突变进行检测未发现阳性结果. 在对于其他易感基因的筛查的研究中, 研究者尝试将Wnt信号通路中的各种重要基因进行检测, Renkonen等[8]对常规筛查手段认为APC(-)的患者筛查发现了AXIN2基因的突变与FAP相关; 而由Abraham等[34]及Cao等[35]分别针对β-catenin及GSK-3β进行检测, 但是未发现阳性结果.
项目组前期对于云南省FAP的致病基因筛查的研究中发现, 对于APC基因按照常规筛查程序, APC基因突变检出率较低, 因此, 项目组选择5个符合临床诊断的FAP患者, 对APC基因进行了启动子区域以及分别包含了1-15号外显子前后约200 bp的内含子区域的筛查, 并进行MYH基因及AXIN2基因的筛查, 研究结果提示, 对于APC基因的筛查, 项目组筛选得到一个位于15号外显子区域的新的致病性突变; 对于MYH基因, 项目组同样筛选得到了一个新的致病性突变; 而针对AXIN2基因的筛查, 虽然筛选得到的均为同义突变, 但是, 对比既往研究, 其中一个同义突变为已报道的致病性突变.
总之, 本研究结果显示, 在对FAP患者进行致病基因筛查过程中, 除常规进行APC基因筛查以外, 为避免遗漏, 针对APC(-)的FAP患者, 进行MYH基因及AXIN2基因的常规筛查是FAP致病基因筛查的重要补充. 同样, 需要说明的是, 在对上述基因进行全部筛查后, 仍会有部分患者的致病原因是目前检测手段无法解释的, 二代测序技术用于全基因组外显子组的检测可能会是下一条途径.
既往报道提示家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)的发生与APC(adenomatous polyposis coli)基因突变有直接关系, 而本课题前期研究显示, 云南省FAP患者的APC基因突变检出率相对较低, 新近研究提示MYH(MutY Homologue)以及轴抑制蛋白(axis inhibition protein 2, AXIN2)基因也可能是FAP患者的致病原因, 因此, 本项目组选择云南省遗传性大肠癌组织标本库中的5例典型的FAP患者进行了APC、MYH以及AXIN2基因的筛查, 以探索可能的致病原因.
万军, 教授, 中国人民解放军总医院南楼老年消化科
当前, 与FAP致病相关的基因(APC、MYH及AXIN2基因等)及相应的突变位点正逐渐被发现并报道, 但仍会有部分患者的致病原因是目前检测手段无法解释的, 二代测序技术等用于全基因组外显子组的检测手段可能是寻找更多相关致病基因的途径.
国外同类研究证实, 大约有25%左右的APC(-)的FAP患者是由于MYH基因突变所导致. 但是, 除此以外, 仍有一大部分APC(-)及MYH(-)的FAP患者存在, 一个可能的解释是APC和MYH基因异常突变的存在, 如内含子和启动子的点突变, 存在表突变或遗传嵌合体; 另一种可能性是其他易感基因的存在, 如AXIN2基因的突变.
本文报道了云南省部分FAP患者的组织样本APC基因的突变情况, 在对APC(-)的FAP患者筛查过程中发现了MYH及AXIN2基因的突变, 同时发现了新的可疑的致病基因位点.
本研究证实, 对FAP患者进行基因检测时除针对APC基因检测以外, 为避免遗漏, 进行MYH及AXIN2基因突变检测是FAP致病基因筛查的重要补充.
本研究有助于进一步了解对于FAP患者的APC基因的突变状况, 并加深对MYH及AXIN2基因检测在FAP患者的致病基因筛查中必要性的认识.
编辑: 郭鹏 电编:闫晋利
国家自然科学基金资助项目, No. 81160245
云南省科学技术联合专项基金资助项目, No. 2011FB160
| 1. | Gardner EJ, Burt RW, Freston JW. Gastrointestinal Polyposis: Syndromes and Genetic Mechanisms. West J Med. 1980;132:488-499. [PubMed] |
| 2. | Ficari F, Cama A, Valanzano R, Curia MC, Palmirotta R, Aceto G, Esposito DL, Crognale S, Lombardi A, Messerini L. APC gene mutations and colorectal adenomatosis in familial adenomatous polyposis. Br J Cancer. 2000;82:348-353. [PubMed] [DOI] |
| 3. | Kinzler KW, Nilbert MC, Vogelstein B, Bryan TM, Levy DB, Smith KJ, Preisinger AC, Hamilton SR, Hedge P, Markham A. Identification of a gene located at chromosome 5q21 that is mutated in colorectal cancers. Science. 1991;251:1366-1370. [PubMed] [DOI] |
| 5. | Spirio L, Olschwang S, Groden J, Robertson M, Samowitz W, Joslyn G, Gelbert L, Thliveris A, Carlson M, Otterud B. Alleles of the APC gene: an attenuated form of familial polyposis. Cell. 1993;75:951-957. [PubMed] [DOI] |
| 6. | van der Luijt RB, Meera Khan P, Vasen HF, Breukel C, Tops CM, Scott RJ, Fodde R. Germline mutations in the 3' part of APC exon 15 do not result in truncated proteins and are associated with attenuated adenomatous polyposis coli. Hum Genet. 1996;98:727-734. [PubMed] [DOI] |
| 7. | Moisio AL, Järvinen H, Peltomäki P. Genetic and clinical characterisation of familial adenomatous polyposis: a population based study. Gut. 2002;50:845-850. [PubMed] [DOI] |
| 8. | Renkonen ET, Nieminen P, Abdel-Rahman WM, Moisio AL, Järvelä I, Arte S, Järvinen HJ, Peltomäki P. Adenomatous polyposis families that screen APC mutation-negative by conventional methods are genetically heterogeneous. J Clin Oncol. 2005;23:5651-5659. [PubMed] [DOI] |
| 9. | Lammi L, Arte S, Somer M, Jarvinen H, Lahermo P, Thesleff I, Pirinen S, Nieminen P. Mutations in AXIN2 cause familial tooth agenesis and predispose to colorectal cancer. Am J Hum Genet. 2004;74:1043-1050. [PubMed] [DOI] |
| 10. | Rivera B, Perea J, Sánchez E, Villapún M, Sánchez-Tomé E, Mercadillo F, Robledo M, Benítez J, Urioste M. A novel AXIN2 germline variant associated with attenuated FAP without signs of oligondontia or ectodermal dysplasia. Eur J Hum Genet. 2014;22:423-426. [PubMed] [DOI] |
| 11. | Spier I, Horpaopan S, Vogt S, Uhlhaas S, Morak M, Stienen D, Draaken M, Ludwig M, Holinski-Feder E, N öthen MM. Deep intronic APC mutations explain a substantial proportion of patients with familial or early-onset adenomatous polyposis. Hum Mutat. 2012;33:1045-1050. [PubMed] [DOI] |
| 14. | Wei SC, Su YN, Tsai-Wu JJ, Wu CH, Huang YL, Sheu JC, Wang CY, Wong JM. Genetic analysis of the APC gene in Taiwanese familial adenomatous polyposis. J Biomed Sci. 2004;11:260-265. [PubMed] [DOI] |
| 15. | Prior TW, Bridgeman SJ. Identifying mutations for MYH-associated polyposis. Curr Protoc Hum Genet. 2010;Chapter 10:Unit 10.13. [PubMed] [DOI] |
| 16. | Pan M, Cong P, Wang Y, Lin C, Yuan Y, Dong J, Banerjee S, Zhang T, Chen Y, Zhang T. Novel LOVD databases for hereditary breast cancer and colorectal cancer genes in the Chinese population. Hum Mutat. 2011;32:1335-1340. [PubMed] [DOI] |
| 17. | Zhang T, Moss A, Cong P, Pan M, Chang B, Zheng L, Fang Q, Zareba W, Robinson J, Lin C. LQTS gene LOVD database. Hum Mutat. 2010;31:E1801-E1810. [PubMed] [DOI] |
| 18. | Sherry ST, Ward MH, Kholodov M, Baker J, Phan L, Smigielski EM, Sirotkin K. dbSNP: the NCBI database of genetic variation. Nucleic Acids Res. 2001;29:308-311. [PubMed] [DOI] |
| 19. | Flicek P, Aken BL, Beal K, Ballester B, Caccamo M, Chen Y, Clarke L, Coates G, Cunningham F, Cutts T. Ensembl 2008. Nucleic Acids Res. 2008;36:D707-D714. [PubMed] |
| 20. | Mostowska A, Biedziak B, Jagodzinski PP. Axis inhibition protein 2 (AXIN2) polymorphisms may be a risk factor for selective tooth agenesis. J Hum Genet. 2006;51:262-266. [PubMed] [DOI] |
| 21. | Vasen HF. Clinical diagnosis and management of hereditary colorectal cancer syndromes. J Clin Oncol. 2000;18:81S-92S. [PubMed] |
| 22. | Groden J, Thliveris A, Samowitz W, Carlson M, Gelbert L, Albertsen H, Joslyn G, Stevens J, Spirio L, Robertson M. Identification and characterization of the familial adenomatous polyposis coli gene. Cell. 1991;66:589-600. [PubMed] [DOI] |
| 23. | Sieber OM, Lipton L, Crabtree M, Heinimann K, Fidalgo P, Phillips RK, Bisgaard ML, Orntoft TF, Aaltonen LA, Hodgson SV. Multiple colorectal adenomas, classic adenomatous polyposis, and germ-line mutations in MYH. N Engl J Med. 2003;348:791-799. [PubMed] [DOI] |
| 24. | Al-Tassan N, Chmiel NH, Maynard J, Fleming N, Livingston AL, Williams GT, Hodges AK, Davies DR, David SS, Sampson JR. Inherited variants of MYH associated with somatic G: C--& gt; T: A mutations in colorectal tumors. Nat Genet. 2002;30:227-232. [PubMed] [DOI] |
| 25. | Sampson JR, Dolwani S, Jones S, Eccles D, Ellis A, Evans DG, Frayling I, Jordan S, Maher ER, Mak T. Autosomal recessive colorectal adenomatous polyposis due to inherited mutations of MYH. Lancet. 2003;362:39-41. [PubMed] [DOI] |
| 26. | Vandrovcová J, Stekrová J, Kebrdlová V, Kohoutová M. Molecular analysis of the APC and MYH genes in Czech families affected by FAP or multiple adenomas: 13 novel mutations. Hum Mutat. 2004;23:397. [PubMed] [DOI] |
| 27. | Sheng JQ, Cui WJ, Fu L, Jin P, Han Y, Li SJ, Fan RY, Li AQ, Zhang MZ, Li SR. APC gene mutations in Chinese familial adenomatous polyposis patients. World J Gastroenterol. 2010;16:1522-1526. [PubMed] |
| 28. | Torrezan GT, da Silva FC, Santos EM, Krepischi AC, Achatz MI, Aguiar S, Rossi BM, Carraro DM. Mutational spectrum of the APC and MUTYH genes and genotype-phenotype correlations in Brazilian FAP, AFAP, and MAP patients. Orphanet J Rare Dis. 2013;8:54. [PubMed] [DOI] |
| 29. | Gómez-Fernández N, Castellví-Bel S, Fernández-Rozadilla C, Balaguer F, Muñoz J, Madrigal I, Milà M, Graña B, Vega A, Castells A. Molecular analysis of the APC and MUTYH genes in Galician and Catalonian FAP families: a different spectrum of mutations? BMC Med Genet. 2009;10:57. [PubMed] [DOI] |
| 30. | Fostira F, Thodi G, Sandaltzopoulos R, Fountzilas G, Yannoukakos D. Mutational spectrum of APC and genotype-phenotype correlations in Greek FAP patients. BMC Cancer. 2010;10:389. [PubMed] [DOI] |
| 31. | Rivera B, González S, Sánchez-Tomé E, Blanco I, Mercadillo F, Letón R, Benítez J, Robledo M, Capellá G, Urioste M. Clinical and genetic characterization of classical forms of familial adenomatous polyposis: a Spanish population study. Ann Oncol. 2011;22:903-909. [PubMed] [DOI] |
| 32. | Kadiyska TK, Todorov TP, Bichev SN, Vazharova RV, Nossikoff AV, Savov AS, Mitev VI. APC promoter 1B deletion in familial polyposis--implications for mutation-negative families. Clin Genet. 2014;85:452-457. [PubMed] [DOI] |
| 33. | Romero-Giménez J, Dopeso H, Blanco I, Guerra-Moreno A, Gonzalez S, Vogt S, Aretz S, Schwartz S, Capella G, Arango D. Germline hypermethylation of the APC promoter is not a frequent cause of familial adenomatous polyposis in APC/MUTYH mutation negative families. Int J Cancer. 2008;122:1422-1425. [PubMed] [DOI] |
| 34. | Abraham SC, Nobukawa B, Giardiello FM, Hamilton SR, Wu TT. Sporadic fundic gland polyps: common gastric polyps arising through activating mutations in the beta-catenin gene. Am J Pathol. 2001;158:1005-1010. [PubMed] [DOI] |
| 35. | Cao X, Eu KW, Seow-Choen F, Cheah PY. Germline mutations are frequent in the APC gene but absent in the beta-catenin gene in familial adenomatous polyposis patients. Genes Chromosomes Cancer. 1999;25:396-398. [PubMed] [DOI] |