修回日期: 2015-11-12
接受日期: 2015-11-17
在线出版日期: 2015-12-28
目的: 评价盐酸吉西他滨联合立体定向放疗治疗局部晚期胰腺癌的疗效.
方法: 118例不能手术切除的胰腺癌患者按治疗方法分为2组: A组盐酸吉西他滨联合立体定向放疗组, 共56例, B组单独立体定向放疗组, 共62例. 立体定向放射治疗, 单次剂量2.8-3.5 Gy, 50%-65%等剂量曲线包绕PTV, 总剂量35-45 Gy, 每周治疗6 d, 治疗次数10-13次. A组首程同步化疗, 吉西他滨600 mg/m2, 放疗开始第1、8天静脉输注, 放疗结束后3 wk开始第2周期化疗, 吉西他滨1000 mg/m2, 21 d为1周期, 共治疗4-6周期.
结果: 2 mo后复查计算机断层扫描及磁共振, A组肿瘤病灶治疗有效率67.8%(38/56), 中位生存时间12.8 mo(范围4-70 mo), 1年生存率58.9%(33/56), 2年生存率28.6%(16/56). 常见不良反应为白细胞、血小板下降及消化系反应. B组肿瘤病灶治疗有效率30.6%(19/62), 中位生存时间8.5 mo(范围5-56 mo), 1年生存率33.9%(21/62), 2年生存率12.9%(8/62). 治疗期间常见不良反应为恶心及呕吐, 白细胞下降. 盐酸吉西他滨联合立体定向放射治疗组的近期疗效及远期疗效均优于立体定向放疗组.
结论: 盐酸吉西他滨联合立体定向放疗具有较好的近远期疗效, 不良反应能够耐受.
核心提示: 本研究样本量大, 立体定向放疗治疗技术成熟, 联合吉西他滨, 临床效果较好, 具有一定应用价值.
引文著录: 季洪兵, 陈忠华. 盐酸吉西他滨联合立体定向放疗治疗局部晚期胰腺癌的临床价值. 世界华人消化杂志 2015; 23(36): 5882-5888
Revised: November 12, 2015
Accepted: November 17, 2015
Published online: December 28, 2015
AIM: To evaluate the clinical effects of stereotactic conformal radiotherapy combined with gemcitabine in patients with locally advanced pancreatic carcinoma.
METHODS: A total of 118 patients with unresectable locally advanced pancreatic carcinoma were divided into two groups to receive either radiotherapy combined with gemcitabine (group A, 56 cases) or radiotherapy alone (group B, 62 cases). The standard dose of stereotactic conformal radiotherapy prescribed was 35-45 Gy to the 50%-65% isodose curve. The total dose was delivered over 10-13 d with a fraction dose of 2.8-3.5 Gy and 6 fractions per week. Concomitant chemotherapy started at the first day of radiotherapy: gemcitabine at a dose of 600 mg/m2 was given on days 1 and 8, and adjuvant chemotherapy was administered three weeks after radiotherapy at a dose of gemcitabine 1000 mg/m2 on days 1 and 8, 21 days per cycle, for 4-6 cycles continuously.
RESULTS: The patients underwent CT or MR examination 2 mo after 2 treatment. The tumor response rate of group A was 67.8% (38/56). Median survival time was 12.8 mo (range, 4-70 mo). The overall 1-year and 2-year survival rates were 58.9% (33/56) and 28.6% (16/56), respectively. Main side effects included leukopenia, thrombocytopenia, nausea and vomiting. The tumor response rate of group B was 30.6% (19/62). Median survival time was 8.5 mo (range, 5-56 mo). The overall 1-year and 2-year survival rates were 33.9% (21/66) and 12.9% (8/62), respectively. Main side effects were leukopenia and thrombocytopenia. Both the short-term and long-term therapeutic effects were better in the combination group than in the radiotherapy alone group.
CONCLUSION: Gemcitabine combined with stereotactic conformal radiotherapy is effective and safe in the treatment of patients with locally advanced pancreatic carcinoma.
- Citation: Ji HB, Chen ZH. Clinical effects of stereotactic radiotherapy combined with gemcitabine in treatment of locally advanced pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(36): 5882-5888
- URL: https://www.wjgnet.com/1009-3079/full/v23/i36/5882.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i36.5882
在世界范围内, 胰腺癌占癌症死亡的第4位, 且每年有上升趋势. 据预测, 到2020年, 胰腺癌可能上升至癌症死亡的第2位[1]. 胰腺癌恶性程度高, 进展速度快, 早期无明显症状和体征, 就诊时多属中晚期, 预后极差. 据文献报道[2]局部晚期胰腺癌中位生存期5-11 mo, 而5年生存率低于2%[3]. 国外有放疗联合5-氟尿嘧啶(5-fluorouracil, 5-Fu)+亚叶酸治疗局部晚期胰腺癌的研究[4], 获得中位生存期12 mo、1年和2年生存率分别为48%和29%的结果, 而以吉西他滨化疗联合放疗治疗局部晚期胰腺癌也有相关的报道[5,6]. 本文回顾性分析2008-06/2013-06 118例无法手术切除的局部晚期胰腺癌患者采用吉西他滨联合立体定向放疗与单独行立体定向放疗治疗, 疗效满意, 现报告如下.
病例选择标准: (1)初治的无法手术的局部晚期胰腺癌, 且无远处转移; (2)体力状态评分0-3分; (3)血细胞分析(白细胞≥2000/mm3, 血小板≥100000/mm3, 血红蛋白≥9.0); (4)胰腺至少有1个可测量病灶; (5)无中、大量恶性腹水. 2008-06/2013-06福州总医院收治的118例初治无法手术切除的局部晚期胰腺癌患者符合入组标准. 男性76例, 女性42例, 年龄42-77岁, 中位年龄57岁; 按2002年AJCC标准临床分期: Ⅱ期72例; Ⅲ期46例. 胰腺头颈部86例, 胰腺体尾部32例. 肿瘤大小≤5 cm 55例,>5 cm 63例, 疼痛100例, 血糖异常63例. 118例中, 组织学病理证实58例, 主要通过剖腹探查术、胆肠吻合术及内镜逆行性胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)完成; 无组织学病理证实的病例根据临床表现、计算机断层扫描(computed tomography, CT)及磁共振(magnetic resonance, MR)或正电子发射计算机断层显像(PET-CT)的肿瘤征象, 再结合肿瘤标志物CA19-9升高进行诊断. 118例中有黄疸86例, 皮肤瘙痒65例, 食欲不振62例, 血糖异常63例, 49例行PTCD术, 19例行胆道支架植入, 9例行胆肠吻合术, 98例肿瘤指标CA19-9有不同程度升高. 118例胰腺癌患者按照治疗方案分为A组(56例)和B组(62例). A组给予盐酸吉西他滨联合立体定向放射治疗, B组仅给予立体定向放疗. 两组患者的各项临床基本资料差异均无统计学意义(表1).
| 临床病例参数 | A组 | B组 | χ2值 | P值 |
| (n = 56) | (n = 62) | |||
| 性别 | 0.001 | >0.05 | ||
| 男 | 36 | 40 | ||
| 女 | 20 | 22 | ||
| 年龄(岁) | 0.050 | >0.05 | ||
| <70 | 30 | 32 | ||
| ≥70 | 26 | 30 | ||
| KPS评分 | 0.320 | >0.05 | ||
| <80 | 18 | 23 | ||
| ≥80 | 38 | 39 | ||
| 分期 | 0.480 | >0.05 | ||
| Ⅰ | 36 | 36 | ||
| Ⅱ | 20 | 26 | ||
| 部位 | 0.110 | >0.05 | ||
| 胰腺头部 | 40 | 46 | ||
| 胰体尾部 | 16 | 16 | ||
| 肿瘤直径(cm) | 0.001 | >0.05 | ||
| <5 | 26 | 29 | ||
| ≥5 | 30 | 33 | ||
| 疼痛 | 0.080 | >0.05 | ||
| 有 | 48 | 52 | ||
| 无 | 8 | 10 | ||
| 血糖异常 | 0.001 | >0.05 | ||
| 有 | 30 | 33 | ||
| 无 | 26 | 29 | ||
| 总胆红素(μmol/L) | 1.360 | >0.05 | ||
| ≤17.1 | 18 | 14 | ||
| >17.1且<200 | 15 | 24 | ||
| ≥200 | 23 | 24 | ||
| 减黄处理 | 1.880 | >0.05 | ||
| 有 | 33 | 44 | ||
| 无 | 23 | 18 | ||
| CA19-9 | 0.540 | >0.05 | ||
| 异常 | 48 | 50 | ||
| 正常 | 8 | 12 |
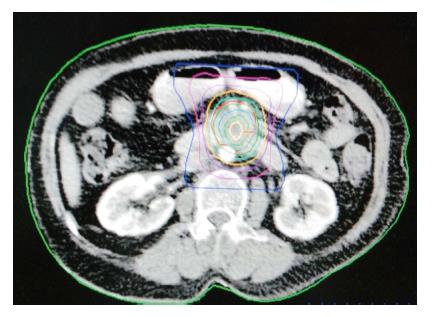
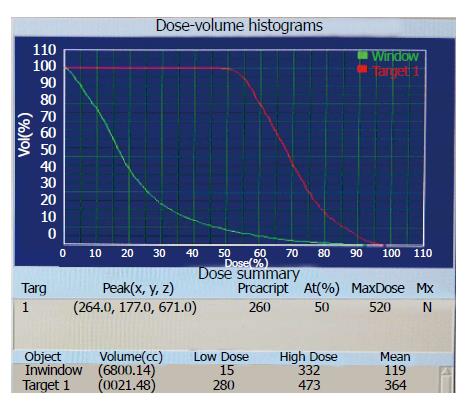
1.2.1 治疗: A组: 盐酸吉西他滨联合立体定向放射治疗. 首程同步化疗, 盐酸吉西他滨600 mg/m2, 第1、8天静脉输注, 放疗结束3 wk后开始序贯化疗, 盐酸吉西他滨1000 mg/m2给量, 第1、8天静脉输注, 21 d为1周期, 共4-6周期. 化疗期间辅助应用地塞米松5 mg、胃复安10 mg、西咪替丁20 mg、托烷司琼3 mg联合止吐. 放疗设备采用OUR-QGD型立体定向体部伽玛射线放射治疗系统. 其原理是通过旋转聚焦方式将30个钴-60放射源能量聚焦于焦点, 形成高剂量区, 肿瘤组织获得高剂量照射[7]. 采用CT定位, 定位时患者仰卧或俯卧于真空负压袋上, 塑形抽真空固定体位, CT增强扫描, 层厚5 mm, 范围180 mm, 记录N值、重复定位尺值及患者体表标记坐标参数x、y、z值. CT扫描数据由PACS系统传输至OUR-TPS工作站, 经过三维立体重建, 根据原发肿瘤和/或转移淋巴结大小、形状勾画肿瘤靶区GTV, 考虑脏器运动、摆位误差等, 计划靶区PGTV为GTV外放5 mm, 制定治疗计划, 通过剂量体积直方图评估治疗计划, 给予处方剂量2.8-3.5 Gy, 等剂量曲线50%-65%覆盖PGTV(图1, 2), 照射总剂量达35-45 Gy, 相邻部分十二指肠受量在30%-50%, 脊髓受量<20%,治疗1次/d, 连续治疗6 d后休息1 d, 11-14 d完成治疗. B组单独行立体定向放射治疗. 放疗过程同A组.
1.2.2 疗效评价: 治疗结束后2 mo开始随访, 每3 mo随访1次, 最后随访时间是2015-06. 疗效评价 所有患者3 mo检查CT或MR(经济条件好的患者治疗1年后可行PET-CT检查), 并血常规、肝功能、肿瘤标志物检测, 记录患者治疗前后的肿瘤大小变化数据、各级不良反应的例数及每例患者生存时间. 肿瘤大小在影像学图像上进行测量. 近期疗效参照WHO实体瘤评价标准: (1)完全缓解(complete response, CR): 肿瘤完全消失4 wk以上, 无新病灶出现; (2)部分缓解(partial response, PR): 肿瘤缩小50%以上, 维持4 wk以上, 无新病灶出现; (3)稳定(stable disease, SD): 肿瘤缩小50%以下或增大未超过25%; (4)进展(progressive disease, PD): 肿瘤增大25%以上或出现新的病灶. 以CR+PR计算治疗有效率. 不良反应参照RTOG标准分1-4级.
统计学处理 采用SPSS19.0软件进行数据处理, 率的比较采用χ2检验, 采用Kaplan-Meier法绘制生存曲线, 比较采用Log-rank检验. 以P<0.05为差异有统计学意义.
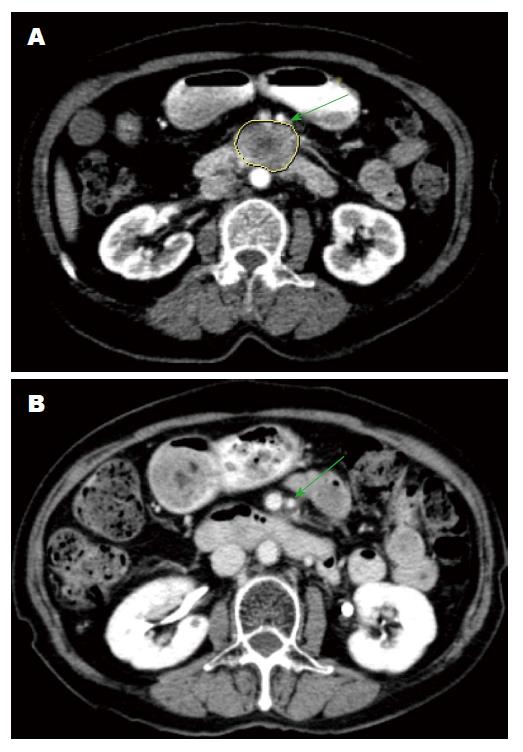
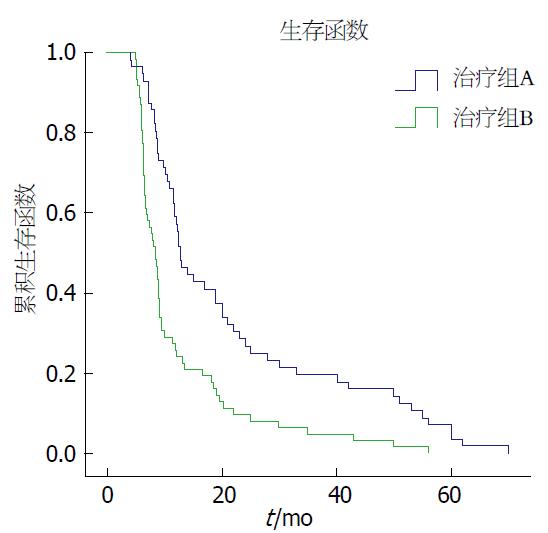
118例均进行随访. 其中A组盐酸吉西他滨联合立体定向放射治疗组有效率67.8%(38/56)(图3), 1年生存率58.9%(33/56), 2年生存率28.6%(16/56), 中位生存时间12.8 mo(4-70 mo); B组立体定向放射治疗组有效率30.6%(19/62), 1年生存率33.9%(21/62), 2年生存率12.9%(8/62), 中位生存时间8.5 mo(5-56 mo). A组与B组比较: 治疗有效率χ2 =16.32, P<0.01; 1年生存率χ2 = 7.44, P<0.01; 2年生存率χ2 = 4.46, P<0.05; 中位生存时间采用Kaplan-Meier绘制生存曲线(图4)及Log-rank检验χ2 = 16.51, P<0.01, 两组比较差异有统计学意义. A组有疼痛48例, 治疗后疼痛减轻46例, 止痛有效率95.8%(46/48); B组有疼痛52例, 治疗后疼痛减轻48例, 止痛有效率92.3%(48/52). 两组比较χ2 = 0.10, P>0.05, 止痛方面两组比较差异无统计学意义. 治疗前A+B组共有CA19-9升高患者98例, 治疗后均有不同程度下降, 有29例下降后经过一段时间随访出现上升趋势.
118例均完成治疗. 无Ⅳ期不良反应. 治疗期间主要的不良反应较轻, 主要是白细胞、血小板下降、贫血及消化系反应, 均为Ⅰ-Ⅲ度. 所有病例均有疲乏, 上述症状经过临床处理后均有改善. 治疗期间未见上消化道出血, 无放射性肝炎和脊髓炎等严重并发症发生. 两组不良反应差异无统计学意义(P>0.05). 不良反应如表2.
| 不良反应 | A组 | B组 | ||||||
| 0 | Ⅰ | Ⅱ | Ⅲ | 0 | Ⅰ | Ⅱ | Ⅲ | |
| 白细胞 | 13 | 29 | 9 | 5 | 29 | 26 | 6 | 1 |
| 血小板 | 33 | 16 | 6 | 1 | 35 | 23 | 3 | 1 |
| 贫血 | 39 | 14 | 3 | 0 | 57 | 5 | 0 | 0 |
| 呕吐 | 39 | 11 | 4 | 2 | 30 | 25 | 5 | 2 |
| 疲乏 | 0 | 49 | 7 | 0 | 0 | 58 | 4 | 0 |
胰腺癌发病隐匿, 大部分患者出现黄疸或腹背部疼痛就诊时已属晚期, 丧失了手术机会, 因手术是潜在唯一能够治愈的方法, 但大部分患者又不能手术, 故有学者对不能手术的局部晚期胰腺癌进行新辅助放化疗以期待后续行手术切除, 但新辅助放化疗后手术切除率极低[8]. 因此, 对于局部晚期胰腺癌, 联合放化疗扮演重要的角色. 一组随机试验表明吉西他滨在减轻症状和延长生存期上是优于5-Fu, 对于晚期和转移性胰腺癌吉西他滨是标准的一线治疗方案[9]. 吉西他滨是阿糖胞苷类似物, 属抗代谢类抗癌药, 容易穿透细胞膜和被细胞摄取, 药物在细胞内驻留时间较长, 能更好发挥抗肿瘤作用. 同时他能够阻止细胞自G1期向S期的进展, 抑制DNA的复制和修复[8], 是胰腺癌放射治疗潜在增敏剂. 但以往文献显示吉西他滨单药化疗, 疗效有局限, 中位生存期为5.3-6.3 mo[10]. 而传统的放疗技术, 因肿瘤病灶毗邻肝脏、肾脏、脊髓及十二指肠且胰腺癌为中低度敏感, 故无法给予根治性剂量, 因而疗效极差. 而近年来立体定向体部伽玛射线放射治疗系统的出现克服这一缺点, 通过旋转聚焦将放射源能量聚焦于焦点, 形成高剂量区, 肿瘤组织获得高剂量照射, 靶区外剂量骤减, 实现刀割效应, 周围正常组织得到很好的保护, 提高治疗增益比, 从而提高肿瘤的局部控制率, 这给放化疗的联合提供了技术支持. 另有研究[11]表明靶区剂量越高, 肿瘤局部控制越好, 患者生存期越长. 吉西他滨联合立体定向放疗治疗局部晚期胰腺癌国内有不少的报道[12,13].
而本研究中, A组有效率67.8%, 1年生存率58.9%, 2年生存率28.6%, 中位生存时间12.8 mo, B组有效率30.6%, 1年生存率33.9%, 2年生存率12.9%, 中位生存时间8.5 mo. 两组比较差异有统计学意义(P<0.01). 与文献报道[12,13]相当. 由于局部晚期胰腺癌容易侵犯腹腔神经丛, 引起持续性上腹部和腰背部疼痛, 严重影响患者的生存质量, 止痛也是晚期胰腺癌治疗的目标之一. 本研究中A组止痛有效率95.8%(46/48), B组止痛有效率92.3%(48/52). A组止痛有效率与B组无明显差异, 原因在于立体定向放疗能使胰腺肿瘤靶区短期内受到大剂量照射, 致使大量肿瘤细胞在较短时间内坏死, 肿瘤体积明显缩小, 从而减轻对腹膜后神经的压迫, 降低肿瘤张力, 改善疼痛症状.
有文献报道[14]当低剂量吉西他滨化疗同步TD30-33Gy的放射治疗严重急性不良反应发生率达23%, 但本组不良反应均为Ⅰ-Ⅲ度, 可耐受, 无Ⅳ级不良反应, 这可能与同步放化疗期间吉西他滨剂量从1000 mg/m2降为600 mg/m2有关. 本组研究中最需要面对的一个重要问题就是超过1/2的病例缺乏组织学病理证实. 临床上多数患者经过彩超和CT、MR发现胰腺肿块或胰腺导管扩张, 超声内镜检查可引导细针穿刺活检, 也可选择ERCP, 但因胰腺癌其位置深且隐蔽, 从这个部位进行活检通常是困难的, 即使进行活检, 也可能出现假阴性, 而临床中也经常出现胰腺癌患者经过手术开腹后认为肿瘤无法切除的, 50%术中没有取病理. 对于这部分没有组织学病理证实的胰腺癌患者, 能不能进行放疗或化疗, 是存在争议的. 国外一项观察性研究[15]表明没有组织学病理证实但高度怀疑胰腺癌的186例患者中只有13例是良性病灶, 并建议对于组织学证实如果非常困难又高度怀疑胰腺恶性肿瘤的患者病理活检不是必需的. 国内也有研究[16]建议对于多学科临床诊断的确无法取得病理的患者, 可以在知情同意条件下选择放化疗. 在本组中, 有60例无组织学病理证实, 其治疗是在患者签署知情同意书后进行的.
CA19-9的变化在诊断和判断肿瘤复发及转移上是有一定意义. 在本组有118例患者检测肿瘤标志物CA19-9, 其中有98例是升高的, 在随访中扮演重要角色, 但CA19-9的变化与生存期延长是否具有相关性, 有待进一步研究.
目前除了报道吉西他滨联合放疗治疗胰腺癌, 也有报道将吉西他滨分别联合顺铂、奥沙利铂、卡培他滨治疗晚期胰腺癌显示PFS和OS有延长[17,18], 还有抗EGFR单抗偶联吉西他滨聚氰基丙烯酸正丁酯纳米粒对胰腺癌的靶向治疗[19], CT引导下125I粒子植入联合GP方案治疗胰腺癌[20], 此外联合厄洛替尼也获得了OS延长的显著性优势[21], 这些方案为局部晚期胰腺癌的治疗提供一种新的思路. 另外像Cyber knife、Tomotherapy等先进放疗设备的出现也使得在放疗方式有了更多选择.
总之, 本组研究显示吉西他滨联合立体定向放疗治疗局部晚期胰腺癌临床疗效好, 是一种安全、可靠的治疗方法, 但在最佳放疗分割剂量、分割次数、总剂量以及放化疗在时间上如何搭配值得进一步临床验证.
胰腺癌恶性程度高, 进展速度快, 就诊时多属中晚期, 预后极差. 目前多学科联合的综合治疗已经取得一定的进展, 但如何提高晚期胰腺癌患者的生存期和生存质量仍为目前治疗的难点和重点, 以往由于放射治疗设备及技术的限制, 胰腺癌的放化疗联合治疗开展较少, 随着精确放疗技术的出现, 使得胰腺癌的局部控制率明显提高, 本文回顾性分析无法手术切除的局部晚期胰腺癌患者采用吉西他滨联合立体定向放疗评价其效果, 为局部晚期胰腺癌提供一种好的治疗方案.
谭晓冬, 教授, 中国医科大学附属盛京医院; 陈其奎, 教授, 中山大学附属第二医院消化内科; 肖恩华, 教授, 中南大学湘雅二医院放射教研室
对不能手术的局部晚期胰腺癌进行新辅助放化疗以期待后续行手术切除, 但新辅助放化疗后手术切除率极低. 目前随着放疗设备及技术快速发展, 吉西他滨联合立体定向治疗局部晚期胰腺癌将成为一个重要的治疗方案.
对于局部晚期胰腺癌治疗, 学者对多种治疗方案进行了探索, 尽管不断有新的抗肿瘤药物问世, 目前疗效最为肯定的仍是吉西他滨, 吉西他滨联合立体定向放疗对于无法手术切除的胰腺癌患者具有重要意义.
本研究采用立体定向放射治疗联合吉西他滨治疗局部晚期胰腺癌, 充分发挥放疗和化疗的优势, 起到协同作用, 提高患者的近期及远期疗效, 改善患者的生活质量.
本研究方法中, 分为吉西他滨联合立体定向放疗组和单独行立体定向放疗治疗组, 但要保证两组患者的各项临床基本资料无差异.
OUR-QGD型立体定向体部伽玛射线放射治疗系统: 其原理是通过旋转聚焦方式将30个钴-60放射源能量聚焦于焦点, 形成高剂量区, 肿瘤组织获得高剂量照射, 靶区外剂量骤减, 实现刀割效应, 周围正常组织得到很好的保护, 提高治疗增益比, 从而提高肿瘤的局部控制率.
局部晚期胰腺癌临床治疗棘手, 作者通过对比研究显示吉西他滨联合立体定向放疗治疗局部晚期胰腺癌优于单纯立体定向放疗, 对临床应用有较好的借鉴作用.
编辑: 于明茜 电编:闫晋利
| 1. | Huguet F, Mukherjee S, Javle M. Locally advanced pancreatic cancer: the role of definitive chemoradiotherapy. Clin Oncol (R Coll Radiol). 2014;26:560-568. [PubMed] [DOI] |
| 2. | Yeo TP, Hruban RH, Leach SD, Wilentz RE, Sohn TA, Kern SE, Iacobuzio-Donahue CA, Maitra A, Goggins M, Canto MI. Pancreatic cancer. Curr Probl Cancer. 2002;26:176-275. [PubMed] [DOI] |
| 3. | Colucci G, Giuliani F, Gebbia V, Biglietto M, Rabitti P, Uomo G, Cigolari S, Testa A, Maiello E, Lopez M. Gemcitabine alone or with cisplatin for the treatment of patients with locally advanced and/or metastatic pancreatic carcinoma: a prospective, randomized phase III study of the Gruppo Oncologia dell'Italia Meridionale. Cancer. 2002;94:902-910. [PubMed] [DOI] |
| 4. | Mawdsley S, Hall M, Glynne-Jones R. Locally advanced pancreatic cancer treated with radiation and 5-fluorouracil. Clin Oncol (R Coll Radiol). 2002;14:308-312. [PubMed] [DOI] |
| 5. | Olsen CC, Schefter TE, Chen H, Kane M, Leong S, McCarter MD, Chen Y, Mack P, Eckhardt SG, Stiegmann G. Results of a phase I trial of 12 patients with locally advanced pancreatic carcinoma combining gefitinib, paclitaxel, and 3-dimensional conformal radiation: report of toxicity and evaluation of circulating K-ras as a potential biomarker of response to therapy. Am J Clin Oncol. 2009;32:115-121. [PubMed] [DOI] |
| 6. | Lin LL, Picus J, Drebin JA, Linehan DC, Solis J, Strasberg SM, Tan B, Thorstad WL, Myerson R. A phase II study of alternating cycles of split course radiation therapy and gemcitabine chemotherapy for inoperable pancreatic or biliary tract carcinoma. Am J Clin Oncol. 2005;28:234-241. [PubMed] [DOI] |
| 8. | Bajetta E, Di Bartolomeo M, Stani SC, Artale S, Ricci SB, Bozzetti F, Mazzaferro V, Toffolatti L, Buzzoni R. Chemoradiotherapy as preoperative treatment in locally advanced unresectable pancreatic cancer patients: results of a feasibility study. Int J Radiat Oncol Biol Phys. 1999;45:285-289. [PubMed] [DOI] |
| 9. | Burris HA, Moore MJ, Andersen J, Green MR, Rothenberg ML, Modiano MR, Cripps MC, Portenoy RK, Storniolo AM, Tarassoff P. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997;15:2403-2413. [PubMed] |
| 10. | Böttger TC, Junginger T. Factors influencing morbidity and mortality after pancreaticoduodenectomy: critical analysis of 221 resections. World J Surg. 1999;23:164-171; discussion 171-172. [PubMed] [DOI] |
| 11. | Koong AC, Le QT, Ho A, Fong B, Fisher G, Cho C, Ford J, Poen J, Gibbs IC, Mehta VK. Phase I study of stereotactic radiosurgery in patients with locally advanced pancreatic cancer. Int J Radiat Oncol Biol Phys. 2004;58:1017-1021. [PubMed] [DOI] |
| 13. | 潘 德键, 王 标, 周 锡建, 李 相勇, 范 晓强, 周 仁贵, 唐 新宇. 盐酸吉西他滨联合伽玛射线立体定向体部放疗治疗局部晚期胰腺癌的临床研究. 现代肿瘤医学. 2015;23:363-366. |
| 14. | Crane CH, Abbruzzese JL, Evans DB, Wolff RA, Ballo MT, Delclos M, Milas L, Mason K, Charnsangavej C, Pisters PW. Is the therapeutic index better with gemcitabine-based chemoradiation than with 5-fluorouracil-based chemoradiation in locally advanced pancreatic cancer? Int J Radiat Oncol Biol Phys. 2002;52:1293-1302. [PubMed] [DOI] |
| 15. | Böttger TC, Junginger T. Treatment of tumors of the pancreatic head with suspected but unproved malignancy: is a nihilistic approach justified? World J Surg. 1999;23:158-162; discussion 162-163. [PubMed] [DOI] |
| 17. | Loehrer PJ, Feng Y, Cardenes H, Wagner L, Brell JM, Cella D, Flynn P, Ramanathan RK, Crane CH, Alberts SR. Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer: an Eastern Cooperative Oncology Group trial. J Clin Oncol. 2011;29:4105-4112. [PubMed] [DOI] |
| 18. | Mukherjee S, Hurt CN, Bridgewater J, Falk S, Cummins S, Wasan H, Crosby T, Jephcott C, Roy R, Radhakrishna G. Gemcitabine-based or capecitabine-based chemoradiotherapy for locally advanced pancreatic cancer (SCALOP): a multicentre, randomised, phase 2 trial. Lancet Oncol. 2013;14:317-326. [PubMed] [DOI] |
| 19. | 李 春梅, 张 林, 候 艳红, 李 楠, 车 明环. 抗EGFR单抗偶联吉西他滨聚氰基丙烯酸正丁酯纳米粒对胰腺癌的靶向治疗. 世界华人消化杂志. 2015;23:1890-1896. [DOI] |
| 21. | Moore MJ, Goldstein D, Hamm J, Figer A, Hecht JR, Gallinger S, Au HJ, Murawa P, Walde D, Wolff RA. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 2007;25:1960-1966. [PubMed] [DOI] |