修回日期: 2015-11-08
接受日期: 2015-11-17
在线出版日期: 2015-12-28
目的: 探索血浆中人类白细胞抗原FAT10(human leukocyte antigen -F adjacent transcript 10, HLA-FAT10) mRNA表达水平, 评估其对肝癌和结肠癌的诊断价值.
方法: 收集70例肝癌、60例肝硬化、64例结肠癌和64例健康对照者的血浆, 应用实时荧光定量PCR(RT-PCR)和酶联吸附试验(ELISA)法检测FAT10 mRNA和甲胎蛋白(α-fetoprotein, AFP)蛋白的表达水平. 采用SPSS21.0统计软件进行数据分析.
结果: FAT10 mRNA在肝癌、肝硬化、健康对照组中的阳性表达率分别为72.85%, 28.3%和12.5%, 三者之间差异显著(P<0.05), 其高表达与肝癌TNM分期及淋巴结转移有关(P<0.05). FAT10 mRNA在结肠癌的阳性表达率明显高于健康对照组(P<0.05), 其上调表达与结肠癌Duke's分期和远处转移相关(P<0.05). 在AFP阴性肝癌中FAT10 mRNA的诊断灵敏度为66.6%. 小肝癌与非肝癌组(肝硬化和健康组)比较时, FAT10 mRNA的灵敏度为68.8%, 特异度为79.8%, 联合AFP蛋白后, 诊断灵敏度提高至84.4%.
结论: FAT10 mRNA有可能成为肝癌和结肠癌诊断中的一个新的血清学指标, 且可以应用于AFP阴性肝癌的辅助诊断, 联合FAT10 mRNA和AFP蛋白可以提高肝癌的诊断率.
核心提示: 本文应用RT-PCR方法和ELISA方法分别检测肝癌、结肠癌、肝硬化、健康对照组血浆中FAT10 mRNA和甲胎蛋白(α-fetoprotein, AFP)的浓度. 结果显示肝癌及结肠癌中FAT10 mRNA高表达. 且FAT10 mRNA在小肝癌、AFP阴性肝癌也具有一定的诊断价值. 因此, FAT10 mRNA的此种表达异常可能参与了肝癌和结肠癌的恶性生物学行为, 对临床肝癌和结肠癌的诊疗具有一定的价值.
引文著录: 张思宇, 曹娜, 陈明凯, 张立达, 白阳秋, 杨玉秀. FAT10 mRNA在肝癌和结肠癌患者血浆中的表达及诊断价值. 世界华人消化杂志 2015; 23(36): 5775-5783
Revised: November 8, 2015
Accepted: November 17, 2015
Published online: December 28, 2015
AIM: To detect plasma levels of human leukocyte antigen (HLA)-F adjacent transcript 10 (FAT10) mRNA in patients with hepatocellular carcinoma (HCC) or colon cancer (CC), and to assess its diagnostic value.
METHODS: Blood samples were collected from 70 patients with HCC, 60 patients with cirrhosis, 64 patients with CC, and 64 healthy volunteers. The expression levels of plasma FAT10 mRNA and α-fetoprotein (AFP) protein were measured by RT-PCR and ELISA, respectively.
RESULTS: The positive rates of FAT10 mRNA in plasma of patients with HCC, those with cirrhosis and healthy controls were 72.85%, 28.3% and 12.5%, respectively, and there were significantly differences in the three groups (P < 0.05). High expression levels of FAT10 mRNA in HCC were related to TNM stage and lymph node metastasis (P < 0.05). The positive rate of FAT10 mRNA was also significantly higher in CC patients than in healthy controls (P < 0.05). The up-regulation of FAT10 mRNA in CC was closely related to Duke's stage and distance metastasis. FAT10 mRNA had a sensitivity of 66.6% for diagnosis of AFP-negative HCC. Furthermore, the FAT10 mRNA had a sensitivity of 68.8% and specificity of 79.8% in distinguishing small HCC patients from non-HCC individuals (cirrhosis patients and healthy controls). Combined AFP and FAT10 mRNA detection could improve the sensitivity to 84.4%.
CONCLUSION: FAT10 mRNA is a promising serological marker for HCC and CC. Plasma FAT10 mRNA and AFP protein could be combined to improve the diagnosis of HCC.
- Citation: Zhang SY, Cao N, Chen MK, Zhang LD, Bai YQ, Yang YX. Diagnostic value of plasma HLA-F adjacent transcript 10 mRNA expression in patients with hepatocellular carcinoma or colon cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(36): 5775-5783
- URL: https://www.wjgnet.com/1009-3079/full/v23/i36/5775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i36.5775
肝癌和结肠癌都是目前世界最常见的恶性肿瘤. 在中国, 肝癌和结肠癌的病死率在恶性肿瘤中分别排名第3位和第5位[1,2], 且近年来结肠癌的患病率明显增加. 肝癌起病隐匿, 早期缺乏典型症状, 出现临床症状者大多已进入中晚期, 极易漏诊或误诊. 对肝癌患者进行早期诊断并及时采取有效治疗措施是提高肝癌预后的重要手段[3-5]. 迄今为止, 甲胎蛋白(α-fetoprotein, AFP)在肝癌早期诊断中一直是个重要指标, 但他在相当一部分慢性肝炎、肝硬化等患者血清中均可呈现非特异性升高, 在早期肝癌中有40%的AFP为阴性[6-8]. 超声(ultrasonography, US)检查对<10 mm的肝癌诊断有一定的局限性[4], 肝组织活检为有创检查且不为大多数疑似肝癌患者所接受. 因此寻找新的特异性血清学肿瘤标志物, 提高肝癌和结肠癌的早期诊断率具有十分重要的临床意义.
人类白细胞抗原FAT10(human leukocyte antigen-F adjacent transcript 10, HLA-FAT10) mRNA位于人类6号染色体上, Ⅰ型主要组织相容性复合物(major histocompatibility complex, MHC)编码区域的末端, 紧挨HLA的F区, 由此而得名[9,10]. FAT10 mRNA定位于真核生物细胞核, 通过非共轭结合人类纺锤体检查位点MAD2参与细胞循环管理, MAD2的异常调节和染色体不稳定性有关[11,12]. 最近发现, FAT10 mRNA可通过诱导细胞循环和染色体不稳定性参与修饰肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)功能, 而染色体不稳定性可能会导致肿瘤形成[13-15]. 在前期相关试验中我们应用含有19378个已知基因的寡核苷酸芯片筛选出肝癌组织差异基因表达谱, 发现FAT10 mRNA是一个明显高表达的基因[16]. 同时我们还探讨了MCM6和CAP2等作为独立诊断标志物在肝癌诊断中的应用价值[17,18]. 有研究[19,20]证明, FAT10基因在炎性环境下的肝癌和结直肠癌组织中高表达. 但是, 血浆中FAT10 mRNA表达水平以及可否作为肝癌和结肠癌的一种血清学诊断标志目前还未有研究. 本实验目的是测定FAT10 mRNA在血浆中的表达水平, 评估其临床诊断价值.
70例肝癌、64例结肠癌来自2014-06/2015-02河南省人民医院肝胆外科和消化内科住院患者, 另选同期住院肝硬化患者60例、健康体检者64例为对照. 70例肝癌中男51例、女19例, 年龄54.03岁±8.93岁. 将所有肝癌患者进行TNM分期, 另外使用Child-Pugh方法进行肝脏功能分级. 结肠癌患者男38例, 女26例, 年龄53.55岁±6.56岁, 使用Duke's方法进行分期. 肝癌及结肠癌血样本收集前均未行放疗或化疗, 且经术后病理证实. 所有患者均签署知情同意书, 本研究经医院伦理委员会批准. TRIzol试剂, 美国Invitrogen公司; 紫外分光光度计UV-2450型, 日本岛津公司; RT-PCR试剂盒, 日本TaKaRa公司; 目的基因FAT10扩增引物由合成; 内参基因GAPDH扩增引物购自日本TaKaRa公司; AFP-ELISA试剂盒, Novatein Biosciences, Cambridge, MA, 02138, USA; 96孔酶标仪BIO-RAD680, 美国Bio-Rad公司.
1.2.1 样本采集: 手术前晨起空腹抽取5 mL外周静脉血置于EDTA-抗凝管内, 立即常温下3500 r/min, 离心15 min, 分装入微型离心管内, -80 ℃冰箱内备用.
1.2.2 实时荧光定量PCR: (1)提取总RNA: 用TRIzol试剂分别提取肝癌、结肠癌、肝硬化和正常对照组血浆中的总RNA; 紫外分光光度计检测总RNA吸光度, 若A260/280在1.8-2.0之间说明所提取的RNA纯度良好; (2)逆转录合成cDNA: 按照反转录试剂盒说明操作. 反应体系为10 μL, 反应条件为42 ℃ 2 min; 随后, 在上述反应液基础上进行cDNA反转录合成, 反应体系共20 μL, 反应条件为37 ℃ 15 min, 85 ℃ 5 s; (3)实时荧光定量PCR: 应用扩增仪SYSR Ex.Taq试剂混合染料进行RT-PCR反应, 按照RT-PCR试剂盒说明书操作. PCR反应体系为20 μL, 包括2 μL样本cDNA, 0.8 μL正、反引物(表1), 0.4 μL Rox reference dye (50×), 10 μL SYBR premix Ex Taq he, 6 μL无RNA酶水. PCR扩增条件为95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 31 s; 进行40个PCR循环; (4)扩增结果: PCR反应结束后出现熔解曲线. 以内参基因GAPDH为标准, 所有样本均设副孔, 并重复试验取平均值去除误差. 计算 2-△△Ct表示样品中FAT10初始cDNA的相对表达量. △Ct = 样品Ct-内参Ct, △△Ct = △Ct-(随机阴性对照样品Ct均值-该样品的内参Ct均值).
| 基因 | 序列 | 产物长度(bp) |
| FAT10 mRNA | 上游引物: 5'-CAATGCTTCCTGCCTCTGTG-3' | 297 |
| 下游引物: 5'-TGCCTCTTTGCCTCATCACC-3' | ||
| GAPDH | 上游引物: 5'-ACCCAGAAGACTGTG GATGG-3' | 138 |
| 下游引物: 5'-TGCTGTAGCCAAATTCGTTG-3' |
1.2.3 ELISA检测: 实验前规划空白孔、标准品孔、样本孔, 每孔均设置副孔, 严格按照AFP-ELISA试剂盒说明书进行操作. 实验结束后, 利用96孔酶标仪测出每孔相应的A值. 根据标准品绘制标准曲线, 通过已知标准品浓度值计算样品浓度值.
统计学处理 应用SPSS21.0统计学软件, 卡方检验方法分析各组之间FAT10 mRNA相对表达频率差异, 并使用平行诊断方法应用灵敏度分析FAT10 mRNA和AFP蛋白联合诊断价值. AFP蛋白计量资料以中位数(四分位数)表示, FAT10 mRNA相对表达量mean±SD表示, 两组间均数比较采用t检验、Wilcoxon秩和检验, 多组间比较采用方差分析, Kruskal-Wallis秩和检验, 双侧检验P<0.05为差异有统计学意义.
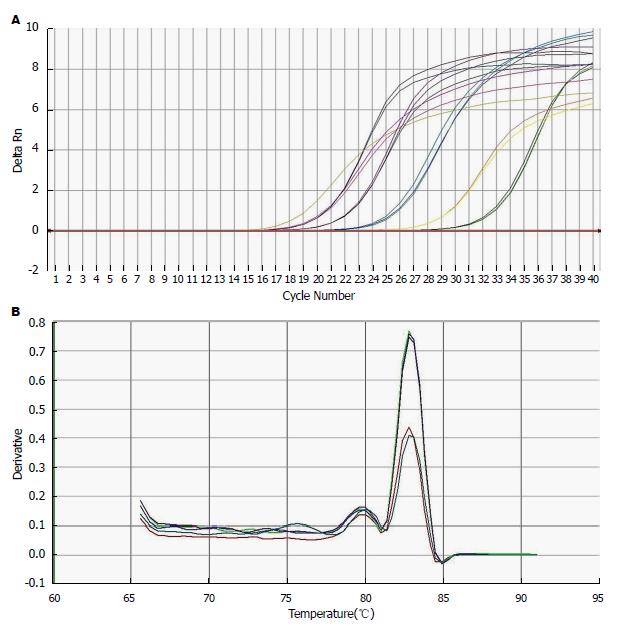
样本Ct值<32时, FAT10 mRNA扩增曲线均为S型, 可见各样品扩增效率较一致, 样本重复性好, 熔解曲线为单峰, 熔解温度与目的基因产物相一致, 可排除二聚体及其他产物(图1). Ct>32时, 扩增曲线呈不规则波浪线, 为目的基因阴性表达.
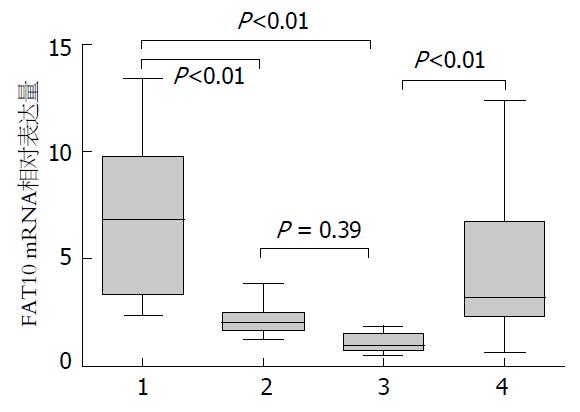
肝癌实验组血浆FAT10 mRNA的阳性表达率为72.85%(51/70), 肝硬化、健康组血浆FAT10 mRNA的阳性表达率分别为28.3%(17/60)和12.5%(8/64), 三者之间比较差异具有统计学意义(P<0.01); 肝癌组分别与肝硬化组(χ2 = 21.29, P<0.01)和正常组(χ2 = 32.19, P<0.01)比较均具有显著差异, 肝硬化组与健康组比较差异无明显统计学意义(χ2 = 2.42, P>0.05). 3组中FAT10 mRNA的相对表达量分别为6.83±3.37、2.14±0.70、1.08±0.46, 差异有统计学意义(F = 27.20, P<0.01)(表2, 图2). AFP蛋白在肝癌、肝硬化、健康组的表达水平(ng/mL)分别是99.15(19.71-270.16)、29.08(15.57-51.24)、11.11(7.01-20.54), 三者之间差异具有统计学意义, 肝癌组明显高表达于肝硬化组和正常组(χ2 = 45.82, P<0.001)(表2).
| 分组 | n | FAT10 mRNA | 阳性率(%) | 2-△△Ct值 | AFP浓度(ng/mL) | |
| 阳性 | 阴性 | M(QR) | ||||
| 肝癌组 | 70 | 51 | 19 | 72.8 | 6.83±3.37 | 99.15(19.71-270.16) |
| 肝硬化组 | 60 | 17 | 43 | 28.3 | 2.14±0.70 | 29.08(15.57-51.24) |
| 正常人组 | 64 | 8 | 56 | 12.5 | 1.08±0.46 | 11.11(7.01-20.54) |
| 结肠癌组 | 64 | 38 | 26 | 59.4 | 4.04±3.33 | - |
70例肝癌患者的详细资料及临床病理特点如表2. 资料显示, FAT10 mRNA的高表达与肝癌患者的年龄、性别、乙型肝炎病毒或丙型肝炎病毒感染情况、肿瘤大小、Child-Pugh分级、分化程度、有无血管侵犯无关(P>0.05), 而与肝癌TNM分期(χ2 = 8.47, P<0.05)、淋巴结转移显著相关(χ2 = 5.44, P<0.05)(表3).
| 临床病理因素 | n | FAT10 mRNA | χ2值 | P值 | |
| 阳性 | 阴性 | ||||
| 年龄(岁) | 1.543 | 0.2141 | |||
| >50 | 45 | 35 | 10 | ||
| ≤50 | 25 | 16 | 9 | ||
| 性别 | 0.489 | 0.4841 | |||
| 男 | 51 | 36 | 15 | ||
| 女 | 19 | 15 | 4 | ||
| 肿瘤直径(cm) | |||||
| >5 | 32 | 25 | 7 | 1.432 | 0.4892 |
| >2及≤5 | 22 | 14 | 8 | ||
| ≤2 | 16 | 12 | 4 | ||
| HBsAg | 2.185 | 0.1391 | |||
| + | 56 | 43 | 13 | ||
| - | 14 | 8 | 6 | ||
| HCVAb | 1.545 | 0.2411 | |||
| + | 12 | 7 | 5 | ||
| - | 58 | 44 | 14 | ||
| Child-Pugh分 | 1.802 | 0.4062 | |||
| A级 | 36 | 26 | 10 | ||
| B级 | 20 | 13 | 7 | ||
| C级 | 14 | 12 | 2 | ||
| TNM分期 | 8.470 | 0.0041 | |||
| Ⅲ+Ⅳ | 48 | 40 | 8 | ||
| Ⅰ+Ⅱ | 22 | 11 | 11 | ||
| 分化程度 | 2.944 | 0.2292 | |||
| 高 | 15 | 12 | 3 | ||
| 中 | 39 | 30 | 9 | ||
| 低 | 16 | 9 | 7 | ||
| 肿瘤有无血管侵犯 | 2.952 | 0.0861 | |||
| 有 | 51 | 40 | 11 | ||
| 无 | 19 | 11 | 8 | ||
| 有无淋巴结转移 | 5.440 | 0.0201 | |||
| 有 | 22 | 12 | 10 | ||
| 无 | 48 | 39 | 9 | ||
结肠癌组FAT10 mRNA相对表达量为4.04±3.33, 阳性表达率为59.4%(38/64), 与健康组比较差异具有显著的统计学意义(χ2 = 19.05, P<0.01). 相关因素分析显示, FAT10 mRNA表达水平与结肠癌患者的年龄、性别、肿瘤直径、肿瘤分化程度无显著相关(P>0.05), 而与肿瘤Duke's分期(χ2 = 5.63, P<0.05)及远处转移相关(χ2 = 6.05, P<0.05)(表2, 4).
70例肝癌中AFP阴性肝癌18例, 小肝癌16例, FAT10 mRNA在AFP阴性肝癌中和小肝癌中分别有12例和11例表达阳性. 表明FAT mRNA对AFP阴性肝癌和小肝癌具有明显诊断价值.
鉴于肝癌早期诊断对肝癌预后的重要性, 本研究采取平行诊断试验以期提高灵敏度. 根据国际推荐标准选择25 ng/mL作为AFP临界值时, AFP对肝癌的诊断灵敏度为72.9%, FAT10 mRNA与AFP蛋白两者联合诊断肝癌可使诊断灵敏度提高至85.7%. 在小肝癌中AFP诊断灵敏度仅为37.5%, 联合FAT10 mRNA灵敏度提高至84.4%(表5).
| 分组 | n | 指标 | 临界值(ng/mL) | 灵敏度(%) | 特异度(%) |
| 肝癌组 | 70 | AFP | 25.0 | 72.9 | 71.0 |
| FAT10 mRNA | 72.8 | 79.8 | |||
| AFP+FAT10 mRNA | 85.7 | 71.0 | |||
| 小肝癌组 | 16 | AFP | 25.0 | 37.5 | 71.0 |
| FAT10 mRNA | 68.8 | 79.8 | |||
| AFP+FAT10 mRNA | 84.4 | 68.5 | |||
| AFP阴性肝癌组 | 18 | FAT10 mRNA | 66.6 | 79.8 |
泛素(ubiquitin, Ub)最先由Goldstein在1975年从胸腺中分离出来, 有76个氨基酸残基组成的高度保守的一种蛋白质, 在真核生物中普遍存在[21]. Ub在调节细胞多种生物学过程如细胞周期循环、细胞凋亡、基因转录、DNA修复及免疫应激等过程中起着重要作用, 他的功能异常会导致恶性肿瘤的发生[22,23]. 近年发现真核生物细胞中存在与Ub序列和功能相近的小分子蛋白质, 即类Ub家族, 其主要分为两个亚家族: Ub结构域蛋白家族(ubiquitin domain proteins, UDPs)和类Ub修饰蛋白家族(ubiquitin like modifiers, UBLs)[23-25]. 其中UDPs代表成员RAD23、Dsk2、ElonginB、Bag1等, 可以与Ub及Ub修饰蛋白质发生非共价结合. UBLs代表成员有ISG15、NEDD8、SUMO等, 具有同Ub单体或二聚体同源的结构域, 在特异性E1、E2、E3酶的作用下, 可通过C末端的双甘氨酸基团与底物蛋白共价结合, 进而调控细胞周期及信号, 在肿瘤发生发展过程中起着重要作用[24-26]. FAT10作为类Ub家族的一员, 他在90%的肝癌组织中上调表达[27,28]. 同时, FAT10 mRNA还被发现在胃肠道肿瘤和女性生殖系统肿瘤组织中有不同程度上调表达[27-29]. 最近的研究[30,31]表明, FAT10基因可以通过管理细胞循环周期和监控细胞循环相关性蛋白如CDK4、CDK6、PCNA和周期蛋白D1等促进肝癌细胞增殖, 认为FAT10基因可能通过Akt/GSK3β途径促进肝癌细胞增殖、凋亡和浸润.
本研究显示, FAT10 mRNA在肝癌患者血浆中具有较高的阳性表达率, 在结肠癌患者血浆中也具有较高的表达水平. 据此, FAT10 mRNA在肝癌和结肠癌诊断中可能会作为一个新的潜在的血清学诊断指标. 还发现FAT10 mRNA的高表达与肝癌的TNM分期、及淋巴结转移显著相关(P<0.05), 有淋巴结转移者表达水平明显高于无淋巴结转移者. FAT10 mRNA在结肠癌中的表达水平与肿瘤Duke's分期及远处转移密切相关(P<0.05), Duke's分期C、D期患者血浆FAT10 mRNA表达水平明显高于A、B期患者. 这些结果提示, FAT10 mRNA可能与肝癌和结肠癌的发生以及肿瘤细胞侵犯周围或远处组织器官有关, 提示FAT10 mRNA可能成为判断肝癌和结肠癌预后的特异性指标, 虽然这一结论尚需进一步研究术后血浆FAT10 mRNA的表达水平, 并进行大量患者预后随访予以证实. 由于AFP与FAT10 mRNA无相关性(Z = -1.136, P = 0.256), FAT10 mRNA为独立于AFP的诊断指标, 可与AFP联合应用于肝癌的诊断. 在AFP阴性肝癌中, FAT10 mRNA有较高的阳性表达率(66.7%), 表明FAT10 mRNA可作AFP阴性肝癌诊断的重要指标. 在肝癌包括小肝癌中联合检测FAT10 mRNA和AFP可使诊断灵敏度增加, 提示了联合应用的前景.
总之, FAT10 mRNA在肝癌和结肠癌诊断中, 可以作为新的潜在血清学标志物, 并且可应用于AFP阴性肝癌的辅助诊断, 联合检测AFP和FAT10 mRNA有望提高肝癌的早期诊断正确率.
肝癌和结肠癌均是世界上最常见的恶性肿瘤, 其早期诊断可提高手术预后, 以往研究表明FAT10 mRNA在肝癌组织和结肠癌组织中高表达, 与肿瘤的发生发展、侵袭转移和预后密切相关, 但是其在血浆水平对肝癌和结肠癌的诊断价值并不清楚.
刘云鹏, 教授, 中国医科大学附属第一医院肿瘤内科; 李正荣, 副教授, 副主任医师, 南昌大学附属第一医院胃肠外科(普六病区)
人类白细胞抗原FAT10是类泛素(ubiquitin, Ub)蛋白家族成员, 在人体组织中已有证据表明FAT10 mRNA表达水平与肿瘤细胞的发生及侵袭能力相关, FAT10基因可以作为肝癌治疗的潜在靶点. 本课题主要检测FAT10在肝癌和结肠癌中的表达情况并初步探讨其表达同临床特点的关系及诊断价值.
Ren等发现FAT10 mRNA和染色体不稳定性有关, 从而参与肿瘤形成. Liu等发现FAT10基因参与细胞循环周期的管理及修饰细胞循环相关蛋白, 并通过Akt/GSK3β途径促进肝癌细胞增殖、凋亡和入侵.
本文拟通过实验提出血浆FAT10 mRNA在肝癌和结肠癌中呈现高表达, 并且可以作为甲胎蛋白(α-fetoprotein, AFP)的补充, 应用于AFP阴性肝癌和小肝癌, 联合FAT10 mRNA和AFP提高肝癌诊断灵敏度, 因此FAT10 mRNA可能成为肝癌和结肠癌新的分子标志物.
应用分子生物学相关技术检测肝癌和结肠癌血浆FAT10 mRNA的表达情况, 评估其诊断价值. 以后有望成为常规的临床肿瘤筛查手段, 使其成为早期诊断标志物及潜在预后预测因子.
Ub: 一种高保守76氨基酸多肽, 在链接靶蛋白中起重要作用, 通过26S蛋白酶体途径标记蛋白使之降解. FAT10是一种18 kDa蛋白, 包含165个氨基酸残基及两个亚胺融合基团, 在正常人成熟B细胞和树突状细胞中表达并参与抗原呈递过程.
本文通过使用RT-PCR和ELISA方法发现, FAT10 mRNA在肝癌和结肠癌诊断中, 可以作为新的潜在血清学标志物. 同时联合AFP和FAT10 mRNA可以提高肝癌的早期诊断率. 该文章思路清晰, 研究内容合理, 文章具有一定创新性, 有一定的科学意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Arbyn M, Castellsagué X, de Sanjosé S, Bruni L, Saraiya M, Bray F, Ferlay J. Worldwide burden of cervical cancer in 2008. Ann Oncol. 2011;22:2675-2686. [PubMed] [DOI] |
| 2. | Lagadec P, Griessinger E, Nawrot MP, Fenouille N, Colosetti P, Imbert V, Mari M, Hofman P, Czerucka D, Rousseau D. Pharmacological targeting of NF-kappaB potentiates the effect of the topoisomerase inhibitor CPT-11 on colon cancer cells. Br J Cancer. 2008;98:335-344. [PubMed] [DOI] |
| 3. | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet. 2012;379:1245-1255. [PubMed] [DOI] |
| 4. | Bruix J, Sherman M. Management of hepatocellular carcinoma: an update. Hepatology. 2011;53:1020-1022. [PubMed] [DOI] |
| 5. | Bruix J, Gores GJ, Mazzaferro V. Hepatocellular carcinoma: clinical frontiers and perspectives. Gut. 2014;63:844-855. [PubMed] [DOI] |
| 6. | Hu B, Tian X, Sun J, Meng X. Evaluation of individual and combined applications of serum biomarkers for diagnosis of hepatocellular carcinoma: a meta-analysis. Int J Mol Sci. 2013;14:23559-23580. [PubMed] [DOI] |
| 7. | Forner A, Reig M, Bruix J. Alpha-fetoprotein for hepatocellular carcinoma diagnosis: the demise of a brilliant star. Gastroenterology. 2009;137:26-29. [PubMed] [DOI] |
| 8. | Forner A, Vilana R, Ayuso C, Bianchi L, Solé M, Ayuso JR, Boix L, Sala M, Varela M, Llovet JM. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology. 2008;47:97-104. [PubMed] |
| 9. | Gruen JR, Nalabolu SR, Chu TW, Bowlus C, Fan WF, Goei VL, Wei H, Sivakamasundari R, Liu Y, Xu HX. A transcription map of the major histocompatibility complex (MHC) class I region. Genomics. 1996;36:70-85. [PubMed] |
| 10. | Fan W, Cai W, Parimoo S, Schwarz DC, Lennon GG, Weissman SM. Identification of seven new human MHC class I region genes around the HLA-F locus. Immunogenetics. 1996;44:97-103. [PubMed] |
| 11. | Liu YC, Pan J, Zhang C, Fan W, Collinge M, Bender JR, Weissman SM. A MHC-encoded ubiquitin-like protein (FAT10) binds noncovalently to the spindle assembly checkpoint protein MAD2. Proc Natl Acad Sci USA. 1999;96:4313-4318. [PubMed] |
| 12. | Liu H, Li J, Tillman B, French BA, French SW. Ufmylation and FATylation pathways are downregulated in human alcoholic and nonalcoholic steatohepatitis, and mice fed DDC, where Mallory-Denk bodies (MDBs) form. Exp Mol Pathol. 2014;97:81-88. [PubMed] [DOI] |
| 13. | Lim CB, Zhang D, Lee CG. FAT10, a gene up-regulated in various cancers, is cell-cycle regulated. Cell Div. 2006;1:20. [PubMed] |
| 14. | Ren J, Kan A, Leong SH, Ooi LL, Jeang KT, Chong SS, Kon OL, Lee CG. FAT10 plays a role in the regulation of chromosomal stability. J Biol Chem. 2006;281:11413-11421. [PubMed] |
| 15. | Ren J, Wang Y, Gao Y, Mehta SB, Lee CG. FAT10 mediates the effect of TNF-α in inducing chromosomal instability. J Cell Sci. 2011;124:3665-3675. [PubMed] [DOI] |
| 17. | Chen M, Zheng T, Han S, Zhang L, Bai Y, Fang X, Ding SZ, Yang Y. A preliminary study of plasma cyclase-associated protein 2 as a novel biomarker for early stage and alpha-fetoprotein negative hepatocellular carcinoma patients. Clin Res Hepatol Gastroenterol. 2015;39:215-221. [PubMed] [DOI] |
| 18. | Zheng T, Chen M, Han S, Zhang L, Bai Y, Fang X, Ding SZ, Yang Y. Plasma minichromosome maintenance complex component 6 is a novel biomarker for hepatocellular carcinoma patients. Hepatol Res. 2014;44:1347-1356. [PubMed] [DOI] |
| 19. | Lukasiak S, Schiller C, Oehlschlaeger P, Schmidtke G, Krause P, Legler DF, Autschbach F, Schirmacher P, Breuhahn K, Groettrup M. Proinflammatory cytokines cause FAT10 upregulation in cancers of liver and colon. Oncogene. 2008;27:6068-6074. [PubMed] [DOI] |
| 20. | Qing X, French BA, Oliva J, French SW. Increased expression of FAT10 in colon benign, premalignant and malignant epithelial neoplasms. Exp Mol Pathol. 2011;90:51-54. [PubMed] [DOI] |
| 21. | Hoeller D, Hecker CM, Dikic I. Ubiquitin and ubiquitin-like proteins in cancer pathogenesis. Nat Rev Cancer. 2006;6:776-788. [PubMed] |
| 22. | Kirkin V, Dikic I. Role of ubiquitin- and Ubl-binding proteins in cell signaling. Curr Opin Cell Biol. 2007;19:199-205. [PubMed] |
| 23. | Dikic I, Wakatsuki S, Walters KJ. Ubiquitin-binding domains - from structures to functions. Nat Rev Mol Cell Biol. 2009;10:659-671. [PubMed] [DOI] |
| 24. | Hochstrasser M. Origin and function of ubiquitin-like proteins. Nature. 2009;458:422-429. [PubMed] [DOI] |
| 25. | van der Veen AG, Ploegh HL. Ubiquitin-like proteins. Annu Rev Biochem. 2012;81:323-357. [PubMed] [DOI] |
| 26. | Bialas J, Groettrup M, Aichem A. Conjugation of the ubiquitin activating enzyme UBE1 with the ubiquitin-like modifier FAT10 targets it for proteasomal degradation. PLoS One. 2015;10:e0120329. [PubMed] [DOI] |
| 27. | Lee CG, Ren J, Cheong IS, Ban KH, Ooi LL, Yong Tan S, Kan A, Nuchprayoon I, Jin R, Lee KH. Expression of the FAT10 gene is highly upregulated in hepatocellular carcinoma and other gastrointestinal and gynecological cancers. Oncogene. 2003;22:2592-2603. [PubMed] |
| 28. | Ji F, Jin X, Jiao CH, Xu QW, Wang ZW, Chen YL. FAT10 level in human gastric cancer and its relation with mutant p53 level, lymph node metastasis and TNM staging. World J Gastroenterol. 2009;15:2228-2233. [PubMed] [DOI] |
| 29. | Yuan R, Jiang C, Hong K, Yu X, Wu L, Liu T, Liu X, Tang X, Cai H, Shao J. Genetic variation in the Fat10 gene is associated with risk of hepatocellular carcinoma in a Chinese population. Asian Pac J Cancer Prev. 2011;12:2117-2122. [PubMed] |