修回日期: 2015-11-20
接受日期: 2015-11-30
在线出版日期: 2015-12-28
目的: 探究受体型蛋白酪氨酸磷酸酶N2(receptor-type tyrosine-protein phosphatase N2, PTPRN2)和增殖细胞核抗原(proliferation cell nuclear antigen, Ki-67)在肝细胞肝癌(hepatocellular carcinoma, HCC)中的表达与临床参数的相关性及其临床意义.
方法: 收集郑州大学第一附属医院HCC标本186例及其相应的癌旁组织(adjacent normal liver tissue, ANLT)180例、远癌组织138例, 运用免疫组织化学染色的方法检测蛋白PTPRN2和Ki-67在HCC、ANLT、远癌组织的表达情况.
结果: 在186例HCC患者中, 蛋白PTPRN2与Ki-67阳性表达率分别为55.9%、49.5%, PTPRN2的表达与血清甲胎蛋白(alpha fetoprotein, AFP)含量、肿瘤大小、临床分期、组织学分化程度相关, 有统计学意义(P<0.05); Ki-67的表达与淋巴结转移、临床分期、组织学分化程度相关, 有统计学意义(P<0.05); PTPRN2和Ki-67的表达无明显相关性(r =﹣0.161, P>0.05)
结论: PTPRN2和Ki-67的高表达与HCC发展进程密切相关, 但两者间无明显相关性.
核心提示: 通过研究受体型蛋白酪氨酸磷酸酶 N2(receptor-type tyrosine-protein phosphatase N2, PTPRN2)和增殖细胞核抗原(proliferation cell nuclear antigen, Ki-67)在肝细胞肝癌(hepatocellular carcinoma, HCC)、癌旁组织(adjacent normal liver tissue, ANLT)及远癌组织的表达, 发现二者在HCC中的表达明显高于ANLT及远癌组织, 推测PTPRN2和Ki-67在HCC中的高表达可能与肿瘤发生发展及预后密切相关, 但二者间无明显相关性, 有待进一步研究.
引文著录: 万家晗, 马秀现, 乔振涛, 李健. PTPRN2和Ki-67在肝细胞肝癌中的表达及临床意义. 世界华人消化杂志 2015; 23(36): 5768-5774
Revised: November 20, 2015
Accepted: November 30, 2015
Published online: December 28, 2015
AIM: To explore the correlation of receptor-type tyrosine-protein phosphatase N2 (PTPRN2) and proliferation cell nuclear antigen (Ki-67) expression with clinical parameters in hepatocellular carcinoma (HCC).
METHODS: We collected 186 HCC specimens from patients treated at the First Affiliated Hospital of Zhengzhou University, 180 tumor adjacent normal liver tissues, and 138 non-neoplastic distant tissues. The expression of PTPRN2 and Ki-67 proteins was examined by immunohistochemistry in the above tissues.
RESULTS: The positive expression rates of PTPRN2 and Ki-67 were 55.9% and 49.5%, respectively. The positive expression of PTPRN2 was correlated with serum AFP level, tumor size, TNM stage, and histopathological differentiation (P < 0.05). The expression of Ki-67 was correlated with lymph node metastasis, TNM stage, and histopathological differentiation (P < 0.05). There was no significant correlation between PTPRN2 and Ki-67 expression (r = -0.161, P > 0.05).
CONCLUSION: The high expression of PTPRN2 and Ki-67 is closely associated with HCC development, but there is no significant correlation between them.
- Citation: Wan JH, Ma XX, Qiao ZT, Li J. Clinical significance of expression of receptor-type tyrosine-protein phosphatase N2 and proliferation cell nuclear antigen in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(36): 5768-5774
- URL: https://www.wjgnet.com/1009-3079/full/v23/i36/5768.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i36.5768
肝癌是最常见的消化系肿瘤之一, 其发生发展是多基因、多途径、多阶段共同作用的结果, 细胞信号传导通路异常和细胞周期调控失常是其发生发展过程中的两个重要方面[1]. 蛋白质酪氨酸磷酸酶参与细胞的信号转导, 调节细胞生长、分化、代谢、基因转录和免疫应答, 在控制肿瘤生长中起重要作用, 受体型蛋白酪氨酸磷酸酶N2(receptor-type tyrosine-protein phosphatase N2, PTPRN2)可能发挥致瘤功能[2,3]. 增殖细胞核抗原(proliferation cell nuclear antigen, Ki-67)与细胞的有丝分裂过程密切相关, 在细胞周期各个阶段都有不同程度表达, 常被用来衡量肿瘤细胞增殖活性及其生物学行为的重要依据[4,5]. 近年有研究[6-10]报道, 多种恶性肿瘤如肺癌、乳腺癌等的发生发展分别与PTPRN2、Ki-67的异常表达密切相关, 但PTPRN2和Ki-67在肝细胞癌(hepatocellular carcinoma, HCC)中的表达及其临床意义尚不明确. 本实验通过免疫组织化学染色的方法检测肝癌组织、癌旁组织、远癌组织中PTPRN2和Ki-67的表达, 分析二者的相关性及其临床意义.
收集郑州大学第一附属医院肝胆外科2010-06/2012-05入院手术治疗的HCC患者, 将其分为3组: 肝癌组186例、癌旁组180例(距癌灶距离<2 cm)、远癌组织138例(距癌灶距离>5 cm). 入选标准: (1)术前所有患者均未经放化疗及其他抗肿瘤治疗; (2)术后病理结果均为HCC. 将术后切除的组织标本经40 g/L的甲醛溶液固定, 常规石蜡包埋切片备用. 一抗为兔抗人Ki-67抗原免疫组织化学单克隆抗体(武汉博士德生物技术有限公司); 兔抗人PTPRN2抗原免疫组织化学单克隆抗体(北京博奥森生物技术有限公司); 免疫组织化学试剂盒为PV-9000(北京中山生物科技有限公司). 本研究经相关患者知情同意并报医院伦理委员会批准.
采用免疫组织化学二步法进行免疫组织染色 石蜡包埋的组织块切成4 μm厚度、常规脱蜡至水、3%H2O2氧化、磷酸盐缓冲液(phosphate buffer saline, PBS)冲洗、室温下孵育、加一抗后孵育过夜、滴加Polymer Helper(试剂1)孵育, PBS冲洗, 滴加polyperoxidase-IgG(试剂2)孵育, PBS冲洗, 二氨基联苯胺(Diaminobenzidine, DAB)染色、自来水冲洗、苏木素复染、中性树胶封固. 结果判定: 在光镜(×400)下随机选取10个视野, 每个视野计数100个细胞, 根据染色强度和阳性细胞比例进行综合评定: 阳性细胞数0-25%记为0分、26%-50%记为1分、51%-75%记为2分、76%-100%记为3分. 染色强度不着色记为0分、浅黄色记为1分、棕黄色记为2分, 深褐色记为3分. 根据两项指标的乘积分数分为阴性(0-1分)和阳性结果(2-9分)[11].
统计学处理 应用SPSS17.0统计软件, 率的比较采用χ2检验, 相关性检验采用非参数Spearman相关处理, 检验水准α = 0.05. P<0.05为差异有统计学意义.
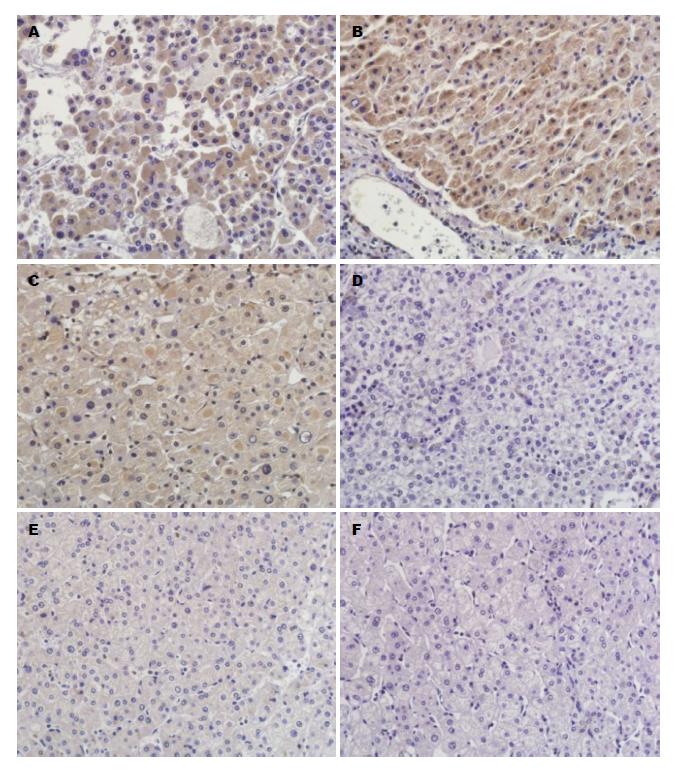
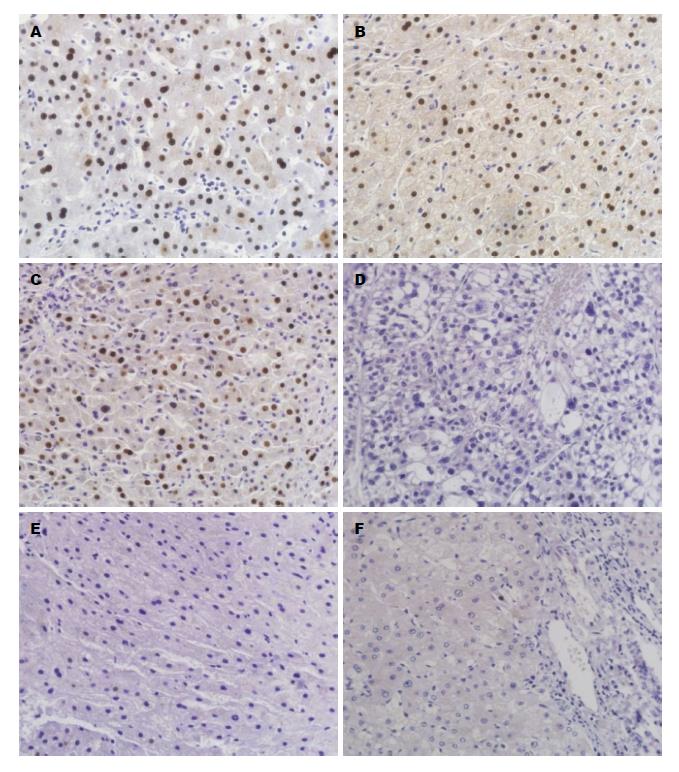
PTPRN2阳性染色呈现棕黄色颗粒, 定位于细胞质, 在HCC的阳性表达率为55.9%, 其明显高于ANLT及远癌组织(χ2 = 81.812, P<0.01)(表1, 图1). Ki-67阳性染色呈棕黄色颗粒, 定位于细胞核, 其表达呈明显的异质性, 在HCC的阳性表达率为49.5%, ANLT及远癌组织中未见Ki-67过度表达, 可见Ki-67在HCC显著高于ANLT及远癌组织(χ2 = 37.318, P<0.01)(表1, 图2).
| 分组 | n | PTPRN2 | Ki-67 | ||
| - | + | - | + | ||
| 肝癌组 | 186 | 82 | 104 | 94 | 92 |
| 癌旁组 | 180 | 142 | 38 | 130 | 50 |
| 远癌组 | 138 | 120 | 18 | 112 | 26 |
在186例HCC患者中, PTPRN2与AFP含量、肿瘤大小、临床分期、组织学分化程度相关(P<0.05); Ki-67的表达与淋巴结转移、临床分期、组织学分化程度相关(P<0.05)(表2). 蛋白PTPRN2和Ki-67的表达无明显相关性(r = -0.161, P>0.05)(表3).
| 临床病理参数 | n | PTPRN2 | Ki-67 | ||||||
| 阳性(+) | 阳性率(%) | χ2值 | P值 | 阳性(+) | 阳性率(%) | χ2值 | P值 | ||
| 性别 | 0.097 | >0.05 | 1.281 | >0.05 | |||||
| 男 | 156 | 88 | 56.4 | 80 | 51.3 | ||||
| 女 | 30 | 16 | 53.3 | 12 | 40.0 | ||||
| 年龄(岁) | 0.115 | >0.05 | 1.057 | >0.05 | |||||
| ≤50 | 66 | 38 | 57.6 | 36 | 54.5 | ||||
| >50 | 120 | 66 | 55.0 | 56 | 46.7 | ||||
| HBsAg | 1.168 | >0.05 | 0.232 | >0.05 | |||||
| - | 26 | 12 | 46.2 | 14 | 53.8 | ||||
| + | 160 | 92 | 57.5 | 78 | 48.8 | ||||
| AFP(ng/mL) | 4.524 | <0.05 | 0.027 | >0.05 | |||||
| ≤400 | 104 | 51 | 49.0 | 52 | 50.0 | ||||
| >400 | 82 | 53 | 64.6 | 40 | 48.8 | ||||
| 肿瘤大小(cm) | 9.664 | <0.01 | 1.033 | >0.05 | |||||
| ≤5 | 108 | 50 | 46.3 | 50 | 46.3 | ||||
| >5 | 78 | 54 | 69.2 | 42 | 53.8 | ||||
| 肿瘤个数 | 0.275 | >0.05 | 0.074 | >0.05 | |||||
| 单个 | 144 | 82 | 56.9 | 72 | 50.0 | ||||
| 多个 | 42 | 22 | 52.4 | 20 | 47.6 | ||||
| 淋巴转移 | 1.384 | >0.05 | 25.457 | <0.01 | |||||
| 有 | 64 | 32 | 50.0 | 48 | 75.0 | ||||
| 无 | 122 | 72 | 59.0 | 44 | 36.1 | ||||
| 肿瘤包膜 | 1.995 | >0.05 | 2.828 | >0.05 | |||||
| 有 | 58 | 28 | 48.3 | 34 | 58.6 | ||||
| 无 | 128 | 76 | 59.4 | 58 | 45.3 | ||||
| TNM分期 | 14.816 | <0.01 | 17.902 | <0.01 | |||||
| Ⅰ期 | 84 | 34 | 40.5 | 52 | 61.9 | ||||
| Ⅱ期 | 58 | 40 | 69.0 | 30 | 51.7 | ||||
| Ⅲ期 | 44 | 30 | 68.2 | 10 | 22.7 | ||||
| 分化程度 | 16.094 | <0.01 | 19.265 | <0.01 | |||||
| 低 | 50 | 40 | 80.0 | 38 | 76.0 | ||||
| 中、高 | 136 | 64 | 47.1 | 54 | 39.7 | ||||
| 肝硬化 | 1.137 | >0.05 | 4.587 | <0.05 | |||||
| 有 | 130 | 76 | 58.5 | 71 | 54.6 | ||||
| 无 | 56 | 28 | 50.0 | 21 | 37.5 | ||||
| PTPRN2 | Ki-67 | 合计 | |
| - | + | ||
| - | 34 | 48 | 82 |
| + | 60 | 44 | 104 |
| 合计 | 94 | 92 | 186 |
新近研究[12]表明, 肝癌在全球范围所有恶性肿瘤中的死亡率高居第3位, 而HCC是肝癌中主要的病理组织学类型, 占原发性肝癌的90%以上[13]. HCC早期诊断难及术后复发率高是影响患者预后主要障碍, 有研究[14]表明, HCC患者术后5年内复发转移可能性达80%, 其转移与多种基因的突变、细胞信号传导通路密切相关[15]. 因此针对基因突变和细胞信号传导通路是解决HCC高复发率的关键所在[16].
蛋白质酪氨酸磷酸化是一项控制细胞增殖、分化、通讯和黏附的基本调节机制, 破坏其关键调控机制能够促成肿瘤、糖尿病和自身免疫性疾病等多种人类疾病[17]. 相关研究已经证实, 蛋白酪氨酸磷酸酶家族成员-蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B, PTP1B)在细胞信号转导和生理调节中起关键作用, 尤其在HCC、乳腺癌、胃癌等多种肿瘤组织中呈现高表达[18-21]. 近年来有研究结果表明, PTPRN2与细胞凋亡有着密切联系[4], 并在多种癌症中异常表达, 包括肺癌、乳腺癌、神经胶质瘤[22]等, 但具体机制尚不明确. 我们推测PTPRN2在HCC患者中具有相似的分子生物学特性, 参与到HCC发生、发展、复发及转移的过程中.
Ki-67作为一种细胞核增殖抗原, 与细胞的有丝分裂过程密切相关, 处于静止期G0的细胞抗Ki-67染色为阴性, 在G1后期开始出现, 在S期和G2期逐渐升高, M期达到高峰, 以此可以识别正常分裂的细胞和肿瘤细胞, 并可作为判断肿瘤复发和预后的有效指标[23,24]. 研究[25-28]表明, Ki-67在多种恶性肿瘤如HCC、胃癌、肺癌、结肠癌和乳腺癌中均有过度表达, 并作为间接反映HCC患者生存期及无病生存期的肿瘤标志物[29]. 目前, Ki-67检测已经被广泛用于反映肿瘤细胞增殖速度和预测肿瘤预后[30].
为证实我们的推测, 采用免疫组织化学染色结果显示, PTPRN2在HCC患者中的阳性率明显高于ANLT和远癌组织, 并与AFP含量、肿瘤大小、临床分期、组织学分化程度相关; Ki-67在HCC患者中的阳性率亦高于ANLT和远癌组织, 并与淋巴结转移、临床分期、组织学分化程度相关; 但蛋白PTPRN2与Ki-67间无明显相关性. 总之, 在HCC患者中蛋白PTPRN2和Ki-67的高表达与HCC发展进程密切相关, 但二者无明显相关性; 因此, 进一步对二者分子水平的研究及分析是必要的.
肝细胞肝癌(hepatocellular carcinoma, HCC)患者早期诊断难及术后复发率高是影响患者预后主要障碍; 因此, 研究HCC复发转移中潜在的分子机制, 在改善HCC患者预后中具有重要的意义.
方哲平, 主任医师, 浙江省台州医院肝胆外科
对HCC患者术后标本进行相关分子机制的研究, 探寻蛋白受体型蛋白酪氨酸磷酸酶N2(receptor-type tyrosine-protein phosphatase N2, PTPRN2)和增殖细胞核抗原(proliferation cell nuclear antigen, Ki-67)对HCC发生发展及转移生物学机制, 在将来可能会成为基因、分子水平治疗HCC的潜在靶点, 但是由于时间和资源设备等限制, 亟待进一步解决.
德克萨斯大学安德森癌症中心的陈俊杰教授发现PTPRN2在肿瘤的发生发展中具有重要作用, 而Ki-67作为一种细胞核增殖抗原, 与细胞的有丝分裂过程密切相关, 在多种恶性肿瘤均有过度表达. 本文将二者结合起来, 探究PTPRN2与Ki-67在HCC患者中的表达情况及其相关性.
关于PTPRN2和Ki-67在HCC的研究尚未见报道; 作者研究了二者在HCC、ANLT及远癌组织中的表达情况, 推测PTPRN2和Ki-67在HCC中的高表达可能与肿瘤的发生、发展及预后相关.
研究HCC发生、发展、复发和转移的分子机制, 使PTPRN2和Ki-67在将来可能成为基因、分子水平治疗HCC的潜在靶点.
作者采用免疫组织化学染色发现PTPRN2和Ki-67在HCC、癌旁组织及远癌组织均有表达, 且在HCC中的表达明显高于癌旁组织及远癌组织, 该研究有一定的新颖性及临床意义, 而且样本量大, 数据真实可靠, 但是相关具体分子机制, 有待进一步探究.
编辑: 郭鹏 电编:闫晋利
| 2. | Julien SG, Dubé N, Hardy S, Tremblay ML. Inside the human cancer tyrosine phosphatome. Nat Rev Cancer. 2011;11:35-49. [PubMed] [DOI] |
| 3. | Sorokin AV, Nair BC, Wei Y, Aziz KE, Evdokimova V, Hung MC, Chen J. Aberrant Expression of proPTPRN2 in Cancer Cells Confers Resistance to Apoptosis. Cancer Res. 2015;75:1846-1858. [PubMed] [DOI] |
| 5. | Tan PH, Bay BH, Yip G, Selvarajan S, Tan P, Wu J, Lee CH, Li KB. Immunohistochemical detection of Ki67 in breast cancer correlates with transcriptional regulation of genes related to apoptosis and cell death. Mod Pathol. 2005;18:374-381. [PubMed] [DOI] |
| 6. | Wielscher M, Vierlinger K, Kegler U, Ziesche R, Gsur A, Weinhäusel A. Diagnostic Performance of Plasma DNA Methylation Profiles in Lung Cancer, Pulmonary Fibrosis and COPD. EBioMedicine. 2015;2:927-934. [PubMed] [DOI] |
| 7. | Selamat SA, Galler JS, Joshi AD, Fyfe MN, Campan M, Siegmund KD, Kerr KM, Laird-Offringa IA. DNA methylation changes in atypical adenomatous hyperplasia, adenocarcinoma in situ, and lung adenocarcinoma. PLoS One. 2011;6:e21443. [PubMed] [DOI] |
| 8. | 冯 振卿, 冯 蕾, 石 永利, 饶 秋, 刘 标, 樊 祥山, 孟 凡青. TK1、Ki-67在非小细胞肺癌组织中的表达及预后意义. 南京医科大学学报(自然科学版). 2012;32:983-988. |
| 9. | Nordgard SH, Johansen FE, Alnaes GI, Bucher E, Syvänen AC, Naume B, Børresen-Dale AL, Kristensen VN. Genome-wide analysis identifies 16q deletion associated with survival, molecular subtypes, mRNA expression, and germline haplotypes in breast cancer patients. Genes Chromosomes Cancer. 2008;47:680-696. [PubMed] [DOI] |
| 12. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 13. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 14. | Tung-Ping Poon R, Fan ST, Wong J. Risk factors, prevention, and management of postoperative recurrence after resection of hepatocellular carcinoma. Ann Surg. 2000;232:10-24. [PubMed] [DOI] |
| 17. | Xu Y, Fisher GJ. Receptor type protein tyrosine phosphatases (RPTPs) - roles in signal transduction and human disease. J Cell Commun Signal. 2012;6:125-138. [PubMed] [DOI] |
| 18. | Shi K, Ugi S, Shimizu S, Sekine O, Ikeda K, Egawa K, Yoshizaki T, Nagai Y, Nishio Y, Takada T. Membrane localization of protein-tyrosine phosphatase 1B is essential for its activation of sterol regulatory element-binding protein-1 gene expression. Biochem Biophys Res Commun. 2007;363:626-632. [PubMed] [DOI] |
| 19. | Kaminski R, Zagozdzon R, Fu Y, Mroz P, Fu W, Seng S, Avraham S, Avraham HK. Role of SRC kinases in Neu-induced tumorigenesis: challenging the paradigm using Csk homologous kinase transgenic mice. Cancer Res. 2006;66:5757-5762. [PubMed] [DOI] |
| 20. | Wang J, Liu B, Chen X, Su L, Wu P, Wu J, Zhu Z. PTP1B expression contributes to gastric cancer progression. Med Oncol. 2012;29:948-956. [PubMed] [DOI] |
| 22. | Lee EJ, Rath P, Liu J, Ryu D, Pei L, Noonepalle SK, Shull AY, Feng Q, Litofsky NS, Miller DC. Identification of Global DNA Methylation Signatures in Glioblastoma-Derived Cancer Stem Cells. J Genet Genomics. 2015;42:355-371. [PubMed] [DOI] |
| 26. | Han B, Lin S, Yu LJ, Wang RZ, Wang YY. Correlation of ¹F-FDG PET activity with expressions of survivin, Ki67, and CD34 in non-small-cell lung cancer. Nucl Med Commun. 2009;30:831-837. [PubMed] [DOI] |
| 27. | Ma YL, Peng JY, Zhang P, Liu WJ, Huang L, Qin HL. Immunohistochemical analysis revealed CD34 and Ki67 protein expression as significant prognostic factors in colorectal cancer. Med Oncol. 2010;27:304-309. [PubMed] [DOI] |
| 28. | 徐 婷, 何 奇, 籍 敏, 邵 玉国, 吴 克瑾, 张 慧娟, 王 啸. 三阴性乳腺癌中p53和Ki67表达的相关研究. 上海交通大学学报(医学版). 2013;33:833-837. |
| 29. | Stroescu C, Dragnea A, Ivanov B, Pechianu C, Herlea V, Sgarbura O, Popescu A, Popescu I. Expression of p53, Bcl-2, VEGF, Ki67 and PCNA and prognostic significance in hepatocellular carcinoma. J Gastrointestin Liver Dis. 2008;17:411-417. [PubMed] |
| 30. | Potemski P, Pluciennik E, Bednarek AK, Kusinska R, Kubiak R, Jesionek-Kupnicka D, Watala C, Kordek R. Ki-67 expression in operable breast cancer: a comparative study of immunostaining and a real-time RT-PCR assay. Pathol Res Pract. 2006;202:491-495. [PubMed] [DOI] |