修回日期: 2015-11-13
接受日期: 2015-11-23
在线出版日期: 2015-12-28
目的: 探讨单b值扩散加权成像(diffusion-weighted imaging, DWI)单指数模型和基于体素内不相干运动(intravoxel incoherent motion, IVIM)理论的多b值DWI双指数模型对兔VX2小肝癌(直径≤3 cm)的诊断价值.
方法: 选取种植VX2肝癌的新西兰大白兔50只, 于种植后第7天和第14天分别行单b值(0和800 s/mm2)和多b值(0、20、50、100、200、400、600、800和1200 s/mm2)DWI. 测量并比较肿瘤边缘区(the rim of tumor, TR)和正常肝组织(the normal region, NR)的表观扩散系数(apparent diffusion coefficient, ADC)、Slow-ADC、Fast-ADC和ffast值. 应用受试者工作特性曲线(receiver operating characteristic, ROC)确定ADC、Slow-ADC、Fast-ADC和ffast的最佳阈值, 并比较DWI单指数模型和双指数模型各参数的诊断效能.
结果: 在第7天和第14天, TR的ADC、Slow-ADC明显高于NR(P<0.05). 第14天, NR的Fast-ADC和ffast高于TR(P<0.05). TR在第7天和第14天比较, 除了Slow-ADC降低以外, ADC、Fast-ADC和ffast差异均无统计学意义(P>0.05). 比较各参数在第7天和第14天的ROC曲线, Slow-ADC对于鉴别TR和NR的敏感性和特异性最高.
结论: 单、双指数模型DWI参数较真实的反映组织微循环灌注及水分子扩散, 对于鉴别兔VX2肝癌与正常肝组织具有一定优势, 其中以Slow-ADC的诊断效能最高.
核心提示: 扩散加权成像(diffusion-weighted imaging)双指数模型不仅包括水分子扩散, 还包括微循环灌注, 可同时测量组织内水分子随机运动(扩散效应)和毛细血管网中血液流动(灌注效应)的数学模型, 能够检测活体组织内水分子扩散运动的无创方法, 在疾病的诊断和鉴别诊断中具有临床应用价值.
引文著录: 周悦, 高剑波, 曲金荣, 王明月, 董军强, 侯平, 许瀚, 王立峰. 扩散加权成像单指数模型和双指数模型对兔VX2小肝癌的诊断价值. 世界华人消化杂志 2015; 23(36): 5760-5767
Revised: November 13, 2015
Accepted: November 23, 2015
Published online: December 28, 2015
AIM: To investigate the value of mono-exponential model with single b-factor and bi-exponential model with extended b-factor range of diffusion-weighted imaging (DWI) in diagnosis of small VX2 hepatic tumors ( ≤ 3 cm) in rabbits.
METHODS: On the 7th day and 14th day after tumor implantation, 50 New Zealand white rabbits with VX2 hepatic tumors underwent DWI based on single b-factor (b values of 0 and 800 s/mm2) and multi-b-factor (b values of 0, 20, 50, 100, 200, 400, 600, 800 and 1200 s/mm2). Apparent diffusion coefficient (ADC), slow ADC, fast ADC and fraction fast ADC (ffast) were measured in the rim of tumor (TR) and the normal region (NR) and compared between the two groups. The best thresholds of ADC, slow ADC, fast ADC and ffast were calculated by the receiver operating characteristic curve (ROC).
RESULTS: There were significant differences between TR and NR in ADC values on days 7 and 14 (P < 0.05). The values of slow ADC of TR were superior than those of NR on both days 7 and 14. Fast ADC and ffast of NR were higher than those of TR on the 14th day (P < 0.05). Expect for slow ADC, no statistical difference was observed in ADC, Fast-ADC or ffast of TR between the 7th day and 14th day. Slow ADC offered the highest sensitivity and specificity compared to ADC, slow-ADC, fast-ADC and ffast for differentiating between TR and NR on both days 7 and 14.
CONCLUSION: The parameter values of mono-exponential model and bi-exponential model, especially slow-ADC, reflect perfusion of microcirculation and diffusion of water molecules, thus having value for the diagnosis of small hepatic tumors.
- Citation: Zhou Y, Gao JB, Qu JR, Wang MY, Dong JQ, Hou P, Xu H, Wang LF. Comparison of mono-exponential and bi-exponential models of diffusion-weighted MRI in diagnosis of small VX2 hepatic tumors in rabbits. Shijie Huaren Xiaohua Zazhi 2015; 23(36): 5760-5767
- URL: https://www.wjgnet.com/1009-3079/full/v23/i36/5760.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i36.5760
1986年, Le Bihan等[1]提出了体素内不相干运动(intravoxel incoherent motion, IVIM)的概念, 即通过双指数模型获取分别反映组织扩散和微循环毛细血管灌注效应的参数, 分别量化其中的扩散运动成分和血流灌注成分. 近年来, 随着磁共振成像(magnetic resonance imaging, MRI): 核磁共振(nuclear magnetic resonance, MR)硬件及软件设备的不断更新换代, 多b值的多指数模型的应用在不断的开展. 双指数衰减表观扩散系数(apparent diffusion coefficient, ADC)值对活体组织可表现出"快"(Fast-ADC)和"慢"(Slow-ADC)两种, 分别代表细胞外和细胞内水分子的扩散运动状态[2]. 兔VX2肝癌模型是用于肝癌实验研究的大型动物模型. 本实验欲通过单b值及多b值DWI研究, 探讨单、双指数模型在兔VX2肝癌与正常肝实质鉴别诊断方面的应用价值.
选取新西兰大白兔50只, 雌雄不限, 体质量2000-3000 g. 实验兔由河南省医学动物实验中心提供. 速眠新Ⅱ(吉林省圣达动物药品有限公司); 可吸收明胶海绵(上海同舸医疗器械有限公司); 利多卡因(浙江泰康药业集团有限公司); 庆大霉素注射液(山西必康制药有限公司); CT扫描设备: 德国西门子双源Flash CT(Siemens Definition Flash CT); 双筒高压注射器: Stellent双筒高压注射器(美国Medrad公司); CT增强对比剂: 碘佛醇溶液, 规格320 mgI/mL(江苏恒瑞医药股份有限公司); 留置针(24 G)(苏州碧迪医疗器械有限公司); 兔转化生长因子(transforming growth factor, TGF)-α Elisa试剂盒(上海吉凯基因化学技术有限公司); 酶标仪(450 nm)(美国Molecular Devices公司).
1.2.1 VX2细胞株制备: VX2肝癌荷瘤兔由广州中山大学医学动物实验中心购置. 3 wk左右, 触摸到荷瘤兔大腿外侧有瘤结节生成. 切开瘤体, 切取肿瘤边缘的鱼肉样瘤组织, 并将瘤组织剪成约直径约2.0 mm的瘤块, 将瘤块浸在4 ℃生理盐水中备用.
1.2.2 VX2兔肝癌模型的制备: 参照前期研究[3], 动物需术前禁食12 h, 禁水4 h. 采用肌注速眠新Ⅱ 0.2 mL/kg麻醉, 仰卧位固定在手术台上. 常规备皮、消毒、铺巾, 使用利多卡因局麻. 于剑突下备皮并常规消毒、铺巾. 取剑突下腹部正中切口, 逐层分离皮肤、皮下组织、肌肉层及腹膜, 暴露肝脏. 寻找肝左内叶, 在距膈面边缘约2 cm处用无齿镊刺破肝实质形成一楔形小切口, 先取约2 mm3的明胶海绵块塞入楔形切口底部, 以压迫肝组织防止出血, 然后取约2 mm3的瘤组织块植入该切口中, 最后再塞入约3 mm3的明胶海绵块, 封闭切口以防止瘤块脱出. 随后将肝脏还纳入腹腔并依次逐层缝合切口. 当日给予庆大霉素4万单位腹腔内注射, 并在术后3 d内连续肌注庆大霉素8万单位.
1.2.3 DWI检查设备及参数: 实验兔分别于种植后第7天和第14天行DWI扫描. 扫描前禁食12 h, 仰卧于自制兔板上, 四肢固定后放置于MR扫描床上. 使用美国GE Flash CT(Siemens Definition Flash CT), 行双能量增强扫描. 采用Discovery MR 750 3.0 T MR扫描仪及膝关节相控阵线圈. 扫描范围包括肝上缘至肝下缘. 包括以下序列: (1)冠状面屏气单次激发FSE T2WI: TE 67.0 ms, 重复时间(repetition time, TR) 1800 ms, 矩阵288×288. 视野(field of view, FOV) 36 cm×36 cm-40 cm×40 cm, 层厚7 mm, 层间距1 mm; (2)横轴面脂肪抑制T2WI: TR 9230.8 ms, 回波时间(echo time, TE) 8.8 ms, 矩阵320×320. FOV、层厚和层间距同序列(1); (3)横轴面单次激发自旋平面回波DWI序列, TE 57.9 ms, TR 6000 ms, 矩阵128×160, FOV 36 cm×36 cm-40 cm×40 cm, 层厚5 mm, 层间距l mm. 先行2个b值(b = 0、800 s/mm2)DWI扫描, 然后再行9个b值(b = 0、20、50、100、200、400、600、800、1200 s/mm2)DWI扫描.
1.2.4 图像后处理: 扫描后得到的DWI图像(b = 0、800 s/mm2)传送到AW 4.5工作站, 自带的Function-ADC软件处理图像得到ADC图, 选择ROI获得单指数模型参数ADC值; 多b值DWI图像应用Function-MADC软件处理图像得到慢速表观扩散系数(slow apparent diffusion coefficient, Slow-ADC)图、快速表观扩散系数(fast apparent diffusion coefficient, Fast-ADC)图和快速扩散成分所占比例(fraction of fast apparent diffusion coefficient, ffast)图. 测量病变的ADC值、Slow-ADC、Fast-ADC和ffast值. ROI的选择结合常规T1WI、T2WI和DWI, 选取病灶显示最大层面, 将ROI置于病灶实质部位, 避开出血、坏死、囊变区, 测量3次取平均值.
统计学处理 使用SPSS19.0统计软件包进行处理. 计数资料用mean±SD表示. 采用配对t检验比较肿瘤边缘区、正常肝组织ADC值、Slow-ADC、Fast-ADC和ffast值间的差异. 绘制ROC曲线确定各个参数最佳诊断阈值, 并通过比较曲线下面积(area under curve, AUC)来比较ADC、Slow-ADC、Fast-ADC和ffast值的诊断效能. P<0.05为差异有统计学意义.
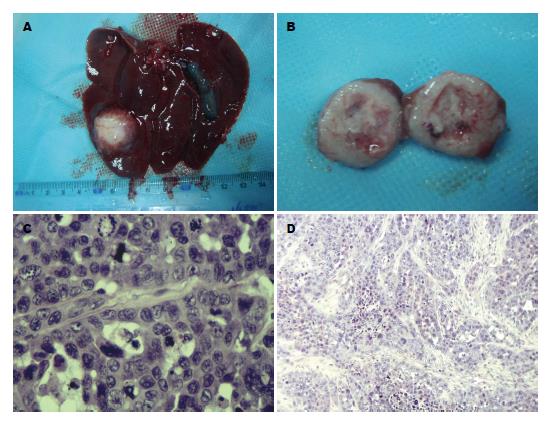
大体观肿瘤呈类圆形, 灰白色, 有完整的包膜, 切面质地较韧, 部分中心可见液化坏死区. 低倍镜下瘤细胞呈巢状分布, 肿瘤间质内血管丰富, 周边见大量纤维组织增生. 高倍镜下肿瘤细胞体积大, 呈圆形或不规则形, 胞浆较少, 核大浓染, 有明显的异形性, 核分裂像多见(图1).
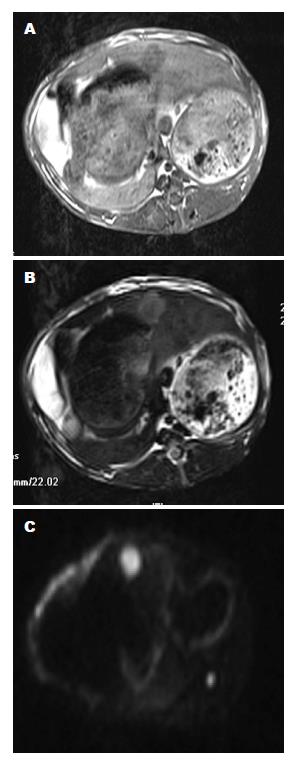
兔VX2肝癌在T1WI上表现为低信号, T2WI为高信号. 肿瘤边界清晰, DWI图像显示明显的高信号, 与周围正常肝实质比较, 呈现"灯泡征". 肿瘤中心的液化坏死区分别显示为T1WI低信号, T2WI高信号(图2).
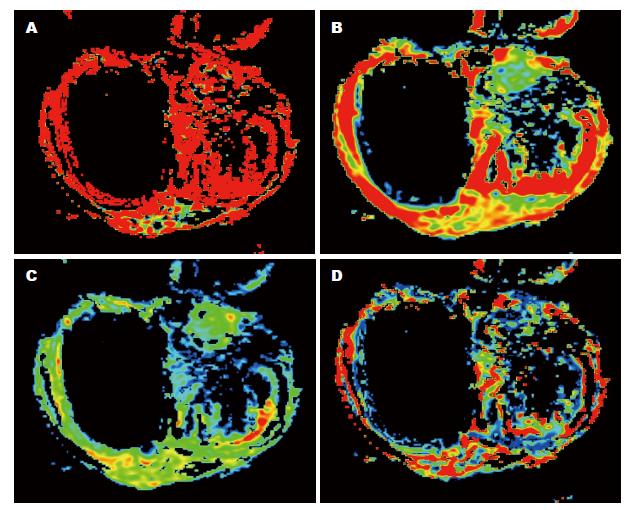
在第7天和第14天, TR的ADC、Slow-ADC明显高于NR(P<0.05)(表1), 因此, 如图3所示, TR的ADC图及Slow-ADC图表现出以红色和黄色为主的高伪彩, 第14天, NR的Fast-ADC和ffast高于TR(P<0.05), 因此TR的Fast-ADC图和ffast图则表现为以蓝色和绿色为主的低伪彩. TR在第7天和第14天比较, 除了Slow-ADC降低以外, ADC、Fast-ADC和ffast差异均无统计学意义(P>0.05).
ROC曲线显示, 各参数在第7天和第14天比较, Slow-ADC对于鉴别TR和NR的敏感性和特异性最高(表2).
| 时间 | 参数 | 阈值 | AUC | 敏感性n(%) | 特异性n(%) |
| 第7天 | ADC(×10-3 mm2/s) | 0.31 | 0.72 | 80(40.0) | 28(53.3) |
| Slow-ADC(×10-3 mm2/s) | 0.21 | 0.86 | 47(93.3) | 37(73.3) | |
| Fast-ADC(×10-3 mm2/s) | 22.50 | 0.52 | 28(53.3) | 17(33.3) | |
| ffast | 0.24 | 0.55 | 40(80.0) | 23(46.7) | |
| 第14天 | ADC(×10-3 mm2/s) | 0.29 | 0.69 | 40(80.0) | 37(73.7) |
| Slow-ADC(×10-3 mm2/s) | 0.18 | 0.94 | 50(100.0) | 37(73.7) | |
| Fast-ADC(×10-3 mm2/s) | 26.15 | 0.56 | 23(46.7) | 40(80.0) | |
| ffast | 0.23 | 0.56 | 47(93.3) | 33(66.7) |
兔VX2肝移植瘤影像学模型是由Shope病毒在兔皮肤诱发的鳞状细胞癌经72次传代而建立的转移性瘤细胞株, 以肝动脉供血为主[4-7]. 种植后第1周肿瘤尚处于血管生成前期, 种植后第2-3周左右, 为肿瘤生长旺盛时期, 即肿瘤血管形成期, 可建立早期肝癌动物模型. 在种植3 wk后, 肿瘤体积明显增大, 中心易出现坏死, 此时为肿瘤血管稳定期, 可建立进展期肝癌动物模型. 种植后28-35 d, 肿瘤体积进一步增大, 坏死较多, 转移广泛, 此时为肿瘤血管退化期, 可建立晚期肝癌动物模型[8-10].
活体组织内, DWI通过检测人体组织中水分子扩散运动受限制的方向和程度等信息, 间接反映组织微观结构的变化, 可为肝脏病变的检查提供定性及定量信息, 增加病灶检出率. 但ADC值的测量依赖于b值的选择, 用低b值进行DWI, 在一定程度上反映了局部组织的微循环血流灌注情况, 但是所测得的ADC值稳定性较差, 且易受其他生理活动的影响, 不能有效地反映分子的真实扩散运动. 而用高b值进行DWI, 所测得的ADC值受血流灌注的影响相对减少, 能较好地反映组织内水分子的扩散运动[11-14].
使用双指数模型多个b值计算所得的ADC值可重复性高, 并且更为精确, 可通过不同信号强度来诊断疾病, 也可通过后处理得到定量信息, 反映组织的病理特征及评估组织功能. 1999年, Yamada等[15]首次将IVIM成像应用于腹部, 用于评估腹部脏器和肝脏病变的扩散系数, 结果显示正常腹部脏器和肝脏病变的ADC值明显高于相应的Slow-ADC和Fast-ADC值, 说明灌注效应会影响腹部实性脏器的ADC值. 本研究发现, 第7天NR的ADC值明显高于TR. 第7天和第14天的最佳阈值分别为0.31×10-3 mm2/s和0.29×10-3 mm2/s. 第7天和第14天的敏感性均为80%, 特异性分别为53.3%和73.3%. 这表明TR的血供及灌注均高于NR.
本研究发现, NR的ADC值和Slow-ADC值高于TR, 其原因在于肝癌由形态和结构不同的癌细胞组成, 细胞小而密集, 细胞外间隙明显减少, 胞核大而胞质少, 癌组织内的自由水更少, 水分子扩散受限明显从而使代表扩散效应的Slow-ADC降低. IVIM模型中扩散系数Slow-ADC取决于液体的黏度, 并且反映了由细胞膜、大分子和纤维造成的细胞内外自由水分子扩散受限的情况, 限制扩散的程度主要取决于细胞的密度和大小(增殖、坏死、收缩或膨胀)和增多的物质量(如出血或基质胶原蛋白量)[16-18].
IVIM参数中Fast-ADC值和ffast值描述的是毛细血管微循环灌注的影响. Fast-ADC取决于微血管的平均血流速度和毛细血管段的长度, ffast代表来自灌注的信号部分, 即ffast可以反映毛细血管的容量[19-23]. 肝细胞癌的Fast-ADC值较低, 这是因为有新生血管生成, 新生血管可表现出缓慢血液流动, 血流量很慢的血管是通过扩散效应而非灌注效应被检测到的, 肿瘤新生微血管管径细小、基底膜不完整, 毛细血管血流减慢甚至滞留, 快速流动的血液减少, 导致肝细胞肝癌的f值较低[24-26]. 本研究中, TR的Fast-ADC值低于NR. 这说明肿瘤新生血管结构紊乱、形态短小, 导致了其Fast-ADC值的降低. Fast-ADC和ffast体现了毛细血管微循环灌注的影响. Fast-ADC在肿瘤组织中的下降恰恰说明了在肿瘤生长的过程中, 伴随着新生血管的生成.
由于早期肿瘤血管的生长比较缓慢, 第7天Fast-ADC值和ffast值在TR和NR间差异无统计学意义. 在毛细血管形成早期, 即从第7天到第14天期间, 新生血管基底膜的上皮细胞受到多种因素的影响, 所以肿瘤组织的灌注并不稳定且不充足[27-31]. 因此, TR的ADC、Fast-ADC和ffast在第7天与第14天之间比较, 差异无统计学意义. 运用ROC曲线分析发现, Slow-ADC值在鉴别TR和NR时拥有最高的诊断效能, 在第7天和第14天的曲线下面积分别为0.86和0.94, 敏感性分别为93.3%和100%, 特异性均为73.3%. Fast-ADC和ffast对于鉴别TR和NR的诊断效能最低. 其原因可能与Slow-ADC值为组织中纯水分子扩散系数, 能够反映出生物组织体内真实的水分子扩散运动, 而Fast-ADC和ffast值受不同微血管灌注成分的影响有关.
总之, 单、双指数模型DWI参数较真实的反映组织微循环灌注及水分子扩散, 对于鉴别兔VX2肝癌与正常肝组织具有一定优势, 其中以Slow-ADC的诊断效能最高. 当然, 本研究也存在诸多不足之处, 如兔胃肠道内气体的干扰、动物出现麻醉耐受而使CT检查时呼吸频率难以控制以及实验的样本量不足也会对检查和结果造成一定影响, 且研究的肝脏疾病的种类较为单一, 需要在今后的实验和研究中加以改进.
近年来, 随着核磁共振成像(nuclear magnetic resonance imaging, MRI)技术的发展和临床需求的增加, MRI功能成像成为研究的热点, 大范围多b值的多指数衰减模型的研究也在不断深入, 其在临床应用上显示出巨大的潜力和广阔的应用前景.
饶圣祥, 副主任医师, 复旦大学附属中山医院放射科
双指数模型能够从病变发生发展过程中不同来源的水分子方面进行分析, 对于小肝癌的诊断及鉴别诊断提供了独特的信息, 特别是双指数衰减表观扩散系数(apparent diffusion coefficient, ADC)、Slow-ADC和Fast-ADC在临床中拥有广泛发展空间.
1986年, Le Bihan提出了体素内不相干运动的概念, 通过双指数模型获取分别反映组织扩散和微循环毛细血管灌注效应的参数, 分别量化其中的扩散运动成分和血流灌注成分.
源于活体组织扩散的ADC值反映了生物组织细胞内外的布朗运动, 可以提供肿瘤微环境的信息, 已经逐渐应用于肿瘤的定量分析. 双指数衰减表观扩散系数值对活体组织可分析出"快"(Fast)和"慢"(Slow)两种ADC值, 分别代表细胞外和细胞内水分子不同的扩散状态.
多b值双指数衰减模型DWI的Slow-ADC在直径≤3 cm的小肝癌诊断中具有可行性, 其参数的完全量化为临床诊断提供了更客观的方法, 能将扩散和灌注用不同参数进行独立评估, 且无需注入对比剂.
体素不相干运动磁共振成像(IVIM-MRI): 通过双指数模型获取分别反映组织扩散和微循环毛细血管灌注效应的参数, 可用于分别量化其中的扩散运动成分和血流灌注成分.
本文使用先进的DWI成像技术, 结合基础实验研究, 体现了单、双指数模型在肝癌诊断的方面的优势和临床价值. 全文思路清晰, 结构完整, 内容充实, 实用性及可读性强.
编辑: 郭鹏 电编:闫晋利
| 1. | Le Bihan D, Breton E, Lallemand D, Grenier P, Cabanis E, Laval-Jeantet M. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology. 1986;161:401-407. [PubMed] [DOI] |
| 2. | Clark CA, Le Bihan D. Water diffusion compartmentation and anisotropy at high b values in the human brain. Magn Reson Med. 2000;44:852-859. [PubMed] [DOI] |
| 3. | 周 悦, 王 明月, 高 剑波, 董 军强, 许 瀚, 侯 平. 宝石CT能谱成像及灌注成像评价兔VX2肝癌抗血管生成的治疗疗效. 世界华人消化杂志. 2014;22:4726-4733. [DOI] |
| 7. | Ma GL, Bai RJ, Jiang HJ, Hao XJ, Dong XP, Li DQ, Liu XD, Wei L. Early changes of hepatic hemodynamics measured by functional CT perfusion in a rabbit model of liver tumor. Hepatobiliary Pancreat Dis Int. 2012;11:407-411. [PubMed] [DOI] |
| 9. | Kuszyk BS, Boitnott JK, Choti MA, Bluemke DA, Sheth S, Magee CA, Horton KM, Eng J, Fishman EK. Local tumor recurrence following hepatic cryoablation: radiologic-histopathologic correlation in a rabbit model. Radiology. 2000;217:477-486. [PubMed] [DOI] |
| 10. | Zhao JG, Feng GS, Kong XQ, Li X, Li MH, Cheng YS. Changes of tumor microcirculation after transcatheter arterial chemoembolization: first pass perfusion MR imaging and Chinese ink casting in a rabbit model. World J Gastroenterol. 2004;10:1415-1420. [PubMed] [DOI] |
| 11. | Liang XM, Tang GY, Cheng YS, Zhou B. Evaluation of a rabbit rectal VX2 carcinoma model using computed tomography and magnetic resonance imaging. World J Gastroenterol. 2009;15:2139-2144. [PubMed] [DOI] |
| 12. | Metens T, Miranda D, Absil J, Matos C. What is the optimal b value in diffusion-weighted MR imaging to depict prostate cancer at 3T? Eur Radiol. 2012;22:703-709. [PubMed] [DOI] |
| 13. | Yili Z, Xiaoyan H, Hongwen D, Yun Z, Xin C, Peng W, Youmin G. The value of diffusion-weighted imaging in assessing the ADC changes of tissues adjacent to breast carcinoma. BMC Cancer. 2009;9:18. [PubMed] [DOI] |
| 15. | Yamada I, Aung W, Himeno Y, Nakagawa T, Shibuya H. Diffusion coefficients in abdominal organs and hepatic lesions: evaluation with intravoxel incoherent motion echo-planar MR imaging. Radiology. 1999;210:617-623. [PubMed] [DOI] |
| 16. | Baunin C, Schmidt G, Baumstarck K, Bouvier C, Gentet JC, Aschero A, Ruocco A, Bourlière B, Gorincour G, Desvignes C. Value of diffusion-weighted images in differentiating mid-course responders to chemotherapy for osteosarcoma compared to the histological response: preliminary results. Skeletal Radiol. 2012;41:1141-1149. [PubMed] [DOI] |
| 17. | Le Bihan D, Turner R. The capillary network: a link between IVIM and classical perfusion. Magn Reson Med. 1992;27:171-178. [PubMed] [DOI] |
| 18. | Moteki T, Horikoshi H. Evaluation of hepatic lesions and hepatic parenchyma using diffusion-weighted echo-planar MR with three values of gradient b-factor. J Magn Reson Imaging. 2006;24:637-645. [PubMed] [DOI] |
| 22. | 张 水兴, 贾 乾君, 张 忠平, 梁 长虹, 邱 前辉, 陈 文波, 郭 牟莹. 基于体素内不相干运动的扩散加权成像对鼻咽癌与炎性增生性疾病的鉴别诊断. 中华放射学杂志. 2013;47:617-621. |
| 23. | Biffar A, Sourbron S, Dietrich O, Schmidt G, Ingrisch M, Reiser MF, Baur-Melnyk A. Combined diffusion-weighted and dynamic contrast-enhanced imaging of patients with acute osteoporotic vertebral fractures. Eur J Radiol. 2010;76:298-303. [PubMed] [DOI] |
| 25. | Ginat DT, Mangla R, Yeaney G, Johnson M, Ekholm S. Diffusion-weighted imaging for differentiating benign from malignant skull lesions and correlation with cell density. AJR Am J Roentgenol. 2012;198:W597-W601. [PubMed] [DOI] |
| 26. | Liu X, Peng W, Zhou L, Wang H. Biexponential apparent diffusion coefficients values in the prostate: comparison among normal tissue, prostate cancer, benign prostatic hyperplasia and prostatitis. Korean J Radiol. 2013;14:222-232. [PubMed] [DOI] |
| 27. | Dyvorne HA, Galea N, Nevers T, Fiel MI, Carpenter D, Wong E, Orton M, de Oliveira A, Feiweier T, Vachon ML. Diffusion-weighted imaging of the liver with multiple b values: effect of diffusion gradient polarity and breathing acquisition on image quality and intravoxel incoherent motion parameters--a pilot study. Radiology. 2013;266:920-929. [PubMed] [DOI] |
| 28. | Anderson SW, Barry B, Soto JA, Ozonoff A, O'Brien M, Jara H. Quantifying hepatic fibrosis using a biexponential model of diffusion weighted imaging in ex vivo liver specimens. Magn Reson Imaging. 2012;30:1475-1482. [PubMed] [DOI] |
| 30. | Oka K, Yakushiji T, Sato H, Yorimitsu S, Hayashida Y, Yamashita Y, Mizuta H. Ability of diffusion-weighted imaging for the differential diagnosis between chronic expanding hematomas and malignant soft tissue tumors. J Magn Reson Imaging. 2008;28:1195-1200. [PubMed] [DOI] |
| 31. | Nilsen LB, Fangberget A, Geier O, Seierstad T. Quantitative analysis of diffusion-weighted magnetic resonance imaging in malignant breast lesions using different b value combinations. Eur Radiol. 2013;23:1027-1033. [PubMed] [DOI] |