修回日期: 2015-11-02
接受日期: 2015-11-09
在线出版日期: 2015-12-18
目的: 探讨药物相关分子靶标检测在原发性肝癌切除术后预防性肝动脉介入化疗栓塞(transcatheter arterial chemoembolization, TACE)中的临床价值.
方法: 将原发性肝癌切除并在术后行预防性TACE的92例患者分为分子靶标检测筛选化疗药物组(观察组, n = 50)和经验选用化疗药物组(对照组, n = 42), 比较两组患者1年复发率、TACE后不良反应发生情况, 应用Kaplan-Meier法比较无瘤生存期, 绘制无瘤生存曲线并进行Log-rank检验.
结果: 观察组1年复发率明显低于对照组(χ2 = 4.422, P = 0.035); 观察组平均无瘤生存期明显优于对照组(t = 3.081, P = 0.003). 两组无瘤生存曲线差异有统计学意义(χ2 = 5.99, P = 0.014); 观察组TACE后恶心呕吐、腹泻、白细胞计数下降发生率低于对照组(P<0.05), 两组发热发生率差异无统计学意义(χ2 = 0.091, P = 0.763).
结论: 原发性肝癌切除术后依据分子靶标检测筛选化疗药物行预防性TACE可明显延缓肿瘤复发、延长无瘤生存期、减少不良反应发生.
核心提示: 原发性肝癌手术切除后, 依据分子靶标检测结果筛选高敏感性化疗药物较经验性盲目选用化疗药物行个体化肝动脉化疗栓塞术可明显延缓肿瘤复发、延长无瘤生存期、减少不良反应发生.
引文著录: 程冰冰, 李晓勇, 陈艳军, 崔卫东, 陈升阳, 刘少朋. 药物相关分子靶标检测在原发性肝癌化疗栓塞中的价值. 世界华人消化杂志 2015; 23(35): 5693-5698
Revised: November 2, 2015
Accepted: November 9, 2015
Published online: December 18, 2015
AIM: To investigate the value of detection of molecules associated with drug sensitivity in preventive transcatheter arterial chemoembolization (TACE) for patients with hepatocellular carcinoma (HCC) after hepatectomy.
METHODS: A total of 92 patients with HCC receiving preventive TACE within three months after hepatectomy were divided into an observation group (n = 50) and a control group (n = 42). In the observation group, chemotheraputic agents were selected based on the detection of molecules associated with drug sensitivity, while chemotheraputic agents were chosen empirically in the control group. The one-year recurrence rate, side effects of TACE and disease-free survival time were compared between the two groups.
RESULTS: The one-year recurrence rate in the observation group was lower than that of the control group (χ2 = 4.422, P = 0.035). The difference in disease-free survival time between the two groups was of statistical significance (t = 3.081, P = 0.003). The disease-free survival curve of the observation group differed from that of the control group (χ2 = 5.99, P = 0.014). The incidence rates of nausea, emesis, diarrhea, and leukopenia in the observation group after TACE were significantly lower than those of the control group (P < 0.05). The difference in the incidence rate of fever after TACE had no statistical difference between the two groups (χ2 = 0.091, P = 0.763).
CONCLUSION: Selection of chemotheraputic agents based on detection of molecules can delay recurrence, prolong disease-free survival time and reduce the incidence of side effects after TACE in patients with HCC after hepatectomy.
- Citation: Cheng BB, Li XY, Chen YJ, Cui WD, Chen SY, Liu SP. Value of detection of molecules associated with drug sensitivity in individualized chemoembolization for hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5693-5698
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5693.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5693
原发性肝癌(primary hepatic carcinoma, PHC)包括肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)及肝细胞癌-胆管细胞癌混合型等不同病理类型, 其中HCC最为常见, 约占90%[1]. 目前外科手术切除仍是HCC最重要的治疗方法, 但术后复发转移是影响患者生存期及生活质量的主要因素. 肝癌切除术后5年复发率高达60%左右[2-4], 如何延缓肝癌术后复发转移是长期以来肝癌治疗的重点研究课题. 肝癌切除后行预防性肝动脉介入化疗栓塞(transcatheter arterial chemoembolization, TACE)可巩固手术疗效、降低术后复发率、提高无瘤生存率[5,6]. 但长期以来TACE中化疗药物的选择以经验为主, 缺乏针对性及实验室依据. 随着分子生物学、遗传学等学科的发展, 分子靶向药物的研究、分子诊断技术的逐步成熟, 抗肿瘤药物的敏感性与相关基因突变之间的关系逐渐明确[7], 依据分子靶标检测筛选敏感药物进行化疗已逐渐受到重视. 本课题探讨分子靶标检测在肝癌切除术后个体化化疗栓塞中的临床价值.
回顾性分析整理2013-03/2014-03在郑州大学第五附属医院肝胆胰腺外科行肝癌切除术且术后行预防性TACE的HCC患者. 纳入标准: 术前影像学提示肿瘤为单个, 且直径≤10 cm, 无门静脉癌栓; 术中达到R0切除, 术后病理示无淋巴结及远处转移, TNM分期均为T2N0M0; 术后1-3 mo行TACE, 且肝动脉造影未发现肿瘤着色及肿瘤血管. 符合上述标准的共有92例, 男72例, 女20例, 年龄23-78岁, 平均55.45岁±11.10岁. 按照TACE中化疗药选择方式分为: 分子靶标检测筛选组(观察组, n = 50), 经验筛选组(对照组, n = 42). 两组患者的术前资料如表1.
| 分组 | 观察组 | 对照组 | 统计量 | P值 |
| 年龄(岁) | 56.34±12.59 | 54.38±9.05 | t = 0.842 | 0.402 |
| 性别(男/女) | 37/13 | 35/7 | χ2 = 1.169 | 0.280 |
| 肝功能Child-Pugh评分 | 6.08±1.027 | 6.14±1.095 | t = -0.284 | 0.777 |
| 肿瘤直径(cm) | 5.20±0.88 | 5.16±0.86 | t = 0.233 | 0.816 |
| AFP数值(≥g/L)μ200 | 36/14 | 30/12 | χ2 = 0.004 | 0.952 |
1.2.1 肿瘤化疗药物相关性分子靶标检测: 观察组患者均于外科手术切除后1 wk内采集外周静脉血20 mL, 将血标本送至上海赛安-复旦临床病理诊断联合实验室, 依据目前国外文献报道多数基因位点突变均与抗肿瘤化疗药物敏感性相关[7], 采用聚合酶链式反应(polymerase chain reaction, PCR)扩增和测序的方法测定与铂类药物敏感性相关的ERCC1(C118T)[8]、与氟尿嘧啶敏感性密切相关的MTHFR(C677T)[9,10]、TS(2R/3R)[11,12]、与蒽环类药物敏感性相关的GSTP1(I105V)[13]、MDR(C3435T)[14]、与吉西他滨敏感性相关的CDA(A79C)[15,16]等基因位点突变情况, 根据患者自身具体条件及检测结果筛选高敏感性抗肿瘤化疗药物.
1.2.2 预防性肝动脉介入治疗: 观察组和对照组患者均在外科手术切除术后1-3 mo行预防性TACE. 在郑州大学第五附属医院导管室于DSA辅助下进行. 采用Seldinger技术, 在局部浸润麻醉下经皮股动脉穿刺, 置入5F短鞘, 选用泥鳅导丝、Cobro导管沿右侧(或左侧)股动脉依次进入髂总动脉、腹主动脉、腹腔动脉干, 选入肝总动脉、肝固有动脉常规造影, 确认无肿瘤血管及肿瘤病灶后给予碘化油10 mL, 观察组患者选择分子靶标检测筛选出的高敏感性化疗药, 对照组患者依据传统经验选用化疗药物.
1.2.3 随访及观察指标: 随访截止时间为2015-03, 随访终点为确定出现肝内复发灶或肝外转移灶. 复发诊断标准为: SCT、彩超、核磁共振成像及肝动脉造影等影像学检查方法中的任何一种发现肝内病灶符合原发性肝癌特征. 此外, 影像学检查未发现肝内外病灶, 但术后多次复查甲胎蛋白(α-fetoprotein, AFP)再次升高达200 μg/L以上, 排除活动性肝病或妊娠亦可认为是肝癌切除术后复发. 无瘤生存时间是外科手术切除术日与复发日之间的间隔时间, 以月为单位计算. 观察TACE后出现恶心呕吐、发热、腹泻及白细胞计数降低情况.
统计学处理 应用SPSS17.0软件对数据进行分析, 率的比较采用χ2检验, 计量资料比较采用t检验, Kaplan-Meier法计算无瘤生存期, 应用Log-rank检验比较两组无瘤生存曲线. 检验水准α = 0.05, P<0.05认为差异有统计学意义.
随访时间为12-24 mo. 随访12 mo时, 92例患者中有14例出现肿瘤复发, 肝内复发10例, 肝内复发并肝外转移4例, 复发率为15.22%(14/92例). 其中, 术后1年观察组4例复发, 复发率为8%(4/50例), 对照组10例复发, 复发率为23.8%(10/42例). 两组差异有统计学意义(χ2 = 4.422, P = 0.035), 依据分子靶标检测选用化疗药行预防性TACE较经验选用化疗药行预防性TACE使HCC患者外科切除术后1年肿瘤复发率明显降低.
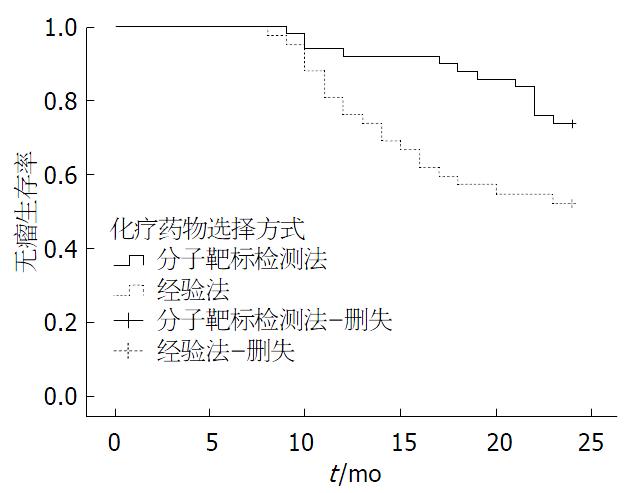
至随访结束, 观察组肿瘤复发13例(26.0%), 无瘤生存时间22.30 mo±3.92 mo, 对照组肿瘤复发20例(47.6%), 无瘤生存时间19.0 mo±5.94 mo. 两组无瘤生存时间差异有统计学意义(t = 3.081, P = 0.003). 两组患者无瘤生存曲线如图1, 经Log-rank检验, 两组无瘤生存曲线差异有统计学意义(χ2 = 5.99, P = 0.014). HCC患者外科术后依据分子靶标检测选用化疗药行预防性TACE无瘤生存期明显优于凭经验选用化疗药行预防性TACE.
观察组中50例患者中有18例出现恶心、呕吐(36%), 27例出现发热(54%), 4例出现腹泻(8%), 11例出现白细胞计数下降低于正常值(22%); 对照组中42例患者中出现恶心呕吐的有24例(57.14%), 出现发热的24例(57.14%), 出现腹泻的10例(23.81%), 白细胞计数下降低于正常值的有18例(42.86%). 经χ2检验, 两组TACE后发热无差异(χ2 = 0.091, P = 0.763), 而在恶心呕吐、腹泻、白细胞计数下降方面差异均有统计学意义(表2).
| 分组 | 恶心、呕吐 | 发热 | 腹泻 | 白细胞计数下降 | ||||
| 有 | 无 | 有 | 无 | 有 | 无 | 有 | 无 | |
| 观察组 | 18 | 32 | 27 | 23 | 4 | 46 | 11 | 39 |
| 对照组 | 24 | 18 | 24 | 18 | 10 | 32 | 18 | 24 |
| χ2值 | 4.113 | 0.091 | 4.422 | 4.600 | ||||
| P值 | 0.043 | 0.763 | 0.035 | 0.032 | ||||
原发性肝癌是全球最常见的第5大恶性肿瘤, 在肿瘤相关死亡中位居第3位[17]. 我国每年新发患者约占全球的55%, 且发病率呈逐年增长趋势, 在肿瘤相关死亡中排列第2位[18]. HCC治疗方法众多, 手术切除是首选且最有效的方法, 尤其是对于早期肝癌. 但HCC根治性切除术后远期疗效尚不满意, 其中肿瘤复发转移是影响远期生存的最主要因素[19]. TACE是目前公认的无法手术切除的中晚期肝癌的首选治疗方法[20], 能够有效控制肿瘤生长, 明显延长患者生存期[21]. 而对于可切除的原发性肝癌, 外科切除术后行TACE在预防肿瘤复发、延长生存时间方面的意义和价值逐渐受到越来越多临床医生的重视[22].
系统性化疗曾广泛应用于不能手术切除的HCC患者, 但因多耐药基因在肿瘤中过度表达, 其整体有效率不足20%, 且严重的不良反应给患者带来了巨大的痛苦[23]. TACE是HCC化疗的重要方式, 经肝动脉灌注, 化疗药物在肝脏中的浓度是全身浓度的100-400倍, 而在肿瘤区域的浓度是肝组织浓度的5-10倍, 这样不仅增加了抗肿瘤效应[24], 而且减轻了全身的不良反应. TACE中化疗药物的选择、化疗方案的制定长期以来以医生的主观经验、患者的病情及肿瘤的病理分期等为依据, 具有较大的随意性. 相同的化疗药物在不同的肝癌患者中的效果差异明显. 对患者而言, 化疗药物的选择往往存在一个试药-换药-再试药-再换药的不良过程, 造成了病情的延误, 浪费了医疗资源, 增加了患者承受不良反应及经济损失的几率. 肿瘤的发生是多因素影响、多基因作用、多靶标位点激活的极为复杂的生物学过程. 近年来, 国内外关于肿瘤基因的研究[25-27]发现, 每个肿瘤都可通过靶标检测明确其驱动变异基因, 根据不同的变异基因情况, 施行针对性的个体化治疗. 肿瘤的个体化治疗是目前肿瘤治疗的主要导向, 随着人类基因组学、蛋白组学、转录组学及分子生物学、遗传学等学科的逐渐发展成熟, 一些与抗肿瘤药物疗效相关的靶信号通路、靶点基因、同一基因的多态性表达位点已逐渐明确[28]. 因此, 通过分子靶标基因检测可明确不同患者基因表达差异情况, 进而筛选相对高敏感低毒抗肿瘤药物, 从而用以指导临床化疗方案的选择, 改善HCC患者的预后. 本研究中观察组患者肿瘤1年复发率及无瘤生存期均明显优于对照组患者, 体现了分子靶标检测筛选化疗药物在HCC个体化栓塞化疗中的价值.
在不良反应方面, 观察组患者恶心呕吐、腹泻及白细胞计数下降的发生率均低于对照组, 差异有统计学意义, 而两组发热发生率差异无统计学意义. 原因在于TACE中的栓塞剂可选择性栓塞肿瘤的末梢血管, 阻断肿瘤血供, 造成肿瘤细胞缺血、缺氧, 继而发生坏死, 坏死的肿瘤组织吸收入血后引起机体发热, 而且两组患者TACE治疗中栓塞剂的种类及剂量均相同, 故化疗栓塞后发热的发生无差异.
总之, 以分子靶标基因检测为指导筛选化疗药物, 制定个体化化疗方案行HCC外科术后预防性TACE, 在延缓肿瘤复发、改善患者远期生存及降低化疗药物不良反应方面比凭经验盲目制定化疗方案行术后预防性TACE效果更为明显, 具有一定的临床意义及价值.
原发性肝癌(primary hepatic carcinoma, PHC)是我国最常见的恶性肿瘤之一, 目前外科手术切除仍是肝细胞癌(hepatocellular carcinoma, HCC)最重要的治疗方法, 但术后复发转移是影响患者生存期及生活质量的重要因素之一. 肝癌切除后行预防性肝动脉介入化疗栓塞(transcatheter arterial chemoembolization, TACE)有助于延缓肿瘤复发、延长无瘤生存期, 但长期以来TACE中化疗药物的选择以经验为主, 缺乏针对性及实验室依据. 研究显示多数基因位点突变均与抗肿瘤化疗药物敏感性相关, 分子靶标基因检测可识别HCC患者个体差异, 为TACE中化疗药物选择及化疗方案的制定提供直观、科学的依据.
姜春萌, 教授, 主任, 大连医科大学附属第二医院消化科; 崔杰峰, 副研究员, 硕士生导师, 复旦大学附属中山医院肝癌研究所
近年来, 国外研究提示肿瘤患者多数基因位点突变均与抗肿瘤化疗药物敏感性相关, 每个肿瘤都可通过靶标检测明确其驱动变异基因, 根据不同基因变异情况, 制定针对性个体化治疗. HCC术后预防性TACE的临床价值已被广泛接受, 但依据分子靶标检测筛选化疗药物行预防性TACE国内鲜有报道, 其是否有肯定的临床价值也尚无明确结论.
张琨、青云等研究表明HCC外科切除术后行预防性TACE可明显延缓肿瘤近期复发率, 显著提高生存率, Garnett等研究提示肿瘤患者多数基因突变与抗肿瘤化疗药物敏感性密切相关, 杨惠夷研究显示化疗药物疗效相关靶标基因可预测肿瘤患者术后复发及生存获益情况.
本研究分析了分子靶标检测筛选高敏感性化疗药物在HCC术后行个体化预防性TACE的肿瘤近期复发率、无瘤生存期及TACE不良反应方面的优势, 首次探讨了分子靶标检测制定个体化治疗方案在HCC领域的临床价值.
检测与HCC化疗药物敏感性相关的靶标基因(ERCC1、MTHFR、TS、GSTP1、MDR、CDA)突变情况, 为HCC术后制定个体化预防性TACE中化疗药物方案及治疗策略提供客观、科学依据.
分子靶标检测: 是应用聚合酶链式反应扩增和测序等方法测定肿瘤患者与某些化疗药物敏感性相关的基因位点突变情况, 继而筛选出高敏感性抗肿瘤药物以指导临床应用的技术, 是肿瘤个体化治疗的重要组成部分; TACE: 是在DSA透视引导下, 穿刺股动脉将导管送至肿瘤供血的靶动脉, 注入适量栓塞剂及化疗药物以达预期治疗目的的技术.
论文通过化疗药物相关敏感基因检测, 选择敏感的化疗药物, 使HCC术后TACE疗效明显提高, 论文书写基本规范, 有一定的临床参考价值.
编辑: 于明茜 电编:都珍珍
| 2. | Chang CH, Chau GY, Lui WY, Tsay SH, King KL, Wu CW. Long-term results of hepatic resection for hepatocellular carcinoma originating from the noncirrhotic liver. Arch Surg. 2004;139:320-325; discussion 326. [PubMed] [DOI] |
| 3. | Tung-Ping Poon R, Fan ST, Wong J. Risk factors, prevention, and management of postoperative recurrence after resection of hepatocellular carcinoma. Ann Surg. 2000;232:10-24. [PubMed] |
| 5. | Martin J, Bhanot K, Athreya S. Complications and reinterventions in uterine artery embolization for symptomatic uterine fibroids: a literature review and meta analysis. Cardiovasc Intervent Radiol. 2013;36:395-402. [PubMed] [DOI] |
| 7. | Garnett MJ, Edelman EJ, Heidorn SJ, Greenman CD, Dastur A, Lau KW, Greninger P, Thompson IR, Luo X, Soares J. Systematic identification of genomic markers of drug sensitivity in cancer cells. Nature. 2012;483:570-575. [PubMed] [DOI] |
| 8. | Ryu JS, Hong YC, Han HS, Lee JE, Kim S, Park YM, Kim YC, Hwang TS. Association between polymorphisms of ERCC1 and XPD and survival in non-small-cell lung cancer patients treated with cisplatin combination chemotherapy. Lung Cancer. 2004;44:311-316. [PubMed] [DOI] |
| 9. | Jakobsen A, Nielsen JN, Gyldenkerne N, Lindeberg J. Thymidylate synthase and methylenetetrahydrofolate reductase gene polymorphism in normal tissue as predictors of fluorouracil sensitivity. J Clin Oncol. 2005;23:1365-1369. [PubMed] [DOI] |
| 10. | Derwinger K, Wettergren Y, Odin E, Carlsson G, Gustavsson B. A study of the MTHFR gene polymorphism C677T in colorectal cancer. Clin Colorectal Cancer. 2009;8:43-48. [PubMed] [DOI] |
| 11. | Marcuello E, Altés A, del Rio E, César A, Menoyo A, Baiget M. Single nucleotide polymorphism in the 5' tandem repeat sequences of thymidylate synthase gene predicts for response to fluorouracil-based chemotherapy in advanced colorectal cancer patients. Int J Cancer. 2004;112:733-737. [PubMed] [DOI] |
| 12. | Villafranca E, Okruzhnov Y, Dominguez MA, García-Foncillas J, Azinovic I, Martínez E, Illarramendi JJ, Arias F, Martínez Monge R, Salgado E. Polymorphisms of the repeated sequences in the enhancer region of the thymidylate synthase gene promoter may predict downstaging after preoperative chemoradiation in rectal cancer. J Clin Oncol. 2001;19:1779-1786. [PubMed] |
| 13. | Yuille M, Condie A, Hudson C, Kote-Jarai Z, Stone E, Eeles R, Matutes E, Catovsky D, Houlston R. Relationship between glutathione S-transferase M1, T1, and P1 polymorphisms and chronic lymphocytic leukemia. Blood. 2002;99:4216-4218. [PubMed] [DOI] |
| 14. | Ashariati A. Polymorphism C3435T of the MDR-1 gene predict response to preoperative chemotherapy in locally advanced breast cancer with Her2/neu expression. Acta Med Indones. 2008;40:187-191. [PubMed] |
| 15. | Laliberté J, Momparler RL. Human cytidine deaminase: purification of enzyme, cloning, and expression of its complementary DNA. Cancer Res. 1994;54:5401-5407. [PubMed] |
| 16. | Tibaldi C, Giovannetti E, Vasile E, Mey V, Laan AC, Nannizzi S, Di Marsico R, Antonuzzo A, Orlandini C, Ricciardi S. Correlation of CDA, ERCC1, and XPD polymorphisms with response and survival in gemcitabine/cisplatin-treated advanced non-small cell lung cancer patients. Clin Cancer Res. 2008;14:1797-1803. [PubMed] [DOI] |
| 17. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 19. | Ercolani G, Grazi GL, Ravaioli M, Del Gaudio M, Gardini A, Cescon M, Varotti G, Cetta F, Cavallari A. Liver resection for hepatocellular carcinoma on cirrhosis: univariate and multivariate analysis of risk factors for intrahepatic recurrence. Ann Surg. 2003;237:536-543. [PubMed] [DOI] |
| 21. | Wang Y, Shen Y. Unresectable hepatocellular carcinoma treated with transarterial chemoembolization: clinical data from a single teaching hospital. Int J Clin Exp Med. 2013;6:367-371. [PubMed] |
| 24. | 冯 超, 赵 剑波, 陈 勇, 何 晓峰, 曾 庆乐, 梅 雀林, 王 江云, 庞 桦进, 李 彦豪. 原发性肝癌切除术后预防性经肝动脉介入治疗: 肝动脉化疗栓塞术和化疗灌注术比较. 介入放射学杂志. 2014;23:679-682. |
| 25. | Shaw AT, Yeap BY, Solomon BJ, Riely GJ, Gainor J, Engelman JA, Shapiro GI, Costa DB, Ou SH, Butaney M. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol. 2011;12:1004-1012. [PubMed] [DOI] |
| 26. | Bergethon K, Shaw AT, Ou SH, Katayama R, Lovly CM, McDonald NT, Massion PP, Siwak-Tapp C, Gonzalez A, Fang R. ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol. 2012;30:863-870. [PubMed] [DOI] |
| 27. | Wang R, Hu H, Pan Y, Li Y, Ye T, Li C, Luo X, Wang L, Li H, Zhang Y. RET fusions define a unique molecular and clinicopathologic subtype of non-small-cell lung cancer. J Clin Oncol. 2012;30:4352-4359. [PubMed] [DOI] |