修回日期: 2015-10-18
接受日期: 2015-10-26
在线出版日期: 2015-11-28
目的: 探讨组蛋白去乙酰化酶1(histone deacetylase 1, HDAC1)在胃癌组织中的表达及临床意义.
方法: 采用免疫组织化学方法检测80例胃癌组织及其癌旁组织标本中的HDAC1表达水平, 并结合患者的临床病例资料进行分析.
结果: HDAC1在胃癌组织中的表达总体阳性率达93.75%, 显著高于癌旁组织的表达阳性率8.75%(P<0.05), 并且HDAC1的表达水平与肿瘤分化程度、肿瘤淋巴结转移及患者的生存预后密切相关(P<0.05).
结论: HDAC1在胃癌中异常高表达, 检测其表达水平对胃癌的早期诊断及预后的判断具有一定的意义.
核心提示: 该文通过免疫组织化学方法检测了组蛋白去乙酰化酶1(histone deacetylase 1, HDAC1)在80例癌旁组织、80例胃癌组织标本中的表达, 并探讨了与临床病理特征、患者生存间的关系. 证实了HDAC1在胃癌中异常高表达, 并且HDAC1的表达水平与肿瘤分化程度、肿瘤淋巴结转移及患者的生存预后密切相关.
引文著录: 余森源, 侯曦露, 段晓伟, 严和中, 刘卫, 唐郡. HDAC1在胃癌中的表达及其临床意义. 世界华人消化杂志 2015; 23(33): 5290-5295
Revised: October 18, 2015
Accepted: October 26, 2015
Published online: November 28, 2015
AIM: To investigate the expression of histone deacetylase 1 (HDAC1) protein in gastric cancer (GC) and to analyze its clinical significance.
METHODS: Immunohistochemistry was used to detect the expression of HDAC1 in 80 gastric cancer (GC) tissues and matched tumor adjacent tissues. The correlation between HDAC1 expression and clinicopathological features of GC was then analyzed.
RESULTS: The expression of HDAC1 was significantly higher in GC tissues than in tumor adjacent tissues (P < 0.05). The expression of HDAC1 was correlated with tumor differentiation, tumor lymph metastasis and survival in GC (P < 0.05).
CONCLUSION: HDAC1 is highly expressed in gastric cancer. Detection of HDAC1 expression may be helpful in early diagnosis and prognosis prediction in GC.
- Citation: Yu SY, Hou XL, Duan XW, Yan HZ, Liu W, Tang J. Significance of expression of HDAC1 protein in gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(33): 5290-5295
- URL: https://www.wjgnet.com/1009-3079/full/v23/i33/5290.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i33.5290
胃恶性肿瘤是当前最为常见的恶性肿瘤之一, 在人类的所有癌症中, 其发病率位居世界第5位[1], 而在我国胃癌的发病率更是高居各类肿瘤的第1位[2]. 然而到目前为止, 尚没有有效的胃癌治疗方案, 而早期发现并积极切除病灶能够明显提高胃癌患者的5年生存率[3]. 因此深入研究胃癌的早期诊断并及早治疗, 是当前胃癌治疗中最为迫切的需求. 组蛋白去乙酰化酶1(histone deacetylase 1, HDAC1)是20世纪90年代由美国科学家Taunten率先于哺乳动物中发现的组蛋白去乙酰化酶, 他广泛参与各种蛋白质复合物的催化过程, 包括非组蛋白及组蛋白的去乙酰化[4].
近年来的研究[5]表明HDAC1在胰腺癌, 结肠癌, 肝癌及肺癌等组织中均异常高表达, 并与肿瘤的发生发展和侵袭转移紧密相关, 已成为目前肿瘤研究的热点[6]. 然而, HDAC1在胃癌中的表达尚鲜有报道, 因此本研究意在检测HDAC1蛋白在人胃癌组织及其相对应的癌旁组织中的表达差异, 并初步探究HDAC1蛋白与胃癌患者临床特征之间的关系.
收集中国人民解放军第105医院2007-01/2009-12经手术切除的胃癌组织及其相应的癌旁组织, 所有胃癌患者术前均没有进行相应的放疗及化疗. 共80例标本, 其中男性58例, 女性22例, 年龄为35-80岁, 平均54.4岁±13.9岁. 免疫组织化学SP试剂盒均购自中国中杉生物科技有限公司. HDAC1鼠抗人单克隆抗体购自美国ORIGENE公司, HDAC1工作液浓度为1:100, 二抗均购自北京中杉生物科技有限公司.
所有胃癌组织及癌旁组织标本均首先经40 g/L甲醛固定, 常规脱水后使用石蜡包埋, 按照4 μm厚度切片备用. 免疫组织化学方法均采用SP法[7], 免疫组织化学方法全部过程均按照试剂盒说明书操作完成. 在200倍高倍显微镜下每张切片随机选择6个视野, 使用Image-Pro Plus 6.0软件测定各标本免疫组织化学染色切片中HDAC1表达的平均光密度值[8,9], 用以衡定其HDAC1蛋白表达的强弱.
统计学处理 采用SPSS16.0软件进行统计学处理, 计量资料以mean±SD表示, 两组间比较采用t检验或非参数秩和检验, 多组间比较采用单因素方差分析; Kaplan-Meier与Log-rank检验进行生存曲线估计及分析, 并通过Cox回归分析胃癌的独立危险预后因素.
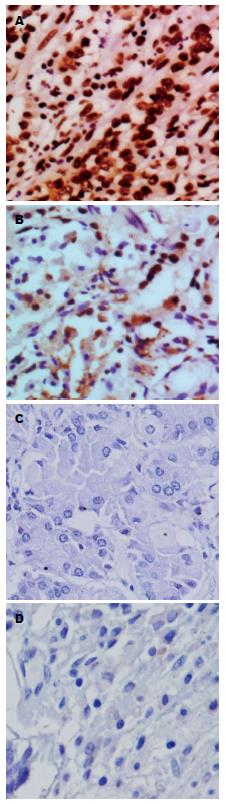
HDAC1蛋白的表达主要定位于细胞核中, 在光镜下, 表现为深棕色或深黄色着色. 我们发现80例胃癌组织中有75例阳性表达, 总体阳性率达93.75%; 而HDAC1蛋白在胃癌癌旁组织中表达降低或无表达; 在80例胃癌的癌旁组织标本中, 仅有7例阳性表达, 总体阳性率仅为8.75%. 提示HDAC1在胃癌组织中表达显著高于癌旁组织(P<0.05); 说明HDAC1蛋白在胃癌组织中表达水平上调(图1).
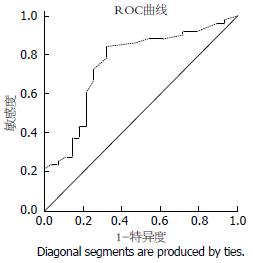
使用Image-Pro Plus 6.0软件测定各个胃癌组织切片中HDAC1表达的平均光密度值, 以此判定HDAC1的表达高低, 并采用受试者工作特征(receiver operating characteristic, ROC)曲线得到HDAC1的最佳诊断界限值1.205[10], 根据最佳诊断值将80例胃癌标本分为HDAC1高表达组及低表达组; 进一步结合患者的临床病例资料分析, 我们发现在胃癌组织中的HDAC1蛋白表达水平在淋巴结转移组较无淋巴结转移组显著升高(P<0.05), 并且HDAC1蛋白的表达水平在高-中分化组明显低于低分化组(P<0.05), 而HDAC1蛋白的表达水平高低和患者的年龄、性别、临床分期、远处转移及肿瘤的浸润程度无相关性(P>0.05)(表1, 图2).
| 临床病理参数 | n | HDAC1 | P值 | |
| 低表达 | 高表达 | |||
| 年龄(岁) | 0.578 | |||
| ≤60 | 53 | 19 | 34 | |
| >60 | 27 | 8 | 19 | |
| 性别 | 0.854 | |||
| 男 | 58 | 14 | 44 | |
| 女 | 22 | 6 | 16 | |
| 分化程度 | 0.039 | |||
| 高、中分化 | 27 | 15 | 12 | |
| 低分化 | 53 | 8 | 45 | |
| 有无淋巴结转移 | 0.044 | |||
| 无 | 34 | 24 | 10 | |
| 有 | 46 | 9 | 37 | |
| 有无浆膜浸润 | 0.104 | |||
| 无 | 26 | 12 | 14 | |
| 有 | 54 | 25 | 29 | |
| 临床分期 | 0.817 | |||
| Ⅰ+Ⅱ | 38 | 18 | 20 | |
| Ⅲ+Ⅳ | 42 | 20 | 22 | |
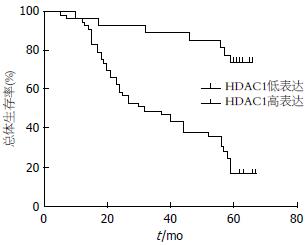
根据患者ROC曲线得到的HDAC1最佳诊断界限值分组, 进一步进行术后生存时间分析[10], 我们发现, HDAC1蛋白高表达组患者的术后生存时间较低表达组患者明显减少(P<0.05)(图3).
同时我们通过Cox多因素回归模型分析证实了HDAC1蛋白是胃癌患者的危险预后因素[11](P<0.05)(表2).
| 多因素分析 | 危险因数 | 95%CI | P值 |
| ≤60岁 vs >60岁 | 0.738 | 0.355-1.524 | 0.295 |
| 女性 vs 男性 | 1.195 | 0.613-2.328 | 0.601 |
| 高分化+中分化 vs 低分化 | 0.956 | 0.487-1.878 | 0.896 |
| 不存在浆膜浸润 vs 浆膜浸润 | 0.591 | 0.275-1.271 | 0.178 |
| 无淋巴结转移 vs 淋巴结转移 | 0.592 | 0.230-1.522 | 0.277 |
| Ⅲ期+Ⅳ期 vs Ⅰ期+Ⅱ期 | 1.961 | 0.763-5.039 | 0.016 |
| HDAC1水平高 vs HDAC1水平低 | 4.893 | 2.070-11.569 | 0.001 |
毫无疑问, 包括组蛋白去乙酰化在内的表观遗传学修饰在人类恶性肿瘤的发生、发展过程中起着至关重要的作用[12-15]. 既往有文献报道, 当HDACs异常结合到特定的启动子区时, 会诱发与肿瘤增殖、肿瘤转移、肿瘤血管生成、肿瘤分化、肿瘤浸润等有关的各种基因的转录进程被抑制[16,17], 从而导致了恶性肿瘤的发生、发展, 这极有可能是癌症发生的机制之一[18,19]. 目前已知的HDACs家族成员共有18个[20], 我们根据其结构及发挥的相关功能共将其划分为四大类[21], 第一类是HDACs家族中最具特征性的蛋白, 具体就包括HDAC1、HDAC2、HDAC3、HDAC8[22], 而其中HDAC1是20世纪90年代由美国科学家Taunten率先于哺乳动物中发现的HDACs, 也是目前为止发现的与肿瘤发生发展最为密切的HDACs; HDAC1广泛参与各种蛋白质复合物的催化过程, 包括非组蛋白及组蛋白的去乙酰化. 研究[23,24]表明, RNA干扰沉默HDAC1基因可通过细胞周期阻滞、诱导分化和凋亡等机制对血液系统肿瘤及一些实体肿瘤[25-27]有明显抑制作用. 既往有国外文献报道[28], HDAC1可能通过介导核小体改变及调节基因的表达, 参与细胞周期及细胞分化的相关进程, 已经有学者发现HDAC1可以通过介导位点特异DNA结合的转录抑制子的相应转录抑制作用. 此外, HDAC1还可以通过线粒体转位而促进相关癌基因的生成, 导致相关细胞凋亡抑制与分化障碍, 从而介导恶性肿瘤的发生发展[29]. 可见HDAC1在癌症的发生发展及其侵袭转移进程演变中扮演着及其重要的角色.
既然HDAC1在肿瘤发生发展中的作用如此重要, 那么在发病率居高不下的胃癌发生发展进程中, HDAC1扮演了什么样的角色? 在本研究中, 我们发现了HDAC1在胃癌组织中表达量要显著高于其相应癌旁组织, 并且差异具有统计学意义(P<0.05); 说明HDAC1蛋白在胃癌组织中表达水平异常上调. 此外, 我们发现HDAC1的表达水平随着肿瘤分化程度的升高及肿瘤淋巴结转移的发生而显著增高(P<0.05), 并且我们进一步研究发现, HDAC1表达量与胃癌患者的生存预后密切相关, HDAC1蛋白高表达组患者的生存率明显低于其低表达组(P<0.05), 通过Cox回归分析证实了HDAC1蛋白是胃癌的独立危险预后因素. 这就表明HDAC1可以通过促使组蛋白去乙酰化, 对胃癌的发生和发展起推动作用, 他可能是胃恶性肿瘤发生、发展进程中的一个非常关键"幕后推手", 在正常胃黏膜组织向恶性肿瘤组织癌变的演进过程中发挥重要作用. 虽然当前生命科学在高速发展, 但在恶性肿瘤发生、发展和演进过程中, 包含组蛋白去乙酰化在内的表观遗传学修饰作用关系错综复杂[30,31], 其具体分子机制至今仍需进一步阐明, 有待今后广大同仁进一步探讨. 在后续实验中, 我们将扩大样本量进一步探究HDAC1与胃癌发生发展的相关具体机制及抑制HDAC1对肿瘤细胞生长、增殖、侵袭与凋亡的影响.
总之, 本研究结果提示HDAC1在胃癌组织中表达增高, HDAC1的表达水平与胃癌的分化程度、淋巴结转移密切相关; 而与患者的年龄、性别、肿瘤的浸润程度、临床分期及远处转移无明显相关性; 同时还发现HDAC1的表达水平与胃癌患者的预后成负相关. 本研究结果提示HDAC1在将来的临床实践中可能作为于肿瘤治疗的预后判断指标, 同时, 鉴于其在肿瘤发生发展过程中的重要作用, HDAC1今后可能作为胃癌的治疗靶点. 本研究为胃癌基于HDAC1的预后判断及靶向治疗提供了理论基础.
近年来的研究表明组蛋白去乙酰化酶1(histone deacetylase 1, HDAC1)在胰腺癌、结肠癌、肝癌及肺癌等组织中均异常高表达, 并与肿瘤的发生发展和侵袭转移紧密相关, 已成为目前肿瘤研究的热点. 然而, HDAC1在胃癌中的表达尚鲜有报道, 因此本研究意在检测HDAC1蛋白在人胃癌组织及其相对应的癌旁组织中的表达差异, 并初步探究HDAC1蛋白与胃癌患者临床特征之间的关系.
陈洪, 主任医师, 教授, 东南大学附属中大医院消化科; 郑丽端, 副教授, 副主任医师, 华中科技大学同济医学附属协和医院
HDAC1在胰腺癌、结肠癌、肝癌及肺癌等组织中均异常高表达, 已成为目前肿瘤研究的热点. 包含组蛋白去乙酰化在内的表观遗传学修饰作用关系错综复杂, 其具体分子机制至今仍需进一步阐明.
研究表明, RNA干扰沉默HDAC1基因可通过细胞周期阻滞、诱导分化和凋亡等机制对血液系统肿瘤及一些实体肿瘤有明显抑制作用. 既往有国外文献报道, HDAC1可能通过介导核小体改变及调节基因的表达, 参与细胞周期及细胞分化的相关进程, 已经有学者发现HDAC1可以通过介导位点特异DNA结合的转录抑制子的相应转录抑制作用.
本研究结果提示HDAC1在胃癌组织中表达增高, HDAC1的表达水平与胃癌的分化程度、淋巴结转移密切相关; 而与患者的年龄, 性别, 肿瘤的浸润程度, 临床分期及远处转移无明显相关性; 同时还发现HDAC1的表达水平与胃癌患者的预后成负相关.
本研究结果提示HDAC1在将来的临床实践中可能作为肿瘤治疗的预后判断指标, 同时, 鉴于其在肿瘤发生发展过程中的重要作用, HDAC1今后可能作为胃癌的治疗靶点. 本研究为胃癌基于HDAC1的预后判断及靶向治疗提供了理论基础.
平均光密度值: 表示在视野内所有选定对象的平均反应强度. 一般用于对免疫组织化学或原位杂交法染色的组织切片, 定量的测定其特异性染色的水平.
本文通过免疫组织化学方法检测了HDAC1在癌旁组织和胃癌组织各80例标本中的表达, 并探讨了其与临床病理特征、患者生存间的关系.
编辑: 于明茜 电编: 都珍珍
| 1. | McLean MH, El-Omar EM. Genetics of gastric cancer. Nat Rev Gastroenterol Hepatol. 2014;11:664-674. [PubMed] [DOI] |
| 4. | Taunton J, Hassig CA, Schreiber SL. A mammalian histone deacetylase related to the yeast transcriptional regulator Rpd3p. Science. 1996;272:408-411. [PubMed] [DOI] |
| 5. | Nakagawa M, Oda Y, Eguchi T, Aishima S, Yao T, Hosoi F, Basaki Y, Ono M, Kuwano M, Tanaka M. Expression profile of class I histone deacetylases in human cancer tissues. Oncol Rep. 2007;18:769-774. [PubMed] |
| 7. | 陈 文敏. 川芎嗪对实验性溃疡性结肠炎NF-kB/COX-2信号通路的影响. 重庆: 重庆医科大学 2012; 1-53. |
| 12. | Yoo CB, Jones PA. Epigenetic therapy of cancer: past, present and future. Nat Rev Drug Discov. 2006;5:37-50. [PubMed] |
| 16. | Xu WS, Parmigiani RB, Marks PA. Histone deacetylase inhibitors: molecular mechanisms of action. Oncogene. 2007;26:5541-5552. [PubMed] |
| 22. | Weichert W. HDAC expression and clinical prognosis in human malignancies. Cancer Lett. 2009;280:168-176. [PubMed] [DOI] |
| 23. | Kuendgen A, Gattermann N. Valproic acid for the treatment of myeloid malignancies. Cancer. 2007;110:943-954. [PubMed] [DOI] |
| 24. | Bug G, Schwarz K, Schoch C, Kampfmann M, Henschler R, Hoelzer D, Ottmann OG, Ruthardt M. Effect of histone deacetylase inhibitor valproic acid on progenitor cells of acute myeloid leukemia. Haematologica. 2007;92:542-545. [PubMed] [DOI] |
| 25. | Ahn MY, Jung JH, Na YJ, Kim HS. A natural histone deacetylase inhibitor, Psammaplin A, induces cell cycle arrest and apoptosis in human endometrial cancer cells. Gynecol Oncol. 2008;108:27-33. [PubMed] [DOI] |
| 26. | Mukhopadhyay NK, Weisberg E, Gilchrist D, Bueno R, Sugarbaker DJ, Jaklitsch MT. Effectiveness of trichostatin A as a potential candidate for anticancer therapy in non-small-cell lung cancer. Ann Thorac Surg. 2006;81:1034-1042. [PubMed] [DOI] |
| 27. | Bluethner T, Niederhagen M, Caca K, Serr F, Witzigmann H, Moebius C, Mossner J, Wiedmann M. Inhibition of histone deacetylase for the treatment of biliary tract cancer: a new effective pharmacological approach. World J Gastroenterol. 2007;13:4761-4770. [PubMed] [DOI] |
| 28. | Minucci S, Pelicci PG. Histone deacetylase inhibitors and the promise of epigenetic (and more) treatments for cancer. Nat Rev Cancer. 2006;6:38-51. [PubMed] [DOI] |
| 29. | Smith KT, Workman JL. Histone deacetylase inhibitors: anticancer compounds. Int J Biochem Cell Biol. 2009;41:21-25. [PubMed] [DOI] |
| 30. | Fang JY, Chen YX, Lu J, Lu R, Yang L, Zhu HY, Gu WQ, Lu LG. Epigenetic modification regulates both expression of tumor-associated genes and cell cycle progressing in human colon cancer cell lines: Colo-320 and SW1116. Cell Res. 2004;14:217-226. [PubMed] [DOI] |
| 31. | Ocker M, Schneider-Stock R. Histone deacetylase inhibitors: signalling towards p21cip1/waf1. Int J Biochem Cell Biol. 2007;39:1367-1374. [PubMed] [DOI] |