修回日期: 2015-10-14
接受日期: 2015-10-26
在线出版日期: 2015-11-28
目的: 观察RhoGTP酶解离抑制蛋白2(RhoGTPase dissociation inhibitor 2, RhoGDI2)、14-3-3σ在胃癌患者组织中的表达状况, 并评价其与胃癌临床病理特征的相关性, 分析两者表达相关性.
方法: 采用免疫组织化学技术检测152例胃癌组织中RhoGDI2与14-3-3σ的表达状况, 并分析两者表达相关性.
结果: 胃癌组织中RhoGDI2和14-3-3σ蛋白表达阳性率分别为76.97%、27.63%; 胃癌中RhoGDI2和14-3-3σ的蛋白表达与下列因素密切相关: 胃癌分化程度、胃癌浸润深度、淋巴结转移数、是否存在远处转移和TNM分期; 胃癌组织RhoGDI2与14-3-3σ的蛋白表达水平呈负相关.
结论: 14-3-3σ极可能受到RhoGDI2的调控, 也许是RhoGDI2在胃癌浸润转移过程中的下游靶点基因之一, 两种基因很可能共同参与调控胃癌侵袭转移的过程.
核心提示: RhoGTP酶解离抑制蛋白2(RhoGTPase dissociation inhibitor 2, RhoGDI2)在大多数胃癌组织中的蛋白表达状况均较在胃正常黏膜组织中升高, 且与各项临床病理特征(胃癌分化程度、浸润深度、淋巴结转移、远处转移和TNM分期)密切相关; 其疑似下游靶点基因14-3-3σ表达状况则与之相反. RhoGDI2与14-3-3σ的表达负相关. 通过此项研究, 初步揭示胃癌组织RhoGDI2和14-3-3σ的表达与肿瘤发生侵袭转移相关, 14-3-3σ很可能是RhoGDI2在肿瘤发生浸润、转移时直接的下游调控靶基因.
引文著录: 石干, 吴杰, 王萍, 宋敏, 孙亮, 涂玉洁, 黄晓东. 胃癌中RhoGDI2及其疑似下游靶基因14-3-3σ的原位表达和两者相关性. 世界华人消化杂志 2015; 23(33): 5282-5289
Revised: October 14, 2015
Accepted: October 26, 2015
Published online: November 28, 2015
AIM: To detect the expression of RhoGDI2 and 14-3-3σ in gastric cancer, analyze their correlation with clinicopathological characteristics of gastric cancer, and assess their correlation.
METHODS: Immunohistochemistry was used to detect the expression of RhoGDI2 and 14-3-3σ in 152 gastric cancer specimens.
RESULTS: The positive rates of RhoGDI2 and 14-3-3σ in gastric cancer were 76.97% and 27.63%, respectively. The expression of RhoGDI2 and 14-3-3σ was related with tumor differentiation, depth of invasion, lymph node metastasis, distant metastasis and TNM stage in gastric cancer. There was a negative correlation between the expression of RhoGDI2 and 14-3-3σ in gastric cancer.
CONCLUSION: There is a correlation between the expression of RhoGDI2 and 14-3-3σ in gastric cancer. 14-3-3σ is very likely regulated by RhoGDI2 and functions as a downstream target gene of RhoGDI2 in tumor invasion and metastasis. They may be both involved in regulating the invasion and metastasis of gastric cancer.
- Citation: Shi G, Wu J, Wang P, Song M, Sun L, Tu YJ, Huang XD. Expression of RhoGDI2 and 14-3-3σ in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(33): 5282-5289
- URL: https://www.wjgnet.com/1009-3079/full/v23/i33/5282.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i33.5282
近年来, 我国罹患癌症的患者人数逐年上升, 这其中胃癌的致死率最高, 位列恶性肿瘤第一, 其5年生存率极低. 胃癌患者死亡的主要诱因是肿瘤转移. 若能明确胃癌的发生和转移相关机制, 则能够挽救大多数患者的生命. RhoGTP酶解离抑制蛋白2(RhoGTPase dissociation inhibitor 2, RhoGDI2)是一种肿瘤转移抑制基因, 他能够使Rho家族GTP酶在活化状态下活性下调. RhoGDI2在不同部位肿瘤的表达水平各不相同[1]. 肿瘤类型不同, RhoGDI2的表达水平和功能也不同[2]. 有据可查的文献资料显示, 国际上RhoGDI2和胃癌相关的报道甚少. 我们近2年的研究[3]显示在胃癌组织中, RhoGDI2表达升高. 14-3-3σ是一种肿瘤抑制基因, 在细胞周期调控、细胞程序性凋亡、DNA损伤、细胞分化、细胞增殖中意义重大[4]. 2013年国外研究[5]报道, 在RhoGDI2过表达的高转移性SNU-484胃癌细胞株中14-3-3σ mRNA表达下调, 而在RhoGDI2耗竭的MKN-28胃癌细胞株中14-3-3σ mRNA表达上调, 首次揭示14-3-3σ可能是一种受RhoGDI2调控的基因, RhoGDI2或许能导致14-3-3σ表达下调. 若能够检测RhoGDI2与14-3-3σ在胃癌组织中蛋白水平的表达状况以及进一步检测两种基因的相关性, 应该对揭示两者在胃癌浸润转移过程所起的作用有较大帮助. 经查询文献, 国际上没有相似的文献报道. 本研究主要采取免疫组织化学的检测手段, 对152例胃癌病例组织中RhoGDI2与14-3-3σ蛋白表达水平进行检测, 统计分析RhoGDI2与14-3-3σ是否具有表达相关性, 并将各项临床病理特征与两者之间的关系进行比对.
报武汉市中心医院伦理委员会批准本实验, 履行告知义务并获患者知情同意. 选择2013-01/2015-01在武汉市中心医院住院的胃癌患者152例, 首先在消化内镜中心行胃镜检查, 活检取组织标本(活检前所有患者均未行放化疗); 再记录患者的一般病例资料数据, 如患者的性别、年龄、胃癌部位、病灶直径、组织学分级等, 记录其实验室及影像学检查结果、胃癌手术情况、临床分期(胃癌浸润深度、是否存在淋巴结转移和远处转移)并进行统计分析. 入组病例各项分类资料及数据如表1. 对照组选取41例, 为非胃癌组织标本(手术切除胃癌组织癌旁5 cm组织), 病检报告"黏膜呈轻度慢性炎症改变"或"正常胃黏膜表现". 胃癌TNM分期采用2010年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM分期标准. 武汉谷歌生物技术公司提供一抗兔抗人多克隆抗体RhoGDl2(#ab15198)、兔抗人多克隆抗体14-3-3σ(#S7323)、DAB显色试剂盒(#ARl022).
| 临床病理特征 | n | 14-3-3σ蛋白 | RhoGDI2蛋白 | ||||||
| 阳性 | 阳性率(%) | χ2值 | P值 | 阳性 | 阳性率(%) | χ2值 | P值 | ||
| 性别 | 0.52 | >0.05 | 0.03 | >0.05 | |||||
| 男 | 98 | 27 | 27.55 | 75 | 76.53 | ||||
| 女 | 54 | 12 | 22.22 | 42 | 77.78 | ||||
| 年龄(岁) | 0.82 | >0.05 | 0.03 | >0.05 | |||||
| <60 | 46 | 15 | 32.61 | 35 | 76.09 | ||||
| ≥60 | 106 | 27 | 25.47 | 82 | 77.36 | ||||
| 肿瘤位置 | 1.07 | >0.05 | 0.51 | >0.05 | |||||
| 贲门胃底 | 34 | 10 | 29.42 | 25 | 73.53 | ||||
| 胃体 | 28 | 8 | 28.57 | 21 | 75.00 | ||||
| 胃角 | 41 | 13 | 31.71 | 32 | 78.05 | ||||
| 胃窦 | 49 | 11 | 22.45 | 39 | 79.59 | ||||
| 原发灶直径(cm) | 1.10 | >0.05 | 0.31 | >0.05 | |||||
| <5 | 114 | 29 | 25.44 | 89 | 78.07 | ||||
| ≥5 | 38 | 13 | 34.21 | 28 | 73.68 | ||||
| 组织学分级 | 44.22 | <0.05 | 16.15 | <0.05 | |||||
| 高-中分化 | 42 | 28 | 66.67 | 23 | 54.76 | ||||
| 低分化 | 110 | 14 | 12.73 | 94 | 85.45 | ||||
| 原发灶分期 | 23.93 | <0.05 | 5.97 | <0.05 | |||||
| T1, T2 | 64 | 31 | 48.44 | 43 | 67.19 | ||||
| T3, T4 | 88 | 11 | 12.50 | 74 | 84.09 | ||||
| 淋巴结转移 | 54.73 | <0.05 | 32.17 | <0.05 | |||||
| N0 | 31 | 25 | 80.65 | 12 | 38.71 | ||||
| N1-N3 | 121 | 17 | 14.05 | 105 | 86.78 | ||||
| 远处转移 | 37.34 | <0.05 | 11.35 | <0.05 | |||||
| M0 | 51 | 30 | 58.82 | 31 | 60.78 | ||||
| M1 | 101 | 12 | 11.88 | 86 | 85.15 | ||||
| 临床分期 | 11.75 | <0.05 | 12.14 | <0.05 | |||||
| Ⅰ+Ⅱ | 78 | 31 | 39.74 | 51 | 65.38 | ||||
| Ⅲ+Ⅳ | 74 | 11 | 14.86 | 66 | 89.19 | ||||
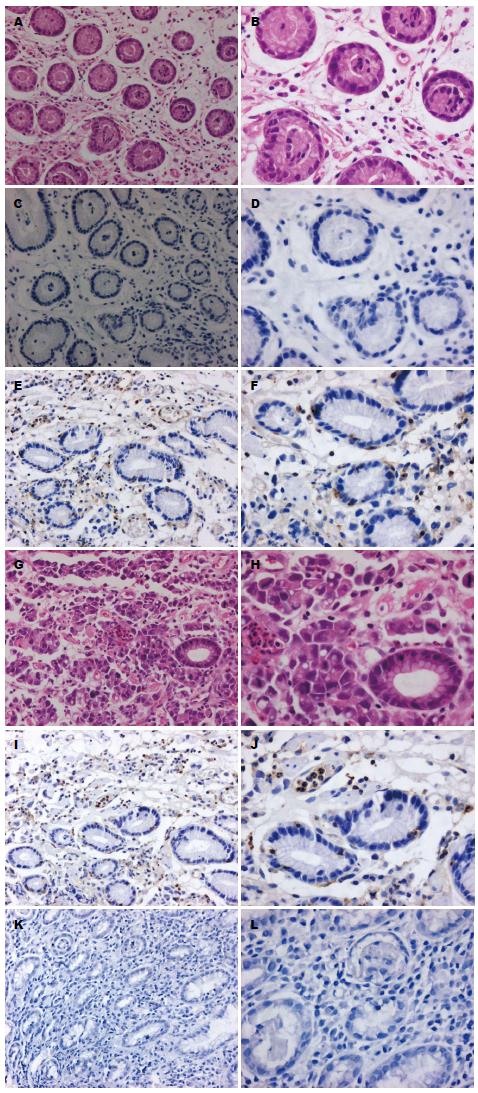
1.2.1 免疫组织化学法(LP法)操作步骤: 切片常规脱蜡至水; 缓冲液洗3 min×2次; 为了降低内源性过氧化物酶造成的非特异性背景染色, 将切片放在Hydrogen Peroxide Block中孵育15 min; 缓冲液洗5 min×2次; 滴加Ultra V Block, 在室温下孵育5 min以封闭非特异性的背景染色; 缓冲液洗5 min×2次; 滴加一抗工作液37 ℃孵育2 h; 缓冲液洗5 min×2次; 滴加Primary Antibody Enhancer(增强子), 在室温下孵育20 min; 缓冲液洗5 min×2次; 滴加HRP Polymer(酶标二抗), 在室温下孵育30 min; 缓冲液洗5 min×2次; 向1 mL DAB Plus Substrate中滴加2滴DAB Plus Chromogen, 混匀后滴加到切片上, 孵育5 min; 自来水充分冲洗, 复染、脱水、透明、封片. 将已知的阳性切片作为阳性对照, 以PBS代替一抗作阴性对照. RhoGDI2阳性细胞为棕黄色, 阳性颗粒物多在细胞浆或细胞核定位. 14-3-3σ阳性细胞也为棕黄色, 阳性颗粒物多在细胞浆定位.
1.2.2 免疫组织化学染色结果评定: 采用Remmele和Stegner的"免疫反应积分"(IRS)评分方法[6], 采用双盲法, 每张切片观察5个视野(×200), 取其平均值即为每张切片的观察结果. 对染色强度进行评分: 不着色为阴性(-)即0分; 浅黄色为弱阳性(+)即1分; 黄色为阳性(++)即2分; 棕黄色为强阳性(+++)即3分. 其中阴性、弱阳性、阳性和强阳性分别表示不表达、弱表达、中度表达和强表达.
统计学处理 采用SPSS19.0软件进行χ2检验, P<0.05认为差异具有统计学意义.
RhoGDI2阳性表达于肿瘤细胞, 多半位于细胞浆或细胞核. 胃癌组织中RhoGDI2表达率为76.97%(117/152), 在对照组(标本病检提示"黏膜呈轻度慢性炎症改变"或"正常胃黏膜表现")中的表达率为14.63%(6/41), 具有统计学差异(χ2 = 54.29, P<0.01); 低分化型胃癌组显著比高-中分化型胃癌组高(χ2 = 16.15, P<0.05); 随浸润深度(分别浸润至黏膜层、黏膜下层、肌层、浆膜层)的增加, RhoGDI2表达率上升(χ2 = 5.97, P<0.05); 淋巴结转移组显著高于无转移组(χ2 = 32.17, P<0.05); 胃癌无转移组明显低于远处转移组(χ2 = 11.35, P<0.05); 临床分期Ⅰ+Ⅱ期组明显比Ⅲ+Ⅳ期组低(χ2 = 12.14, P<0.05). RhoGDI2表达与患者的性别、年龄、胃癌部位、病灶大小没有相关性(P>0.05)
14-3-3σ阳性表达于肿瘤细胞, 多半位于细胞浆. 胃癌组织中14-3-3σ表达率为27.63%(42/152), 在对照组(标本病检提示"黏膜呈轻度慢性炎症改变"或"正常胃黏膜表现")中表达率为75.61%(31/41), 具有统计学差异(χ2 = 31.61, P<0.05); 低分化型胃癌组明显比高-中分化型胃癌组低(χ2 = 44.22, P<0.05); 随浸润深度(分别浸润至黏膜层、黏膜下层、肌层、浆膜层)的增加, 14-3-3σ的表达率降低(χ2 = 23.93, P<0.05); 淋巴结转移组显著比无转移组低(χ2 = 54.73, P<0.05); 胃癌无转移组明显高于远处转移组(χ2 = 37.34, P<0.05); 临床分期Ⅰ+Ⅱ期组明显比Ⅲ+Ⅳ期组高(χ2 = 11.75, P<0.05). 14-3-3σ的表达与患者的性别、年龄、胃癌部位、病灶大小没有相关性(P>0.05)(表1, 图1).
近年来我国罹患癌症的人口数逐年上升, 而死亡人数也成比例提高, 其中胃癌的发病率和肿瘤转移率、致死率均很高. 多项研究显示, 在胃癌发生侵袭转移时会涉及众多特殊类型基因, 如胃癌转移基因、胃癌转移抑制基因等. 现在还不清楚胃癌发生侵袭、转移的原因, 若能够明确相关机制, 则意义重大: 可帮助我们更好地理解胃癌侵袭、转移相关调控因子, 也将为未来临床研究开发胃癌靶向干预生物药物提供巨大帮助.
RhoGDI2已经被明确定义为肿瘤转移抑制基因, 但他同时也是一种抑制肿瘤发生转移的"非主流"基因, 近年来不少研究[7]报道: 在不同种类肿瘤中, RhoGDI2发挥作用不同: 促进或抑制肿瘤发生侵袭、转移, RhoGDI2在不同肿瘤类型中具有不同的表达水平和作用. 已经有研究发现, 在膀胱癌[8]、肺癌[9]、霍奇金淋巴瘤[10]中RhoGDI2低表达, 在卵巢癌[11,12]、白血病[13]、胃癌[14]高表达. 目前国内外很少有关于RhoGDI2与胃癌相关研究的报道. 有研究[14]检测20例胃癌组织RhoGDI2的表达状况, 揭示正常胃黏膜组织中的RhoGDI2表达呈阴性或表达微弱, 而在中晚期胃癌组织中表达明显上升, 同时与是否存在淋巴结转移明显相关. 我们前年的研究报道[3]更进一步, 通过大样本量实验数据, 证实了胃癌中RhoGDI2为高表达状态.
2013年Kim等[5]的研究揭示, 高转移性SNU-484胃癌细胞株中, 若过表达RhoGDI2, 则会导致14-3-3σ在mRNA水平表达下调, 而在RhoGDI2耗竭的MKN-28胃癌细胞株中14-3-3σ mRNA表达上调, 首次揭示14-3-3σ可能是一种受RhoGDI2调控的基因, RhoGDI2或许能导致14-3-3σ表达下调. 但该研究未从蛋白水平及mRNA水平将RhoGDI2与14-3-3σ的表达进行比较研究, 验证两个基因之间是否存在负相关性. 从中我们将能够大胆假设两个因子在胃癌浸润转移过程中的确存在着上下游关联: 14-3-3σ是一种与胃癌侵袭转移相关的基因, 在RhoGDI2介导胃癌细胞浸润转移时可能具有功能, 也可能是与RhoGDI2胃癌侵袭转移时相关的下游靶基因之一. 目前的研究[15]表明, 肿瘤从本质上来说是基因病. 其中, 抑癌基因的基因调控失活很大程度会导致肿瘤发展, 在许多癌组织中发现, 由于启动子的DNA高度甲基化而致抑癌基因沉默. 其中就包括14-3-3σ基因[16]. 14-3-3蛋白是一组广泛存在于真核细胞中高度保守的酸性蛋白家族, 由Moore等在1967年分离发现. 在哺乳动物中14-3-3蛋白含有7种亚型, 其中14-3-3σ蛋白与癌关系最密切[17], 在细胞周期调控、细胞程序性凋亡、DNA损伤、细胞分化、细胞增殖中意义重大. 目前研究[18]表明, 14-3-3R基因被认为是抑癌基因p53可诱导的基因, 能够在DNA损伤时迅速做出反应, 阻止有丝分裂的启动[19], 也能够与CDK2-CDK4结合阻止真核细胞的转录[20]. CPG甲基化致14-3-3R基因沉默和他的畸变表达可在一些癌前病变中见到, 有学者报道在60%外阴上皮瘤样病变, 95%前列腺上皮瘤样病变, 83%乳腺导管原位癌, 甚至癌旁正常的组织中观察到该现象[21-23]. 肿瘤中导致14-3-3σ基因出现表达下降或缺失的根本诱因是在其发生基因突变、缺失、启动子异常甲基化之后, 后果则导致肿瘤细胞的负调控作用受到抑制, 从而促进了细胞的无约束生长. 目前研究显示, 在人类多种恶性肿瘤细胞中, 14-3-3σ基因均有表达. 随着肿瘤种类不同, 14-3-3σ则在某些肿瘤细胞中表达升高, 某些肿瘤细胞中表达降低, 其表达水平不一[24]. 例如, 有研究者在宫颈癌[25]、胰腺癌[26]肿瘤细胞中检测到14-3-3σ高表达; 而在前列腺癌[27]、黑色素瘤[28]、肾癌[29]、小细胞肺癌等[30]肿瘤细胞中则检测到14-3-3σ低表达. 另有少量研究报道显示14-3-3σ基因在胃癌中的表达状况尚不明了, 其表达水平也存在争议. 2000年, Suzuki等[31]在胃低分化腺癌中检测显示14-3-3σ甲基化失活, 推断14-3-3σ的表达降低也许与胃癌的分化程度降低相关, 14-3-3σ超甲基化失活, 即14-3-3σ表达缺失存在于25例胃癌组织样本(总共60例), 占43%; 而Tanaka等[32]发现, 至少67%的胃肠道肿瘤患者中存在14-3-3σ蛋白及其mRNA表达上调, 认为14-3-3σ可表达于大多数胃肠道恶性肿瘤中. 而通过分析34例胃癌患者14-3-3σ与临床病理特征相关性发现, 胃癌Borrmann分型为1、2型的组织中14-3-3σ的表达程度比Borrmann分型为3、4型的更高.
搜索文献显示, 国际上极少有14-3-3σ与胃癌相关的研究. 通过近年来各个研究团队的多项试验显示, RhoGDI2在各种类肿瘤中的表达状况各异, 有趣的是, 在各个类型的肿瘤组织中, 14-3-3σ表达高低程度也各不相同. 迄今为止国际上尚没有RhoGDI2和14-3-3σ在胃癌组织中蛋白水平的表达状况及两个蛋白之间相关性的研究报道, 我们近两年的2项研究[3,33]证实, 胃癌RhoGDI2蛋白表达程度升高, 但其下游蛋白及靶向原理还不清楚, 本实验通过免疫组织化学方法, 分别对152例胃癌组织中RhoGDI2和14-3-3σ的蛋白表达程度进行检测后, 观测到RhoGDI2蛋白在许多胃癌组织的表达程度均较正常黏膜组织中的表达程度高, 而14-3-3σ蛋白则相反, 他的表达程度均较正常黏膜组织中低, 也与胃癌的分化程度、浸润深度、淋巴结是否存在转移、远处转移、TNM分期等因素密切相关. 研究发现, 若胃癌患者符合如下条件: 组织分化程度较高、肿瘤浸润较浅、未发生淋巴结转移或未发生远处转移、临床分期较早, 则一般来说14-3-3σ蛋白的表达程度较高; 若是胃癌患者的组织分化程度较低、肿瘤浸润较深、发生淋巴结转移或远处转移、临床分期较晚, 则14-3-3σ蛋白表达程度相应较低; RhoGDI2与14-3-3σ表达水平呈负相关. 我们的研究揭示RhoGDI2和14-3-3σ蛋白的表达程度具有相关性, 14-3-3σ很有可能扮演者RhoGDI2在调控胃癌发生发展过程时下游靶蛋白的重要角色.
总之, 胃癌组织中RhoGDI2与14-3-3σ表达状况与胃癌发生侵袭转移的程度相互关联; RhoGDI2能够调控14-3-3σ的表达程度, 在胃癌侵袭转移过程中, 14-3-3σ很可能发挥着RhoGDI2下游靶点的关键作用. 目前的研究显示, 针对胃癌RhoGDI2功能所开展的研究方兴未艾, 若能够通过各项实验技术手段对RhoGDI2相关的上、下游靶蛋白进行功能检测, 则对找寻那些在胃癌侵袭、转移过程中发挥着抑制作用的干预因子大有帮助, 今后的胃癌靶向生物治疗技术也有望获得全新进展.
RhoGTP酶解离抑制蛋白2(RhoGDI2)是近年来发现的一种肿瘤转移抑制基因. 在不同类型的肿瘤中, RhoGDI2表达水平不同, 也发挥着促进或抑制肿瘤侵袭和转移的不同功用. 本文作者之前的几项研究均检测到RhoGDI2在胃癌中蛋白表达水平升高, 而国内外目前还没有联合检测RhoGDI2和14-3-3σ在胃癌组织中蛋白表达状况及RhoGDI2和14-3-3σ两种基因间相关性的报道.
徐灿, 副教授, 副主任医师, 上海市长海医院; 郑鹏远, 教授, 主任医师, 博士生导师, 郑州大学第五附属医院消化内科
通过基因芯片技术对转染RhoGDI2前后胃癌细胞的差异表达基因展开分析, 进一步研究RhoGDI2调控14-3-3σ的分子机制, 亦可发现RhoGDI2在调节胃癌细胞侵袭转移过程中相关的其他上下游调控基因靶点.
2013年底Kim等发现在RhoGDI2过表达的高转移性SNU-484胃癌细胞株中14-3-3σ mRNA表达下调, 而在RhoGDI2耗竭的MKN-28胃癌细胞株中14-3-3σ mRNA表达上调, 首次揭示14-3-3σ可能是一种受RhoGDI2调控的基因, RhoGDI2或许能导致14-3-3σ表达下调. 但该研究未进一步在组织及蛋白水平对RhoGDI2与14-3-3σ的表达状况展开比较研究.
本文作者在之前研究基础上, 通过本实验首次联合检测胃癌RhoGDI2与14-3-3σ的蛋白表达状况, 并分析其表达相关性. 研究揭示, RhoGDI2在大多数胃癌组织中的蛋白表达水平均较在胃正常黏膜组织中升高, 且与胃癌分化程度、浸润深度、淋巴结转移、远处转移和TNM分期密切相关; 14-3-3σ蛋白表达水平则与之相反. RhoGDI2与14-3-3σ表达呈负相关.
进一步对RhoGDI2的疑似上、下游靶点基因(如14-3-3σ等)及其在肿瘤发生发展过程中的调控机制进行追踪研究, 有望发掘出更多靶点基因, 最终可通过干预、抑制肿瘤侵袭转移过程中的相关靶基因, 为开发防治肿瘤生物性药品提供新的思路方法.
RhoGDI2: 属于RhoGDI家族成员, 能使Rho家族GTP酶的活性下调, 是近年来发现的一种肿瘤转移抑制基因. 在不同类型的肿瘤RhoGDI2表达水平不同, 功能也不同; 14-3-3σ: 是一种肿瘤抑制基因, 在细胞周期调控、细胞程序性凋亡、DNA损伤、细胞分化、细胞增殖中意义重大. 肿瘤中14-3-3σ基因发生突变、丢失、启动子异常甲基化后, 可导致其表达降低或缺失, 从而抑制肿瘤细胞的负调控作用, 促进了细胞的无约束生长.
当今肿瘤转移抑制基因的研究是个新兴热门话题. 目前国内外鲜见关于肿瘤转移抑制基因RhoGDI2及其上下游调控基因的研究报道, 而有关联合检测RhoGDI2及其上、下游基因在胃癌组织中的表达及其相关性的研究报道也甚少. 本作在前期对肿瘤转移抑制基因RhoGDI2胃癌表达的研究基础上, 进一步拓展思路, 联合检测胃癌组织中RhoGDI2及其疑似下游靶点蛋白14-3-3σ的表达状况, 揭示两者表达状况与肿瘤侵袭转移相关, 验证两个基因具有表达相关性, 进一步为后续研究RhoGDI2的其他上、下游基因及其调控机制打下了基础, 也为未来临床开发防治肿瘤药物提供了新的理论支持.
编辑: 于明茜 电编: 都珍珍
| 1. | Smith SC, Theodorescu D. Learning therapeutic lessons from metastasis suppressor proteins. Nat Rev Cancer. 2009;9:253-264. [PubMed] [DOI] |
| 2. | Griner EM, Theodorescu D. The faces and friends of RhoGDI2. Cancer Metastasis Rev. 2012;31:519-528. [PubMed] [DOI] |
| 4. | Tzivion G, Gupta VS, Kaplun L, Balan V. 14-3-3 proteins as potential oncogenes. Semin Cancer Biol. 2006;16:203-213. [PubMed] [DOI] |
| 5. | Kim IK, Park SM, Cho HJ, Baek KE, Nam IK, Park SH, Ryu KJ, Ryu J, Choi J, Hong SC. 14-3-3σ attenuates RhoGDI2-induced cisplatin resistance through activation of Erk and p38 in gastric cancer cells. Oncotarget. 2013;4:2045-2056. [PubMed] [DOI] |
| 6. | Yamashita H, Nishio M, Toyama T, Sugiura H, Zhang Z, Kobayashi S, Iwase H. Coexistence of HER2 over-expression and p53 protein accumulation is a strong prognostic molecular marker in breast cancer. Breast Cancer Res. 2004;6:R24-R30. [PubMed] [DOI] |
| 7. | Gildea JJ, Seraj MJ, Oxford G, Harding MA, Hampton GM, Moskaluk CA, Frierson HF, Conaway MR, Theodorescu D. RhoGDI2 is an invasion and metastasis suppressor gene in human cancer. Cancer Res. 2002;62:6418-6423. [PubMed] |
| 8. | Theodorescu D, Sapinoso LM, Conaway MR, Oxford G, Hampton GM, Frierson HF. Reduced expression of metastasis suppressor RhoGDI2 is associated with decreased survival for patients with bladder cancer. Clin Cancer Res. 2004;10:3800-3806. [PubMed] [DOI] |
| 9. | Niu H, Li H, Xu C, He P. Expression profile of RhoGDI2 in lung cancers and role of RhoGDI2 in lung cancer metastasis. Oncol Rep. 2010;24:465-471. [PubMed] |
| 10. | Ma L, Xu G, Sotnikova A, Szczepanowski M, Giefing M, Krause K, Krams M, Siebert R, Jin J, Klapper W. Loss of expression of LyGDI (ARHGDIB), a rho GDP-dissociation inhibitor, in Hodgkin lymphoma. Br J Haematol. 2007;139:217-223. [PubMed] [DOI] |
| 11. | Zhou JW, Gan NY, Zhang WJ. [The expression of MKP-1 and p-ERK(1/2) in primary ovarian epithelial tumor tissues]. Fen Zi Xi Bao Sheng Wu Xue Bao. 2009;42:224-230. [PubMed] |
| 12. | Stevens EV, Banet N, Onesto C, Plachco A, Alan JK, Nikolaishvili-Feinberg N, Midkiff BR, Kuan PF, Liu J, Miller CR. RhoGDI2 antagonizes ovarian carcinoma growth, invasion and metastasis. Small GTPases. 2011;2:202-210. [PubMed] [DOI] |
| 13. | Cui JW, Li WH, Wang J, Li AL, Li HY, Wang HX, He K, Li W, Kang LH, Yu M. Proteomics-based identification of human acute leukemia antigens that induce humoral immune response. Mol Cell Proteomics. 2005;4:1718-1724. [PubMed] [DOI] |
| 14. | Cho HJ, Baek KE, Park SM, Kim IK, Choi YL, Cho HJ, Nam IK, Hwang EM, Park JY, Han JY. RhoGDI2 expression is associated with tumor growth and malignant progression of gastric cancer. Clin Cancer Res. 2009;15:2612-2619. [PubMed] [DOI] |
| 15. | Jones PA, Baylin SB. The fundamental role of epigenetic events in cancer. Nat Rev Genet. 2002;3:415-428. [PubMed] |
| 16. | Maruyama R, Toyooka S, Toyooka KO, Harada K, Virmani AK, Zöchbauer-Müller S, Farinas AJ, Vakar-Lopez F, Minna JD, Sagalowsky A. Aberrant promoter methylation profile of bladder cancer and its relationship to clinicopathological features. Cancer Res. 2001;61:8659-8663. [PubMed] |
| 17. | Ferl RJ, Manak MS, Reyes MF. The 14-3-3s. Genome Biol. 2002;3:REVIEWS3010. [PubMed] |
| 18. | Hermeking H, Lengauer C, Polyak K, He TC, Zhang L, Thiagalingam S, Kinzler KW, Vogelstein B. 14-3-3 sigma is a p53-regulated inhibitor of G2/M progression. Mol Cell. 1997;1:3-11. [PubMed] [DOI] |
| 19. | Chan TA, Hermeking H, Lengauer C, Kinzler KW, Vogelstein B. 14-3-3Sigma is required to prevent mitotic catastrophe after DNA damage. Nature. 1999;401:616-620. [PubMed] [DOI] |
| 20. | Laronga C, Yang HY, Neal C, Lee MH. Association of the cyclin-dependent kinases and 14-3-3 sigma negatively regulates cell cycle progression. J Biol Chem. 2000;275:23106-23112. [PubMed] [DOI] |
| 21. | Wellenhofer A, Brustmann H. Expression of human telomerase reverse transcriptase in vulvar intraepithelial neoplasia and squamous cell carcinoma: an immunohistochemical study with survivin and p53. Arch Pathol Lab Med. 2012;136:1359-1365. [PubMed] [DOI] |
| 22. | Henao SP, Kusy RP. Evaluation of the frictional resistance of conventional and self-ligating bracket designs using standardized archwires and dental typodonts. Angle Orthod. 2004;74:202-211. [PubMed] |
| 23. | Cheng L, Pan CX, Zhang JT, Zhang S, Kinch MS, Li L, Baldridge LA, Wade C, Hu Z, Koch MO. Loss of 14-3-3sigma in prostate cancer and its precursors. Clin Cancer Res. 2004;10:3064-3068. [PubMed] [DOI] |
| 24. | Li Z, Liu JY, Zhang JT. 14-3-3sigma, the double-edged sword of human cancers. Am J Transl Res. 2009;1:326-340. [PubMed] |
| 25. | Sano T, Shimooka H, Weixa P, Segawa A, Jian Z, Motegi A, Nakayama H, Oyama T, Nakajima T. Immunohistochemical expression of 14-3-3 sigma protein in various histological subtypes of uterine cervical cancers. Pathol Int. 2004;54:743-750. [PubMed] [DOI] |
| 26. | Guweidhi A, Kleeff J, Giese N, El Fitori J, Ketterer K, Giese T, Büchler MW, Korc M, Friess H. Enhanced expression of 14-3-3sigma in pancreatic cancer and its role in cell cycle regulation and apoptosis. Carcinogenesis. 2004;25:1575-1585. [PubMed] [DOI] |
| 27. | Lodygin D, Diebold J, Hermeking H. Prostate cancer is characterized by epigenetic silencing of 14-3-3sigma expression. Oncogene. 2004;23:9034-9041. [PubMed] [DOI] |
| 28. | Schultz J, Ibrahim SM, Vera J, Kunz M. 14-3-3sigma gene silencing during melanoma progression and its role in cell cycle control and cellular senescence. Mol Cancer. 2009;8:53. [PubMed] [DOI] |
| 29. | Liang S, Xu Y, Shen G, Zhao X, Zhou J, Li X, Gong F, Ling B, Fang L, Huang C. Gene expression and methylation status of 14-3-3sigma in human renal carcinoma tissues. IUBMB Life. 2008;60:534-540. [PubMed] [DOI] |
| 30. | Osada H, Tatematsu Y, Yatabe Y, Nakagawa T, Konishi H, Harano T, Tezel E, Takada M, Takahashi T. Frequent and histological type-specific inactivation of 14-3-3sigma in human lung cancers. Oncogene. 2002;21:2418-2424. [PubMed] [DOI] |
| 31. | Suzuki H, Itoh F, Toyota M, Kikuchi T, Kakiuchi H, Imai K. Inactivation of the 14-3-3 sigma gene is associated with 5' CpG island hypermethylation in human cancers. Cancer Res. 2000;60:4353-4357. [PubMed] |
| 32. | Tanaka K, Hatada T, Kobayashi M, Mohri Y, Tonouchi H, Miki C, Nobori T, Kusunoki M. The clinical implication of 14-3-3 sigma expression in primary gastrointestinal malignancy. Int J Oncol. 2004;25:1591-1597. [PubMed] [DOI] |