修回日期: 2015-10-04
接受日期: 2015-10-19
在线出版日期: 2015-11-18
目的: 探讨肠易激综合征(irritable bowel syndrome, IBS)患者结肠黏膜血管活性肠肽受体(vasoactive intestinal peptide receptor, VIPR)、降钙素基因相关肽受体(calcitonin gene-related peptide receptor, CGRPR)的变化, 以及他们在IBS中的可能作用及临床意义.
方法: 对腹泻型IBS(IBS-D)20例、便秘型IBS(IBS-C)8例和正常对照组(control)8例各取乙状结肠黏膜标本, 应用实时荧光定量PCR、免疫组织化学染色法分别检测VIPR、CGRPR.
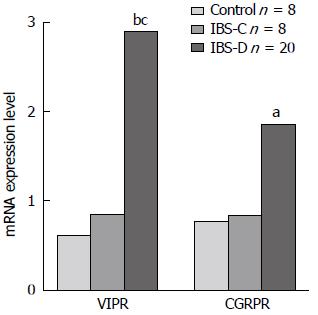
结果: IBS-D组VIPR mRNA 表达水平显著高于IBS-C组和control组(2.89±1.74 vs 0.85±0.6、0.62±0.31, P<0.05), IBS-C组和control组比较差异无统计学意义; IBS-D组CGRPR mRNA表达水平显著高于control组(1.86±1.36 vs 0.77±0.5, P<0.05), IBS-C组和IBS-D及control组比较差异无统计学意义; IBS-D、IBS-C组VIPR表达水平显著高于control组(0.24±0.03、0.17±0.02 vs 0.13±0.01, P<0.05), IBS-D、IBS-C组间有显著差异性(P<0.05); IBS-D、IBS-C组CGRPR表达水平显著高于control组(0.23±0.02、0.18±0.02 vs 0.13±0.02, P<0.05), IBS-D、IBS-C组间有显著差异性(P<0.05).
结论: VIPR、CGRPR可能参与了IBS的病理生理过程. VIPR、CGRPR在肠黏膜中的作用对于进一步研究这些脑肠肽受体在IBS发病机制的病理生理意义具有一定意义.
核心提示: 肠易激综合征(irritable bowel syndrome, IBS)患者肠黏膜脑肠肽受体血管活性肠肽受体(vasoactive intestinal peptide receptor, VIPR)、降钙素基因相关肽受体(calcitonin gene-related peptide receptor, CGRPR)表达水平升高, 尤其以IBS-D为显著, 提示VIPR、CGRPR参与了IBS的发生、发展过程, 且在不同亚型IBS中存在受体表达水平的差异.
引文著录: 罗和生, 聂仁, 张法灿, 梁列新, 张国. 肠易激综合征患者肠黏膜VIPR、CGRPR的变化情况. 世界华人消化杂志 2015; 23(32): 5157-5163
Revised: October 4, 2015
Accepted: October 19, 2015
Published online: November 18, 2015
AIM: To investigate the expression of vasoactive intestinal peptide receptor (VIPR) and calcitonin gene-related peptide receptor (CGRPR) in the colon mucosa of patients with irritable bowel syndrome (IBS), and to study their possible roles.
METHODS: Endoscopic biopsies of the sigmoid colon were collected from 20 patients with diarrhea-predominant IBS (IBS-D), 8 with constipation-predominant IBS (IBS-C) and 8 healthy volunteers (controls). The mRNA expression of VIPR and CGRPR was evaluated by qRT-PCR. The immunohistochemical method was conducted to detect the expression of VIPR and CGRPR proteins. The results of immunohistochemistry were analyzed with Image Pro plus 6.0.
RESULTS: Elevation of the mRNA expression of VIPR was found in IBS-D patients compared with IBS-C patients and controls (2.89 ± 1.74 vs 0.85 ± 0.6, 0.62 ± 0.31, P < 0.05). No significant difference was observed between IBS-C patients and controls. The expression of CGRPR mRNA was elevated in IBS-D patients compared with controls (1.86 ± 1.36 vs 0.77 ± 0.5, P < 0.05), but no significant difference was observed between IBS-C and IBS-D/controls. Compared with healthy controls, significant up-regulation of VIPR and CGRPR was found in IBS-D and IBS-C patients (VIPR: 0.24 ± 0.03, 0.17 ± 0.02 vs 0.13 ± 0.01, P < 0.05; CGRPR: 0.23 ± 0.02, 0.18 ± 0.02 vs 0.13 ± 0.02, P < 0.05), and a significant difference was also observed between IBS-D and IBS-C patients (P < 0.05).
CONCLUSION: VIPR and CGRPR are involved in the pathophysiology of IBS in certain ways. The possible roles of VIPR and CGRPR in the colon suggest that further studies of the alterations of these neuropeptide receptors may be useful in understanding IBS pathophysiology.
- Citation: Luo HS, Nie R, Zhang FC, Liang LX, Zhang G. Expression of colonic vasoactive intestinal peptide receptor and calcitonin gene-related peptide receptor in irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5157-5163
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5157.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5157
肠易激综合征(irritable bowel syndrome, IBS)是一种以腹痛或腹部不适伴排便习惯改变为特征的功能性肠病, 根据其临床症状特点, 可分为腹泻型、便秘型、腹泻便秘交替型和未定型. 其病因和发病机制尚不完全清楚, 目前研究认为, 其发病与胃肠动力异常、内脏敏感性增高、脑肠轴异常、肠道感染与炎症反应、精神心理异常、遗传等因素有关. 有研究[1]表明, 脑肠轴通过分泌脑肠肽, 作用于胃肠道平滑肌细胞的相应受体, 进而调节胃肠道的内脏感觉、分泌及运动功能, 在IBS的发病中起重要作用, 但具体调控机制尚未完全明确[2], 有关脑肠肽受体表达与IBS的关系亦未明确. 本研究通过免疫组织化学染色法、实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)对IBS 患者及正常人结肠黏膜血管活性肠肽受体(vasoactive intestinal peptide receptor, VIPR)、降钙素基因相关肽受体(calcitonin gene-related peptide receptor, CGRPR)的表达进行研究, 从分子生物学水平探讨这些脑肠肽受体在IBS患者的结肠黏膜的变化, 从而为进一步了解IBS的病理生理机制提供一定的实验依据.
选择2012-05/2012-11到广西壮族自治区人民医院门诊及住院部就诊的IBS患者28例, 其中腹泻型IBS组(IBS-D)20例, 便秘型IBS组8例, 男10例, 女18例, 年龄24-64岁, 平均38岁; 正常对照组8例, 男3例, 女5例, 年龄30-60岁, 平均45.9岁, 均为健康体检人员. 全部IBS患者均符合罗马Ⅲ诊断标准[3,4]. 所有纳入研究的对象均需除外严重的系统疾病、消化系器质性疾病、过敏性疾病等, 无近期服药史, 对照组近期无消化系及神经系统症状和体征、无近期服药史. 所有纳入研究的对象均告知相关事项, 并签署知情同意书. VIPR兔抗人多克隆抗体(博奥森, 北京), CGRPR兔抗人多克隆抗体(博奥森, 北京), SP-9000免疫组织化学试剂盒(中杉金桥, 北京); DAB显色试剂盒(中杉金桥, 北京); 逆转录试剂盒(Takra); 实时荧光定量PCR试剂盒(天根); Image Pro-plus图像分析软件.
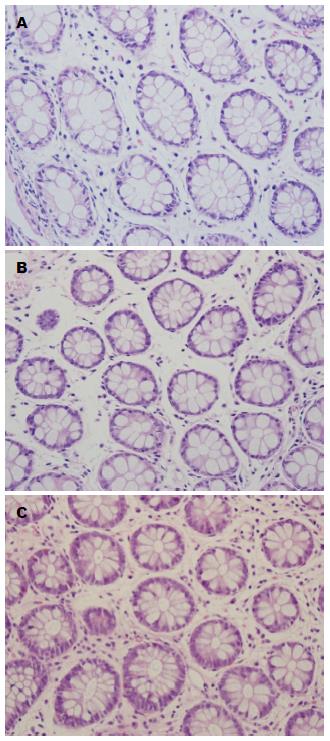
1.2.1 标本收集: 行结肠镜检查退镜时在距肛门外口约20 cm处(即乙状结肠直乙交界处)钳取5块黏膜组织, 2块中性甲醛固定, 石蜡包埋成蜡块后切片, 用于常规病理学检查和免疫组织化学研究, 3块立即液氮冷冻待作qRT-PCR检测. 病理组织学检查: 切片做苏木精-伊红(HE)染色, 观察黏膜层结构及炎症细胞浸润情况[5].
1.2.2 免疫组织化学染色法: 结肠镜下取肠黏膜组织, 石蜡包埋后切片, 常规脱蜡至水; 在枸橼酸钠溶液中高压修复2 min, 3%H2O2室温下避光孵育10 min, PBS洗3次×3 min; 正常山羊血清工作. 液封闭组织15 min, 倾去, 勿洗; 加入一抗, 于37 ℃湿盒中恒温孵育2.5 h, PBS洗3次×3 min; 加入二抗工作液, 室温孵育10 min, PBS洗3次×3 min; 辣根酶标记链霉卵白素工作液室温孵育10 min, PBS洗3次×3 min; 新鲜配制的DAB工作液显色约5-10 min(显微镜下观察显色结果, 适时终止); 苏木素复染3 min; 10 mL/L的乙醇盐酸溶液分化3 s; 氨水返蓝5 s; 脱水、透明、封片, 置于光镜下观察. 以上操作步骤严格地按照所使用的试剂盒的说明书进行. 阳性对照采用大鼠肝脏切片, 阴性对照以PBS代替一抗.
1.2.3 qRT-PCR方法: 肠黏膜组织放入1 mL Tripure工作液中, 冰上研磨, 按说明书步骤提取总RNA, Nanodrop测量RNA浓度, 使用Takara逆转录试剂盒按照说明书进行逆转录, 逆转录产物cDNA用于进行qRT-PCR, VIPR上游引物: 5'-GCCTACCTGCTCTCCAAGTC-3', 下游引物: 5'-TTGATTCCTGTTGCTTCCAC-3'; CGRPR上游引物: 5'-CTCTTCTCCACACCGTCACC-3', 下游引物: 5'-TATGCTGGGTCCTCTTCGTC-3'; GAPDH; 上游引物: 5'-AGAAGGCTGGGGCTCATTTG-3',下游引物: 5'-AGGGGCCATCCACAGTCTTC-3'. qRT-PCR反应总体积为20 µL, 内含有cDNA 2 µL, 2×SuperReal PreMix Plus 10 µL, 50×ROX Reference Dye 0.4 µL, ddH2O 6.4 µL, 上下游引物(浓度为10 µmol/L)共1.2 µL. 反应条件: 95 ℃ 15 min; 95 ℃ 10 s, 60 ℃ 32 s, 共40个循环; 60 ℃ 32 s, 采集荧光信号. 使用2-△△Ct法计算腹泻组、便秘组mRNA循环数相对正常组的比值.
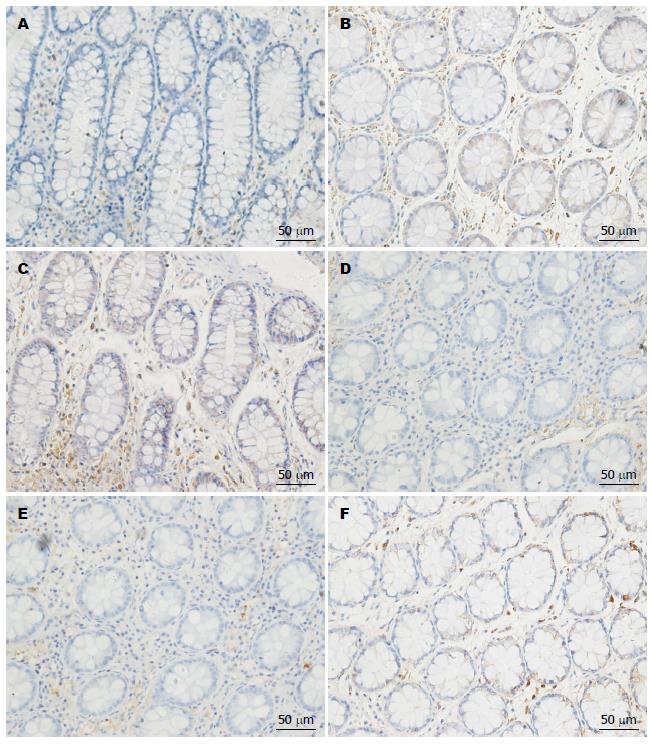
1.2.4 免疫组织化学染色定量检测: 于200倍高倍镜下观察, 每张切片随机选择3个不同视野, 视野中深棕黄色的颗粒状、点状或短细线状物质为检测蛋白的阳性表达, 同一条件下拍摄照片后以Image Pro-plus软件对图片中阳性表达处进行平均光密度(OD)的测定.
统计学处理 采用SPSS16.0统计软件; 计量资料以mean±SD表示, 组间比较采用非参数检验(Kruscal-Wallis H检验)和方差分析. P<0.05为差异有统计学意义.
HE染色显示肠黏膜组织结构正常, IBS-D组、IBS-C组及正常组中均可见少量炎症细胞浸润(图1).
IBS-D、IBS-C组VIPR、CGRPR表达水平显著高于正常对照组, IBS-D、IBS-C组间有显著差异性(P<0.05)(表1, 图2).
IBS-D组VIPR mRNA 表达水平显著高于IBS-C组和正常对照组, IBS-C组和正常对照组比较差异无统计学意义; IBS-D组CGRPR mRNA表达水平显著高于正常对照组, IBS-C组和IBS-D组比较无组间差异性, IBS-C组和正常对照组比较差异无统计学意义(图3).
IBS是以腹痛或腹部不适, 伴排便习惯改变和大便性状异常, 持续或间歇发作而缺乏形态学改变为主要特点的功能性肠病. 近年来脑肠轴异常介导IBS的发病机制受到学界的关注. 脑肠肽存在于中枢及肠道神经系统, 是由神经细胞等产生的一种小分子多肽类, 具有调节胃肠运动、分泌吸收、内脏感觉等功能, 并受情绪影响[6]. 脑肠肽作用的靶部位是胃肠道平滑肌细胞的特异性受体, 如VIPR、CGRPR等通过这些受体调控及受体后信息传递, 产生一定的生物学效应, 从而影响胃肠道的内脏感觉、分泌、运动功能. 神经肽受体在人体内脏的不同部位均有所分布, 所起到的生物学功能也不尽相同. 但目前这些神经肽受体与IBS的关系的研究甚少, 神经肽受体如何参与IBS的病理生理过程仍尚未清楚.
VIP是调节肠道运动、分泌等功能的重要神经肽. 存在于许多不同的肠神经元亚型, 包括中间神经元, 抑制运动神经元, 促进分泌神经元[7]. 李兆申等[8]研究发现IBS-D、IBS-C患者结肠黏膜VIP含量显著高于正常对照组. 国外相关研究[9,10]认为VIP与IBS患者的腹痛、腹泻、便秘等症状相关. VIP主要通过激活两个G蛋白偶联受体亚型: VIPR1/VIPR2发挥作用[11-13]. VIP可以直接刺激黏膜表达VIPR1[14]. VIPR是介导VIP信息传递的靶标蛋白分子, VIP信息传递所引起的生物效应不仅取决于组织中含量的高低, 而且与VIPR在靶细胞表面的表达量有着直接关系[15]. 研究[16]表明, VIP与相应受体结合后产生偶联放大效应作用于平滑肌使之舒张. 豚鼠回肠和结肠的肌肉收缩性研究表明, VIP通过激活平滑肌上VIPR2放松肌肉[17,18]以及刺激纵行肌神经源性收缩[19,20]. 大鼠结肠动力性研究表明VIP和VIPR1参与其结肠动力调控机制[21]. 有研究[22]报道通过VIPR1拮抗剂pg97-269去验证存在于猪空肠的这种受体在调控肌肉收缩和促进分泌的作用, 结果发现VIP通过VIPR1介导兴奋性运动神经元刺激释放乙酰胆碱调控纵肌收缩, 还发现VIP激活胆碱能促分泌神经元上的VIPR1. VIPR1是VIPR家族的一种亚型, 为G蛋白偶联受体, 与VIP具有高亲和力. 有研究[23]报道, VIP与VIPR1结合后, 通过胞内cAMP信号通路激活结肠黏膜上水通道蛋白(AQPs), 增加膜通透性, 大量水分子进入肠腔导致腹泻. Wang等[24]通过IBS-D结肠组织中AQP8 mRNA表达变化的研究发现结肠AQP8 mRNA表达水平下降, 提示随着结肠AQP8表达的减少, 结肠吸收功能发生障碍, 水吸收量减少, 导致粪便稀薄行成腹泻. 王德山等[25]研究发现IBS-D大鼠血清、结肠组织中VIP含量增加、VIPR1 mRNA表达水平上调, 提示VIPR的表达水平变化参与了VIP的病理生理效应. 我们的研究结果发现, 与正常对照组比较, IBS-D、IBS-C组VIPR蛋白表达水平显著增高, 且IBS-D组VIPR表达水平高于IBS-C; 同时, 与正常对照组、IBS-C组比较, IBS-D组VIPR1 mRNA表达水平明显上调, 提示VIPR1表达上调与IBS密切相关, 并且VIPR1介导的VIP信息传递在不同亚型IBS的作用机制可能不一致, 而VIPR1如何通过介导VIP信息传递从而导致IBS的发生、发展仍有待进一步的研究.
CGRP是一种脑肠肽, 参与调节胃肠道血液灌注、胃肠分泌以及运动功能, 还具有调节免疫反应的作用. 在中枢神经系统CGRP参与疼痛、知觉和中枢敏感化调节[26]. 牛庆慧等[27]发现腹泻性IBS患者回盲部和乙状结肠部位CGRP阳性神经肽纤维强度明显增强, 便秘型、混合型及未定型IBS患者与对照组比较无明显增强. CGRP功能主要由其受体介导, CGRPR属于G蛋白介导的受体超家族, 有研究报道CGRP与CGRPR结合后, 经G蛋白介导, 激活细胞内腺苷酸环化酶, 使环磷酸腺苷(cAMP)水平增加, 参与气道的神经性炎症反应、血管扩张、通透性增加[28]. 有研究在老鼠的硬脑膜的肥大细胞发现存在CGRPR, 提示CGRPR可能参与肥大细胞脱颗粒和炎症反应, 尽管这些发现在人类尚未复制[29]. 我们的研究发现, 与正常对照组比较, IBS-D、IBS-C组CGRPR的蛋白表达水平显著增高, 且IBS-D组CGRPR表达水平高于IBS-C, 同时, CGRPR mRNA表达水平仅在IBS-D组中上调, 而IBS-D组与IBS-C组无差异. 前期研究也发现IBS-D患者结肠黏膜中CGRP表达水平显著高于正常对照组, 与IBS-C及正常对照组相比较CGRP的表达均有显著性差异, IBS-D患者的肠黏膜CGRP水平与排稀便显著相关[30]. 因此, CGRPR表达上调与IBS密切相关, 尤其可能与IBS-D的发生或发展密切相关.
在本研究, 我们发现一个有趣的事情, IBS患者VIPR、CGRPR mRNA和蛋白质的表达趋势存在一定差异, 提示受体表达后的结构与功能可能是决定这些神经肽病理生理功能的主要因素.
总之, IBS患者肠黏膜脑肠肽受体VIPR、CGRPR表达水平升高, 尤其以IBS-D为显著, 提示VIPR、CGRPR参与了IBS的发生、发展过程, 且在不同亚型IBS中存在受体表达水平的差异. 但本研究仅是一个初步的研究、且研究样本量小, 同时, 受体后的调控机制仍未阐明, 因此, 今后需更广泛、深入的研究以进一步了解脑肠肽在IBS发病机制的病理生理意义.
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的功能性肠病. 近年来脑肠轴异常介导IBS的发病机制受到学界的关注. 脑肠轴通过分泌脑肠肽, 作用于胃肠道平滑肌细胞的相应受体, 进而调节胃肠道的内脏感觉、分泌及运动功能, 在IBS的发病中起重要作用, 但具体调控机制尚未完全明确, 有关脑肠肽受体表达与IBS的关系亦未明确.
李晓波, 教授, 上海交通大学药学院
血管活性肠肽受体(vasoactive intestinal peptide receptor, VIPR)、降钙素基因相关肽受体(calcitonin gene-related peptide receptor, CGRPR)是两种常见的脑肠肽受体, 但肠道黏膜中VIPR、CGRPR表达与IBS的关系的相关研究较少, 其如何参与IBS的病理生理过程仍尚未清楚.
王德山等研究发现IBS-D大鼠血清、结肠组织中VIP含量增加、VIPR1 mRNA 表达水平上调, 提示VIPR的表达水平变化参与了VIP的病理生理效应.
本研究通过免疫组织化学染色法、实时荧光定量对IBS患者及正常人结肠黏膜VIPR、CGRPR的表达进行研究, 从分子生物学水平探讨这些脑肠肽受体在IBS患者的结肠黏膜的变化, 从而为进一步了解IBS的病理生理机制提供一定的实验依据.
IBS患者肠黏膜脑肠肽受体VIPR、CGRPR表达水平升高, 尤其以IBS-D为显著. 因此, 通过检测肠黏膜组织中这些脑肠肽受体表达水平, 可以有助于IBS的诊断, 并为治疗IBS提供一定的靶向.
水通道蛋白(AQPs): 普遍存在的膜通道蛋白, 其所介导的自由水快速被动的跨生物膜转运是水进出细胞的主要途径.
本文采用免疫组织化学和qRT-PCR方法对IBS患者及正常人结肠黏膜VIPR、CGRPR的表达进行研究, 研究结果对于进一步研究脑肠肽在IBS发病机制的病理生理意义具有一定价值.
编辑: 郭鹏 电编: 闫晋利
| 2. | 李 宁宁, 方 秀才. 脑-肠轴在肠易激综合征发病中的作用. 胃肠病学和肝病学杂志. 2013;22:163-166. |
| 4. | Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology. 2006;130:1480-1491. [PubMed] [DOI] |
| 5. | 张 利荣. 腹泻为主的IBS患者空肠肥大细胞功能存在数量异常. 胃肠病学和肝病学杂志. 2007;16:99-99. |
| 7. | Furness JB. Types of neurons in the enteric nervous system. J Auton Nerv Syst. 2000;81:87-96. [PubMed] [DOI] |
| 9. | Morise K, Furusawa A, Yamamoto H, Saito H. [Role of gut hormones in irritable bowel syndrome]. Nihon Rinsho. 1992;50:2697-2702. [PubMed] |
| 10. | Simrén M, Abrahamsson H, Björnsson ES. An exaggerated sensory component of the gastrocolonic response in patients with irritable bowel syndrome. Gut. 2001;48:20-27. [PubMed] [DOI] |
| 11. | Dickson L, Finlayson K. VPAC and PAC receptors: From ligands to function. Pharmacol Ther. 2009;121:294-316. [PubMed] [DOI] |
| 12. | Harmar AJ, Arimura A, Gozes I, Journot L, Laburthe M, Pisegna JR, Rawlings SR, Robberecht P, Said SI, Sreedharan SP. International Union of Pharmacology. XVIII. Nomenclature of receptors for vasoactive intestinal peptide and pituitary adenylate cyclase-activating polypeptide. Pharmacol Rev. 1998;50:265-270. [PubMed] |
| 13. | Laburthe M, Couvineau A, Marie JC. VPAC receptors for VIP and PACAP. Receptors Channels. 2002;8:137-153. [PubMed] [DOI] |
| 14. | Reddix R, Kuhawara A, Wallace L, Cooke HJ. Vasoactive intestinal polypeptide: a transmitter in submucous neurons mediating secretion in guinea pig distal colon. J Pharmacol Exp Ther. 1994;269:1124-1129. [PubMed] |
| 15. | Itoh A, Tsujikawa T, Fujiyama Y, Bamba T. Enhancement of aquaporin-3 by vasoactive intestinal polypeptide in a human colonic epithelial cell line. J Gastroenterol Hepatol. 2003;18:203-210. [PubMed] [DOI] |
| 17. | Harmar AJ, Sheward WJ, Morrison CF, Waser B, Gugger M, Reubi JC. Distribution of the VPAC2 receptor in peripheral tissues of the mouse. Endocrinology. 2004;145:1203-1210. [PubMed] [DOI] |
| 18. | Robberecht P, De Neef P, Lefebvre RA. Influence of selective VIP receptor agonists in the rat gastric fundus. Eur J Pharmacol. 1998;359:77-80. [PubMed] [DOI] |
| 19. | Kusunoki M, Tsai LH, Taniyama K, Tanaka C. Vasoactive intestinal polypeptide provokes acetylcholine release from the myenteric plexus. Am J Physiol. 1986;251:G51-G55. [PubMed] |
| 20. | Katsoulis S, Schmidt WE, Clemens A, Schwörer H, Creutzfeldt W. Vasoactive intestinal polypeptide induces neurogenic contraction of guinea-pig ileum. Involvement of acetylcholine and substance P. Regul Pept. 1992;38:155-164. [PubMed] [DOI] |
| 21. | Shi XZ, Sarna SK. Gene therapy of Cav1.2 channel with VIP and VIP receptor agonists and antagonists: a novel approach to designing promotility and antimotility agents. Am J Physiol Gastrointest Liver Physiol. 2008;295:G187-G196. [PubMed] [DOI] |
| 22. | Fung C, Unterweger P, Parry LJ, Bornstein JC, Foong JP. VPAC1 receptors regulate intestinal secretion and muscle contractility by activating cholinergic neurons in guinea pig jejunum. Am J Physiol Gastrointest Liver Physiol. 2014;306:G748-G758. [PubMed] [DOI] |
| 24. | Wang JP, Hou XH. Expression of aquaporin 8 in colonic epithelium with diarrhoea-predominant irritable bowel syndrome. Chin Med J (Engl). 2007;120:313-316. [PubMed] |
| 26. | Powell KJ, Ma W, Sutak M, Doods H, Quirion R, Jhamandas K. Blockade and reversal of spinal morphine tolerance by peptide and non-peptide calcitonin gene-related peptide receptor antagonists. Br J Pharmacol. 2000;131:875-884. [PubMed] [DOI] |
| 28. | Martin JG, Xu LJ, Toh MY, Olivenstein R, Powell WS. Leukotrienes in bile during the early and the late airway responses after allergen challenge of sensitized rats. Am Rev Respir Dis. 1993;147:104-110. [PubMed] [DOI] |