修回日期: 2015-09-24
接受日期: 2015-10-13
在线出版日期: 2015-11-18
目的: 探讨浮舰蛋白-1(flotillin-1, FLOT1)在胃癌组织中的表达水平及其与预后相关的临床意义.
方法: 分别运用荧光定量PCR和Western blot方法检测16组新鲜胃癌及癌旁组织中FLOT1 RNA和FLOT1蛋白的表达情况; 采用免疫组织化学法检测187例胃癌及癌旁石蜡组织中FLOT1的表达水平. 分析FLOT1蛋白的表达与胃癌患者临床病理特征及预后的关系.
结果: FLOT1 RNA和FLOT1蛋白在新鲜胃癌组织中均呈高表达(13/16; 12/16). FLOT1在胃癌组织中的阳性表达率高于癌旁正常组织(92.35% vs 26.67%, P<0.05); FLOT1蛋白的表达与胃癌患者的性别、年龄、肿瘤大小、肿瘤分化程度和肿瘤位置均无关(P>0.05), 仅与肿瘤浸润深度(P = 0.000)、肿瘤淋巴结转移(P = 0.000)、肿瘤远处转移(P = 0.000)和肿瘤AJCC临床分期(P = 0.016)有关. FLOT1高表达预示患者预后较差.
结论: FLOT1过表达可能与胃癌的侵袭转移及预后密切相关, 有望成为胃癌的早期诊断指标和治疗靶点.
核心提示: 目前肿瘤的TNM分期尚不能很准确的判断患者的预后, 本研究采用荧光定量PCR、Western blot和免疫组织化学法检测胃癌组织浮舰蛋白-1(flotillin-1, FLOT1)的表达水平. 并分析FLOT1与临床病理、生存预后的关系, 结果表明FLOT1高表达可能与胃癌的侵袭转移及预后密切相关.
引文著录: 曹传林, 李太原, 曹超, 熊强强, 江群广, 刘东宁. FLOT1蛋白在胃癌组织中的表达及临床意义. 世界华人消化杂志 2015; 23(32): 5141-5147
Revised: September 24, 2015
Accepted: October 13, 2015
Published online: November 18, 2015
AIM: To investigate the expression of flotillin-1 (FLOT1) protein in gastric cancer and analyze their correlation with pathological characteristics and prognosis.
METHODS: We detected the FLOT1 expression in fresh gastric cancer samples and matched adjacent noncancerous tissue samples by real-time florescence quantitative PCR (qRT-PCR) (n = 16) and Western blot analysis (n = 16). Additionally, immunohistochemistry was performed to examine FLOT1 protein expression in paraffin-embedded gastric carcinoma tissues and matched normal specimens from 187 gastric cancer patients. Statistical analyses were applied to evaluate the associations of FLOT1 expression with clinical parameters and prognosis.
RESULTS: FLOT1 mRNA and protein levels were evidently up-regulated in gastric cancer tissues compared with adjacent non-cancerous tissue samples (13/16; 12/16). FLOT1 expression in gastric cancer tissues was significantly higher than that in corresponding adjacent normal tissues (92.35% vs 26.67%, P < 0.05). Expression of FLOT1 in tumor tissue was not significantly associated with gender, age, tumor size, differentiation status or tumor location. However, elevated FLOT1 expression was strongly correlated with depth of invasion (P = 0.000), lymph node metastasis (P = 0.000), distant metastasis (P = 0.000), and AJCC stage (P = 0.016). Elevated FLOT1 cases had a poor prognosis.
CONCLUSION: FLOT1 expression is significantly correlated with depth of invasion and distant metastasis. FLOT1 may be used as an early diagnostic marker and therapeutic target for gastric carcinoma.
- Citation: Cao CL, Li TY, Cao C, Xiong QQ, Jiang QG, Liu DN. Clinical significance of flotillin-1 overexpression in human gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5141-5147
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5141.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5141
胃癌属高发肿瘤, 近年来胃癌的发病有低龄化趋势[1], 但其早期诊断、治疗及预后仍不理想, 因而为胃癌的早期诊断及治疗寻找有效的生物学标志物成为当前的研究焦点. 最近研究表明, 浮舰蛋白-1(flotillin-1, FLOT1)在乳腺癌[2]和食管癌[3]中表达均上调并与其临床病理特征密切相关, 而且FLOT1高表达的乳腺癌和食管癌患者预后较差. 国内外现在对FLOT1在胃癌方面的报道甚少, 本研究采用免疫组织化学、Western blot和实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)方法检测FLOT1在胃癌及癌旁组织中的表达情况, 并初步探讨其表达与临床病理特征及预后的关系.
收集2015-05在南昌大学第一附属医院行手术患者的16例新鲜胃癌及癌旁组织(距癌灶距离>5 cm). 选择南昌大学第一附属医院病理科2007-01/2008-06经手术切除, 并且病理诊断确诊为胃癌的石蜡包埋组织200例, 所选病例均为首次发现, 术前均未行放化疗. 最后获得完整随访资料157例, 其中男85例, 女72例, 年龄27-89岁, 平均年龄63.25岁±1.21岁. 另外选取30例癌旁组织, 有两位高年资经验丰富的病理医师指导收集病理标本和阅片. 上述标本采集均由患者本人知情同意并通过医院伦理委员会审核通过. 蛋白提取试剂盒(碧云天), RNA提取试剂盒(碧云天), FLOT1单克隆抗体(Abnova公司), qRT-PCR分析仪9700(美国ABI公司), FluorChem FC2凝胶成像分析系统(美国Alpha Innotech公司).
1.2.1 qRT-PCR检测胃癌组织中FLOT1 mRNA的表达: 采用TRIzol试剂提取胃癌及癌旁组织中总RNA. 采用紫外分光光度计测定浓度. 首先将TRIzol法获得的RNA进行逆转录成cDNA. 逆转录的反应条件为: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min. 将cDNA稀释100倍, 参20 μL反应体系: SYBR 10 μL、FLOT1上下游引物各1 μL、cDNA 6 μL及H2O2 2 μL. 反应条件: 95 ℃ 10 min, 随后95 ℃ 15 s, 59 ℃ 60 s, 40个循环. 根据获得的Ct值按统计学分析FLOT1在胃癌及癌旁组织中FLOT1 mRNA的表达情况. GAPDH基因作为内参检测.
1.2.2 Western blot检测胃癌组织中FLOT1蛋白的表达: 提取组织总蛋白, Bradford比色法测定蛋白浓度. 取40 μg变性蛋白质加入十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)80 V进行电泳, 30 min后指示剂进入分离胶, 电压调制120 V继续电泳1 h, 电转膜仪转移到PVDF膜上. 5%脱脂奶粉封闭2 h后滴加兔抗人FLOT1单克隆抗体(1:200)和鼠抗人GAPDH单克隆抗体(1:800), 在4 ℃下孵育过夜. 用T-TBS洗涤液洗膜后, 加入HRP标记的抗兔、抗鼠二抗(1:2000)室温下孵育60 min. 洗涤后采用ECL化学发光显色试剂盒反应, 在暗室中压片, 然后显影、定影; 扫描仪扫描显色带.
1.2.3 EliVisionTM plus免疫组织化学染色检测: 石蜡切片脱蜡、水化, PBS冲洗3次×3 min; 高温高压抗原修复; 加3%H2O2溶液, 室温下孵育10 min, 以阻断内源性过氧化物酶; PBS冲洗3次×3 min; 加第一抗体(1:400), 室温下孵育60 min; PBS冲洗3次×5 min; 加聚合物增强剂(试剂A), 室温下孵育20 min; PBS冲洗3次×3 min; 加酶标抗鼠聚合物(试剂B), 室温下孵育30 min; PBS冲洗3次×3 min; 加新配制的DAB显色液, 显微镜下观察3-10 min, 阳性显色为棕黄色; 自来水冲洗, 苏木素复染, 0.1%盐酸分化, 自来水冲洗, PBS冲洗返蓝; 梯度酒精脱水干燥中性树脂封片. 实验中以胃癌标本做阳性对照, PBS代替FLOT1抗体作为阴性对照.
1.2.4 结果判定: 免疫组织化学采用Greenspan半定量法对细胞染色强度及阳性细胞百分率进行评分[4-6]. 细胞不着色为0分, 基本不着色(淡黄色)为1分, 中等着色(棕黄色)为2分, 强着色(棕褐色)为3分. 着色细胞占计数细胞百分比率0者, 记0分, <10%为1分, 10%-50%为2分, >50%为3分. 将每张切片着色程度得分与着色细胞百分率得分相乘, 既得阳性系数. 阳性系数<4分定义为FLOT1低表达, ≥4分定义为FLOT1高表达.
1.2.5 生存分析: 根据对所有患者随访结果进行生存时间或无瘤生存时间的分析, 得出不同FLOT1表达患者的生存时间或者无瘤生存时间的差异和生存曲线. 随访采用电话随访或者复查方式进行. 随访截止时间为2015-03.
统计学处理 采用SPSS17.0统计软件包进行统计分析, 有序分类计数资料之间的比较以秩和检验, 无序多分类计数资料之间的比较以χ2检验或Fisher确切概率法, 相关性分析采用Spearman相关分析, 生存分析采用Kaplan-Meier、Log-rank检验, P<0.05为差异有统计学意义.
利用qRT-PCR检测16例胃癌及癌旁组织FLOT1 mRNA的表达, FLOT1 mRNA在胃癌组织中的相对表达量3.12±0.10, 而在癌旁组织中相对表达量0.81±0.11, 差别具有统计学意义(P<0.05).
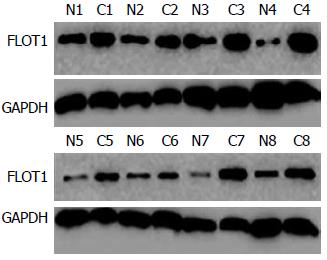
Western blot检测16例胃癌及癌旁组织, FLOT1在胃癌组织中的相对表达量0.82±0.15, 癌旁组织相对表达量0.23±0.11, 差别具有统计学意义(P<0.05, 图1).
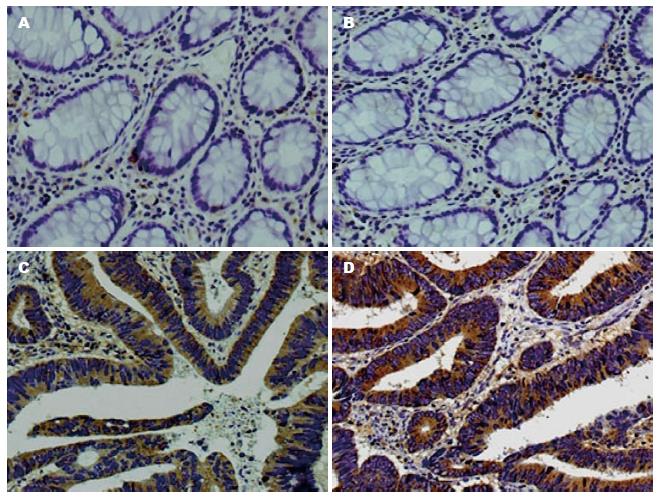
免疫组织化学染色显示, 在157例胃癌和30例癌旁组织中, 大部分均检测到有FLOT1表达, FLOT1在胞膜胞质均有表达(图2), 157例胃癌组织中FLOT1阳性率92.35%(145/157), 癌旁组织中FLOT1阳性率26.67%(8/30). FLOT1蛋白在胃癌中高表达107例(68.15%), 低表达50例(31.85%)(表1, 图2).
| 项目 | n | FLOT1 | P值 | |
| 低表达 | 高表达 | |||
| 性别 | 0.734 | |||
| 男 | 85 | 26 | 59 | |
| 女 | 72 | 24 | 48 | |
| 年龄(岁) | 0.605 | |||
| <55 | 59 | 23 | 46 | |
| ≥55 | 98 | 27 | 61 | |
| 肿瘤位置 | 0.531 | |||
| 贲门部 | 31 | 9 | 22 | |
| 胃体部 | 47 | 15 | 32 | |
| 幽门部 | 49 | 18 | 31 | |
| 全胃 | 30 | 8 | 22 | |
| 肿瘤大小(cm) | 0.391 | |||
| <5 | 70 | 25 | 45 | |
| ≥5 | 87 | 25 | 62 | |
| 分化程度 | 0.152 | |||
| 高分化 | 56 | 20 | 36 | |
| 中分化 | 47 | 17 | 30 | |
| 低/未分化 | 54 | 13 | 41 | |
| 浸润深度(T) | 0.000 | |||
| T1+T2 | 56 | 34 | 22 | |
| T3+T4 | 101 | 16 | 85 | |
| 淋巴结转移(N) | 0.000 | |||
| N0 | 45 | 39 | 6 | |
| N1-3 | 112 | 11 | 101 | |
| 远处转移(M) | 0.000 | |||
| M0 | 126 | 54 | 82 | |
| M1 | 31 | 6 | 25 | |
| 临床分期(AJCC) | 0.016 | |||
| Ⅰ+Ⅱ | 68 | 31 | 37 | |
| Ⅲ+Ⅳ | 89 | 19 | 70 | |
从FLOT1的表达与临床特征关系的研究中可以看出: FLOT1的表达与年龄、性别、肿瘤大小、肿瘤分化程度和肿瘤位置均无相关(P>0.05), 而与肿瘤浸润深度、淋巴结转移情况、远处转移情况(包括肝、肺、横结肠、胰腺、腹膜和骨转移)和AJCC临床分期有关(P<0.05)(表1).
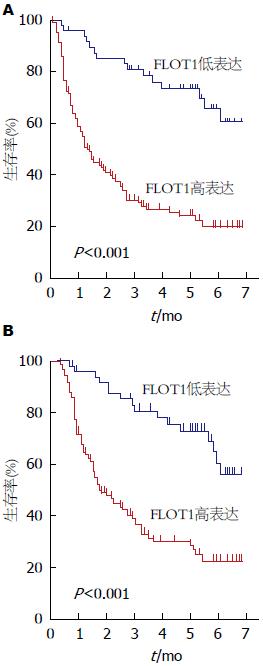
FLOT1高表达胃癌患者中位总生存时间20.00 mo, 低表达组中位总生存时间64.00 mo; FLOT1高表达胃癌患者中位无瘤生存时间15.00 mo, 低表达组中位无瘤生存时间60.21 mo. 不同FLOT1表达程度患者的无瘤生存时间和总生存时间均存在显著性差异(P<0.05)(表2, 图3).
| 时间 | FLOT1 | P值 | |
| 低表达 | 高表达 | ||
| 无瘤生存时间 | 60.21±4.52 | 15.00±2.15 | <0.05 |
| 总生存时间 | 64.00±3.89 | 20.00±2.54 | <0.05 |
胃癌是全球最常见的恶性肿瘤之一, 死亡率居所有肿瘤第2位, 极大地危害人类的健康[7,8]. 根据2008年癌症统计结果, 我国大陆地区人群胃癌发病率和死亡率均仅次于肺癌, 位居第2位[9,10], 高于世界平均水平[11,12]. 大多数患者在确诊时已属中晚期, 治疗效果不佳, 预后很差. 因此, 运用现代生物学技术探寻胃癌早期诊断和治疗分子标志物是目前胃癌基础研究热点之一, 也是未来转化医学研究的重点[13-16].
脂筏(lipid raft)是细胞质膜上富含胆固醇和鞘磷脂的微结构域, 其内聚集着包括表皮生长因子受体(epidermal growth factor receptor, EFGR)等大量蛋白质分子. 脂筏可以通过动态聚集、募集及靶向运输作用为蛋白分子提供功能平台并参与细胞信号的转导[17-19]. 脂筏中的蛋白质大致分为两种: 信号转导相关蛋白和结构蛋白, 其中FLOT1是脂筏的主要结构蛋白之一. 大量研究[20-25]发现FLOT1参与细胞信号传导, 细胞内吞和细胞黏附. 近来研究[2,3,26-29]发现FLOT1与肿瘤的发生发展密切相关. Li等[30]在舌癌中证实FLOT1呈高表达, 且与患者的预后密切相关. 另外, FLOT1在乳腺癌组织中表达也明显增强, 与临床病理特征如肿瘤的分期、远处转移等显著相关; 进一步体外体内功能实验发现, 调低FLOT1的表达可通过激活Akt信号通路促进FOXO3a的表达上调, 从而抑制乳腺癌细胞的增殖[1].
本实验通过qRT-PCR、Western blot和免疫组织化学方法检测临床胃癌及癌旁组织中FLOT1的表达情况, 发现FLOT1在胃癌组织中呈明显高表达, 这与国外文献报道[31]相符. 通过对患者临床资料的分析可知FLOT1的表达与胃癌患者的年龄、性别、肿瘤大小、肿瘤位置均无相关. Song等[3]研究发现FLOT1与食管癌的分化程度有关, 而本研究发现FLOT1的表达与胃癌分化程度无关, 提示FLOT1在不同恶性肿瘤的发生发展中所发挥的作用不同. 进一步分析发现FLOT1高表达与肿瘤浸润深度、淋巴结转移阳性率、远处转移阳性率和AJCC临床分期呈正相关, 提示FLOT1蛋白高表达可能与胃癌的侵袭转移密切相关, 这与FLOT1在其他恶性肿瘤中的作用相似[3,30]. 然而, FLOT1在胃癌中的作用机制还不清楚, 我们将在下一步的实验中探讨FLOT1的上游调控基因、下游调控基因及可能参与调控的信号通路.
总之, 本研究结果提示: FLOT1在大部分胃癌中高表达, 而且与胃癌的侵袭转移密切相关, 很可能是胃癌的一个新的标志物, 为胃癌的早期诊断和治疗提供新的靶点.
胃癌是世界上常见的恶性肿瘤之一. 浮舰蛋白(flotillin, FLOT)在1997年被Schulte等首先报道, 同年, Bickel等在筛选脂筏新的标记分子时, 从鼠肺组织膜提取物中分离到一类蛋白, 将其命名为FLOT. FLOT分为FLOT1和FLOT2, FLOT1是最近发现与多种肿瘤的发生发展密切相关. 因此, 研究FLOT1在胃癌中的作用机制十分重要.
赵青川, 主任医师, 教授, 西京医院消化外科
FLOT1蛋白在体内广泛表达, 参与肿瘤的生成、浸润、转移和预后等过程. 因此胃癌与FLOT1的关系值得进一步研究. FLOT1有望成为胃癌的早期诊断指标和治疗靶点.
Song等研究认为, FLOT1的过表达与食管癌的分化程度、TNM分期及淋巴结转移相关, 而FLOT1高表达的患者预后明显较低表达者差. Lin等研究发现调低FLOT1的表达可以抑制乳腺癌细胞的增殖.
本研究在蛋白及mRNA水平上检测胃癌及癌旁组织中FLOT1的表达, 分析FLOT1高表达与临床病理参数之间的相关性, 并进一步探讨FLOT1与胃癌生存期的关系, 为其临床综合诊治提供依据.
FLOT1在胃癌的发生发展中发挥了重要的作用, FLOT1可能成为治疗胃癌的一个新的靶点.
FLOT1: 是脂筏的一种标记蛋白, 人的FLOT1基因位于染色体6p21.3区段, 全长15 kb, 由13个外显子和12个内含子组成, FLOT1是高度保守的蛋白, 主要位于细胞膜上. FLOT1属于SPFH(stomatins, prohibitins flotillins, HflK/C)蛋白家族, FLOT1参与细胞信号传导, 细胞内吞和细胞黏附.
通过肿瘤分子标志来判断胃癌的早期诊断一直以来是研究的热点, 本研究采用免疫组织化学、Western blot和qTR-PCR方法检测FLOT1在胃癌及癌旁组织中的表达情况, 课题创新性较强, 研究方法和课题设计严密.
编辑: 郭鹏 电编: 闫晋利
| 1. | Alston RD, Geraci M, Eden TO, Moran A, Rowan S, Birch JM. Changes in cancer incidence in teenagers and young adults (ages 13 to 24 years) in England 1979-2003. Cancer. 2008;113:2807-2815. [PubMed] [DOI] |
| 2. | Lin C, Wu Z, Lin X, Yu C, Shi T, Zeng Y, Wang X, Li J, Song L. Knockdown of FLOT1 impairs cell proliferation and tumorigenicity in breast cancer through upregulation of FOXO3a. Clin Cancer Res. 2011;17:3089-3099. [PubMed] [DOI] |
| 3. | Song L, Gong H, Lin C, Wang C, Liu L, Wu J, Li M, Li J. Flotillin-1 promotes tumor necrosis factor-α receptor signaling and activation of NF-κB in esophageal squamous cell carcinoma cells. Gastroenterology. 2012;143:995-1005.e12. [PubMed] [DOI] |
| 4. | Liao WT, Jiang D, Yuan J, Cui YM, Shi XW, Chen CM, Bian XW, Deng YJ, Ding YQ. HOXB7 as a prognostic factor and mediator of colorectal cancer progression. Clin Cancer Res. 2011;17:3569-3578. [PubMed] [DOI] |
| 6. | Zhang SH, Wang CJ, Shi L, Li XH, Zhou J, Song LB, Liao WT. High Expression of FLOT1 Is Associated with Progression and Poor Prognosis in Hepatocellular Carcinoma. PLoS One. 2013;8:e64709. [PubMed] |
| 7. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 8. | Oh SC. Update of adjuvant chemotherapy for resected gastric cancer. J Gastric Cancer. 2012;12:3-6. [PubMed] [DOI] |
| 9. | Chen WQ, Zheng RS, Zhang SW, Li N, Zhao P, Li GL, Wu LY, He J. Report of incidence and mortality in china cancer registries, 2008. Chin J Cancer Res. 2012;24:171-180. [PubMed] [DOI] |
| 11. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 12. | Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-E386. [PubMed] [DOI] |
| 14. | 王 长明, 许 超, 卫 子然, 蔡 清萍. 进展期胃癌新辅助化疗前后IL-6、IL-10的变化及其临床意义. 中华临床医师杂志: 电子版. 2012;6:80-83. |
| 15. | Chang W, Ma L, Lin L, Gu L, Liu X, Cai H, Yu Y, Tan X, Zhai Y, Xu X. Identification of novel hub genes associated with liver metastasis of gastric cancer. Int J Cancer. 2009;125:2844-2853. [PubMed] [DOI] |
| 16. | Han Y, Cai H, Ma L, Ding Y, Tan X, Chang W, Guan W, Liu Y, Shen Q, Yu Y. Expression of orphan nuclear receptor NR4A2 in gastric cancer cells confers chemoresistance and predicts an unfavorable postoperative survival of gastric cancer patients with chemotherapy. Cancer. 2013;119:3436-3445. [PubMed] [DOI] |
| 17. | Lingwood D, Simons K. Lipid rafts as a membrane-organizing principle. Science. 2010;327:46-50. [PubMed] [DOI] |
| 18. | Jacobson K, Mouritsen OG, Anderson RG. Lipid rafts: at a crossroad between cell biology and physics. Nat Cell Biol. 2007;9:7-14. [PubMed] |
| 19. | Bickel PE, Scherer PE, Schnitzer JE, Oh P, Lisanti MP, Lodish HF. Flotillin and epidermal surface antigen define a new family of caveolae-associated integral membrane proteins. J Biol Chem. 1997;272:13793-13802. [PubMed] |
| 20. | Langhorst MF, Reuter A, Stuermer CA. Scaffolding microdomains and beyond: the function of reggie/flotillin proteins. Cell Mol Life Sci. 2005;62:2228-2240. [PubMed] |
| 21. | Edgar AJ, Polak JM. Flotillin-1: gene structure: cDNA cloning from human lung and the identification of alternative polyadenylation signals. Int J Biochem Cell Biol. 2001;33:53-64. [PubMed] |
| 22. | Dermine JF, Duclos S, Garin J, St-Louis F, Rea S, Parton RG, Desjardins M. Flotillin-1-enriched lipid raft domains accumulate on maturing phagosomes. J Biol Chem. 2001;276:18507-18512. [PubMed] |
| 23. | Babuke T, Tikkanen R. Dissecting the molecular function of reggie/flotillin proteins. Eur J Cell Biol. 2007;86:525-532. [PubMed] |
| 24. | Banning A, Tomasovic A, Tikkanen R. Functional aspects of membrane association of reggie/flotillin proteins. Curr Protein Pept Sci. 2011;12:725-735. [PubMed] |
| 25. | Glebov OO, Bright NA, Nichols BJ. Flotillin-1 defines a clathrin-independent endocytic pathway in mammalian cells. Nat Cell Biol. 2006;8:46-54. [PubMed] |
| 26. | Vassilieva EV, Ivanov AI, Nusrat A. Flotillin-1 stabilizes caveolin-1 in intestinal epithelial cells. Biochem Biophys Res Commun. 2009;379:460-465. [PubMed] [DOI] |
| 27. | Patra SK. Dissecting lipid raft facilitated cell signaling pathways in cancer. Biochim Biophys Acta. 2008;1785:182-206. [PubMed] [DOI] |
| 28. | Patra SK, Bettuzzi S. Epigenetic DNA-methylation regulation of genes coding for lipid raft-associated components: a role for raft proteins in cell transformation and cancer progression (review). Oncol Rep. 2007;17:1279-1290. [PubMed] |
| 29. | Staubach S, Hanisch FG. Lipid rafts: signaling and sorting platforms of cells and their roles in cancer. Expert Rev Proteomics. 2011;8:263-277. [PubMed] [DOI] |
| 30. | Li H, Zhang Y, Chen SW, Li FJ, Zhuang SM, Wang LP, Zhang J, Song M. Prognostic significance of Flotillin1 expression in clinically N0 tongue squamous cell cancer. Int J Clin Exp Pathol. 2014;7:996-1003. [PubMed] |
| 31. | Gao W, Xu J, Wang F, Zhang L, Peng R, Shu Y, Wu J, Tang Q, Zhu Y. Plasma membrane proteomic analysis of human Gastric Cancer tissues: revealing flotillin 1 as a marker for Gastric Cancer. BMC Cancer. 2015;15:367. [PubMed] [DOI] |