修回日期: 2015-09-17
接受日期: 2015-09-28
在线出版日期: 2015-11-08
目的: 评价超声内镜(endoscopic ultrasonography, EUS)-弹性成像鉴别诊断胰腺肿块良恶性的诊断价值.
方法: Meta分析. 计算机检索2015-05-01之前在Pubmed、Medline、EMBASE、Science Direct、Springer link、CBM、万方、维普以及中国知网数据库公开发表的有关EUS-弹性成像鉴别诊断胰腺实性肿块良恶性价值的文献, 根据已定的纳入排除标准筛选文献并提取数据, 采用QUADAS量表进行严格的文献质量评价, 运用Meta-Disc1.4统计软件进行异质性分析和综合定量合成, 计算汇总的灵敏度、特异度、阳性似然比(positive likelihood ratio, +LR)、阴性似然比(negative likelihood ratio, -LR)、准确度及约登指数, 并绘制SROC曲线评估诊断效能, 最后利用Stata12.0评估发表偏倚.
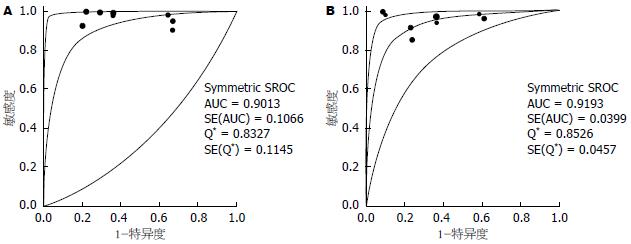
结果: 共纳入15篇英文文献, Meta分析表明: EUS-弹性成像定性法鉴别诊断胰腺实性肿块良恶性价值的合并灵敏度为97%(95%CI: 95%-98%), 合并特异度为63%(95%CI: 55%-70%), +LR为2.48(95%CI: 1.49-4.12), -LR为0.06 (95%CI: 0.02-0.15), SROC曲线下面积为0.9013; EUS-弹性成像定量法鉴别诊断胰腺实性肿块良恶性价值时的合并灵敏度为96%(95%CI: 94%-97%), 合并特异度为71%(95%CI: 63%-78%), +LR为3.00(95%CI: 1.91-4.70), -LR为0.09(95%CI: 0.05-0.15), SROC曲线下面积为0.9193.
结论: EUS-弹性成像法鉴别诊断胰腺实性肿块良恶性的诊断效能较高, 定性法和定量法灵敏度基本一致, 其中定量法有更高的特异性, 误诊率低, 可以作为早期鉴别诊断胰腺实性肿块良恶性的方法之一, 值得临床推广.
核心提示: 评价超声内镜弹性成像技术作为鉴别诊断胰腺实性肿块良恶性的重要手段, 值得临床推广.
引文著录: 彭斌, 黄强, 林先盛, 刘臣海, 谢放. 超声内镜弹性成像鉴别诊断胰腺实性肿块良恶性价值的Meta分析. 世界华人消化杂志 2015; 23(31): 5070-5078
Revised: September 17, 2015
Accepted: September 28, 2015
Published online: November 8, 2015
AIM: To evaluate the value of endoscopic ultrasonography (EUS) elastography in differential diagnosis of benign and malignant solid pancreatic masses.
METHODS: The databases including Pubmed, Medline, EMBASE, Science Direct, Springer link, CBM, Wan fang ,VIP and CNKI were searched before May 1, 2015 to collect the articles reporting the use of EUS-elastography in differential diagnosis of benign and malignant solid pancreatic masses. The retrieved articles were screened and selected according to the inclusion and exclusion criteria. Quality assessment was conducted using the QUADAS scale. Stata 12.0 software was used to evaluate the publication bias, and Meta-Disc1.4 software was used to analyze the heterogeneity of the included articles, calculate the pooled sensitivity, specificity, positive likelihood and negative likelihood, and plot the SROC curve to evaluate the diagnosis value.
RESULTS: A total of 15 English articles were included. The summary sensitivity of qualitative EUS elastography in differential diagnosis of benign and malignant solid pancreatic masses was 97% (95%CI: 95%-98%), the summary specificity was 63% (95%CI: 55%-70%), the positive likelihood ratio was 2.48 (95%CI: 1.49-4.12), the negative likelihood ratio was 0.06 (95%CI: 0.02-0.15), and the area under the SROC curve was 0.9013. The summary sensitivity of quantative EUS elastography in differential diagnosis of benign and malignant solid pancreatic masses was 96% (95%CI: 94%-97%), the summary specificity was 71% (95%CI: 63%-78%), the positive likelihood ratio was 3.00 (95%CI: 1.91-4.70), the negative likelihood ratio was 0.09 (95%CI: 0.05-0.15), and the area under the SROC curve was 0.9193.
CONCLUSION: Quantative EUS elastography has a higher specificity than qualitative EUS elastography in differential diagnosis of benign and malignant solid pancreatic masses, and both of them have higher diagnostic value.
- Citation: Peng B, Huang Q, Lin XS, Liu CH, Xie F. Endoscopic ultrasonography elastography for differential diagnosis of benign and malignant solid pancreatic masses: A systemic review and Meta-analysis. Shijie Huaren Xiaohua Zazhi 2015; 23(31): 5070-5078
- URL: https://www.wjgnet.com/1009-3079/full/v23/i31/5070.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i31.5070
胰腺实性肿块表现多样, 主要包括胰腺癌、炎性包块、胰腺神经内分泌瘤等. 其中, 90%以上的胰腺实性恶性肿瘤为导管腺癌[1]. 胰腺癌是常见消化系恶性肿瘤之一, 发病率低但预后差, 病死率高居消化系恶性肿瘤的第4-5位[2]. 因此, 早期鉴别胰腺实性肿块的良恶性, 及早识别胰腺恶性肿瘤并及时干预病程, 对改善胰腺占位性病变预后, 降低病死率至关重要.
胰腺为腹膜后器官, 位置隐匿, 传统的体表B超、计算机断层扫描(computed tomography)、核磁共振成像(nuclear magnetic resonance imaging)等对胰腺占位性病变性质的诊断较困难[3]. 目前, 超声内镜探查术可通过采用高频超声近距离显示胰腺肿块的局部细节, 清晰度高, 优于传统体表超声技术, 已被认为是诊断胰腺恶性肿瘤必不可少的工具之一, 但对实性肿块良恶性的鉴别仍存在困难[4]. 而弹性成像技术是是超声影像诊断新技术, 通过对组织可视化或弹性系数的量化分析, 能对病变组织的良恶性质做出诊断, 已成功应用于甲状腺、乳腺、肝脏等疾病的诊断, 但因腹部超声对胰腺探查困难, 故在胰腺实性肿块良恶性的鉴别诊断中应用较少[5]. 因此, 将以上两种技术结合在一起的超声内镜(endoscopic ultrasonography, EUS)-弹性成像技术受到极大关注, 他为明确胰腺病变性质及鉴别病变良恶性方面提供有效辅助作用. 目前国内外对EUS-弹性成像技术鉴别诊断胰腺实性肿块良恶性诊断价值的研究[6-22]较多, 但相互之间的结果存在较大差异, 应用受限, 且国内尚无文献对其在胰腺实性肿块良恶性鉴别中的诊断价值进行系统性评价. 因此, 本文拟采用Meta分析方法对EUS-弹性成像技术鉴别诊断胰腺实性肿块良恶性的诊断价值进行系统评价, 旨在为临床提供最佳的循证依据.
检索数据库为: Pubmed、Medline、EMBASE、Science Direct、Springer link、CBM、万方、维普、谷歌学术搜索以及中国知网数据库. 检索词为: endoscopic ultrasonography or ultrasonic endoscope or EUS、elastography or elasticity imaging、pancreatic mass or pancreatic solid mass or pancreatic tumor or pancreatic lesions. 检索时间截止至2015-05-01. 检索语言仅限于英文. 纳入标准: (1)采用EUS-弹性成像技术鉴别诊断胰腺实性肿块的临床诊断性研究; (2)胰腺癌、胰腺神经内分泌瘤、胰腺炎等各类伴有胰腺肿块的良恶性疾病, 金标准包括病理学确诊、超声内镜引导下细针穿刺抽吸活检术及临床随访最终确诊; (3)纳入研究中应注明EUS-弹性成像技术定性法的图像色彩评分标准及定量法(包括测应变率法及彩色直方图法)的cut off值; (4)文献中应给出或可计算出四格表相关数据的值. 包括: 真阳性(true positive, TP)、假阳性(false positive, FP)、假阴性(false negative, FN)、真阴性(true negative, TN). 排除标准: (1)评述类文献、文摘以及讲座等非原始研究和动物实验等基础研究及学位论文、会议论文等; (2)无法获取灵敏度、特异度等数据不全的研究; (3)全文不是英文的研究; (4)纳入研究中的病例未经金标准确诊的.
1.2.1 文献筛选以及资料提取: 2位研究者独立阅读文献, 严格按照已定的纳入排除标准进行筛选, 筛选过程中遵循盲法原则, 对有分歧的文献或数据通过讨论或由第3位研究者决定其是否纳入, 并对纳入研究进行数据提取. 提取信息包括: 作者、发表时间、国家、样本量、研究设计类型及诊断试验的各项参数信息(敏感度、特异度、TP、FP、FN、TN等).
1.2.2 文献质量评估: 根据Whiting等[23]制订的QUADAS质量标准的14个条目, 由2名评价者遵循盲法原则独立对纳入文献进行质量评价, 包括变异、偏倚、和报告质量3个方面, 对每条标准划分为"是"、"否"、"不明确"3个结果. "是"表示入选文献符合该项条目, 计2分; "否"表示不满足, 计0分; 无法提取足够的信息判定为"不清楚", 计1分. 总分0-15分表示文献质量较低, 16-28分表示文献质量较高. 评分有分歧时由2名评价者讨论或者第3研究者决定.
统计学处理 首先运用Meta-Disc1.4软件分析EUS-弹性成像鉴别胰腺实性肿块良恶性的诊断效能并绘制SROC曲线, 用I2评估异质性大小. I2<25%提示有轻度异质性, I2在25%-75%提示中度异质性, I2>75%则提示明显异质性, 显著性水平设定为P = 0.05. 最后用Stata12.0软件检测纳入文献是否存在发表偏倚.
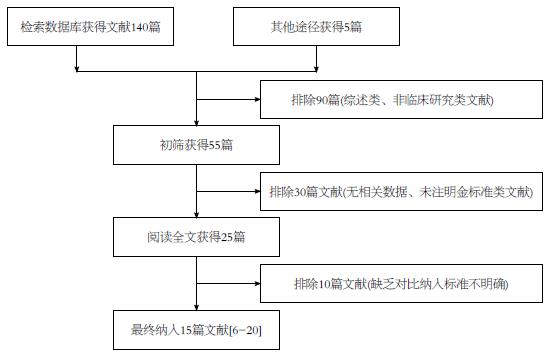
经过2位研究者独立进行筛选文献后, 共检索相关文献145篇, 首先经阅读摘要和全文, 排除非诊断临床试验及综述类文献120篇, 最后剩余25篇. 严格按照文献的纳入与排除标准对于所纳入全文阅读文献进行筛选和剔除, 最终纳入英文文献15篇[6-20]. 文献筛选的PRISMA流程图如图1. 15篇文献共纳入16个临床研究, 包括EUS-定性弹性成像研究8个, EUS-定量弹性成像研究8个, 纳入研究对象共计1127个, 其中胰腺恶性实性肿块纳入研究对象830个, 胰腺良性实性肿块纳入研究对象297个. 纳入研究的基本信息(作者, 发表时间, 国家, 诊断方法, 敏感度, 特异度等)如表1.
| 纳入研究 | 国家 | 诊断方法 | n | 合并灵 | 合并特 | cut off | 研究设计 | QUADAS |
| 敏度(%) | 异度(%) | 类型 | 评分 | |||||
| 定性诊断方法 | ||||||||
| Giovannini等[6] 2006 | 法国 | color pattern | 24 | 100 | 67 | blue predominant | 单中心试验研究 | 18 |
| Janssen等[7] 2007 | 德国 | color pattern | 33 | 100 | 33 | blue predominant | 单中心试验研究 | 17 |
| Giovannini等[8] 2009 | 法国 | color pattern | 121 | 92 | 80 | blue predominant | 多中心试验研究 | 27 |
| Iglesias-Garcia等[9] 2009 | 西班牙 | color pattern | 130 | 100 | 79 | blue predominant | 单中心试验研究 | 28 |
| Iglesias-Garcia等[10] 2010 | 西班牙 | color pattern | 86 | 100 | 71 | blue predominant | 单中心试验研究 | 27 |
| Itokawa等[11] 2011 | 日本 | color pattern | 86 | 99 | 64 | blue predominant | 单中心试验研究 | 18 |
| Hocke等[12] 2012 | 德国 | color pattern | 58 | 95 | 33 | blue predominant | 单中心试验研究 | 15 |
| Kawada等[13] 2012 | 日本 | color pattern | 33 | 90 | 33 | blue predominant | 单中心试验研究 | 16 |
| 总计 | 571 | |||||||
| 定量诊断方法 | ||||||||
| Săftoiu等[14] 2008 | 罗马尼亚 | Hue histogram | 43 | 94 | 64 | >175.00 | 单中心试验研究 | 20 |
| Iglesias-Garcia等[10] 2010 | 西班牙 | Strain ratio | 86 | 100 | 93 | ≥6.04 | 单中心试验研究 | 27 |
| Săftoiu等[15] 2010 | 罗马尼亚 | Hue histogram | 54 | 85 | 76 | >175.00 | 单中心试验研究 | 24 |
| Mayerle等[16] 2012 | 德国 | Strain ratio | 89 | 96 | 39 | >24.80 | 单中心试验研究 | 15 |
| Săftoiu等[17] 2011 | 罗马尼亚 | Hue histogram | 258 | 97 | 64 | >170.00 | 多中心试验研究 | 27 |
| Dawwas等[18] 2012 | 英国 | Strain ratio | 31 | 100 | 40 | ≥4.62 | 单中心试验研究 | 19 |
| Iglesias-Garcia等[19] 2011 | 西班牙 | Strain ratio | 34 | 100 | 93 | ≥12.90 | 单中心试验研究 | 20 |
| Figueiredo等[20] 2012 | 法国 | Strain ratio | 47 | 90 | 75 | >8.00 | 单中心试验研究 | 21 |
| 总计 | 642 | |||||||
| 定性定量总计 | 1213 |
我们严格逐条按QUADAS量表的14个条目对所纳入的15篇文献进行质量评价, 评分如表1. 由表可知, <16分文献2篇, 16-28分文献13篇, 平均21.2分, 纳入文献整体质量较高.
2.3.1 异质性检验结果: 运用MetaDisc1.4软件分析计算Spearman相关系数. EUS-定性、定量弹性成像鉴别诊断胰腺实性肿块良恶性时的Spearman相关系数依次为-0.434(P = 0.283), -0.190(P = 0.651), 不具有统计学意义, 且观察两者的SROC曲线均不存在"肩臂状"分布, 因此不存在阈值效应.
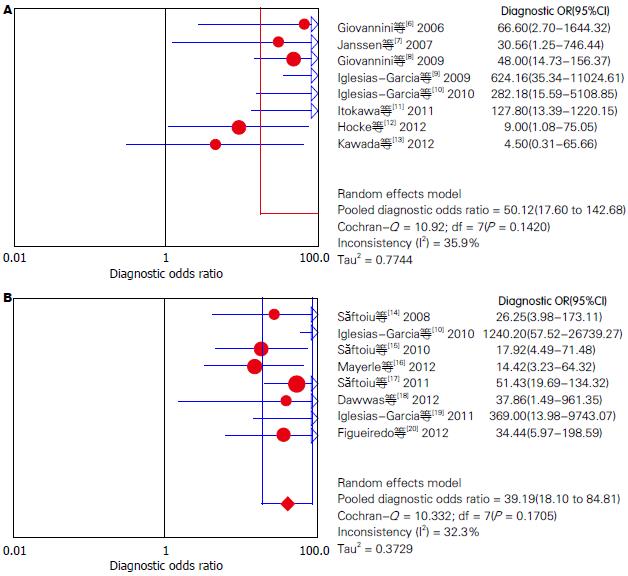
对非阈值效应导致的异质性检验, 在分别提取15篇纳入研究的四格表数据(TP、FP、FN、TN)后采用Meta-Disc1.4软件进行Meta分析, EUS-定性弹性成像及定量弹性成像技术的异质性分析分别如图2. 异质性分析结果表明: EUS-定性弹性成像技术鉴别诊断胰腺实性肿块良恶性时的合并的DOR为50.12(95%CI: 17.60-142.68), 各项纳入研究之间存在中等程度异质性(P = 0.1420, I2 = 35.9%), 采用随机效应模型; EUS-定量弹性成像技术鉴别诊断胰腺实性肿块良恶性时的合并的DOR为39.19(95%CI: 18.10-84.81), 各项纳入研究之间存在中等程度异质性(P = 0.1705, I2 = 32.3%), 采用随机效应模型.
2.3.2 EUS-弹性成像鉴别诊断胰腺良恶性实性肿块的效能及价值: Meta-Disc1.4软件合并分析EUS-定性、定量弹性成像技术鉴别诊断胰腺实性肿块良恶性的诊断价值如表2, 并绘制其合并的SROC曲线以及曲线下面积AUC(图3). Meta分析结果显示: EUS-定性、定量弹性成像技术诊断胰腺实性肿块良恶性诊断价值的研究中, 合并灵敏度、特异度、+LR、-LR时发现各研究间存在异质性, 故均采用随机效应模型进行分析. EUS-定性弹性成像技术的诊断研究中, 合并灵敏度为97%(95%CI: 95%-98%), 合并特异度为63%(95%CI: 55%-70%), 阳性似然比(positive likelihood ratio, +LR)为2.48(95%CI: 1.49-4.12), 阴性似然比(negative likelihood ratio, -LR)为0.06(95%CI: 0.02-0.15), SROC曲线下面积为0.9013; EUS-定量弹性成像技术研究中合并灵敏度为96%(95%CI: 94%-97%), 合并特异度为71%(95%CI: 63%-78%), +LR为3.00(95%CI: 1.91-4.70), -LR为0.09(95%CI: 0.05-0.15), SROC曲线下面积为0.9193. 由以上数据可知: EUS-定性、定量弹性成像技术鉴别诊断胰腺实性肿块良恶性时灵敏度基本一致, 但EUS-定量弹性成像技术的特异度更高, 误诊率较低.
| 分组 | 合并灵敏度 | 合并特异度 | +LR | -LR |
| 定性 | 97%(95%CI: 95%-98%) | 63%(95%CI: 55%-70%) | 2.48(95%CI: 1.49-4.12) | 0.06(95%CI: 0.02-0.15) |
| 定量 | 96%(95%CI: 94%-97%) | 71%(95%CI: 63%-78%) | 3.00(95%CI: 1.91-4.70) | 0.09(95%CI: 0.05-0.15) |
2.3.3 发表偏倚检验结果: Stata12.0软件合并分析EUS-定性、定量弹性成像技术鉴别诊断胰腺实性肿块良恶性研究的发表偏倚, 结果表明: EUS-定性弹性成像技术的诊断研究中, t = -1.79, P = 0.123, 不具有统计学意义, 且Deek's图各点分布对称, 故不存在发表偏倚; EUS-定量弹性成像技术的诊断研究中, t = -0.30, P = 0.771, 不具有统计学意义, 且Deek's图各点分布对称, 因此亦不存在发表偏倚.
胰腺实性肿块是多种胰腺良恶性疾病的临床表现之一, 良性疾病主要为炎性包块, 预后较好, 而恶性疾病中90%以上为胰腺癌, 其恶性度极高[24], 预后差, 发病率几乎等于病死率(发病率0.039‰, 病死率0.037‰)[25]. 因此, 早期明确胰腺实性肿块的病变性质, 及早干预病程是改善预后、降低病死率的关键. 目前用于明确胰腺实性肿块性质的方法较少, 公认准确性较好的主要是超声内镜引导下细针穿刺抽吸活检术(endoscopic ultrasonography-guided fine needle aspiration, EUS-FNA), 其可获取胰腺实质肿块的病理组织, 提供病理依据[26], 准确性优于其他影像学检查方法, 但是, 由于获取组织少, 影响EUS-FNA阳性的因素多, 导致很多病例无法确诊[27], 存在较高比例的假阴性[28], 且EUS-FNA属于有创检查方法, 风险较大, 因此, 对临床医生而言, 寻找准确度高且更加简便、安全的胰腺肿块良恶性鉴别诊断方法很有必要. EUS-弹性成像技术是将超声弹性成像与超声内镜相结合的最新超声内镜诊断技术, 他运用探头压迫胰腺部位, 对采集图像内感兴趣区域进行参数测定, 组织受外力压迫后变形程度不同, 将其受压前后回声信号移动幅度的变化转变为组织弹性系数而得以可视化或量化, 并用软件转化为实时彩色图像, 即为弹性成像[6]. 目前, EUS-弹性成像技术分为定性和定量2种. 定性EUS-弹性成像技术是通过对获取的彩色图像进行色彩模式评分, 按照评分标准判定为正常组织、良性病变或恶性病变. 定量EUS-弹性成像技术则是通过测定胰腺组织的应变率或彩色直方图法定量评估胰腺肿块的良恶性. EUS-弹性成像定性、定量的2种方法在诸多鉴别诊断胰腺实性肿块良恶性的研究中表现出了较好的预测性[6-20], 且无创、安全、操作简便, 具有独特优势. 因此, 本文即采用系统评价的方法对EUS-弹性成像技术预测胰腺肿块良恶性的价值进行评估, 且分别评价了其定性、定量两种方法的鉴别诊断价值并进行对比, 旨在为EUS-弹性成像技术鉴别诊断胰腺实性肿块良恶性的价值提供确切的循证依据, 更好的指导临床工作.
本文采用Meta分析方法对EUS-定性及定量弹性成像技术鉴别诊断胰腺实性肿块良恶性的相关纳入研究进行评价, 共纳入英文文献15篇, 包含临床研究16个, 共计1127个研究对象, 其中EUS-定性、定量弹性成像研究分别8个, QUADAS质量评价提示纳入文献整体质量较高, 且发表偏倚检测提示各纳入研究间不存在发表偏倚. 研究结果显示: EUS-定性弹性成像技术鉴别诊断胰腺实性肿块良恶性时的合并灵敏度为97%, 特异度为63%, +LR为2.48, 阴性似然比为0.06, SROC曲线下面积为0.9013. EUS-定量弹性成像技术鉴别诊断胰腺实性肿块良恶性时的合并灵敏度为96%, 特异度为71%, +LR为3.00, -LR为0.09, SROC曲线下面积为0.9193. 由以上数据可以表明: EUS-定性、定量弹性成像技术诊断价值均较高, 其中定量法较定性法灵敏度基本一致, 但特异性显著提高, 误诊率相对较低, 具有更高的诊断效能. 因此, EUS-弹性成像定量法或定性法均可以作为鉴别胰腺实性肿块良恶性时的初筛诊断方法, 但显然定量法在诊断中会表现更优. 在临床工作中, 对于消化科医生而言, 在常规体表影像学检查方法发现胰腺实性肿块后, 为尽早明确实性肿块的性质, 我们推荐将EUS-定量弹性成像法作为初步鉴别诊断的第一选择, 若无条件行定量法, 定性法也可以作为第一选择, 对EUS-定性、定量法明确为胰腺良性炎性病变的实性肿块, 结合患者临床表现可基本排除实性肿块恶性病变可能, 而对于EUS-定性、定量法提示实性肿块为恶性病变时, 为排除该诊断方法带来的假阳性可能, 我们可结合患者的临床表现来明确诊断或仍无法明确时进一步采取相对复杂且更加准确的诊断方法, 以期尽早发现恶性肿瘤, 及早干预病程, 为患者带来更长的生存期.
本文是通过对近年来EUS-弹性成像技术鉴别诊断胰腺实性肿块良恶性的研究提取相关数据后进行汇总评价, 增大了样本量, 但是由于各研究间存在着多方面差异, 因此我们需要对纳入研究进行异质性分析. 首先, 我们通过观察SROC曲线及计算Spearman相关系数排除了阈值效应导致的异质性, 然后, 我们运用MetaDisc1.4软件汇总统计量时, 发现各研究间在合并灵敏度、特异度、诊断比值比、+LR、-LR时均存在不同程度的异质性, 此为非阈值效应带来的异质性, 分析原因如下: (1)纳入的15篇文献来自不同国家, 因此各研究所纳入研究对象存在地域差异, 该差异不可避免, 因此可能带来异质性; (2)EUS-弹性成像定性法是通过观察来作出判断, 因此受阅片者的阅片技术及主观感觉影响, 导致异质性; (3)EUS-弹性成像定量法是通过量化的方法来作出判断, 排除了主观感觉带来的影响, 但是由于包含了应变率测定法及测色直方图法2种方法, 2种方法的差异对于结果的判断会带来异质性; (4)EUS-弹性成像定量法中, 不同研究间cut off值均不同, 可导致异质性; (5)不同研究间金标准存在差异, 部分研究金标准仅为病理学结果, 但有部分研究还包含了临床随访诊断为胰腺癌的病例, 可产生异质性.
Meta分析作为一种观察性分析, 存在一定的局限性, 本文的不足主要有: (1)本文纳入的15篇文献均为全英文文献, 遗漏了其他语种的研究, 带来了语言偏倚; (2)我们对纳入文献进行严格的质量评估, 尽可能保证高质量文献的纳入, 本文各纳入研究整体质量较高, 但不同研究间质量仍存在差异, 这难免会影响结果的可靠性, 导致文献质量偏倚. 但是, 通过对近期国内几个主要数据库的检索, 本文是国内第一次就EUS-弹性成像技术鉴别诊断胰腺实性肿块良恶性的价值进行Meta分析. 本文研究结果提示: EUS-弹性成像法鉴别诊断胰腺实性肿块具有较高诊断价值, 定性及定量法灵敏度均较高, 可作为胰腺实性肿块鉴别性质时的初筛方法, 漏诊率低, 且定量法具有更高的特异性, 误诊率相对较低. 因此, EUS-弹性成像技术作为鉴别诊断胰腺实性肿块良恶性的重要手段, 值得临床推广. 但是未来仍需要大样本, 前瞻性, 高质量研究来进一步验证EUS-弹性成像技术鉴别诊断胰腺实性肿块良恶性的价值.
超声内镜(endoscopic ultrasonography, EUS)探查术可通过采用高频超声近距离显示胰腺肿块的局部细节, 清晰度高, 优于传统体表超声技术, 是诊断胰腺恶性肿瘤必不可少的工具之一, 但对实性肿块良恶性的鉴别仍存在困难. 而弹性成像技术是是超声影像诊断新技术, 通过对组织可视化或弹性系数的量化分析, 能对病变组织的良恶性质做出诊断, 已成功应用于甲状腺、乳腺、肝脏等疾病的诊断, 但因腹部超声对胰腺探查困难, 故在胰腺实性肿块良恶性的鉴别诊断中应用较少. 目前的临床价值也缺乏研究.
梁国刚, 教授, 大连医科大学附属第一医院
本文拟采用Meta分析方法对EUS-弹性成像技术鉴别诊断胰腺实性肿块良恶性的诊断价值进行系统评价, 旨在为临床提供最佳的循证依据.
EUS-弹性成像联合了超声内镜和弹性成像的优点, 他可为明确胰腺病变性质及鉴别病变良恶性方面提供有效辅助作用.
EUS-定性、定量弹性成像技术诊断价值均较高, 其中定量法较定性法灵敏度基本一致, 但特异性显著提高, 误诊率相对较低, 具有更高的诊断效能.
EUS-弹性成像法鉴别诊断胰腺实性肿块具有较高诊断价值, 定性及定量法灵敏度均较高, 可作为胰腺实性肿块鉴别性质时的初筛方法, 漏诊率低, 且定量法具有更高的特异性, 误诊率相对较低.
超声内镜: 将内镜和超声相结合的消化系检查技术, 将微型高频超声探头安置在内镜顶端, 当内镜插入体腔后, 在内镜直接观察消化系黏膜病变的同时, 可利用内镜下的超声行实时扫描, 可以获得胃肠道的层次结构的组织学特征及周围邻近脏器的超声图像, 从而进一步提高了内镜和超声的诊断水平.
胰腺实性占位性病变由于解剖特点导致临床诊断存在一定的困难, 文章从超声内镜弹性成像技术提供一种新的方法, 作者综述了15篇文献, 采用严格的统计学方法, 缜密的逻辑思路, 得出的结论具有科学性.
编辑: 于明茜 电编: 都珍珍
| 1. | Conrad C, Fernández-Del Castillo C. Preoperative evaluation and management of the pancreatic head mass. J Surg Oncol. 2013;107:23-32. [PubMed] |
| 2. | Jones OP, Melling JD, Ghaneh P. Adjuvant therapy in pancreatic cancer. World J Gastroenterol. 2014;20:14733-14746. [PubMed] |
| 3. | Morris-Stiff G, Escofet X, Barry JD, Lewis WG, Puntis MC, Roberts SA. Selective use of endoscopic ultrasound in the evaluation of carcinomas of the pancreatic head. Dig Surg. 2011;28:373-378. [PubMed] [DOI] |
| 4. | Kadiyala V, Lee LS. Endosonography in the diagnosis and management of pancreatic cysts. World J Gastrointest Endosc. 2015;7:213-223. [PubMed] [DOI] |
| 5. | Caproni N, Marchisio F, Pecchi A, Canossi B, Battista R, D'Alimonte P, Torricelli P. Contrast-enhanced ultrasound in the characterisation of breast masses: utility of quantitative analysis in comparison with MRI. Eur Radiol. 2010;20:1384-1395. [PubMed] |
| 6. | Giovannini M, Hookey LC, Bories E, Pesenti C, Monges G, Delpero JR. Endoscopic ultrasound elastography: the first step towards virtual biopsy? Preliminary results in 49 patients. Endoscopy. 2006;38:344-348. [PubMed] |
| 7. | Janssen J, Schlörer E, Greiner L. EUS elastography of the pancreas: feasibility and pattern description of the normal pancreas, chronic pancreatitis, and focal pancreatic lesions. Gastrointest Endosc. 2007;65:971-978. [PubMed] |
| 8. | Giovannini M, Thomas B, Erwan B, Christian P, Fabrice C, Benjamin E, Geneviève M, Paolo A, Pierre D, Robert Y. Endoscopic ultrasound elastography for evaluation of lymph nodes and pancreatic masses: a multicenter study. World J Gastroenterol. 2009;15:1587-1593. [PubMed] |
| 9. | Iglesias-Garcia J, Larino-Noia J, Abdulkader I, Forteza J, Dominguez-Munoz JE. EUS elastography for the characterization of solid pancreatic masses. Gastrointest Endosc. 2009;70:1101-1108. [PubMed] |
| 10. | Iglesias-Garcia J, Larino-Noia J, Abdulkader I, Forteza J, Dominguez-Munoz JE. Quantitative endoscopic ultrasound elastography: an accurate method for the differentiation of solid pancreatic masses. Gastroenterology. 2010;139:1172-1180. [PubMed] [DOI] |
| 11. | Itokawa F, Itoi T, Sofuni A, Kurihara T, Tsuchiya T, Ishii K, Tsuji S, Ikeuchi N, Umeda J, Tanaka R. EUS elastography combined with the strain ratio of tissue elasticity for diagnosis of solid pancreatic masses. J Gastroenterol. 2011;46:843-853. [PubMed] [DOI] |
| 12. | Hocke M, Ignee A, Dietrich CF. Advanced endosonographic diagnostic tools for discrimination of focal chronic pancreatitis and pancreatic carcinoma--elastography, contrast enhanced high mechanical index (CEHMI) and low mechanical index (CELMI) endosonography in direct comparison. Z Gastroenterol. 2012;50:199-203. [PubMed] [DOI] |
| 13. | Kawada N, Tanaka S, Uehara H, Takakura R, Katayama K, Fukuda J, Matsuno N, Takenaka A, Ishikawa O. Feasibility of second-generation transabdominal ultrasound-elastography to evaluate solid pancreatic tumors: preliminary report of 36 cases. Pancreas. 2012;41:978-980. [PubMed] [DOI] |
| 14. | Săftoiu A, Vilmann P, Gorunescu F, Gheonea DI, Gorunescu M, Ciurea T, Popescu GL, Iordache A, Hassan H, Iordache S. Neural network analysis of dynamic sequences of EUS elastography used for the differential diagnosis of chronic pancreatitis and pancreatic cancer. Gastrointest Endosc. 2008;68:1086-1094. [PubMed] |
| 15. | Săftoiu A, Iordache SA, Gheonea DI, Popescu C, Maloş A, Gorunescu F, Ciurea T, Iordache A, Popescu GL, Manea CT. Combined contrast-enhanced power Doppler and real-time sonoelastography performed during EUS, used in the differential diagnosis of focal pancreatic masses (with videos). Gastrointest Endosc. 2010;72:739-747. [PubMed] |
| 16. | Mayerle J, Kraft M, Menges P, Simon P, Ringel J, Partecke LI, Heidecke CD, Lerch MM. [Intraductal papillary mucinous neoplasia: which findings support observation?]. Chirurg. 2012;83:123-129. [PubMed] [DOI] |
| 17. | Săftoiu A, Vilmann P, Gorunescu F, Janssen J, Hocke M, Larsen M, Iglesias-Garcia J, Arcidiacono P, Will U, Giovannini M. Accuracy of endoscopic ultrasound elastography used for differential diagnosis of focal pancreatic masses: a multicenter study. Endoscopy. 2011;43:596-603. [PubMed] |
| 18. | Dawwas MF, Taha H, Leeds JS, Nayar MK, Oppong KW. Diagnostic accuracy of quantitative EUS elastography for discriminating malignant from benign solid pancreatic masses: a prospective, single-center study. Gastrointest Endosc. 2012;76:953-961. [PubMed] [DOI] |
| 19. | Iglesias-Garcia J, Lariño-Noia J, Dominguez-Munoz JE. [Elastography in the evaluation of chronic pancreatitis]. Gastroenterol Hepatol. 2011;34:629-634. [PubMed] [DOI] |
| 20. | Figueiredo FA, da Silva PM, Monges G, Bories E, Pesenti C, Caillol F, Delpero JR, Giovannini M. Yield of Contrast-Enhanced Power Doppler Endoscopic Ultrasonography and Strain Ratio Obtained by EUS-Elastography in the Diagnosis of Focal Pancreatic Solid Lesions. Endosc Ultrasound. 2012;1:143-149. [PubMed] [DOI] |
| 21. | Dietrich CF, Ignee A, Braden B, Barreiros AP, Ott M, Hocke M. Improved differentiation of pancreatic tumors using contrast-enhanced endoscopic ultrasound. Clin Gastroenterol Hepatol. 2008;6:590-597.e1. [PubMed] |
| 22. | Opačić D, Rustemović N, Kalauz M, Markoš P, Ostojić Z, Majerović M, Ledinsky I, Višnjić A, Krznarić J, Opačić M. Endoscopic ultrasound elastography strain histograms in the evaluation of patients with pancreatic masses. World J Gastroenterol. 2015;21:4014-4019. [PubMed] [DOI] |
| 23. | Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003;3:25. [PubMed] |
| 24. | Jemal A, Tiwari RC, Murray T, Ghafoor A, Samuels A, Ward E, Feuer EJ, Thun MJ. Cancer statistics, 2004. CA Cancer J Clin. 2004;54:8-29. [PubMed] |
| 25. | Bednar F, Simeone DM. Pancreatic cancer stem cell biology and its therapeutic implications. J Gastroenterol. 2011;46:1345-1352. [PubMed] |
| 26. | Ohtsuka T, Ideno N, Aso T, Nagayoshi Y, Kono H, Mori Y, Takahata S, Oda Y, Aishima S, Igarashi H. Role of endoscopic retrograde pancreatography for early detection of pancreatic ductal adenocarcinoma concomitant with intraductal papillary mucinous neoplasm of the pancreas. J Hepatobiliary Pancreat Sci. 2013;20:356-361. [PubMed] |
| 27. | Xu C, Li Z, Wallace M. Contrast-enhanced harmonic endoscopic ultrasonography in pancreatic diseases. Diagn Ther Endosc. 2012;2012:786239. [PubMed] [DOI] |
| 28. | Micames C, Jowell PS, White R, Paulson E, Nelson R, Morse M, Hurwitz H, Pappas T, Tyler D, McGrath K. Lower frequency of peritoneal carcinomatosis in patients with pancreatic cancer diagnosed by EUS-guided FNA vs. percutaneous FNA. Gastrointest Endosc. 2003;58:690-695. [PubMed] |