修回日期: 2015-09-26
接受日期: 2015-10-15
在线出版日期: 2015-11-08
目的: 应用Cre-Loxp系统构建Claudin-7蛋白在肠道可诱导性条件性基因敲除小鼠模型, 并进行表型分析.
方法: 构建Claudin-7打靶载体, 通过电击法转染入小鼠胚胎干细胞(ES细胞), 用正负筛选法筛选阳性ES细胞并进行PCR鉴定和Southern鉴定, 利用显微注射把发生正确同源重组的ES细胞注射进C57BL/6N小鼠囊胚, 移入受体小鼠子宫以获得嵌合体小鼠. 将得到的嵌合体小鼠与C57BL/6N小鼠交配获得Claudin-7-flox小鼠, 该小鼠与Pvillin-CreERT2转基因小鼠杂交, 通过子代自交获得Claudin-7在肠道可诱导性条件性基因敲除(Cldn7fl/flVillin-CreERT2)的小鼠,他莫昔芬(tamoxifen)药物诱导肠道Claudin-7基因敲除, 对小鼠进行表型分析.
结果: 获得Claudin-7-flox小鼠及Claudin-7肠道可诱导性条件性基因敲除小鼠数只, Claudin-7肠道可诱导性条件性基因敲除小鼠出生时表型正常, 发育良好, 他莫昔芬(tamoxifen)药物应用后, 诱导了小鼠肠道上皮细胞Claudin-7基因表达的缺失. 小鼠出现脱水表现, 活泼度降低, 并出现死亡.
结论: 成功构建了Claudin-7肠道可诱导性条件性基因敲除小鼠模型, 利用他莫昔芬诱导肠道Claudin-7基因敲除, 初步构建了肠道炎症模型, 为进一步研究Claudin-7在肠道肿瘤中的作用奠定了基础.
核心提示: 为研究Claudin-7基因在肠道肿瘤发生和发展中的分子生物学作用, 本研究设计基于同源重组理论, 利用ES细胞打靶以及显微注射技术, 构建了Claudin-7基因在肠道中可诱导条件性敲除的小鼠模型, 为体内研究Claudin-7的抑瘤功能奠定了坚实基础.
引文著录: 李腾雁, 王晓楠, 李文晶, 高宏, 丁磊. Claudin-7可诱导性条件性基因敲除小鼠模型的构建和鉴定. 世界华人消化杂志 2015; 23(31): 5017-5023
Revised: September 26, 2015
Accepted: October 15, 2015
Published online: November 8, 2015
AIM: To create an inducible Claudin-7 conditional knockout (ICKO) mouse line using the Cre/LoxP system and analyze the phenotype after inducing knockout in the intestine.
METHODS: Claudin-7 conditional knockout targeted vector was constructed and then transfected into embryonic stem (ES) cells by electroporation. The targeted ES cells were screened by positive-negative selection, and identified by PCR and Southern blot. The screened targeted ES cells were microinjected into the blastula of C57BL/6N mice. Chimerical mice were generated after transplanting the blastula into the host mice, and then the Claudin-7-floxed mice were generated by crossing between the chimerical mice and C57BL/6N mice. Claudin-7 ICKO mice could be obtained by crossing between Pvillin-CreERT2 transgenic mice and Claudin-7-floxed mice. A further phenotype analysis was made by HE staining.
RESULTS: We obtained Claudin-7-floxed mice and Cldn7fl/flVillin-CreERT2 homozygous mice successfully. The deletion of Claudin-7 gene expression in mouse intestinal epithelial cells was successfully induced by tamoxifen. After tamoxifen induction, the mice developed dehydration, the degree of living activity decreased, and death occurred.
CONCLUSION: We have successfully created an inducible Claudin-7 conditional knockout mouse line and induced the gene deletion in the intestine using tamoxifen, which may be used as a model of intestinal inflammation.
- Citation: Li TY, Wang XN, Li WJ, Gao H, Ding L. Generation of an inducible Claudin-7 conditional knockout mouse line. Shijie Huaren Xiaohua Zazhi 2015; 23(31): 5017-5023
- URL: https://www.wjgnet.com/1009-3079/full/v23/i31/5017.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i31.5017
紧密连接蛋白(tight junction, TJ)存在于机体的上皮细胞和内皮细胞间, 具有封闭细胞间隙、维持细胞黏附性、极性和通透性及辅助信号转导的作用. Claudin蛋白是一类跨膜TJ蛋白, Claudin-7作为Claudin家族的重要组成成员之一, 与肿瘤的发生、发展及转归密切相关[1]. 但目前仍缺乏强有力的体内实验依据. 因此, 我们考虑从建立动物模型的基础上, 对Claudin-7进行深入研究. 我们前期实验构建了Claudin-7基因全身性敲除小鼠, 研究[2]发现, Claudin-7基因全身性敲除小鼠诱导了肠道炎症微环境和肠上皮细胞的不典型增生, 模拟了人类溃疡性结肠炎疾病模型, 且在人体大肠癌组织中发现Claudin-7表达明显降低. 遗憾的是Claudin-7基因全身性敲除小鼠出生后7 d左右即死亡. 为进一步研究Claudin-7基因在肠道肿瘤发生和发展中的分子生物学作用, 该研究设计基于同源重组理论, 利用ES细胞打靶以及显微注射技术, 拟构建Claudin-7基因在肠道中可诱导条件性敲除的小鼠, 为体内研究Claudin-7的抑瘤功能、初步探索Claudin-7基因在大肠癌发生、发展中的功能和分子机制奠定坚实基础.
C57BL/6N小鼠、Pvillin-CreERT2小鼠由法国Pierre Chambon教授赠, 野生型、杂合子及基因敲除小鼠均按照无特定病原(specific pathogen free, SPF)级动物饲养标准饲养. 限制性内切酶(TAKARA, CN), T4 DNA连接酶(NEB, CN), Taq酶(博彩, CN), Rnase A(Amresco, USA)Gel extraction kit(BioFlux, CN), PCR purification kit(BioFlux, CN), Prime Script 1st Strand cDNA Synthesis kit(TAKARA, CN), Takara MutanBest kit(TAKARA, CN), QIAGEN Plasmid Midi kit(100)(QIAGEN, DEU), DL2000 DNA marker(TAKARA, CN).
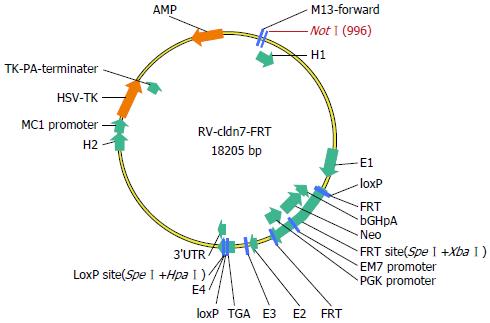
1.2.1 Claudin-7条件性基因敲除(CKO)打靶载体的构建: Claudin-7 CKO打靶载体结构如(图1)所示, 参照相关文献[3,4]进行载体构建. 在Claudin-7基因的4号外显子(69, 967, 555-69, 967, 885)下游的内含子序列中插入LoxP位点, 在2号外显子(69, 966, 943-69, 967, 107)上游内含子序列中插入FRT-Neo-FRT-LoxP元件. 利用Cre重组酶特异识别34 bp的部分回文的Loxp位点之间的序列, 发生特异性的重组或删除.
1.2.2 电击转染ES细胞及筛选: 转染前将打靶载体用NotⅠ酶线性化, ES细胞用胰酶消化后重悬于PBS中, 取25 µg线性化的打靶载体质粒DNA与1 mL细胞混匀; 加入电穿孔槽中电击, 电击参数为240 V、500 µF, 电击时间为6-8 ms; 将电击后的细胞分入4个已铺好滋养层细胞的培养皿中, 置于CO2孵箱培养, 24 h后换成ES细胞筛选培养液(每盘加入10 mL新鲜的ES-DMEM和200 µg/mL G418). 每天更换ES细胞筛选培养液, 第8-10天挑取ES细胞克隆. 将挑取的单个未分化ES克隆置于96孔板中, 充分消化后将每个克隆一分为二, 一份冻存, 另一份培养后转移至24孔培养板上扩增并提取基因组DNA, 用EcoRV酶消化过夜, 缓慢电泳36 h, 通过Long Range PCR及Southern blot筛选出中靶克隆.
1.2.3 囊胚注射制备嵌合体小鼠: (1)小鼠囊胚的准备: 选取4 wk龄左右的♀ C57BL/6N小鼠, 48 h间隔注射孕马血清促性腺激素和人绒毛膜促性腺激素促进排卵. 与♂ C57BL/6N小鼠合笼后次晨检查阴栓, 记为0.5 d. 第2.5天取其胚胎, 培养过夜后用于显微注射; (2)囊胚显微注射: 将以上制备的ES细胞备用, 挑选小而圆、表面光亮的ES细胞进行注射, 每个囊胚注射12-15个ES细胞[5,6]. 注射后的囊胚继续孵箱内培养3 h, 挑选形态正常, 透明带完整的囊胚进行移植; (3)囊胚移植: 选8-10 wk性成熟♀ C57BL/6N小鼠与输精管结扎♂鼠合笼, 次晨检查阴栓(记为0.5 d), 2 d后可用于囊胚的子宫移植. 移植成功后, 仔鼠在17-21 d后出生, 数天后由毛色初步判断是否为嵌合体小鼠[1].
1.2.4 ♂嵌合体小鼠繁育得到Claudin-7-flox小鼠: 嵌合小鼠出生后, 根据毛色筛选嵌合率在50%及以上的♂鼠. 将其与Flper小鼠配繁一代, 去除Neo抗性基因, 排除Neo基因对小鼠表型分析的干扰, 以获得Claudin-7-flox小鼠.
1.2.5 Claudin-7肠道可诱导性条件性基因敲除小鼠的获得: 筛选Claudin-7-flox杂合小鼠与Pvillin-CreERT2小鼠杂交, 并通过子代自交获得Claudin-7在肠道可诱导性条件性基因敲除的纯合子小鼠(Cldn7fl/flVillin-CreERT2).
1.2.6 肠道Claudin-7基因诱导敲除: Cldn7fl/flVillin-CreERT2纯合子小鼠进行腹腔注射他莫昔芬(Tamoxifen), 剂量为3 mg/只, 连续给药5 d, 对照组给同等剂量的溶剂.
1.2.7 肠道病理切片、HE染色、免疫印迹(Western blot): 解剖1.2.6中得到的Claudin-7在肠道可诱导性条件性基因敲除的纯合子小鼠, 取小鼠肠道制作病理切片进行HE染色及Western blot分析.
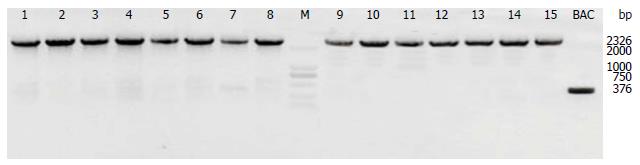
所有质粒均经PCR鉴定, 终载体中FRT位点至第二个LoxP位点之间片段均存在. 利用loxptF:GTACGAGTTTGGACCTGCCA引物单向测序(约2000 bp), 检测结果显示34 bp的LoxP位点正确. 电转后得到药物抗性ES细胞克隆96个, 分别经Long Range PCR及Southern blot鉴定, 最终筛选出6个阳性克隆. 载体构建鉴定如图2.
显微注射后得到由基因敲除ES细胞和供体胚胎细胞共同发育而来的嵌合小鼠. 挑选嵌合率在50%及以上的成熟♂嵌合体小鼠与Flper小鼠配繁一代后再与野生型B6小鼠进行交配, 得到的F1代小鼠, 经PCR鉴定基因型后获得Claudin-7-flox杂合体(基因型表示为: fl/wt)小鼠.
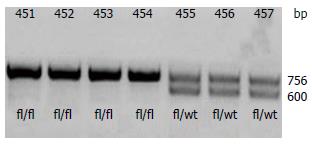
Claudin-7-flox小鼠与Pvillin-CreERT2小鼠杂交, 后代小鼠自交后进行剪尾鉴定, 成功获得肠道诱导性条件性基因敲除(Cldn7fl/flVillin-CreERT2)的小鼠模型, 经基因型鉴定均为Cldn7fl/flVillin-CreERT2(图3).
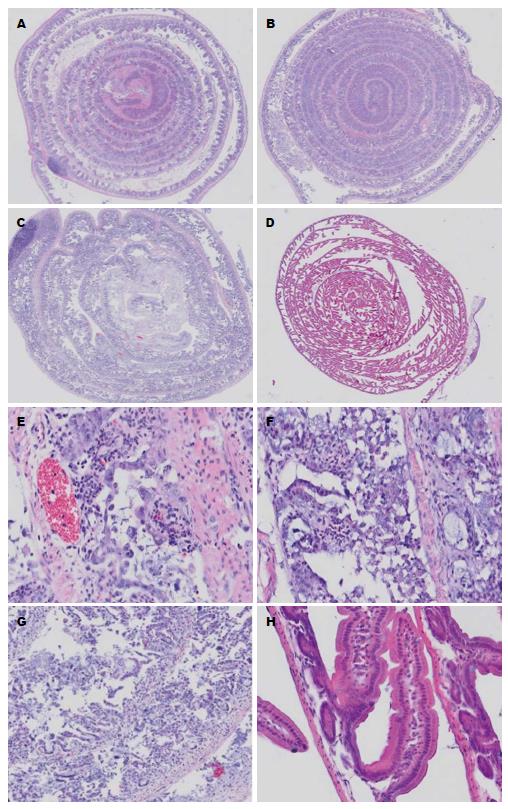
实验组连续给药后第5天晚陆续死亡, 溶剂对照鼠给药结束后第3天仍存活. 处死小鼠并进行肠道切片HE染色(图4), 显示实验组小鼠肠上皮细胞明显脱落、极性丧失、并伴有显著的黏膜增厚和大量炎性细胞(淋巴细胞、巨噬细胞、中性粒细胞)的浸润. 溶剂对照组小鼠肠上皮结构完整. 对肠道上皮进行蛋白免疫印迹检测(图5), 显示溶剂对照组Claudin-7表达存在, 他莫昔芬药物组Claudin-7表达缺失.
Claudin-7是Claudin家族的主要成员之一, 主要分布在肠道、胃、肺、膀胱、皮肤和肾脏等部位, 其异常表达导致了细胞旁紧密连接的功能异常, 进一步导致细胞旁通透性增加, 并允许营养物质和其他肿瘤相关因子扩散, 导致了肿瘤的侵袭和转移[7-11]. 但目前的研究结果多局限于细胞系及组织水平, 缺乏整体动物水平的研究, 因此, 我们考虑从建立动物模型的基础上, 对Claudin-7进行深入研究. 通过基因敲除, 可以从整体和细胞水平上反应基因敲除后一系列表型的改变. 而小鼠基因与人类非常相似, 且小鼠生命力强、操作方便、易于得到, 使得小鼠已成为肿瘤学、生理学、免疫学和遗传学研究中重要的手段[2,12,13].
基因敲除技术是近年来生命科学基础研究领域的重大突破, 是研究基因功能的重要工具[12], 他是指运用特定的方法及手段, 在体外构建相应的打靶载体, 通过同源重组的方式, 敲除一个序列已知但功能未知的基因, 令特定的基因功能丧失作用, 进而推测出该基因的生物学功能. 他的策略通常是先构建一个两端与目的基因同源的外源序列, 外源序列通常包含新霉素基因(Neo). 当该段序列与目的基因在ES细胞内发生同源重组时, 则可在选择性标记G418上生长, 因此G418可作为阳性筛选[14]. 此外, 通常也引入一个与同源序列平行的具有毒性的外源基因(如白喉基因)[15], 当发生同源重组时, 这个基因被剪切, 宿主细胞得以存活, 而随机插入的基因片段则因为自身毒性作用而不能存活. 这样, 内源性目的基因的转录子发生中断, ES细胞不再表达这种基因, 相当于这种基因被敲除.
我们前期建立了Claudin-7基因全身性敲除小鼠[16]. 遗憾的是小鼠7 d左右死亡, 难以进一步研究Claudin-7在肠道中的功能; 并且, 这种全身性基因敲除技术影响了机体的所有细胞, 不利于明确基因敲除动物出现的表型是该基因直接还是间接造成的原因. 为了更精确的探明目的基因在特定细胞中的特异性作用, 在原有全身性基因敲除的基础上, 我们利用Cre/LoxP系统建立了肠道Claudin-7可诱导性条件性基因敲除小鼠模型.
Cre/LoxP技术是近年来普遍应用的一种条件性基因敲除的方法[17,18], 这项技术得益于从噬菌体P1中发现的Cre重组酶. 将Cre重组酶基因插入一段启动子序列中, 通过转基因小鼠技术培育表达Cre重组酶的小鼠, 当其与基因组序列中两端锚定Loxp序列的转基因小鼠杂交后, 可实现靶基因的特异性敲除.
运用这一系统建立的基因敲除模型需要两种转基因动物. 一种是在靶基因序列中插入Loxp的杂合子小鼠: Claudin-7-flox小鼠, 删除两个Loxp位点之间的序列也就获得了Claudin-7的基因敲除小鼠. 另一种是表达Cre重组酶的转基因小鼠: Pvillin-Cre转基因小鼠(Cre重组酶特异性表达于肠道组织中). 当Claudin-7-flox小鼠与Pvillin-Cre转基因小鼠杂交后, 其切除Claudin-7编码区两个同向Loxp位点之间的序列, 并可遗传到子代细胞中. 而其他组织由于Cre不表达, Claudin-7的表达水平不会变化. 通过Cre/Loxp体系对基因进行组织特异性的调控, 为研究基因在特定组织中的作用提供可能.
为研究细胞旁屏障功能变化是否启动炎症, Tanaka等[19]成功培育出肠Claudin-7条件性基因敲除小鼠(CKO小鼠), 该实验中CKO小鼠出生时即表现出致命性的表型改变, 在出生后4 wk后死亡, 对死亡小鼠肠道进行病理组织切片染色, 发现小鼠肠道上皮出现明显的炎症反应, 丧失了基本的肠道基本结构.
肠道Claudin-7条件性基因敲除的小鼠存活时间过短, 不利于进行进一步的大肠癌肿瘤发生发展研究, 为此我们将Claudin-7-flox小鼠与Pvillin-CreERT2转基因小鼠[20,21]杂交, 从而得到了基因型为Cldn7fl/flVillin-CreERT2的小鼠. Pvillin-CreERT2转基因小鼠其Cre重组酶已经融合到一个人雌激素受体突变的配体结合域, 产生了一个他莫昔芬依赖的Cre重组酶, 该重组酶由他莫昔芬激活, 而不是雌二醇. 转基因小鼠在巨细胞病毒启动子的控制下表达Cre重组酶, 对小鼠使用他莫昔芬后会导致两Loxp位点间的染色体基因整体切除, 而未接受过他莫昔芬药物的小鼠不会产生此现象[20]. 利用他莫昔芬诱导从而实现肠道Claudin-7的可诱导性敲除. 然而目前尚无明确的药物剂量梯度, 因此进一步探索可靠的药物梯度从而进一步延长小鼠存活时间达到体内成瘤将是未来的重要研究方向.
相关研究表明Claudin-7与多种恶性肿瘤发生发展呈负相关, 但目前仍缺乏强有力的体内实验依据. 为模拟炎症-大肠癌模型, 本研究利用Cre/Loxp重组系统实现条件性基因敲除, 建立了肠道Claudin-7可诱导性条件性基因敲除小鼠模型.
陆斌, 副教授, 中国人民解放军第二军医大学
目前人们认为上皮细胞的细胞旁屏障功能的缺陷启动了肠道炎症, 然而哪种类型的分子机制参与炎症反应仍然是未知的. Claudin-7是主要在肠道表达的Claduin蛋白家族之一, 肠道特定基因敲除小鼠模拟结肠炎症-肿瘤发展的机制是目前研究的热点领域, 但目前小鼠模型的存活时间仍远未达到实验要求.
日本学者Hiroo Tanaka提及了Claudin-7肠道特定条件基因敲除小鼠模型的构建. 该研究认为穿过细胞紧密连接的特定的细胞旁路小有机溶质流量的增加, 启动了肠道炎症的发生.
本研究首次成功的构建了肠道Claudin-7可诱导性条件性基因敲除小鼠模型, 对模拟炎症-肿瘤发生发展奠定了实验基础.
本实验构建的肠道Claudin-7可诱导性条件性基因敲除小鼠模型, 延长了小鼠生存时间, 具有肠道肿瘤诱导的可行性, 为体内研究Claudin-7的分子机制奠定了实验基础.
Cre-Loxp系统: Cre重组酶属于位点特异性重组酶, 他能识别34 bp的部分回文的Loxp位点之间的序列, 当两个Loxp序列方向相同并且位于同一条染色体上时, Cre重组酶将相同方向的Loxp位点之间的核苷酸序列切除成为游离态; 当两个Loxp的序列相反时, Cre重组酶使两个Loxp序列颠倒.
通过Cre-Loxp系统构建了肠道内Claudin-7基因可诱导条件性敲除小鼠模型, 利用他莫昔芬可成功诱导小鼠肠道上皮细胞Claudin-7基因表达的缺失, 有望为Claudin-7基因与肠道肿瘤的相关性研究提供动物模型.
编辑: 郭鹏 电编: 都珍珍
| 1. | Koller BH, Hagemann LJ, Doetschman T, Hagaman JR, Huang S, Williams PJ, First NL, Maeda N, Smithies O. Germ-line transmission of a planned alteration made in a hypoxanthine phosphoribosyltransferase gene by homologous recombination in embryonic stem cells. Proc Natl Acad Sci U S A. 1989;86:8927-8931. [PubMed] |
| 3. | Liu P, Jenkins NA, Copeland NG. A highly efficient recombineering-based method for generating conditional knockout mutations. Genome Res. 2003;13:476-484. [PubMed] [DOI] |
| 4. | Chan W, Costantino N, Li R, Lee SC, Su Q, Melvin D, Court DL, Liu P. A recombineering based approach for high-throughput conditional knockout targeting vector construction. Nucleic Acids Res. 2007;35:e64. [PubMed] [DOI] |
| 6. | 吴 兴龙. ES小鼠的制备及SP-B mRNA的表达分析. 保定: 河北农业大学 2011; . |
| 7. | Van Itallie CM, Anderson JM. Claudin interactions in and out of the tight junction. Tissue Barriers. 2013;1:e25247. [PubMed] [DOI] |
| 9. | Mineta K, Yamamoto Y, Yamazaki Y, Tanaka H, Tada Y, Saito K, Tamura A, Igarashi M, Endo T, Takeuchi K. Predicted expansion of the claudin multigene family. FEBS Lett. 2011;585:606-612. [PubMed] [DOI] |
| 10. | Schneeberger EE, Lynch RD. The tight junction: a multifunctional complex. Am J Physiol Cell Physiol. 2004;286:C1213-C1228. [PubMed] [DOI] |
| 11. | Runkle EA, Mu D. Tight junction proteins: from barrier to tumorigenesis. Cancer Lett. 2013;337:41-48. [PubMed] [DOI] |
| 13. | 石 玉衡. 基因敲除模型小鼠在疾病研究中的应用. 中国组织工程研究与临床康复. 2011;15:6239-6242. |
| 15. | 方 悦群, 王 春晖, 王 涛, 何 星, 崔 萱林, 谢 贵林, 王 秉瑞. 白喉毒素基因序列染色体整合质粒的构建[J]. 中华微生物学和免疫学杂志. 2001;21:76-79. |
| 16. | Ding L, Lu Z, Foreman O, Tatum R, Lu Q, Renegar R, Cao J, Chen YH. Inflammation and disruption of the mucosal architecture in claudin-7-deficient mice. Gastroenterology. 2012;142:305-315. [PubMed] [DOI] |
| 17. | Nishihama R, Ishida S, Urawa H, Kamei Y, Kohchi T. Conditional Gene Expression/Deletion Systems for Marchantia polymorpha Using its Own Heat-Shock Promoter and Cre/loxP-Mediated Site-Specific Recombination. Plant Cell Physiol. 2015; Jul 6. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Okuyama T, Isoe Y, Hoki M, Suehiro Y, Yamagishi G, Naruse K, Kinoshita M, Kamei Y, Shimizu A, Kubo T. Controlled Cre/loxP site-specific recombination in the developing brain in medaka fish, Oryzias latipes. PLoS One. 2013;8:e66597. [PubMed] [DOI] |
| 19. | Tanaka H, Takechi M, Kiyonari H, Shioi G, Tamura A, Tsukita S. Intestinal deletion of Claudin-7 enhances paracellular organic solute flux and initiates colonic inflammation in mice. Gut. 2015;64:1529-1538. [PubMed] [DOI] |
| 20. | Metzger D, Chambon P. Site- and time-specific gene targeting in the mouse. Methods. 2001;24:71-80. [PubMed] [DOI] |
| 21. | Trinh KR, Morrison SL. Site-specific and directional gene replacement mediated by Cre recombinase. J Immunol Methods. 2000;244:185-193. [PubMed] [DOI] |