修回日期: 2015-09-13
接受日期: 2015-09-28
在线出版日期: 2015-11-08
目的: 探讨高血糖对胰腺癌浸润转移的影响.
方法: 选取胰腺癌患者111例, 其中合并高血糖者31例为研究组, 血糖正常者80例为对照组. 分别比较两组患者的肿瘤相关血清学指标[甲胎蛋白(α-fetoprotein, AFP)、血清癌胚抗原(carcinoembryonic antigen, CEA)、糖蛋白抗原125(carbohydrate antigen 125, CA125)、CA19-9、CA724、CA15-3、CA242、血清铁蛋白]、免疫组织化学Ki67指数和各项临床病理特征(肿瘤体积、肿瘤分化程度、癌旁胰腺组织的慢性炎症、淋巴细胞包绕神经、癌组织的神经浸润、淋巴结转移、静脉癌栓、远处脏器转移).
结果: 胰腺癌血糖正常组与胰腺癌高血糖组比较, CA724、血清铁蛋白浓度、Ki67指数、肿瘤分化程度、癌旁胰腺组织的慢性炎症、淋巴细胞包绕神经、癌组织的神经浸润、淋巴结转移、静脉癌栓、远处脏器转移等指标差异有统计学意义(P<0.05), 而AFP、CEA、CA125、CA19-9、CA15-3、CA242、肿瘤的体积等指标差异无统计学意义(P>0.05).
结论: 提示高血糖可能通过增强肿瘤的侵袭性和转移能力而参与胰腺癌的恶性进展; 因此对血糖增高的胰腺癌患者有必要做好血糖的监控, 以提高其生活质量和改善预后.
核心提示: 通过对临床标本的血清学检测、免疫组织化学检查和对临床病理资料的整理分析, 从临床角度说明高血糖可能促进胰腺癌的浸润和转移, 因此在对胰腺癌患者进行治疗时不能忽视血糖的监控.
引文著录: 秦雯, 陈傲寒, 甘青青, 李坤芳, 夏宁. 高血糖对胰腺癌浸润转移的影响. 世界华人消化杂志 2015; 23(31): 4975-4981
Revised: September 13, 2015
Accepted: September 28, 2015
Published online: November 8, 2015
AIM: To evaluate the effect of hyperglycemia on pancreatic cancer infiltration and metastasis.
METHODS: One hundred and eleven patients with pancreatic cancer were selected as participants. Among them, 31 patients with hyperglycemia were included in a research group, and 80 patients with normal glycemia were included in a control group. Serological indicators related to tumor [including α-fetoprotein (AFP), carcino-embryonic antigen (CEA), carbohydrate antigen 125 (CA125), CA19-9, CA724, CA15-3, CA242 and serum ferritin], Ki67 proliferation index and clinicopathological features (including tumor volume, tumor differentiation degree, chronic inflammation of the pancreas tissue adjacent to carcinoma, nerves surrounding lymphocytes, neural invasion of cancer tissue, lymph node metastasis, venous cancer embolism and distant organ metastasis) were compared between the two groups.
RESULTS: Compared with the control group, the research group showed a significant difference in CA724, serum ferritin, Ki67 proliferation index, tumor differentiation degree, chronic inflammation of the pancreas tissue adjacent to carcinoma, nerves surrounding lymphocytes, neural invasion of cancer tissue, lymph node metastasis, venous cancer embolism and distant organ metastasis (P < 0.05). However, the differences in AFP, CEA, CA125, CA19-9, CA15-3, CA242 and tumor volume between the two groups were not significant (P > 0.05).
CONCLUSION: Hyperglycemia may contribute to the malignant progression of pancreatic cancer through enhancing tumor infiltration and metastasis. Thus, blood glucose should be well monitored for pancreatic cancer patients with hyperglycemia in order to improve their life of quality and prognosis.
- Citation: Qin W, Chen AH, Gan QQ, Li KF, Xia N. Effect of hyperglycemia on infiltration and metastasis of pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(31): 4975-4981
- URL: https://www.wjgnet.com/1009-3079/full/v23/i31/4975.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i31.4975
胰腺癌是一种恶性程度高、病情进展快、预后极差的消化系肿瘤. 其预后主要与局部复发、腹膜后浸润、周围神经浸润、淋巴结转移和肝转移有关. 近年来, 越来越多的研究[1,2]表明, 糖尿病与胰腺癌的发生发展密切相关: 有将近50%-80%的胰腺癌患者在确诊时, 同时符合糖尿病的诊断标准或是有糖耐量受损. 然而, 高血糖与胰腺癌浸润、转移的关系报道较少. 本研究通过临床标本的血清学检测、免疫组织化学检查和对临床病理资料的整理分析, 探讨高血糖对胰腺癌浸润转移的影响.
随机抽取2012-06/2015-06于广西医科大学第一附属医院诊断为胰腺癌的患者111例, 其中合并高血糖的胰腺癌患者31例为研究组, 血糖正常的胰腺癌患者80例为对照组. 研究组31例中: 男16例、女15例, 年龄42-81岁, 平均年龄62.81岁±10.92岁. 对照组80例中: 男41例、女39例, 年龄42-79岁, 平均年龄62.43岁±9.88岁. 本研究中胰腺癌患者入组前均未经过放、化疗及手术治疗, 且均有术后病理证实. 研究组与对照组胰腺癌患者的基本资料比较差异无统计学意义(P>0.05), 具有可比性. 瑞士罗氏Elecsys2010型电化学发光免疫分析仪及其提供的试剂盒进行血清学检测. Ki67免疫组织化学检测试剂购自福建迈新生物技术有限公司.
1.2.1 肿瘤相关血清学指标的检测: 所有入组患者均实施空腹静脉采血. 所有血液样本在4 ℃冰箱保存的条件下于24 h内进行处理和检测. 采用瑞士罗氏Elecsys2010型电化学发光免疫分析仪, 由专人按试剂盒操作标准检测甲胎蛋白(alpha-fetoprotein, AFP)、血清癌胚抗原(carcinoembryonic antigen, CEA)、糖蛋白抗原125(carbohydrate antigen 125, CA125)、CA19-9、CA724、CA15-3、CA242、血清铁蛋白等8种肿瘤相关血清学指标.
1.2.2 Ki67免疫组织化学检测: 将入组患者手术标本制成的蜡块制成4 μm厚的连续切片, 染色前常规脱蜡、水化, 经PBS液3次冲洗后进行抗原修复. 抗原修复条件为: pH 6.0枸橼酸缓冲液高压蒸汽修复. 之后用3%H2O2灭活内源性过氧化酶的活性, 经PBS液3次冲洗后用一抗4 ℃孵育过夜、二抗常温孵育、DAB显色、苏木精复染、盐酸乙醇分化, 最后脱水、透明、封片、镜检. Ki67阳性染色的判读[3]: 任意选取5个高倍视野中阳性细胞所占的百分比, 取其平均值来作为结果的判定依据.
1.2.3 临床病理资料的整理分析: 复查入组患者存档的HE切片, 记录肿瘤体积、分化程度、神经浸润、癌旁胰腺慢性炎症、淋巴细胞包绕神经、淋巴结转移、静脉癌栓形成和远处脏器转移情况. 其中肿瘤体积(V) = a×b2/2, a为肿瘤长径(cm), b为肿瘤短径(cm).
统计学处理 应用SPSS16.0统计学软件包对实验数据进行统计分析. 首先进行数据正态性检验, 符合正态分布者使用mean±SD表示, 不符合正态分布者使用四分位间距表示. 两组间率的比较使用χ2检验, 肿瘤大小和Ki67指数使用非参数检验法, P<0.05为差异有统计学意义.
胰腺癌血糖正常组与胰腺癌高血糖组比较, 血清AFP、CEA、CA125、CA15-3、CA19-9、CA242浓度差异均无统计学意义(P>0.05), 而血清CA724、铁蛋白浓度差异有统计学意义(P<0.05)(表1).
| 血清学指标 | 胰腺癌高血糖组(n = 31)[P50(P25, P75)] | 胰腺癌血糖正常组(n = 80)[P50(P25, P75)] | Z值 | P值 |
| AFP | 2.89(1.92, 3.70) | 2.61(1.93, 3.91) | -0.026 | 0.979 |
| CEA | 5.26(2.07, 13.43) | 4.04(1.65, 11.13) | -1.328 | 0.184 |
| CA125 | 34.30(19.10, 176.20) | 27.87(12.18, 86.66) | -1.660 | 0.097 |
| CA15-3 | 12.34(9.09, 33.70) | 14.00(7.75, 20.35) | -0.335 | 0.737 |
| CA19-9 | 350.70(11.75, 1049.0) | 73.47(11.46, 898.50) | -0.917 | 0.359 |
| CA242 | 62.20(7.60, 157.50) | 29.50(2.35, 157.20) | -0.764 | 0.445 |
| CA724 | 1.30(0.80, 2.10) | 6.30(1.80, 17.08) | -4.632 | 0.000 |
| 血清铁蛋白 | 952.40(219.49, 1856.4) | 341.80(205.10, 536.37) | -3.254 | 0.001 |
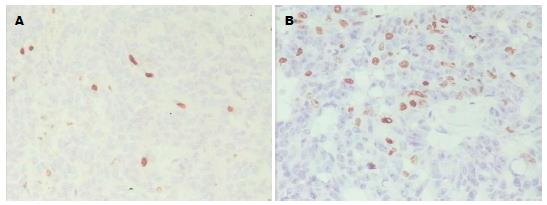
Ki67指数在胰腺癌高血糖组的癌组织中的中位数值是20%, 而在胰腺癌血糖正常组的癌组织中的中位数值是10%, 即Ki67指数在高血糖组的胰腺癌组织中高于血糖正常组的胰腺癌组织(P<0.05)(图1).
两组胰腺癌患者在肿瘤体积的比较上差异无统计学意义(P>0.05), 而在肿瘤分化程度、癌旁胰腺组织的慢性炎症、淋巴细胞包绕神经、癌组织的神经浸润、淋巴结转移、静脉癌栓、远处脏器转移这7项临床病理学特征的比较上差异有统计学意义(P<0.05). 在胰腺癌高血糖组中, 低分化或未分化癌、癌旁胰腺组织的慢性炎症、淋巴细胞包绕神经、癌组织的神经浸润、淋巴结转移、静脉癌栓、远处脏器转移发生的概率远远高于胰腺癌血糖正常组(表2).
| 临床病理特征 | 胰腺癌高血糖组(n = 31) | 胰腺癌血糖正常组(n = 80) | χ2(Z)值 | P值 |
| 肿瘤体积(cm3)[P50(P25, P75)] | 31.27(3.76, 55.23) | 14.04(3.69, 39.75) | -0.950 | 0.342 |
| 低分化癌或未分化癌n(%) | 7(22.58) | 7(8.75) | 3.878 | 0.049 |
| 癌旁胰腺慢性炎症n(%) | 29(93.55) | 41(51.25) | 17.161 | 0.000 |
| 淋巴细胞包绕神经现象n(%) | 28(90.32) | 47(58.75) | 10.163 | 0.001 |
| 癌组织的神经浸润n(%) | 27(87.10) | 45(56.25) | 9.328 | 0.002 |
| 淋巴结转移n(%) | 16(51.61) | 24(30.00) | 4.528 | 0.033 |
| 静脉癌栓n(%) | 14(45.16) | 17(21.25) | 6.346 | 0.012 |
| 远处脏器转移n(%) | 10(32.26) | 11(13.75) | 4.989 | 0.026 |
目前, 高血糖对眼、肾、神经和心脏等器官的影响受到广泛重视, 而其对肿瘤的影响则常常被忽视. 流行病学调查发现糖尿病在实质器官恶性肿瘤的发生中起到重要作用, 这些恶性肿瘤包括肝癌、胰腺癌、结直肠癌、乳腺癌、子宫内膜癌和膀胱癌[1,2,4-7]; 其中肝癌和胰腺癌与高血糖的关系最为密切. 还有研究[8-12]发现, 高血糖与肿瘤的进展和演化密切相关, 例如导致恶性度更高的表型出现、促进肿瘤细胞的增殖、抑制肿瘤细胞的凋亡、增加神经浸润的机会、对化疗产生耐药性等. 这是因为高血糖不仅能通过增加循环中的炎性细胞因子间接影响肿瘤细胞, 还能通过激活调控多种信号通路[8]的酶而直接影响肿瘤细胞[13,14].
葡萄糖是肿瘤细胞唯一的能量来源. 瓦尔堡效应指出, 肿瘤细胞的葡萄糖代谢是增加的, 特别是通过无氧糖酵解的方式增加. 因此, 长期的高血糖状态可作为营养基而促进肿瘤细胞的生长, 使肿瘤细胞有更充足的能量来完成快速增殖. 肿瘤细胞株的体外实验已经证实高血糖能使促进肿瘤细胞增殖、浸润、转移的肿瘤基因的表达增加[15], 从而引起相关蛋白的增加, 如细胞周期蛋白依赖性激酶2、转录因子E2F、细胞周期素A、细胞周期素E等. 此外, 高血糖还降低钙黏蛋白E的水平, 并增加蛋白激酶C-α亚基(protein kinase C-α, PKC-α)通路, 导致更具侵袭性表型的产生[15]. 就胰腺癌而言, 在高血糖的条件下, 人类胰腺癌细胞株BxPC-3和MIA PaCa-2中酪氨酸激酶受体基因、转染重排基因水平是增加的[16], 因此导致了肿瘤细胞的增殖. 还有研究表明, 人类胰腺癌细胞株BxPC-3和Panc-1的转移和侵袭能力与超氧化物歧化酶(superoxide dismutase, SOD)有关, 而SOD能在高血糖的条件下催化更多的超氧阴离子转化为过氧化氢[17].
甚至在肿瘤的神经浸润(perineural invasion, PNI)中高血糖也起到了不容忽视的作用. 肿瘤的神经浸润可发生在没有淋巴结转移和血管浸润的情况下, 他是一种与侵袭性有关的肿瘤生物学行为, 能导致更差的临床预后. 近年来有研究[18]表明, 高血糖能促进几种肿瘤的神经浸润, 特别是胰腺癌. 高血糖可以使神经元的血糖水平增高4倍; 如果这种高血糖状态持续存在, 细胞内的葡萄糖代谢将导致神经元的损害, 如脱髓鞘作用和神经元轴突的退化. 同时, 在高血糖条件下, 氧化应激和促炎因子水平的升高将导致神经损害和炎症反应. 这些都为肿瘤细胞的神经浸润创造了条件[19].
本研究通过选择与高血糖关系比较密切的胰腺癌作为研究对象, 初步证实了上述观点. 首先将胰腺癌高血糖组与胰腺癌血糖正常组的肿瘤相关血清学指标作了比较. 在这些指标中, CA19-9为黏液糖蛋白抗原, 在胰腺癌中研究和应用最为广泛. 其阳性率最高(70%-85%), 被认为是诊断胰腺癌的"黄金标志物". 有报道称血清CA19-9水平与胰腺肿瘤的大小、位置和TNM分期之间存在一定的关系; CA19-9升高可以作为肿瘤复发转移亚临床诊断的重要辅助诊断指标. 当CA19-9血清浓度>300 U/mL时, 常提示肿瘤已达晚期, >1000 U/mL的胰腺癌90%已不能手术切除. 此外, 另一种糖蛋白抗原CA242也是胰腺癌较好的肿瘤标志物, 其特异性高, 常被用于胰腺癌的诊断. 而肝癌相关抗原AFP、胃癌相关抗原CA724、乳腺癌相关抗原CA15-3、卵巢癌相关抗原CA125、广谱性肿瘤标志物CEA、肿瘤与宿主相互作用后产生的血清铁蛋白在胰腺癌患者血清中也常有升高. 有报道表明上述血清学指标不仅可用于胰腺癌的早期诊断, 还能在一定程度上反映肿瘤的进展和预后. 本研究结果显示: 胰腺癌血糖正常组与胰腺癌高血糖组比较, 血清AFP、CEA、CA125、CA15-3、CA19-9、CA242浓度差异均无统计学意义(P>0.05), 而血清CA724、铁蛋白浓度差异有统计学意义(P<0.05). 这一结果间接反映了高血糖与胰腺癌进展的关系.
本研究还分别对高血糖组的胰腺癌组织和血糖正常组的胰腺癌组织做了Ki67指数的免疫组织化学检查. Ki67是一种核蛋白, 由Pillai等[3]首先发现. 他定位在10号染色体, 在细胞增殖的各期(G1, S, G2和M)中均有表达, 但在细胞静止期G0期不表达, 因此能特异性地反映细胞增殖活性. 有文献报道Ki67指数高低与许多肿瘤分化程度、浸润、转移及预后密切相关. 本研究结果发现在高血糖组的胰腺癌组织中Ki67指数更高(P<0.05), 这也间接说明高血糖与胰腺癌的浸润转移有关.
此外, 本研究还对两组患者的各项临床病理特征进行了比较. 其中包括癌旁胰腺慢性炎症和淋巴细胞包绕神经现象, 因为有研究表明癌旁胰腺慢性炎症中的淋巴细胞以及包绕神经的淋巴细胞所产生的细胞因子与肿瘤的侵袭相关[20-22]. 本研究结果显示: 两组患者在肿瘤体积上的差异无统计学意义(P>0.05), 但在低分化癌或未分化癌、癌旁胰腺慢性炎症、淋巴细胞包绕神经现象、癌组织的神经浸润、淋巴结转移、静脉癌栓、远处脏器转移发生的比率上, 胰腺癌高血糖组均高于胰腺癌血糖正常组(P<0.05). 这就直接说明高血糖与胰腺癌的浸润转移有关.
然而血糖增高和胰腺癌间的因果关系一直以来都是争论的焦点. 一些学者认为糖尿病是胰腺癌的高危因素[23-25], 另一些学者认为胰腺癌患者更容易罹患糖尿病[26]. 还有学者则认为二者可能互为因果, 糖尿病是胰腺癌的高危因素, 且胰腺癌也可以促使糖尿病的发生[27-30].
本研究结果提示, 高血糖可能通过增强肿瘤的侵袭性和转移能力而参与胰腺癌的恶性进展; 因此对血糖增高的胰腺癌患者有必要做好血糖的监控, 以提高其生活质量和改善预后. 但是, 本研究也存在一些不足: 首先, 由于常规病理学检查常常难以做到完全取材和连续切片, 因而易遗漏一些较微小的神经侵犯病灶和微小的癌栓, 所以研究的结果会有少量的偏差. 另外, 后续需要继续补充细胞学以及一些相关的体内外实验研究, 尽可能多角度地证实此结论.
感谢赵同领在本试验中给予的大力帮助.
胰腺癌是预后最差的消化系恶性肿瘤之一. 其疗效差是因为其癌细胞具有较强的局部侵袭和远处转移能力, 就诊时80%-85%的患者由于肿瘤已存在广泛局部浸润和远处转移而失去手术机会. 目前国内外研究表明, 肿瘤的进展不仅与肿瘤细胞本身的生物学特征有关, 还与微环境密切相关; 微环境能与肿瘤细胞相互作用, 从而促进肿瘤细胞的生存、增殖和侵袭. 在这些微环境中血糖的作用不容忽视. 从临床研究的角度探讨高血糖与胰腺癌浸润转移的关系, 将为胰腺癌的临床治疗提供新的思路.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
流行病学调查显示糖尿病患者中某些肿瘤的发病率显著增高, 而糖尿病对这些肿瘤的浸润、转移也有一定影响. 有学者推测高血糖可以给饥饿的肿瘤细胞供能, 从而使其免于凋亡、抵抗化疗、形成更具侵袭性的表型.
Liu等研究发现, 在高血糖的条件下, 人类胰腺癌细胞株BxPC-3和MIA PaCa-2中酪氨酸激酶受体基因、转染重排基因水平是增加的, 因此导致了肿瘤细胞的增殖. Li等研究发现, 人类胰腺癌细胞株BxPC-3和Panc-1的转移和侵袭能力与超氧化物歧化酶(superoxide dismutase, SOD)有关, 而SOD能在高血糖的条件下催化更多的超氧阴离子转化为过氧化氢.
目前关于糖尿病与胰腺癌关系的研究主要集中于糖尿病与胰腺癌发生的关系或胰腺癌与糖尿病发生的关系上, 而糖尿病与胰腺癌浸润转移的关系则少见报道. 本研究通过一系列深入的临床病理分析发现, 高血糖可能增加胰腺癌浸润转移的能力, 为临床治疗提供依据.
对恶性肿瘤的患者, 治疗措施常集中在对肿瘤本身的处理方面. 本研究从临床病理指标变化的角度探索了高血糖与胰腺癌浸润转移的关系, 提示在胰腺癌的治疗中不仅要针对肿瘤本身, 还应注意调控"血糖"等肿瘤所处的微环境, 从而使肿瘤得到更好的控制.
通过寻找内分泌学和肿瘤学两个不同学科的交叉点进行临床和微观病理组织学的研究, 有一定的深度和创新. 目前糖尿病与胰腺癌的因果关系仍然存在争议, 本文对此进行了一定的探索和尝试, 从临床研究的角度为糖尿病对胰腺癌浸润转移的影响提供了依据.
编辑: 郭鹏 电编: 都珍珍
| 1. | Nath SD, Habib SL, Abboud HE. Fasting serum glucose level and cancer risk in Korean men and women. JAMA. 2005;293:2210-2211; author reply 2211. [PubMed] [DOI] |
| 2. | Coughlin SS, Calle EE, Teras LR, Petrelli J, Thun MJ. Diabetes mellitus as a predictor of cancer mortality in a large cohort of US adults. Am J Epidemiol. 2004;159:1160-1167. [PubMed] [DOI] |
| 3. | Pillai K, Pourgholami MH, Chua TC, Morris DL. Prognostic Significance of Ki67 Expression in Malignant Peritoneal Mesothelioma. Am J Clin Oncol. 2015;38:388-394. [PubMed] [DOI] |
| 4. | Yun J, Rago C, Cheong I, Pagliarini R, Angenendt P, Rajagopalan H, Schmidt K, Willson JK, Markowitz S, Zhou S. Glucose deprivation contributes to the development of KRAS pathway mutations in tumor cells. Science. 2009;325:1555-1559. [PubMed] [DOI] |
| 5. | Lipscombe LL, Goodwin PJ, Zinman B, McLaughlin JR, Hux JE. Diabetes mellitus and breast cancer: a retrospective population-based cohort study. Breast Cancer Res Treat. 2006;98:349-356. [PubMed] [DOI] |
| 6. | Mkrtchian S. Targeting unfolded protein response in cancer and diabetes. Endocr Relat Cancer. 2015;22:C1-C4. [PubMed] [DOI] |
| 7. | Lewis JD, Ferrara A, Peng T, Hedderson M, Bilker WB, Quesenberry CP, Vaughn DJ, Nessel L, Selby J, Strom BL. Risk of bladder cancer among diabetic patients treated with pioglitazone: interim report of a longitudinal cohort study. Diabetes Care. 2011;34:916-922. [PubMed] [DOI] |
| 8. | Duan W, Shen X, Lei J, Xu Q, Yu Y, Li R, Wu E, Ma Q. Hyperglycemia, a neglected factor during cancer progression. Biomed Res Int. 2014;2014:461917. [PubMed] [DOI] |
| 9. | Derr RL, Ye X, Islas MU, Desideri S, Saudek CD, Grossman SA. Association between hyperglycemia and survival in patients with newly diagnosed glioblastoma. J Clin Oncol. 2009;27:1082-1086. [PubMed] [DOI] |
| 10. | Gallagher EJ, LeRoith D. Obesity and Diabetes: The Increased Risk of Cancer and Cancer-Related Mortality. Physiol Rev. 2015;95:727-748. [PubMed] [DOI] |
| 11. | Adham SA, Al Rawahi H, Habib S, Al Moundhri MS, Viloria-Petit A, Coomber BL. Modeling of hypo/hyperglycemia and their impact on breast cancer progression related molecules. PLoS One. 2014;9:e113103. [PubMed] [DOI] |
| 12. | Ryu TY, Park J, Scherer PE. Hyperglycemia as a risk factor for cancer progression. Diabetes Metab J. 2014;38:330-336. [PubMed] [DOI] |
| 13. | Suh S, Kim KW. Diabetes and cancer: is diabetes causally related to cancer? Diabetes Metab J. 2011;35:193-198. [PubMed] [DOI] |
| 14. | Johnson JA, Carstensen B, Witte D, Bowker SL, Lipscombe L, Renehan AG. Diabetes and cancer (1): evaluating the temporal relationship between type 2 diabetes and cancer incidence. Diabetologia. 2012;55:1607-1618. [PubMed] [DOI] |
| 15. | Masur K, Vetter C, Hinz A, Tomas N, Henrich H, Niggemann B, Zänker KS. Diabetogenic glucose and insulin concentrations modulate transcriptome and protein levels involved in tumour cell migration, adhesion and proliferation. Br J Cancer. 2011;104:345-352. [PubMed] [DOI] |
| 16. | Liu H, Ma Q, Li J. High glucose promotes cell proliferation and enhances GDNF and RET expression in pancreatic cancer cells. Mol Cell Biochem. 2011;347:95-101. [PubMed] [DOI] |
| 17. | Li W, Ma Q, Li J, Guo K, Liu H, Han L, Ma G. Hyperglycemia enhances the invasive and migratory activity of pancreatic cancer cells via hydrogen peroxide. Oncol Rep. 2011;25:1279-1287. [PubMed] [DOI] |
| 18. | Li J, Ma Q, Liu H, Guo K, Li F, Li W, Han L, Wang F, Wu E. Relationship between neural alteration and perineural invasion in pancreatic cancer patients with hyperglycemia. PLoS One. 2011;6:e17385. [PubMed] [DOI] |
| 19. | Vincent AM, Callaghan BC, Smith AL, Feldman EL. Diabetic neuropathy: cellular mechanisms as therapeutic targets. Nat Rev Neurol. 2011;7:573-583. [PubMed] [DOI] |
| 20. | Bellone G, Smirne C, Mauri FA, Tonel E, Carbone A, Buffolino A, Dughera L, Robecchi A, Pirisi M, Emanuelli G. Cytokine expression profile in human pancreatic carcinoma cells and in surgical specimens: implications for survival. Cancer Immunol Immunother. 2006;55:684-698. [PubMed] [DOI] |
| 21. | Komura T, Sakai Y, Harada K, Kawaguchi K, Takabatake H, Kitagawa H, Wada T, Honda M, Ohta T, Nakanuma Y. Inflammatory features of pancreatic cancer highlighted by monocytes/macrophages and CD4+ T cells with clinical impact. Cancer Sci. 2015;106:672-686. [PubMed] [DOI] |
| 22. | Deng S, Zhu S, Wang B, Li X, Liu Y, Qin Q, Gong Q, Niu Y, Xiang C, Chen J. Chronic pancreatitis and pancreatic cancer demonstrate active epithelial-mesenchymal transition profile, regulated by miR-217-SIRT1 pathway. Cancer Lett. 2014;355:184-191. [PubMed] [DOI] |
| 23. | Song S, Wang B, Zhang X, Hao L, Hu X, Li Z, Sun S. Long-Term Diabetes Mellitus Is Associated with an Increased Risk of Pancreatic Cancer: A Meta-Analysis. PLoS One. 2015;10:e0134321. [PubMed] [DOI] |
| 24. | Mao Y, Tao M, Jia X, Li D. Diabetes associated with short survival in pancreatic cancer. J Clin Oncol. 2015;33:2120-2121. [PubMed] [DOI] |
| 25. | Zechner D, Radecke T, Amme J, Bürtin F, Albert AC, Partecke LI, Vollmar B. Impact of diabetes type II and chronic inflammation on pancreatic cancer. BMC Cancer. 2015;15:51. [PubMed] [DOI] |
| 26. | Li Y, Pan M, Qiu S, Wang P, Shao X, Zhang L. [Analysis of the changes of blood glucose after radiotherapy in pancreatic cancer patients associated with diabetes mellitus and their related factors]. Zhonghua Zhong Liu Za Zhi. 2015;37:33-36. [PubMed] |
| 27. | Zhang C, Yang G, Ling Y, Chen G, Zhou T. The early diagnosis of pancreatic cancer and diabetes: what's the relationship? J Gastrointest Oncol. 2014;5:481-488. [PubMed] [DOI] |
| 28. | Salvatore T, Marfella R, Rizzo MR, Sasso FC. Pancreatic cancer and diabetes: A two-way relationship in the perspective of diabetologist. Int J Surg. 2015;21 Suppl 1:S72-S77. [PubMed] [DOI] |
| 29. | Korc M. Pancreatic cancer-associated diabetes is an "exosomopathy". Clin Cancer Res. 2015;21:1508-1510. [PubMed] [DOI] |