修回日期: 2014-11-27
接受日期: 2014-12-05
在线出版日期: 2015-01-28
目的: 探讨微型染色体维持蛋白7(mini-chromosome maintenance proteins 7, MCM7)和尾型同源盒基因-2蛋白(caudal-related homeobox gene 2, CDX2)在Ⅱ期结直肠癌组织中的表达水平及其与预后相关的临床意义.
方法: 采用免疫组织化学法检测220例Ⅱ期结直肠癌患者癌组织与癌旁组织中MCM7和CDX2蛋白的表达水平; 分析MCM7和CDX2蛋白的表达与Ⅱ期结直肠癌患者临床病理特征及预后的关系.
结果: MCM7蛋白在结直肠癌组织中的阳性表达率为62%, 显著高于癌旁正常组织(12%, P<0.001). CDX2蛋白在结直肠癌组织中的阳性表达率76%, 显著低于癌旁正常组织(98%, P<0.01). MCM7和CDX2蛋白的表达与Ⅱ期结直肠癌患者的性别、年龄和浸润深度均无关(P>0.05), MCM7的表达仅与肿瘤的分化程度呈正相关(P<0.01), CDX2蛋白的表达仅与肿瘤的分化程度呈负相关(P<0.01). 在结直肠癌组织中, MCM7和CDX2蛋白的表达呈负相关(r = -0.773, P<0.05). 生存分析的结果显示, 220例Ⅱ期结直肠癌患者的中位无病生存时间为51 mo. MCM7阳性/CDX2阴性患者的预后最差, 而MCM7阴性/CDX2阳性患者的预后最好.
结论: MCM7和CDX2蛋白表达水平的联合检测对预测Ⅱ期结直肠癌患者的预后具有重要的临床意义, 但是否可作为判断结直肠癌患者预后的标志物仍需进一步研究.
核心提示: 目前的肿瘤的TNM分期尚不能很准确的判断患者的预后, Ⅱ期结直肠癌患者是否行辅助和/或新辅助治疗与预后的关系不明确, 本研究发现微型染色体维持蛋白7(minichromosome maintenance proteins 7)和尾型同源盒基因-2蛋白(caudal-related homeobox gene 2)两种分子标志物可用于预测结Ⅱ期直肠癌患者的预后, 为其临床综合诊治提供依据.
引文著录: 张新星, 于瑞莲, 代小松, 谢沁. MCM7和CDX2蛋白在Ⅱ期结直肠癌组织中的表达及意义. 世界华人消化杂志 2015; 23(3): 495-501
Revised: November 27, 2014
Accepted: December 5, 2014
Published online: January 28, 2015
AIM: To investigate the expression of mini-chromosome maintenance protein 7 (MCM7) and caudal-related homeobox gene 2 (CDX2) in stage Ⅱ colorectal cancer (CRC) and to analyze their correlation with pathological characteristics and prognosis.
METHODS: Immunohistochemistry was used to detect the expression of MCM7 and CDX2 in 220 pairs of stage Ⅱ CRC and adjacent normal tissues. Differential MCM7 and CDX2 expression was analyzed according to the donors' pathological features and prognosis.
RESULTS: MCM7 expression in CRC tissues was significantly higher than that in corresponding adjacent normal tissues (P < 0.001), whereas CDX2 abundance in malignant tissues was dramatically lower compared with corresponding normal counterparts (P < 0.01). Moreover, MCM7 was correlated inversely with tumor differentiation, whereas CDX2 was positively related to tumor differentiation. Kaplan-Meier survival analysis revealed that MCM7-/CDX2+patients had a better outcome.
CONCLUSION: The elevated expression of MCM7 and decreased expression of CDX2 could be combined to act as a prognostic factor for stage Ⅱ CRC.
- Citation: Zhang XX, Yu RL, Dai XS, Xie Q. Prognostic significance of expression of MCM7 and CDX2 in stage Ⅱ colorectal cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 495-501
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/495.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.495
结直肠癌是消化系常见的肿瘤之一, 根据世界卫生组织(World Health Organization, WHO)统计, 其发病率和死亡率分别位于所有肿瘤的第3位和第4位[1]. 结直肠癌在中国的恶性肿瘤中的发病率列第5位, 并且发病率有逐年上升的趋势[2], 2012年中国肿瘤登记年报显示, 肿瘤发病的排位中, 结直肠癌首次超过胃癌, 跃居第2位[3].
结直肠癌的发生发展是一个多基因、多因子共同作用的结果, 其治疗的方案是以手术治疗为主, 结合各种辅助治疗的综合治疗. Ⅰ期患者除了手术外不需要接受任何额外的治疗, 因为他们局部复发率很低(约3%), 进行新辅助治疗的收益非常小. Ⅲ期患者可以从新辅助治疗中获益, 而基于TNM分期的Ⅱ期结直肠癌患者无论是辅助治疗还是新辅助治疗目前仍具较大争议性, 哪些患者可以受益仍不明确[1]. 肿瘤的TNM分期系统虽然是目前国际上作为通用的肿瘤分期系统, 但目前的TNM分期尚不能很准确的判断患者的预后[4], 因此希望通过发现新的分子标志物用于预测结直肠癌患者的预后. 当前, 关于分子生物学预后因素的回顾性分析研究提示, 可能存在一组复发风险较高, 预后较差的Ⅱ期结直肠癌患者, 如克里斯汀鼠肉瘤病毒致癌基因(Kirsten rat sarcoma viral oncogene, KRAS)突变、微卫星稳定(microsatellite stability, MSS)等, 但识别这些患者预后的标志物尚无前瞻性研究证实[1]. 发现更多的Ⅱ期结直肠癌的分子标志物, 探讨其与临床病理资料及预后的关系, 有助于更好的了解Ⅱ期结直肠癌的生物学行为, 识别有复发高风险和预后差的Ⅱ期患者, 从而选择手术联合辅助和/或新辅助治疗等更优的治疗方案.
微型染色体维持蛋白家族(minichromo-some maintenance proteins, MCMs)是一组DNA复制准许因子, 能够敏感而特异地反映细胞的增殖情况, 是较传统标记分子如增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)更为可靠的增殖指标[5]. 已有研究[6,7]证明MCM在结直肠癌中过度表达, 但是对其判断肿瘤预后的作用并无进一步的研究. MCM7属于MCM家族, 研究证实他不但是DNA复制与延伸的重要组成部分, 同时也和细胞异常增殖密切相关[8]. 尾型同源盒基因-2蛋白(caudal-related homeobox gene 2, CDX2)是一种特异性的核转录因子, 他的表达与肠源性肿瘤的发生密切相关, 而且其表达的降低与更高的结直肠癌的TNM分期、肿瘤的低分化及不良预后有关[9,10]. MCM7和CDX2都是与细胞增殖相关的蛋白, MCM7在结直肠癌中报道较少, 在结直肠癌中两者之间的关系还未有研究. 本研究通过检测MCM7蛋白和CDX2蛋白在Ⅱ期结直肠癌组织中的表达, 探讨二者与各临床病理指标水平及预后的关系, 为Ⅱ期结直肠癌患者综合诊治提供依据.
收集四川省人民医院病理科2001- 05/2011-01手术根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第六版TNM分期术后病理证明为Ⅱ期结直肠癌病例且临床病历资料完整的220例患者作为观察组. 其中男123例, 女97例, 平均年龄60(43-89)岁; 根据世界卫生组织(World Health Organization, WHO)组织学分级, 高、中分化147例, 低分化73例. 以上全部病例资料完整, 术前均未行放化疗(表1). 按全国结直肠癌病理研究统一规范进行诊断和组织学分型. 对照组标本取自手术标本距癌缘5 cm以上的正常直肠组织. 随访上述患者的生存时间为15-81 mo(以mo计算).
| 临床病理特征 | 数值 | MCM7 | CDX2 | ||||
| 低表达 | 高表达 | P值 | 低表达 | 高表达 | P值 | ||
| n | 220 | 84 | 136 | 54 | 166 | ||
| 年龄(岁) | 0.596 | 0.307 | |||||
| <60 | 51(113/220) | 52 | 61 | 31 | 82 | ||
| ≥60 | 49(107/220) | 32 | 75 | 23 | 84 | ||
| 性别 | 0.773 | 0.230 | |||||
| 男 | 56(123/220) | 47 | 76 | 34 | 89 | ||
| 女 | 44(97/220) | 36 | 60 | 20 | 77 | ||
| 分化程度 | 0.002 | 0.001 | |||||
| 高分化/中分化 | 76(147/220) | 66 | 81 | 26 | 121 | ||
| 低分化 | 24(73/220) | 16 | 57 | 28 | 45 | ||
| 分期 | 0.242 | 0.327 | |||||
| T3 | 34(76/220) | 25 | 51 | 16 | 60 | ||
| T4 | 66(144/220) | 59 | 85 | 40 | 106 | ||
1.2.1 免疫组织化学: 收集Ⅱ期结直肠癌病例220例癌组织及其癌旁组织(距癌组织5 cm)标本(病理切片完成后所留组织), 置液氮罐中保存. 标本均经常规甲醛溶液固定, 脱水, 石蜡包埋, 4 µm连续切片. 免疫组织化学染色及显色试剂盒均购自北京中杉金桥公司; 兔抗人多克隆抗体购自Santa Cruz公司, 稀释浓度为1:400. 按照PV-9000试剂盒的步骤进行操作, 切片脱蜡至水, 过氧化氢阻断内源性过氧化物酶, 微波抗原修复, 加入一抗4 ℃过夜, DAB显色, 苏木素复染, PBS代替一抗作阴性对照.
1.2.2 免疫组织化学结果判定: 计数20个高倍视野的免疫组织化学反应着色的细胞, 染色强度积分为: 无染色0分, 弱染色1分, 中等染色2分, 强染色3分; 染色面积积分为: 着色范围 ≤ 10%为0分,>10%-25%为1分,>25%-50%为2分,>50%-75%为3分,>75%为4分. 若两者积分之和≥3分则为阳性(高表达), 低于3分则为阴性(低表达).
1.2.3 预后分析: 采用Kaplan-Meier生存函数统计MCM7阳性/CDX2阳性、MCM7阳性/CDX2阴性、MCM7阴性/CDX2阳性、MCM7阴性/CDX2阴性4组患者的预后.
统计学处理 采用SPSS17.0统计软件包进行统计分析, 计数资料采用两个或多个样本率比较的χ2检验, 组间差异比较采用t检验. 积分相关性采用Spearman等级相关分析. 用Kaplan-Meier进行生存期分析. 以α = 0.05为检验水准. P<0.05为差异有统计学意义.
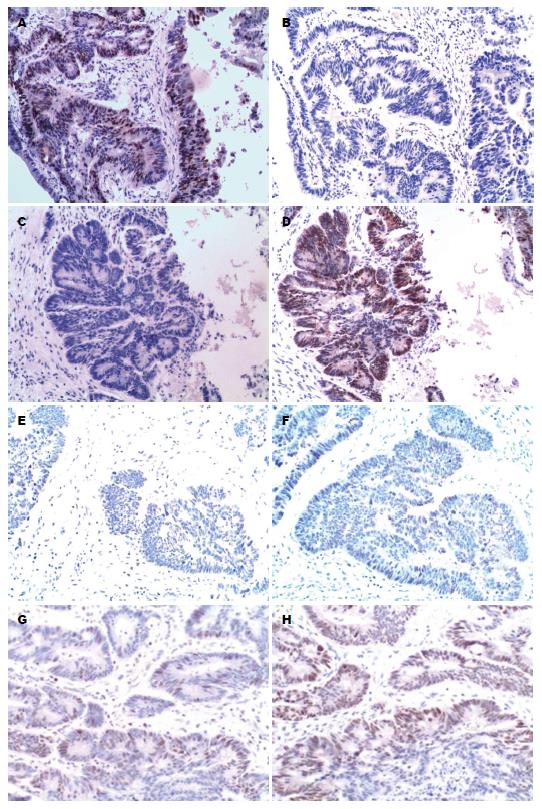
MCM7阳性表达在细胞浆, CDX2阳性表达在细胞核上, 均呈棕黄色细颗粒(图1).
MCM7蛋白在结直肠癌组织中的阳性表达率为62%, 显著高于癌旁正常组织12% (P<0.001). CDX2蛋白在结直肠癌组织中的阳性表达率76%, 显著低于癌旁正常组织98% (P<0.01).
MCM7和CDX2蛋白的表达与结直肠癌患者的性别、年龄、和浸润深度均无关(P>0.05). MCM7的表达与癌组织的分化程度相关, 高、中分化和低分化组的阳性率分别为55.1%和78.1%, 差异有统计学意义(P<0.01), CDX2的表达也与癌组织的分化程度相关, 高、中分化和低分化组的阳性率分别为82.3%和61.6%, 差异有统计学意义(P<0.01).
在结直肠癌组织中, MCM7和CDX2蛋白的表达呈负相关(r = -0.773, P<0.05)(表2).
| MCM7 | CDX2 | 总数 | |
| 阴性 | 阳性 | ||
| 阴性 | 12 | 72 | 84 |
| 阳性 | 42 | 94 | 136 |
| 总数 | 54 | 166 | 220 |
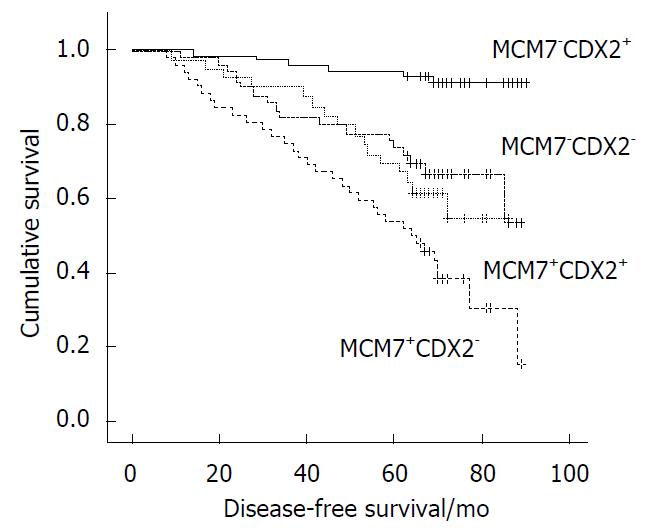
生存分析的结果显示, 220例Ⅱ期结直肠癌患者的中位无病生存时间为51 mo. MCM7阳性/CDX2阴性患者的预后最差, 约42 mo; 而MCM7阴性/CDX2阳性患者的预后最好, 约65 mo(图2).
CDX2是一种特异性的核转录因子, 能够调节肠上皮细胞的增殖和分化, 对肠上皮细胞正常形态和功能的维持起一定的作用[11]. 已有研究[12]表明, 相对于在癌旁组织中的表达, CDX2在结直肠癌组织中呈低表达, CDX2能抑制结直肠肿瘤的发生且CDX2表达的减少与结直肠癌的预后不良有关[9,10]. 本研究发现CDX2蛋白在结直肠癌组织中呈低表达, 且在Ⅱ期结直肠癌组织中的表达水平与癌组织分化程度有关, 在高中分化癌组织中的表达明显高于在低分化癌组织中的表达, 与Olsen等[13]对52篇有关CDX2在结直肠癌中表达研究的分析结果类似. Mizoshita等[14]发现CDX2 mRNA高表达组的生存期明显高于低表达组的生存期, 且预后较好. 本研究生存分析提示结直肠癌组织中CDX2阴性患者的生存期比CDX2阳性患者短, 提示CDX2可以作为Ⅱ期结直肠癌患者预后判断的指标.
MCMs是一组DNA复制准许因子, 共有MCM2-MCM8七个成员, 在调节DNA复制及延伸中起重要的作用, 同时与细胞周期调控、细胞异常增殖、肿瘤形成有关[15]. MCM蛋白已经被报道在其他包括宫颈癌、卵巢癌、非小细胞肺癌和前列腺癌中与TNM分期或组织学分级相关[16-19], 但在结直肠中的表达及其与预后的相关性研究很少. 本研究发现MCM7在Ⅱ期结直肠癌组织中的表达水平与癌组织分化程度有关, MCM7与CDX2表达呈负相关, 且MCM7的高表达与预后相关, MCM7高表达者预后更差. 但也有研究结果表明MCM7是与结直肠癌分化程度、TNM分期、肿瘤大小等情况无关的独立预后因子[20]或者是MCM7能否对结直肠癌预后有预测作用与肿瘤不同分期有关, 在Dukes C期的结直肠癌中, 相对于MCM7低表达的患者, MCM7高表达患者预后差, 生存期短, 而在Dukes A和B期的结直肠癌患者中, 这种差别不明显[21].
CDX2通过上调P21抑制肿瘤细胞的DNA合成是其抑制肿瘤发生的机制之一[22]. 染色体不稳定(chromosomal instability, CIN)、微卫星不稳定(microsatellite instability, MSI)和CpG岛甲基化的表型(epigenetic sileneing through the CpG island methylator phenotype, CIMP)是目前公认的结直肠癌临床预测、预后和指导治疗的重要分子机制. 在结直肠癌的发病机制的相关研究中已经证实, CDX2参与到上述的分子机制中[23]. 在高频率的微卫星不稳定(high-level microsatellite instability, MSI-H)的结直肠癌中, CDX2低表达与肿瘤的分化程度, CpG岛甲基化表型高表达(high-level epigenetic sileneing through the CpG island methylator phenotype, CIMP-H)和不良预后密切相关[24]. 在与肿瘤相关的48种蛋白的研究中, CDX2被挑选出成为结直肠癌CIMP-H的替代指标[25]. 分子生物学研究[26]表明, MCM7蛋白水平能够敏感而特异地反映细胞的增殖情况, 但其在结直肠癌中的具体作用机制和分子途径还不清楚, 目前相关的研究极少, 有待于进一步的研究探讨.
结直肠癌是消化系常见的肿瘤, 其发病机制仍不十分清楚, Ⅱ期结直肠癌患者是否行辅助治疗与预后的关系不明确, 发现更多的Ⅱ期结直肠癌的分子标志物, 探讨其与临床病理资料及预后的关系, 有助于选择更优的治疗方案.
李正荣, 副教授, 副主任医师, 南昌大学附属第一医院胃肠外科(普六病区)
肿瘤的TNM分期系统虽然是目前国际上通用的肿瘤分期系统, 但目前的TNM分期尚不能很准确的判断患者的预后, 因此希望通过发现新的分子标志物用于预测结直肠癌患者的预后, 特别是治疗存在争议的Ⅱ期结直肠癌.
Yuge等学者研究发现, 微型染色体维持蛋白7(minichromosome maintenance proteins 7, MCM7)表达阳性Dukes C期结直肠癌患者比MCM7表达阴性患者预后更差, 肿瘤更容易复发, 生存期更短, 并进一步证实MCM7是Dukes C期结直肠癌患者预后的独立危险因素.
本研究着眼于基于TNM分期的Ⅱ期结直肠癌患者辅助和/或新辅助治疗与否目前仍具较大争议性, 以Ⅱ期结直肠癌患者为研究对象, 发现尾型同源盒基因-2蛋白(caudal-related homeobox gene 2, CDX2)和MCM7两种分子标志物可用于预测Ⅱ期结直肠癌患者的预后, 为Ⅱ期结直肠癌患者综合诊治提供依据.
迄今为止, Ⅱ期结直肠癌患者是否行辅助和/或新辅助治疗与预后的关系不明确, 本研究发现CDX2和MCM7两种分子标志物可用于预测Ⅱ期直肠癌患者的预后, 为Ⅱ期结直肠癌患者临床综合诊治提供依据.
尽管MCM7和CDX2蛋白与结直肠癌的个述已有相关报道, 但文章在整体上有一定的创新性, 特别是选择Ⅱ期结直肠癌患者作为研究对象, 关注预后, 为Ⅱ期结直肠癌患者临床综合诊治提供依据. 对临床有一定的指导意义.
编辑: 韦元涛 电编:都珍珍
| 1. | Southgate BA, Manson-Bahr PE. Studies in the epidemiology of East African leishmaniasis. 4. The significance of the positive leishmanin test. J Trop Med Hyg. 1967;70:29-33. [PubMed] [DOI] |
| 2. | 万 德森. 结直肠癌流行趋势及其对策. 第七届全国大肠癌学术会议论文汇编. 2009;1-4. |
| 4. | O'Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst. 2004;96:1420-1425. [PubMed] |
| 5. | Köhler CU, Kreuter A, Rozynkowski MC, Rahmel T, Uhl W, Tannapfel A, Schmidt WE, Meier JJ. Validation of different replication markers for the detection of beta-cell proliferation in human pancreatic tissue. Regul Pept. 2010;162:115-121. [PubMed] [DOI] |
| 6. | Davies RJ, Freeman A, Morris LS, Bingham S, Dilworth S, Scott I, Laskey RA, Miller R, Coleman N. Analysis of minichromosome maintenance proteins as a novel method for detection of colorectal cancer in stool. Lancet. 2002;359:1917-1919. [PubMed] [DOI] |
| 7. | Scott IS, Morris LS, Bird K, Davies RJ, Vowler SL, Rushbrook SM, Marshall AE, Laskey RA, Miller R, Arends MJ. A novel immunohistochemical method to estimate cell-cycle phase distribution in archival tissue: implications for the prediction of outcome in colorectal cancer. J Pathol. 2003;201:187-197. [PubMed] [DOI] |
| 8. | Freeman A, Morris LS, Mills AD, Stoeber K, Laskey RA, Williams GH, Coleman N. Minichromosome maintenance proteins as biological markers of dysplasia and malignancy. Clin Cancer Res. 1999;5:2121-2132. [PubMed] |
| 9. | Hong KD, Lee D, Lee Y, Lee SI, Moon HY. Reduced CDX2 expression predicts poor overall survival in patients with colorectal cancer. Am Surg. 2013;79:353-360. [PubMed] |
| 10. | Baba Y, Nosho K, Shima K, Freed E, Irahara N, Philips J, Meyerhardt JA, Hornick JL, Shivdasani RA, Fuchs CS. Relationship of CDX2 loss with molecular features and prognosis in colorectal cancer. Clin Cancer Res. 2009;15:4665-4673. [PubMed] [DOI] |
| 11. | 肖 焘, 蔡 军. CDX2与肿瘤的研究进展. 南昌大学学报(医学版). 2011;51:84-88. |
| 12. | Bonhomme C, Duluc I, Martin E, Chawengsaksophak K, Chenard MP, Kedinger M, Beck F, Freund JN, Domon-Dell C. The Cdx2 homeobox gene has a tumour suppressor function in the distal colon in addition to a homeotic role during gut development. Gut. 2003;52:1465-1471. [PubMed] [DOI] |
| 13. | Olsen J, Espersen ML, Jess P, Kirkeby LT, Troelsen JT. The clinical perspectives of CDX2 expression in colorectal cancer: a qualitative systematic review. Surg Oncol. 2014;23:167-176. [PubMed] [DOI] |
| 14. | Mizoshita T, Tsukamoto T, Nakanishi H, Inada K, Ogasawara N, Joh T, Itoh M, Yamamura Y, Tatematsu M. Expression of Cdx2 and the phenotype of advanced gastric cancers: relationship with prognosis. J Cancer Res Clin Oncol. 2003;129:727-734. [PubMed] [DOI] |
| 15. | Calaf GM, Roy D. Gene and protein expressions induced by 17beta-estradiol and parathion in cultured breast epithelial cells. Mol Med. 2007;13:255-265. [PubMed] |
| 16. | Lobato S, Tafuri A, Fernandes PÁ, Caliari MV, Silva MX, Xavier MA, Vago AR. Minichromosome maintenance 7 protein is a reliable biological marker for human cervical progressive disease. J Gynecol Oncol. 2012;23:11-15. [PubMed] [DOI] |
| 17. | Ota T, Clayton AC, Minot DM, Shridhar V, Hartmann LC, Gilks CB, Chien JR. Minichromosome maintenance protein 7 as a potential prognostic factor for progression-free survival in high-grade serous carcinomas of the ovary. Mod Pathol. 2011;24:277-287. [PubMed] [DOI] |
| 18. | Toyokawa G, Masuda K, Daigo Y, Cho HS, Yoshimatsu M, Takawa M, Hayami S, Maejima K, Chino M, Field HI. Minichromosome Maintenance Protein 7 is a potential therapeutic target in human cancer and a novel prognostic marker of non-small cell lung cancer. Mol Cancer. 2011;10:65. [PubMed] [DOI] |
| 19. | Shi YK, Yu YP, Tseng GC, Luo JH. Inhibition of prostate cancer growth and metastasis using small interference RNA specific for minichromosome complex maintenance component 7. Cancer Gene Ther. 2010;17:694-699. [PubMed] [DOI] |
| 20. | Nishihara K, Shomori K, Fujioka S, Tokuyasu N, Inaba A, Osaki M, Ogawa T, Ito H. Minichromosome maintenance protein 7 in colorectal cancer: implication of prognostic significance. Int J Oncol. 2008;33:245-251. [PubMed] |
| 21. | Ishibashi Y, Kinugasa T, Akagi Y, Ohchi T, Gotanda Y, Tanaka N, Fujino S, Yuge K, Kibe S, Yoshida N. Minichromosome maintenance protein 7 is a risk factor for recurrence in patients with Dukes C colorectal cancer. Anticancer Res. 2014;34:4569-4575. [PubMed] |
| 22. | Bai YQ, Miyake S, Iwai T, Yuasa Y. CDX2, a homeobox transcription factor, upregulates transcription of the p21/WAF1/CIP1 gene. Oncogene. 2003;22:7942-7949. [PubMed] [DOI] |
| 23. | Dawson H, Galván JA, Helbling M, Muller DE, Karamitopoulou E, Koelzer VH, Economou M, Hammer C, Lugli A, Zlobec I. Possible role of Cdx2 in the serrated pathway of colorectal cancer characterized by BRAF mutation, high-level CpG Island methylator phenotype and mismatch repair-deficiency. Int J Cancer. 2014;134:2342-2351. [PubMed] [DOI] |
| 24. | Kim JH, Rhee YY, Bae JM, Cho NY, Kang GH. Loss of CDX2/CK20 expression is associated with poorly differentiated carcinoma, the CpG island methylator phenotype, and adverse prognosis in microsatellite-unstable colorectal cancer. Am J Surg Pathol. 2013;37:1532-1541. [PubMed] [DOI] |
| 25. | Zlobec I, Bihl M, Foerster A, Rufle A, Lugli A. Comprehensive analysis of CpG island methylator phenotype (CIMP)-high, -low, and -negative colorectal cancers based on protein marker expression and molecular features. J Pathol. 2011;225:336-343. [PubMed] [DOI] |
| 26. | Bailis JM, Forsburg SL. MCM proteins: DNA damage, mutagenesis and repair. Curr Opin Genet Dev. 2004;14:17-21. [PubMed] [DOI] |