修回日期: 2014-12-08
接受日期: 2014-12-18
在线出版日期: 2015-01-28
非编码RNA(non-coding RNA, ncRNA)是指没有编码蛋白质功能的所有RNA, 缺乏开放阅读框, 常由编码蛋白质的基因反义转录而来, 根据长度分为长链ncRNA(long chain of ncRNA, lncRNA)和短链ncRNA, 而短链ncRNA包括microRNA、piRNA等. ncRNA不仅参与生命活动的一些基本过程, 而且与肿瘤细胞的分化、增殖、迁移及侵袭浸润密切相关, 在癌症的发生发展中起重要作用. 肝细胞肝癌[原发性肝癌(hepatocellular carcinoma, HCC)]是消化系发病率和死亡率都很高的恶性肿瘤, 严重威胁着人类的健康, 但是具体发病机制目前还不清楚. 近年来, 大量的研究发现, ncRNA表达水平的改变在HCC的发生发展过程中有着举足轻重的作用, 文章综述了ncRNA与HCC的关系及相关机制的研究进展, 为肝癌的诊断和治疗提供线索.
核心提示: 本文系统阐述3种非编码RNA(non-coding RNA, ncRNA)分别参与肝癌的发生以及演进, 调控细胞周期, 在各个水平调控基因的表达, 介导肝癌细胞的增殖、凋亡、迁移和侵袭, 揭示不同ncRNA与肝癌的关系, 对于更加全面地阐明肝癌的发病机制及提供新的药物治疗靶点, 具有十分重要的临床价值和科学意义.
引文著录: 连娇燕, 庹必光. 非编码RNA与肝细胞肝癌发生发展的研究进展. 世界华人消化杂志 2015; 23(3): 396-403
Revised: December 8, 2014
Accepted: December 18, 2014
Published online: January 28, 2015
Non-coding RNAs (ncRNAs) refer to all RNAs without protein encoding function due to the lack of an open reading frame, and they are often transcribed from the complementary strand of protein encoding genes. Based on the length, ncRNAs can be divided into long ncRNAs (lncRNAs) and short ncRNAs, and short ncRNAs include microRNAs, piRNAs and so on. ncRNAs are not only involved in life activities but also closely related to tumor cell differentiation, proliferation, migration, invasion and infiltration. ncRNAs play an important role in the development of cancer. Hepatocellular carcinoma is a digestive cancer with high incidence and mortality rates, posing a serious threat to human health; however, its pathogenesis is still unclear. In recent years, a large number of studies have found that changes in the expression of ncRNAs have a pivotal role in the development of hepatocellular carcinoma. This review summarizes the current state of knowledge about the association between ncRNAs sand hepatocellular carcinoma, with an aim to provide some clues to its diagnosis and treatment.
- Citation: Lian JY, Tuo BG. Role of non-coding RNAs in development and progression of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 396-403
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/396.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.396
原发性肝癌(hepatocellular carcinoma, HCC)作为一种十分常见的恶性肿瘤. 其发病率在东南亚和非洲最高, 在恶性肿瘤的病死率中他排在第3位, 在中国每年约有23万人死于肝癌, 占世界肝癌死亡总人数的53%. HCC中有80%-90%是肝细胞性肝癌(以下简称肝癌), 其他为胆管细胞性肝癌和混合性肝癌等. 肝癌的致死率高、侵袭力强, 肝癌早期的有效治疗手段为外科手术切除、肝移植, 但术后5年生存率仅为70%, 进展期的肝癌治疗手段更为有限, 由于就诊时已发生血行转移, 多数患者丧失手术机会, 而化疗作用疗效甚微且有药物毒性[1]. 因此, 为了改善肝癌的预后和治疗, 人们一直在致力于研究导致肝癌细胞恶变及肝细胞癌发生的细胞及分子生物学机制. 早期诊断是有效治疗肝癌的关键, 寻找肝癌有效的早期诊断标志显得甚为重要. 近年来大量的研究发现, 非编码RNA(non-coding RNA, ncRNA)与肿瘤的发生有关, 为肝癌的诊断和治疗提供新的研究方向.
长链ncRNA(long chain of ncRNA, lncRNA), 长度在200-100000 nt之间的RNA分子. 根据lncRNA在基因组中与蛋白质编码基因的相对位置, 可分为5类: (1)正义lncRNA; (2)反义lncRNA; (3)双向lncRNA; (4)基因内lncRNA; (5)基因间lncRNA. lncRNA可通过多种方式调控基因表达, 包括外源性沉默、剪切调控、与微小RNA(microRNA, miRNA)相互作用、与蛋白质相互作用以及遗传变异, 尤其是lncRNA可在多个水平调控基因的表达[2]. 自从lncRNA的生物学功能被关注以来, 其在各种疾病中的差异表达与疾病发生机制的关联性研究也逐渐开展和深入. lncRNA是否在恶性肿瘤中存在特异性表达在早期研究中已经被提出, 但是缺乏足够的证据支持. 随着肿瘤基因组学和转录组学研究的发展, 越来越多的证据显示: 不仅在同型肿瘤中可存在不同的lncRNA, 而且同一种lncRNA也可在不同肿瘤中表达. lncRNA在HCC的发生发展中起着重要作用, 与肝癌相关的lncRNA参与肝癌细胞的增殖、凋亡、侵袭、远处转移以及以及新生血管的形成等各个过程[3]. 目前研究[4]发现与肝癌相关性较强的lncRNA基因有: H19、HOX转录反义RNA(HOX transcript antisense RNA, HOTAIR)、肺腺癌转移相关转录子1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)、肝癌高表达基因(highly up-regulated in liver cancer, HULC)和母系印记基因3(maternal expressed gene 3, MEG3)等. H19是第一个发现的ncRNA基因, 编码2.3 kb的lncRNA, 由位于染色体11p15.5上的H19基因转录, 在HCC中表达上调, 他是通过与蛋白质相互作用抑制肝癌细胞的迁移. HOTAIR是一个长度为2.2 kb的基因定位在哺乳动物12q13.13上HOX C位点, 不编码任何蛋白质, 他在HCC中表达上调, HOTAIR过表达可以辅助异常polycomb抑制复合物2(polycomb repressive complex 2, PRC2)募集到其靶基因的基因组位置处表观抑制PRC2的靶基因, 通过外源性基因沉默的方式调控基因表达进而促进肝癌细胞的增殖[5]. MALAT1长约7 kb, 由位于染色体11q13上的MALAT1基因转录, 可通过调节丝氨酸/精氨酸剪切因子的磷酸化和去磷酸化, 从而使mRNA的前体发生不同形式的选择性剪切, 最终影响和调控基因表达, 肝癌时他的含量明显上升. HULC由位于染色体6p24.3上的HULC基因转录, 当结直肠肿瘤肝转移时, 他表达上调, 但仅有淋巴转移者其表达无变化, 故他可以作为结直肠肿瘤肝转移的标志物[6]. MEG3长度约1.6 kb, 定位于人类染色体14q32.3, MEG3抑制细胞的增殖可能是通过抑癌基因p53发挥作用的, 但同时也发现在p53缺失的细胞系中MEG3还能通过其他的方式抑制肿瘤细胞的增殖, 在HCC的表达是下调的, MEG3能显著地抑制细胞增殖, 但是对细胞周期和细胞凋亡没有显著的影响[7].
miRNA是一类长约21-25核苷酸的内源性ncRNA, 他们广泛存在于植物和动物中并通过影响mRNA的翻译或稳定性来发挥重要的调节作用. 在核内, miRNA首先由RNA聚合酶Ⅱ或Ⅲ转录生成初级miRNA(Pri-miRNA), 随后Pri-miRNA经酶-蛋白复合体(Drosha酶-DGCR8蛋白)作用, 形成长度为70-85个核苷酸的含有缺陷茎环结构的前体miRNA(pre-miRNA), 接着, pre-miRNA在exportin-5和Ran/GTP的帮助下转运到细胞浆, 进入细胞浆后, 在Dicer酶切作用下形成约22个核苷酸长度的双链miRNA, 双链miRNA的任意一条链选择性结合到RNA引诱沉默复合体(RNA-induced silencing complex, RISC)中, 形成成熟的miRNA, 而发挥生物调控功能. miRNA与RISC结合, 通过互补或不完全互补的方式识别并结合靶基因, 经RNA干扰途径引起基因沉默, 使靶基因mRNA裂解或遏制蛋白翻译, 在转录后水平影响基因表达[8]. 也有研究[9]表明, miRNA可以促进靶mRNA的翻译, 通过招募蛋白质复合物到富含腺苷酸和尿苷酸的mRNA, 或者是通过与阻遏目的基因翻译的蛋白相互作用而去阻遏mRNA的翻译, 进而间接增加目的蛋白的输出[10]. 大量的研究显示, miRNA功能失调可能是由以下原因引起的: 基因扩增[11]、基因转位癌性转录因子活化[12]、DNA甲基化等表观遗传学修饰[13]、miRNA点突变[14]或基因多态性[15]、低氧状态[16]和致癌病毒蛋白产物[17]等. miRNA是起癌基因还是抑癌基因取决于他们的靶基因在细胞内的功能[18]. 既往在大量的HCC病例研究中, 人们只是有限地认识到HCC的发生发展过程中涉及到一系列基因的改变, 但对其具体的分子机制并不清楚. 细胞周期调节蛋白, 如p53c-Myc Cyclin D1、Wnt/β-catenin信号通路以及多种酪氨酸激酶生长因子受体和配体等基因的异常表达, 在肝癌的发生中发挥着重要的功能, 而miRNA作为这一系列重要基因的上游调控分子, 可能起着更关键的作用[19]. 第一个被确认的miRNA是1993年Lujambio等[20]在线虫中发现的lin-4, 并通过定点突变发现lin-4不编码蛋白, 而是编码一种小分子RNA, 其与靶标基因lin-14的mRNA 3'端非翻译区(3' untranslated region, 3'UTR)特定区域结合来抑制lin-14的翻译. 近来, 许多研究人员开始利用miRNA表达谱芯片研究HCC中miRNA表达谱的变化, 发现与HCC发病相关的miRNA达几十种[21].
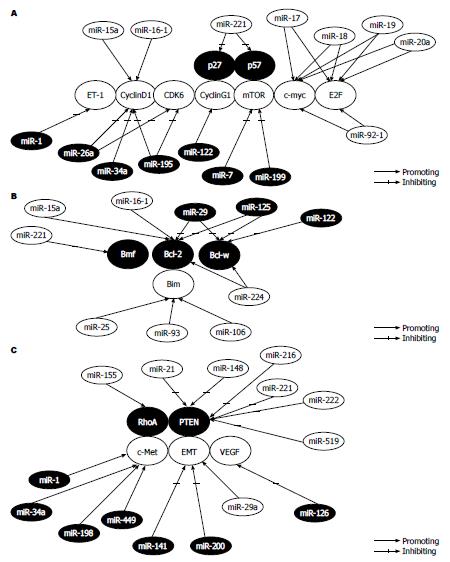
有一部分miRNA在HCC中的表达是下调的, 表明这些miRNA可能起到抑癌基因的作用, 其中miR-122和miR-199被认为是最重要的[22]. miR-122是肝脏特异性表达的miRNA, 也是肝脏miRNA中表达最多的, 他在肝细胞癌的细胞株和组织中表达都是下调的, 肝癌细胞株HepG2、HepB3过表达miR-122表现为促进肝癌细胞的凋亡, 抑制增殖[23]. 小鼠敲除miR-122基因可以表现出肝脏炎症、纤维化以及产生类似于HCC的瘤状物, 表明了miR-122的抑癌作用以及他在肝细胞的新陈代谢及细胞分化中的重要作用[24,25]. 之前的研究[26]表明Cyclin G1是miR-122的下游调控基因, 而Cyclin G1/miR-122的相互作用调控p53的活性并影响HCC对阿霉素的敏感性. miR-199家族的3个成员miR-199a-1、miR-199a-2及miR-199b在HCC中均是表达下调的, miR-199a的变异或者是高表达, 使细胞周期停滞在G1期, 降低了癌细胞侵袭性, HCC的miR-199下调可能与肝癌的复发率及术后短期复发有关[27]. miR-199的一个重要靶基因是CD44, 是一种跨膜糖蛋白, 与细胞间的相互作用、细胞黏附和细胞迁移有关[28]. 有一部分miRNA在HCC中的表达是上调的, 表明这些miRNA可能起到癌基因的作用, miR-221/miR-222以及miR-21被认为是促进肿瘤活性的[29]. miR-221和miR-222是两种高度同源性的miRNA, 在很多肿瘤高表达, 是发挥癌基因还是抑癌基因的功能取决于肿瘤的类型[30]. 肝癌细胞过表达miR-221增强了癌细胞的生长、分化、迁移及侵袭的能力, 他的过表达促进癌细胞的迁移是通过蛋白激酶B(protein kinase B, AKT)信号通路[31]. miR-21是HCC中被证明具有癌基因并且过表达最普遍的miRNA, 与肝癌细胞的迁移的侵袭有关, miR-21负性调控靶基因的蛋白表达程序性细胞死亡4(programmed cell death 4, PDCD4)和下游的信号分子, 还可以诱导上皮间质化通过AKT/细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)信号通路进而调控肝癌细胞的增殖及肿瘤的生长[32]. 有一部分miRNA表达异常与细胞周期有关, 其中miR-26a, miR-195的低表达被认为是HCC中最有意义. miR-26a和miR-195在HCC中低表达, 通过作用于Cyclin D1, 周期蛋白依赖性激酶6(cyclin-dependent kinases 6, CDK6)、基因E2F转录因子3(E2F transcription factor 3, E2F3)等多种分子阻断了Rb/E2F信号通路, 进而抑制了细胞周期G1/S的转换[33]. 在HCC中, miR-34a作为抑癌基因p53的下游信号分子, 通过Cyclin D1、CDK4和CDK2等分子连接p53信号通路和细胞周期调控[34]. miR-193b和miR-520b通过抑制肝癌细胞形成克隆而抑制癌细胞的侵袭和增殖, 还可以诱导细胞周期停滞[35]. miR-221和miR-222通过负性调控磷酸酶-张力蛋白基因和金属激酶抑制因子3, 进而抑制肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL)引导的凋亡[36].
新生血管的形成和转移在肿瘤的演进过程中起重要作用. 部分miRNA有拮抗血管形成或是促进血管形成的作用. 其中miR-221和miR-222通过直接调控下游的c-kit、p27Kip1、p57Kip2和Cyclin G1等信号分子可以影响内皮细胞的迁移、增殖[37]. 另外, miR-15a-16-1家族可以促进凋亡、抑制细胞的增殖、抑制血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达, 是通过作用于Bcl-2、Cyclin D1、无翅型乳腺瘤(wingless mammary tumor, MMMT)整合素家族成员3A(wingless Int1 3A, WNT3A)、AKT3、核糖体蛋白S6、丝裂原激活蛋白(mitogen-activated protein MAP)激酶、细胞核因子κB(nuclear factor-kappa B, NF-κB)激动剂细胞周期蛋白复性调控因子-kip家族因子3(CDK inhibtors-kip family factor 3, MAP3-KIP3)等[38]. miR-122可以通过抑制肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)转化酶而抑制新生血管的形成和肝内转移[39]. 内皮细胞特异性表达的miR-126可以调控VEGF的水平和内皮细胞的增殖, miR-296通过直接作用于介导生长因子受体降解的酪氨酸激酶基质调控的肝细胞生长因子(hepatocyte growth factor regulated tyrosine kinase substrate, HGS), 进而调节VEGF受体2和血小板衍生生长因子(platelet-derived growth factor, PDGF)受体β的表达[40]. miR-17-92家族, 包括miR-17、miR-18、miR-19a、miR-19b-1、miR-20a和miR-92-1, 可以促进肿瘤新生血管的形成, 通过作用于血小板反应蛋白-1(thrombospondin-1, TSP-1)、结缔组织生长因子(connective tissue growth factor, CTGF)和一些促血管新生因子[41]. 一些miRNA通过调节上皮细胞间质化(epithelial-mesenchymal transition, EMT)参与肿瘤细胞的转移. miR-200家族(包括miR-200a、miR-200b、miR-200c、miR-141和miR-429)和miR-205可增加E钙黏蛋白的表达, 降低波形蛋白的表达, 抑制EMT, 阻碍肿瘤细胞的迁移和侵袭[42]. miR-155在癌细胞中的表达是上调的, 在转化生长因子(transformating growth factor, TGF)引导的EMT和细胞的迁移和侵袭中的作用是肯定的, 通过作用于Ras同源基因家族成员A[43]. miR-124通过下调Rho相关激酶2(Rho-associated coiled coil forming protein kinase 2, ROCK2)和组蛋白甲基化转移酶2(enhancer of zeste homolog 2, EZH2), 抑制细胞骨架的改装和EMT, 最终抑制HCC的侵袭和迁移[44]. miR-29a可以促进EMT和癌细胞的转移, 与抑制癌基因Ras信号通路中三磷酸胸苷(thymidine triphosphate, TTP)有关, TTP是与3'UTR富含AU碱基的mRNA的降解有关[45]. 与HCC癌细胞的增殖、凋亡和迁移发生发展有关的关键性miRNA的相互作用如图1[46].
Piwi蛋白相互作用RNA(Piwi-interacting RNA, piRNA)是一类长度为26-31 nt单链的小RNA, 大部分集中在29-30 nt, 与miRNA和rasiRNAs一样, 5'端也具有强烈的尿嘧啶倾向性(约86%). 2006-07, Nature和Science等杂志几乎同时报道了一类新的非编码小RNA, 发现他们与生殖细胞发育密切相关[47]. piRNA在染色体上的分布极不均匀, 在小鼠中他们主要分布于17、5、4、2号染色体上, 而很少分布于1、3、16、19和X染色体上, 基本不分布于Y染色体上[48]. 另外, piRNA主要存在于基因间隔区, 而很少存在于基因区或重复序列区. 他们主要成簇分布在1-100 kb相对较短的基因组位点, 且包含有10-4500个小分子RNA[49]. 由于piRNA成簇分布, 且每一个几乎都具有同一取向, 说明同一簇piRNA可能来源于同一长初始转录物, 但有一部分成簇的piRNA会突然改变取向, 说明这些双向的成簇piRNA可能由相同的启动子按不同的方式转录而来[50]. piRNA被认为是最神秘的调控小RNA, 尤其是在肿瘤形成机制中, 一些细胞株中的piRNA调控异常可能以一种未知的方式在肿瘤形成过程中起关键性的作用[51]. Law等[52]的研究通过高通量测序, 发现在肝脏肿瘤的形成过程中有piRNA的新成员piR-Hep1的参与, 肝癌组织piR-Hep1的表达比正常肝组织上调了46.6%, 沉默掉piR-Hep1基因抑制细胞的发育、运动和侵袭的能力, 并伴随着AKT信号通路磷酸化的下降.
ncRNA与肝癌等肿瘤的发生发展过程密切相关, ncRNA表达的失调在促进肝癌的发生发展过程中有重要意义, ncRNA的主要功能是下调靶基因的表达. 然而, ncRNA还可能有其他未知的促进靶基因转录的功能, ncRNA新类型和新功能的发现为我们提供了更多更深刻的线索探索肝细胞肝癌的的分子机制或者是发病机理. ncRNA可能不止一个靶基因, 对其他怎么作用于靶基因并通过怎样的信号转导导致肝癌的发生目前仍不清楚. 所以, 进一步探索ncRNA的调节分子网络将帮助我们明确肝癌的的发病机理并找到早期诊断和治疗的方法. 随着对ncRNA研究的不断深入, ncRNA干扰技术有可能成为肝癌的有效治疗手段.
非编码RNA(non-coding RNA, ncRNA)结构和功能的正常是维持生命活动的基础, 其表达和功能的异常与肿瘤的发生发展密切相关. 其中ncRNA与肝细胞癌的关系逐步成为研究热点, 在此基础上, 我们系统介绍3种ncRNA在肝细胞癌发生发展中的作用.
王阁, 教授, 中国人民解放军第三军医大学第三附属医院
本文主要概述了当前通过应用细胞分子生物学等技术方法系统探寻ncRNA与及调节肝细胞癌发生机制的研究, 阐明肝细胞癌发生发展的分子生物学机制及作为靶点治疗的方向.
Law等通过高通量测序, 研究了Piwi蛋白相互作用RNA(Piwi-interacting RNA, piRNA)的新成员piR-Hep1在肝细胞癌中的表达和功能, 揭示了piRNA在调节肝细胞运动能力及信号转导中的重要作用, 并为肝癌微环境治疗提供了靶向性, 对完善肝癌发病机制及药物治疗的研究有着十分重要的导向作用.
本文以探寻肝细胞癌发生发展的机制为基础, 系统概括了3种ncRNA在肝细胞癌发生发展中扮演的不同角色和调节作用, 揭示ncRNA可作为靶点治疗的可行性.
通过对肝细胞癌的细胞分子机制的研究, 揭示了ncRNA与肝细胞癌发生发展的密切关联, 为肝细胞癌的临床药物疗提供靶点, 有十分重要的科学意义和临床意义.
上皮细胞间质化(epithelial-mesenchymal transition): 又称上皮间充质转化, 上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程, 主要的特征有细胞黏附分子(如E-钙黏蛋白)表达的减少、细胞角蛋白细胞骨架转化为波形蛋白(Vimentin)为主的细胞骨架及形态上具有间充质细胞的特征.
本文综述设计合理, 内容丰富, 有一定的学术价值.
编辑:韦元涛 电编:都珍珍
| 1. | Xu XB, Zhang XH Yang MF, Li ML, Zhu RM. Expression and significance of PTPeta in hepatocellular carcinoma tissues and cell lines. Med J Chin PLA. 2012;37:970-973. |
| 2. | Ponting CP, Oliver PL, Reik W. Evolution and functions of long noncoding RNAs. Cell. 2009;136:629-641. [PubMed] [DOI] |
| 3. | Wapinski O, Chang HY. Long noncoding RNAs and human disease. Trends Cell Biol. 2011;21:354-361. [PubMed] [DOI] |
| 4. | Tsang WP, Kwok TT. Riboregulator H19 induction of MDR1-associated drug resistance in human hepatocellular carcinoma cells. Oncogene. 2007;26:4877-4881. [PubMed] [DOI] |
| 5. | Gupta RA, Shah N, Wang KC, Kim J, Horlings HM, Wong DJ, Tsai MC, Hung T, Argani P, Rinn JL. Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis. Nature. 2010;464:1071-1076. [PubMed] [DOI] |
| 6. | Matouk IJ, Abbasi I, Hochberg A, Galun E, Dweik H, Akkawi M. Highly upregulated in liver cancer noncoding RNA is overexpressed in hepatic colorectal metastasis. Eur J Gastroenterol Hepatol. 2009;21:688-692. [PubMed] [DOI] |
| 7. | Zhou Y, Zhang X, Klibanski A. MEG3 noncoding RNA: a tumor suppressor. J Mol Endocrinol. 2012;48:R45-R53. [PubMed] [DOI] |
| 8. | Bushati N, Cohen SM. microRNA functions. Annu Rev Cell Dev Biol. 2007;23:175-205. [PubMed] [DOI] |
| 9. | Kostial K, Kargacin B, Arezina R, Landeka M, Simonović I. Factors influencing the efficiency of chelation therapy. J Hyg Epidemiol Microbiol Immunol. 1991;35:337-350. [PubMed] [DOI] |
| 10. | Eiring AM, Harb JG, Neviani P, Garton C, Oaks JJ, Spizzo R, Liu S, Schwind S, Santhanam R, Hickey CJ. miR-328 functions as an RNA decoy to modulate hnRNP E2 regulation of mRNA translation in leukemic blasts. Cell. 2010;140:652-665. [PubMed] [DOI] |
| 11. | Jin HY, Oda H, Lai M, Skalsky RL, Bethel K, Shepherd J, Kang SG, Liu WH, Sabouri-Ghomi M, Cullen BR. MicroRNA-17~92 plays a causative role in lymphomagenesis by coordinating multiple oncogenic pathways. EMBO J. 2013;32:2377-2391. [PubMed] [DOI] |
| 12. | Spengler RM, Oakley CK, Davidson BL. Functional microRNAs and target sites are created by lineage-specific transposition. Hum Mol Genet. 2014;23:1783-1793. [PubMed] [DOI] |
| 13. | Chhabra R. miRNA and methylation: a multifaceted liaison. Chembiochem. 2015;16:195-203. [PubMed] [DOI] |
| 14. | Huang CJ, Chen HY, Lin WY, Choo KB. Differential expression of speckled POZ protein, SPOP: putative regulation by miR-145. J Biosci. 2014;39:401-413. [PubMed] [DOI] |
| 15. | Maharjan S, Mopidevi B, Kaw MK, Puri N, Kumar A. Human aldosterone synthase gene polymorphism promotes miRNA binding and regulates gene expression. Physiol Genomics. 2014;46:860-865. [PubMed] [DOI] |
| 16. | Adyshev DM, Moldobaeva N, Mapes B, Elangovan V, Garcia JG. MicroRNA regulation of nonmuscle myosin light chain kinase expression in human lung endothelium. Am J Respir Cell Mol Biol. 2013;49:58-66. [PubMed] [DOI] |
| 17. | Ren M, Qin D, Li K, Qu J, Wang L, Wang Z, Huang A, Tang H. Correlation between hepatitis B virus protein and microRNA processor Drosha in cells expressing HBV. Antiviral Res. 2012;94:225-231. [PubMed] [DOI] |
| 18. | Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75:843-854. [PubMed] [DOI] |
| 19. | Wang DN, Zhang LP. Advance in research on role of miRNA in onset and progress of hepatocel-lular carcinoma and its therapeutic application. Chin J Biological. 2011;24:1239-1247. |
| 21. | Ura S, Honda M, Yamashita T, Ueda T, Takatori H, Nishino R, Sunakozaka H, Sakai Y, Horimoto K, Kaneko S. Differential microRNA expression between hepatitis B and hepatitis C leading disease progression to hepatocellular carcinoma. Hepatology. 2009;49:1098-1112. [PubMed] [DOI] |
| 22. | Hou J, Lin L, Zhou W, Wang Z, Ding G, Dong Q, Qin L, Wu X, Zheng Y, Yang Y. Identification of miRNomes in human liver and hepatocellular carcinoma reveals miR-199a/b-3p as therapeutic target for hepatocellular carcinoma. Cancer Cell. 2011;19:232-243. [PubMed] |
| 23. | Datta J, Kutay H, Nasser MW, Nuovo GJ, Wang B, Majumder S, Liu CG, Volinia S, Croce CM, Schmittgen TD. Methylation mediated silencing of MicroRNA-1 gene and its role in hepatocellular carcinogenesis. Cancer Res. 2008;68:5049-5058. [PubMed] [DOI] |
| 24. | Hsu SH, Wang B, Kota J, Yu J, Costinean S, Kutay H, Yu L, Bai S, La Perle K, Chivukula RR. Essential metabolic, anti-inflammatory, and anti-tumorigenic functions of miR-122 in liver. J Clin Invest. 2012;122:2871-2883. [PubMed] [DOI] |
| 25. | Tsai WC, Hsu SD, Hsu CS, Lai TC, Chen SJ, Shen R, Huang Y, Chen HC, Lee CH, Tsai TF. MicroRNA-122 plays a critical role in liver homeostasis and hepatocarcinogenesis. J Clin Invest. 2012;122:2884-2897. [PubMed] [DOI] |
| 26. | Fornari F, Gramantieri L, Giovannini C, Veronese A, Ferracin M, Sabbioni S, Calin GA, Grazi GL, Croce CM, Tavolari S. MiR-122/cyclin G1 interaction modulates p53 activity and affects doxorubicin sensitivity of human hepatocarcinoma cells. Cancer Res. 2009;69:5761-5767. [PubMed] [DOI] |
| 27. | Jia XQ, Cheng HQ, Qian X, Bian CX, Shi ZM, Zhang JP, Jiang BH, Feng ZQ. Lentivirus-mediated overexpression of microRNA-199a inhibits cell proliferation of human hepatocellular carcinoma. Cell Biochem Biophys. 2012;62:237-244. [PubMed] [DOI] |
| 28. | Henry JC, Park JK, Jiang J, Kim JH, Nagorney DM, Roberts LR, Banerjee S, Schmittgen TD. miR-199a-3p targets CD44 and reduces proliferation of CD44 positive hepatocellular carcinoma cell lines. Biochem Biophys Res Commun. 2010;403:120-125. [PubMed] [DOI] |
| 29. | Medina R, Zaidi SK, Liu CG, Stein JL, van Wijnen AJ, Croce CM, Stein GS. MicroRNAs 221 and 222 bypass quiescence and compromise cell survival. Cancer Res. 2008;68:2773-2780. [PubMed] [DOI] |
| 30. | Garofalo M, Quintavalle C, Romano G, Croce CM, Condorelli G. miR221/222 in cancer: their role in tumor progression and response to therapy. Curr Mol Med. 2012;12:27-33. [PubMed] [DOI] |
| 31. | Wong QW, Ching AK, Chan AW, Choy KW, To KF, Lai PB, Wong N. MiR-222 overexpression confers cell migratory advantages in hepatocellular carcinoma through enhancing AKT signaling. Clin Cancer Res. 2010;16:867-875. [PubMed] [DOI] |
| 32. | Bao L, Yan Y, Xu C, Ji W, Shen S, Xu G, Zeng Y, Sun B, Qian H, Chen L. MicroRNA-21 suppresses PTEN and hSulf-1 expression and promotes hepatocellular carcinoma progression through AKT/ERK pathways. Cancer Lett. 2013;337:226-236. [PubMed] [DOI] |
| 33. | Kota J, Chivukula RR, O'Donnell KA, Wentzel EA, Montgomery CL, Hwang HW, Chang TC, Vivekanandan P, Torbenson M, Clark KR. Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model. Cell. 2009;137:1005-1017. [PubMed] [DOI] |
| 34. | Cheng J, Zhou L, Xie QF, Xie HY, Wei XY, Gao F, Xing CY, Xu X, Li LJ, Zheng SS. The impact of miR-34a on protein output in hepatocellular carcinoma HepG2 cells. Proteomics. 2010;10:1557-1572. [PubMed] [DOI] |
| 35. | Zhang W, Kong G, Zhang J, Wang T, Ye L, Zhang X. MicroRNA-520b inhibits growth of hepatoma cells by targeting MEKK2 and cyclin D1. PLoS One. 2012;7:e31450. [PubMed] [DOI] |
| 36. | Garofalo M, Di Leva G, Romano G, Nuovo G, Suh SS, Ngankeu A, Taccioli C, Pichiorri F, Alder H, Secchiero P. miR-221& amp; 222 regulate TRAIL resistance and enhance tumorigenicity through PTEN and TIMP3 downregulation. Cancer Cell. 2009;16:498-509. [PubMed] [DOI] |
| 37. | Poliseno L, Tuccoli A, Mariani L, Evangelista M, Citti L, Woods K, Mercatanti A, Hammond S, Rainaldi G. MicroRNAs modulate the angiogenic properties of HUVECs. Blood. 2006;108:3068-3071. [PubMed] [DOI] |
| 38. | Bonci D, Coppola V, Musumeci M, Addario A, Giuffrida R, Memeo L, D'Urso L, Pagliuca A, Biffoni M, Labbaye C. The miR-15a-miR-16-1 cluster controls prostate cancer by targeting multiple oncogenic activities. Nat Med. 2008;14:1271-1277. [PubMed] [DOI] |
| 39. | Tsai WC, Hsu PW, Lai TC, Chau GY, Lin CW, Chen CM, Lin CD, Liao YL, Wang JL, Chau YP. MicroRNA-122, a tumor suppressor microRNA that regulates intrahepatic metastasis of hepatocellular carcinoma. Hepatology. 2009;49:1571-1582. [PubMed] [DOI] |
| 40. | Würdinger T, Tannous BA, Saydam O, Skog J, Grau S, Soutschek J, Weissleder R, Breakefield XO, Krichevsky AM. miR-296 regulates growth factor receptor overexpression in angiogenic endothelial cells. Cancer Cell. 2008;14:382-393. [PubMed] [DOI] |
| 41. | Bonauer A, Carmona G, Iwasaki M, Mione M, Koyanagi M, Fischer A, Burchfield J, Fox H, Doebele C, Ohtani K. MicroRNA-92a controls angiogenesis and functional recovery of ischemic tissues in mice. Science. 2009;324:1710-1713. [PubMed] [DOI] |
| 42. | Gregory PA, Bert AG, Paterson EL, Barry SC, Tsykin A, Farshid G, Vadas MA, Khew-Goodall Y, Goodall GJ. The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1. Nat Cell Biol. 2008;10:593-601. [PubMed] [DOI] |
| 43. | Kong W, Yang H, He L, Zhao JJ, Coppola D, Dalton WS, Cheng JQ. MicroRNA-155 is regulated by the transforming growth factor beta/Smad pathway and contributes to epithelial cell plasticity by targeting RhoA. Mol Cell Biol. 2008;28:6773-6784. [PubMed] [DOI] |
| 44. | Zheng F, Liao YJ, Cai MY, Liu YH, Liu TH, Chen SP, Bian XW, Guan XY, Lin MC, Zeng YX. The putative tumour suppressor microRNA-124 modulates hepatocellular carcinoma cell aggressiveness by repressing ROCK2 and EZH2. Gut. 2012;61:278-289. [PubMed] [DOI] |
| 45. | Gebeshuber CA, Zatloukal K, Martinez J. miR-29a suppresses tristetraprolin, which is a regulator of epithelial polarity and metastasis. EMBO Rep. 2009;10:400-405. [PubMed] [DOI] |
| 46. | Hung CH, Chiu YC, Chen CH, Hu TH. MicroRNAs in hepatocellular carcinoma: carcinogenesis, progression, and therapeutic target. Biomed Res Int. 2014;2014:486407. [PubMed] [DOI] |
| 47. | Aravin A, Gaidatzis D, Pfeffer S, Lagos-Quintana M, Landgraf P, Iovino N, Morris P, Brownstein MJ, Kuramochi-Miyagawa S, Nakano T. A novel class of small RNAs bind to MILI protein in mouse testes. Nature. 2006;442:203-207. [PubMed] |
| 48. | Girard A, Sachidanandam R, Hannon GJ, Carmell MA. A germline-specific class of small RNAs binds mammalian Piwi proteins. Nature. 2006;442:199-202. [PubMed] |
| 49. | Grivna ST, Beyret E, Wang Z, Lin H. A novel class of small RNAs in mouse spermatogenic cells. Genes Dev. 2006;20:1709-1714. [PubMed] |
| 50. | Kim VN. Small RNAs just got bigger: Piwi-interacting RNAs (piRNAs) in mammalian testes. Genes Dev. 2006;20:1993-1997. [PubMed] |
| 51. | Mei Y, Clark D, Mao L. Novel dimensions of piRNAs in cancer. Cancer Lett. 2013;336:46-52. [PubMed] [DOI] |