修回日期: 2015-09-07
接受日期: 2015-09-21
在线出版日期: 2015-10-18
目的: 探讨7,12-二甲基苯并蒽(7,12-dimethylbenzanthracene, DMBA)对大鼠胰腺肿瘤发生的影响.
方法: 80只♂SD大鼠随机分成两组: A组(实验组)70只, 将DMBA按4 mg/100 g体质量置入胰腺; B组(对照组)10只, 仅行胰腺被膜的切开, 不置入任何药物. 2组分别在手术后每月观察体质量变化; 并于手术后2、4、6 mo后取胰腺行病理组织学检查.
结果: A组大鼠术后5 mo及6 mo体质量较B组明显下降. 大鼠术后4 mo平滑肌肉瘤发生率为42.1%(8/19), 6 mo为75%(15/20), 6 mo大鼠肉瘤发生率高于4 mo大鼠肉瘤发生率(P = 0.037); 并伴有恶液质、血性腹水及腹腔胰腺外肿瘤. 但无胰腺导管细胞癌发生.
结论: 采用DMBA置入SD大鼠胰腺内的方法建立胰腺癌动物模型, 出现体质量增长曲线下降趋势, 病理学诊断显示为急、慢性胰腺炎、平滑肌肉瘤及肿瘤浸润食管、胃及肠道等脏器, 无胰腺上皮内瘤变和胰腺癌的出现.
核心提示: 采用中等剂量7,12-二甲基苯并蒽(7,12-dimethylbenzanthracene)(4 mg/100 g体质量)置入SD大鼠可诱导大鼠胰腺平滑肌肉瘤发生, 且平滑肌肉瘤发生率随诱导时间延长而增高, 易产生血性腹水及胃、肠等脏器受累, 但无胰腺导管细胞癌发生, 原因有待进一步研究.
引文著录: 任宇, 侯晓朴, 李丹, 李颖, 朱斌. DMBA对大鼠胰腺肿瘤发生的影响. 世界华人消化杂志 2015; 23(29): 4700-4705
Revised: September 7, 2015
Accepted: September 21, 2015
Published online: October 18, 2015
AIM: To explore the possibility of pancreatic carcinogenesis induced by 7,12-dimethylbenzanthracene (DMBA) implantation in Sprague-Dawley (SD) rats.
METHODS: Eighty male SD rats were randomly divided into two groups: A and B. DMBA (4 mg/100 g body weight) was implanted into the parenchyma of the rat pancreas in group A (n = 70), while no drugs were implanted into the parenchyma of the pancreas in group B (n = 10). Rats were killed at 2, 4 and 6 mo after operation. The pancreatic tissue samples of rats were fixed in formalin for HE staining and immunohistochemical analysis.
RESULTS: The body weight of rats at 5 and 6 mo had significant differences between groups A and B (P = 0.00). In group A, the incidence of leiomyosarcoma was 42.1% at 4 mo and 75% at 6 mo, and the rats were accompanied by cachexia, bloody ascites and metastasis. The incidence of leiomyosarcoma at 6 mo was higher than that at 4 mo (P = 0.037). No pancreatic ductal cell carcinoma occurred.
CONCLUSION: DMBA (4 mg/100 g body weight) implantation into the parenchyma of the pancreas of SD rats induces the development of pancreatic leiomyosarcoma, and the incidence of leiomyosarcoma at 6 mo is higher than that at 4 mo. DMBA implantation does not induce pancreatic ductal cell carcinoma.
- Citation: Ren Y, Hou XP, Li D, Li Y, Zhu B. DMBA induces pancreatic tumorigenesis in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(29): 4700-4705
- URL: https://www.wjgnet.com/1009-3079/full/v23/i29/4700.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i29.4700
胰腺肿瘤是源发于胰腺的恶性肿瘤, 特别是胰腺癌, 恶性程度极高、容易发生转移且预后较差的肿瘤, 5年生存率低于5%, 其发病率和死亡率比约为1:0.99. 据统计, 2012年美国新增胰腺癌患者45220例, 其中男性22740例, 女性22480例, 为癌症致死第4位[1]. 近年来国内外学者对于胰腺癌癌前病变及早期癌的诊断做了大量研究, 取得了一些进展, 但总体仍没有取得实质性突破. 因此急需建立合适的胰腺癌实验动物模型来深入探讨胰腺癌发生、发展、分子生物学特性、侵袭转移机制及新的治疗方法等. 本实验拟将7,12-二甲基苯并蒽(7,12-dimethylbenzanthracene, DMBA)置入SD大鼠胰腺, 定期行大鼠胰腺病理学观察, 研究DMBA对大鼠胰腺肿瘤发生的影响, 探讨DMBA诱导大鼠胰腺肿瘤动物模型的可能性.
♂SD大鼠80只, 体质量180-200 g, 由北京维通利华实验动物技术有限公司提供; DMBA(美国Sigma公司); 10%水合氯醛溶液; 40 g/L甲醛; 石蜡包埋机(德国徕卡仪器公司); 切片机(Leica公司).
1.2.1 分组: 为避免人为因素干扰, 应用随机数字表法将80只SD大鼠进行完全随机化分组, 根据术中是否置入药物随机分为A、B两组, 单笼喂养大鼠. A组: 手术切开大鼠胰腺被膜, 将DMBA按4 mg/100 g置入胰腺, 共70只; B组: 仅行胰腺被膜的切开, 不置入任何药物. 各组大鼠术后每月称量体质量, 术后2、4、6 mo处死, 并取材行病理学检查.
1.2.2 造模: SD大鼠术前24 h电子秤称量体质量后禁食, 不禁水, 选用10%水合氯醛溶液(3 mL/kg)进行腹腔内注射麻醉, 麻醉成功后将大鼠仰卧位固定于动物手术板, 用纱布沾取生理盐水湿润腹部被毛并剔除干净, 碘伏消毒.
每只大鼠均经上腹正中偏左约0.5 cm处作一纵行切口, 长约2.0 cm, 手术刀切开皮肤, 剪刀剪开腹壁肌肉进入腹腔, 用棉签沾取生理盐水后翻转胃体及脾脏, 将胰腺充分暴露, 湿纱布保护其他器官. A组大鼠用显微镊轻轻提起胰腺体尾部, 于胰腺最厚处剪开被膜及部分胰腺实质, 深入胰腺实质约2 mm, 通过自制加药匙按4 mg/100 g剂量置入DMBA, 用6-0Prolene缝合线缝合胰腺被膜, 打结, 距线结0.3 cm处剪断缝合线, 便于后期寻找药物包埋位置. B组仅作开关腹及剪开胰腺被膜, 胰腺内不置入任何药物. 用湿棉签复位腹腔各器官, 3-0缝线连续缝合腹壁肌肉及皮肤. 术后大鼠继续饲养于普通级环境, 饮食同术前. 整个手术过程细致轻柔, 注意不损伤其他组织、器官, 肉眼观察无DMBA晶体散落于腹腔. 造模过程参考文献[2,3].
1.2.3 病理学及免疫组织化学检测: 按照实验分组及计划, 观察大鼠精神及饮食状况, 每月称量体质量. 用10%水合氯醛溶液(3 mL/kg)麻醉处死大鼠后, 解剖暴露腹腔内各器官, 寻找药物包埋时所留的线结标志, 取下药物包埋位置胰腺组织及周围胰腺组织, 所有组织标本均放入40 g/L甲醛溶液进行固定, 固定时间为24 h, 将固定好的胰腺组织进行取材, 所取组织尽量为药物包埋周围组织, 石蜡包埋时切面朝向下放置, 包埋过程迅速, 尽量避免组织块变凉、蜡液凝结或出现气泡. 行切片、HE染色观察肿瘤组织特征, 采用SP法行免疫组织化学检查, 确定肿瘤来源.
统计学处理 所得数据经SPSS16.0软件数据包进行统计学处理, 比较A、B两组大鼠体质量增长变化差异采用独立样本t检验; 比较大鼠成瘤率的变化差异采用χ2检验, P<0.05时表明有显著性差异.
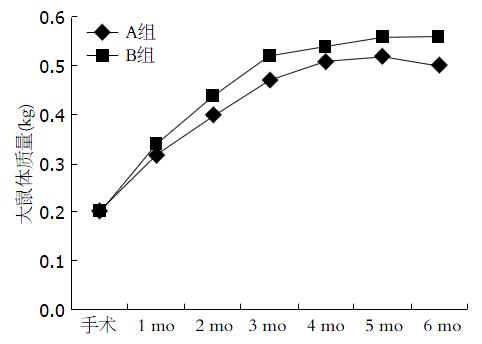
A组异常死亡12只, B组无异常死亡, 死亡大鼠剔除实验入组. A组术后2、4、6 mo分别有19、19、20只大鼠完成实验, B组分别有4、3、3只大鼠按计划完成实验. 术后每月称量2组大鼠体质量, 数据显示A组及B组大鼠术后体质量逐渐增加, A组大鼠术后5-6 mo体质量出现下降趋势. A组大鼠6 mo内体质量下降变化差异大于B组, 且差异具有统计学意义(P = 0.00)(图1).
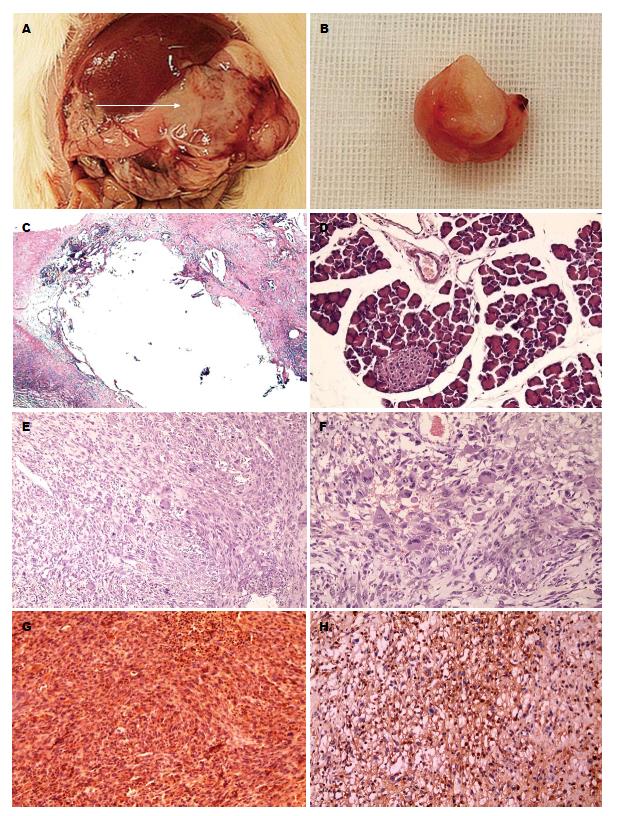
2.2.1 大鼠体标本: A组大鼠解剖后可见血性腹水以及腹腔各器官黏连, 左上腹部最为严重, 不易分离, 胰腺及周围组织形态不规则, 置药标记处可见椭圆形占位, 质硬, 切面呈灰白色, 诊断肿瘤可能性大(图2A, B). 伴体质量下降, 贫血等, 部分有食管、胃、远端肠管等脏器及腹壁转移, 未见肺、肝脏部位明显转移灶. B组大鼠解剖后部分可见轻微黏连.
2.2.2 病理学检查: A组大鼠胰腺置入DMBA 2 mo后呈胰腺炎改变. 镜下可见胰腺组织多灶性坏死、弥漫性纤维素样坏死伴纤维化、部分导管上皮修复性增生, 未见明显异形细胞(图2C). B组大鼠术后镜下表现基本为正常胰腺组织学改变(图2D). A组大鼠4 mo及6 mo后大鼠胰腺部分置药标记处发生肿瘤, 切面灰白色, 呈"鱼肉状". 胰腺肿瘤镜下可见细胞异形, 核分裂易见, 可见多核巨细胞, 诊断为肉瘤, 免疫组织化学提示CD117(个别+), Ki-67(10%+), Desmin(+), CD34(-), SMA(+), 考虑平滑肌肉瘤(图2E-H). 无胰腺导管细胞癌发生. 大鼠术后4 mo平滑肌肉瘤发生率为42.1%(8/19), 6 mo为75.0%(15/20), 并伴有恶液质、血性腹水及腹腔胰腺外肿瘤. 术后6 mo大鼠肉瘤发生率高于4 mo大鼠肉瘤发生率(P = 0.037).
胰腺癌因缺乏特征性的临床表现和有效的诊断方法, 大部分患者在确诊时已属晚期并经常伴有转移, 生存周期只有6-12 mo, 5年生存率为6%[4,5]. 所以对于胰腺癌癌前病变及早期癌的诊断将是改善临床预后的关键. 近年来国内外学者对此做了大量研究, 取得了一些进展, 但总体来讲仍没有取得实质性突破. 因此急需建立合适的胰腺癌实验动物模型来深入探讨胰腺癌发生、发展、分子生物学特性、侵袭转移机制及新的治疗方法等[6]. 目前胰腺癌的动物模型主要分为3种: 致癌药物诱发胰腺癌模型、种植瘤模型[7,8]和基因工程动物模型[9].
化学诱导性胰腺癌动物模型最常用的药物是N-亚硝基双(2-氧丙基)胺[N-nitrosobis(2-oxopropyl) amine]、DMBA、重氮丝氨酸等. DMBA及其他多环类芳香烃等有机物的致癌途径主要通过吸烟、空气污染、以及摄入被污染的水和食物等途径作用于人体导致肿瘤发生. DMBA在人体内通过代谢转化生成的物质可以与DNA共价结合, 在胰腺组织形成DNA加合物, 造成DNA损伤和染色体畸变, 导致癌基因和抑癌基因突变(特别是k-ras基因和p53抑癌基因突变), 从而诱发肿瘤发生, DMBA本身并没有致癌作用[10].
大量研究表明胰腺癌的发生是一个多阶段变化参与的过程, 一些病理学家认为PanIN体现了胰腺癌多阶段发展的过程, 根据组织学特点区分为1A、1B、2和3型. PanIN每一步进展都包含上皮细胞和周围组织的改变, 最主要的特点是纤维炎性基质的集聚, 也就是促结缔组织增生反应, 而在PanIN-1中主要为k-ras2基因第12位密码子的突变, 而在PanIN-2为p16/cdkn2a基因突变, smad4, tp53, brca2等突变通常发生在PanIN-3, 而端粒缩短引起染色体的异常集聚可发生在PanIN早期. DMBA诱导的胰腺癌模型有利于研究PanIN的进展过程.
在本研究中, 我们采用DMBA置入SD大鼠胰腺内的方法试图建立胰腺癌动物模型, A组(4 mg/100 g)58只大鼠术后5 mo后出现体质量增长曲线下降趋势, 病理学诊断显示为急、慢性胰腺炎、平滑肌肉瘤(39.7%, 23/58)及肿瘤浸润食管、胃及肠道等脏器, 并无胰腺上皮内瘤变和胰腺癌的出现. 我们系统的回顾了实验的经过, 并且查阅了更多的相关文献, 手术置入DMBA过程与国内外报道基本一致, 但为什么只诱导出胰腺部位的平滑肌肉瘤而无胰腺导管细胞癌?
国内外学者用DMBA诱导大鼠胰腺癌模型成功, 所用的剂量与时间各不相同. 有文献[11]报道DMBA诱导大鼠产生胰腺癌需要1-9 mo, 高脂肪高蛋白饮食是胰腺癌形成的一个促进因素, 可能的原因是干扰胰腺的自我修复机制以及影响早期病变的形成过程. Pan等[12]用DMBA诱导大鼠建立胰腺癌模型, 用时3-7 mo, 认为腺泡细胞选择性增生、干细胞分化及腺泡向导管转分化对MTC的产生起重要作用. Khalaileh等[10]按100 mg/mL剂量将DMBA溶解入苯试剂, 抽取10 μL注入小鼠胰腺, 3-4 wk出现PanIN, 5-6 mo出现胰腺导管腺癌, 并发现磷酸化rp56参与胰腺癌的产生, 当磷酸化rp56缺失, 首先在腺泡细胞出现k-ras基因突变导致DNA损伤. Guo等[3]将5 mg的DMBA植入大鼠胰腺内, 2 wk后可诱导PanIN产生, 1 mo内胰腺癌发生率为80%. Wang等[13]则使用更大剂量(10 mg/100 g)的DMBA置入SD大鼠胰腺内, 在1-2 mo内就诱导出了PanIN和胰腺癌.
A组按4 mg/100 g剂量置入DMBA, 死亡率17.1%(12/70), 术后5-6 mo体质量呈现明显下降趋势, 出现恶液质、血性腹水及其他脏器转移等症状, 共有23只大鼠病理诊断为平滑肌肉瘤, 肉瘤发生率为39.7%. 平滑肌肉瘤最常发生于胃肠道、腹膜后和子宫, 占肉瘤的2%-9%[14]. 有研究[15]显示非典型间叶细胞的集聚有可能是肉瘤发生早期的变化, 例如非典型成纤维或间叶细胞增殖、毛细血管不规则增生、早期肉瘤细胞超微结构的出现等. 间叶组织通常包含多能性间叶干细胞, 具有分化成骨骼肌细胞、成纤维细胞和平滑肌细胞的能力, 因此很难确定肉瘤的起源. Tan等[2]采用DMBA9 mg置入SD大鼠胰腺, 3-5 mo内胰腺肿瘤发生率为48.7%, 包括17例胰腺导管腺癌和1例胰腺纤维肉瘤. Zhe-Yu等[16]将DMBA(1 mg/25 g)包埋于小鼠胰腺, 2 mo后胰腺癌发生率为25%, 其中, 导管腺癌14例, 胰腺纤维肉瘤1例. Taguchi等[17]分别在新生SD大鼠皮下注射100 μg和500 μg的DMBA溶液, 肉瘤诱导成功率为62%和94%, 说明越高剂量的DMBA诱导肉瘤成功率越高, 而细胞周期、蛋白表达、原癌基因和肿瘤抑制基因, 吞噬和代谢相关酶的活性, 皮下组织的疏松程度均会影响癌基因的扩散. 所以, 本实验我们只发现DMBA置入胰腺诱导出平滑肌肉瘤这一现象, 胰腺部位平滑肌肉瘤的来源及形成机制有待进一步研究.
感谢杨盈赤老师在制模过程中及昌红、石峰老师在病理诊断中给予的大力帮助.
胰腺癌是恶性程度高、预后差的肿瘤, 5年生存率极低, 因此对于胰腺癌及癌前病变的诊断是改善胰腺癌预后的关键, 为了实现胰腺癌早期诊断及治疗的目的, 建立一种理想的胰腺癌动物模型并找到合适的早期诊断方法是必要的. 但本文未诱导出胰腺癌, 只诱导出平滑肌肉瘤.
陈洪, 医学博士, 主任医师, 副教授, 硕士研究生导师, 东南大学附属中大医院消化科; 陈光, 教授, 吉林大学第一医院消化器官外科
近年来国内外出现的各种各样的胰腺癌动物模型建立方法, 包括致癌物质诱发胰腺癌模型、种植瘤模型和基因工程动物模型, 各有各的优点和局限性, 并不能完全复制出人类胰腺癌的发病过程、全部病理变化、生物学特性和转移潜能, 因此提高模型的成功率、可行性、准确性和可重复性, 是将来胰腺癌动物模型的发展方向.
国内外学者用7,12-二甲基苯并蒽诱导大鼠胰腺癌模型成功, 所用的剂量与时间各不相同, 成瘤率波动在17%-39%, 文献报道7,12-二甲基苯并蒽诱导大鼠产生胰腺癌的剂量从1 mg到10 mg不等, 时间需要1-9 mo, 但目前7,12-二甲基苯并蒽诱导大鼠胰腺肿瘤模型尚没有统一的剂量与时间.
本实验发现了7,12-二甲基苯并蒽置入胰腺诱导出肉瘤这一与其他实验不一样的现象, 但关于肉瘤起源及形成机制还需进一步研究.
通过建立采用7,12-二甲基苯并蒽诱导胰腺肿瘤动物模型, 探讨7,12-二甲基苯并蒽合适的剂量和时间. 此外, 本实验发现了7,12-二甲基苯并蒽置入胰腺诱导出肉瘤这一现象, 但原因有待进一步研究.
7,12-二甲基苯并蒽: 是多环芳香烃类化合物, 本身不具有致癌作用, 但是在大鼠或小鼠体内的代谢产物会引起k-ras基因突变, 最终发展成为胰腺癌, 这与人类胰腺癌的发展过程类似, 并且7,12-二甲基苯并蒽一般也不引起其他组织器官的癌变.
论文设计合理, 统计正确, 结论实事求是, 讨论合乎逻辑, 对胰腺肿瘤的动物实验研究有一定的指导价值.
编辑: 于明茜 电编:都珍珍
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11-30. [PubMed] [DOI] |
| 2. | Tan XG, Yang ZL, Yang LP, Miao XY. Expression of DNA-repair proteins and their significance in pancreatic cancer and non-cancerous pancreatic tissues of Sprague-Dawley rats. World J Surg Oncol. 2014;12:32. [PubMed] [DOI] |
| 3. | Guo JC, Li J, Yang YC, Zhou L, Zhang TP, Zhao YP. Oligonucleotide microarray identifies genes differentially expressed during tumorigenesis of DMBA-induced pancreatic cancer in rats. PLoS One. 2013;8:e82910. [PubMed] [DOI] |
| 4. | Hsu CC, Herman JM, Corsini MM, Winter JM, Callister MD, Haddock MG, Cameron JL, Pawlik TM, Schulick RD, Wolfgang CL. Adjuvant chemoradiation for pancreatic adenocarcinoma: the Johns Hopkins Hospital-Mayo Clinic collaborative study. Ann Surg Oncol. 2010;17:981-990. [PubMed] [DOI] |
| 5. | Zhu Z, Liu T, Han F, Zhan SD, Wang CY. Mutations in the p16 gene in DMBA-induced pancreatic intraepithelial neoplasia and pancreatic cancer in rats. Hepatobiliary Pancreat Dis Int. 2015;14:208-214. [PubMed] [DOI] |
| 6. | Ponz-Sarvise M, Tuveson DA, Yu KH. Mouse Models of Pancreatic Ductal Adenocarcinoma. Hematol Oncol Clin North Am. 2015;29:609-617. [PubMed] [DOI] |
| 7. | Zhang Y, Chen L, Yang J, Fleming JB, Chiao PJ, Logsdon CD, Li M. Study human pancreatic cancer in mice: how close are they? Biochim Biophys Acta. 2013;1835:110-118. [PubMed] [DOI] |
| 8. | Herreros-Villanueva M, Hijona E, Cosme A, Bujanda L. Mouse models of pancreatic cancer. World J Gastroenterol. 2012;18:1286-1294. [PubMed] [DOI] |
| 9. | Jang KM, Kim SH, Choi D, Lee SJ, Park MJ, Min K. Pathological correlation with diffusion restriction on diffusion-weighted imaging in patients with pathological complete response after neoadjuvant chemoradiation therapy for locally advanced rectal cancer: preliminary results. Br J Radiol. 2012;85:e566-e572. [PubMed] [DOI] |
| 10. | Khalaileh A, Dreazen A, Khatib A, Apel R, Swisa A, Kidess-Bassir N, Maitra A, Meyuhas O, Dor Y, Zamir G. Phosphorylation of ribosomal protein S6 attenuates DNA damage and tumor suppression during development of pancreatic cancer. Cancer Res. 2013;73:1811-1820. [PubMed] [DOI] |
| 11. | Z'graggen K, Warshaw AL, Werner J, Graeme-Cook F, Jimenez RE, Fernández-Del Castillo C. Promoting effect of a high-fat/high-protein diet in DMBA-induced ductal pancreatic cancer in rats. Ann Surg. 2001;233:688-695. [PubMed] [DOI] |
| 12. | Pan JJ, Oh SH, Lee WC, Petersen BE. Bone marrow-derived progenitor cells could modulate pancreatic cancer tumorigenesis via peritumoral microenvironment in a rat model. Oncol Res. 2009;17:339-345. [PubMed] [DOI] |
| 13. | Wang L, Liu HL, Li Y, Yuan P. Proteomic analysis of pancreatic intraepithelial neoplasia and pancreatic carcinoma in rat models. World J Gastroenterol. 2011;17:1434-1441. [PubMed] [DOI] |
| 15. | Tholpady SS, Katz AJ, Ogle RC. Mesenchymal stem cells from rat visceral fat exhibit multipotential differentiation in vitro. Anat Rec A Discov Mol Cell Evol Biol. 2003;272:398-402. [PubMed] [DOI] |
| 16. | Zhe-Yu N, Qiao-Fei L, Meng-Yi W, Li Z, Lu-Tian Y, Quan L, Yu-Pei Z. Changes in the Expression of Glucose-regulated Protein 78 in the Occurrence and Progression of Pancreatic Cancer in Mouse Models. Zhongguo Yixue Kexueyuan Xuebao. 2015;37:259-263. [PubMed] |
| 17. | Taguchi S, Kuriwaki K, Souda M, Funato M, Ninomiya K, Umekita Y, Yoshida H. Induction of sarcomas by a single subcutaneous injection of 7,12-dimethylbenz[a]anthracene into neonatal male Sprague-Dawley rats: histopathological and immunohistochemical analyses. Toxicol Pathol. 2006;34:336-347. [PubMed] [DOI] |