修回日期: 2015-09-15
接受日期: 2015-09-18
在线出版日期: 2015-10-18
目的: 研究正加速度(+Gz)适应性训练对大鼠胃黏膜前列环素(prostacyclin, PGI2)、血栓素A2(thromboxane A2, TXA2)含量及TXA2/PGI2比值变化的影响.
方法: 40只♂SD大鼠随机分为5组, 每组8只, 分别标记为为A、B、C、D、E组. A组大鼠为空白对照, 不做处理, B组大鼠+5 Gz值暴露5 min, 1次/d, 连续暴露5 d, C组大鼠+10 Gz值暴露5 min, 1次/d, 连续暴露5 d, D组大鼠适应性训练(即+4 Gz值暴露3 min, 1次/d, 连续暴露5 d)后+5 Gz值暴露5 min, 1次/d, 连续暴露5 d, E组大鼠适应性训练(即+4 Gz值暴露3 min, 1次/d, 连续暴露5 d)后+10 Gz值暴露5 min, 1次/d, 连续暴露5 d. 试验结束后肉眼和光学显微镜下观察胃黏膜损伤情况, 计算损伤指数, ELISA法检测胃黏膜内TXB2、6-酮-前列腺素F1α(6-keto-prostaglandin F1α, 6-K-PGF1α)的含量, 并计算TXB2/6-K-PGF1α的比值.
结果: 肉眼和光学显微镜下观察, 除A组外, 其余各组胃黏膜均有损伤, D组损伤轻于B组, E组损伤轻于C组. 适应性训练后, D组损伤指数小于B组(0.875±0.641 vs 1.750±0.707, P<0.05), E组损伤指数小于C组(2.250±1.035 vs 5.625±1.767, P<0.05); D组TXB2低于B组(159.588 pg/mL±36.216 pg/mL vs 251.018 pg/mL±50.845 pg/mL, P<0.01), E组TXB2低于C组(150.476 pg/mL±48.589 pg/mL vs 331.538 pg/mL±79.102 pg/mL, P<0.01); D组6-K-PGF1α高于B组(72.242 pg/mL±12.413 pg/mL vs 52.015 pg/mL±11.827 pg/mL, P<0.01), E组6-K-PGF1α高于C组(87.426 pg/mL±15.833 pg/mL vs 44.726 pg/mL±18.867 pg/mL, P<0.01); D组TXB2/6-K-PGF1α比值小于B组(2.283±0.705 vs 5.128±1.788, P<0.01), E组TXB2/6-K-PGF1α比值小于C组(2.250±1.035 vs 8.599±4.157, P<0.01).
结论: 适应性训练可明显减轻持续+Gz暴露带来的胃黏膜损伤, 其机制与PGI2含量升高、TXA2含量降低以及TXA2/PGI2比值降低有关.
核心提示: 适应性训练可明显减轻正加速度(+Gz)值带来的胃黏膜损伤, 其机制与前列环素(prostacyclin, PGI2)含量升高、血栓素A2(thromboxane A2, TXA2)含量降低以及TXA2/PGI2比值降低有关, 从而为飞行员制定合理的体能训练计划, 减少飞行环境带来的胃肠道损伤提供坚实的理论基础.
引文著录: 刘昊, 陈英, 徐珊, 杜斌, 唐合兰, 邱杰, 杨春敏. 正加速度适应性训练对大鼠胃黏膜PGI2、TXA2含量及TXA2/PGI2比值的影响. 世界华人消化杂志 2015; 23(29): 4680-4686
Revised: September 15, 2015
Accepted: September 18, 2015
Published online: October 18, 2015
AIM: To assess the effect of positive acceleration adaptive training on prostacyclin (PGI2) and thromboxane A2 (TXA2) contents and TXA2/PGI2 ratio in the gastric mucosa of rats.
METHODS: Forty male SD rats were randomly divided into five groups: A, B, C, D and E. Group A did not undergo any treatment. Group B was exposed to +5 Gz for 5 min per day over 5 consecutive days. Group C was exposed to +10 Gz for 5 min per day over 5 consecutive days. Group D was exposed to +4 Gz for 3 min per day over 5 consecutive days and +5 Gz for 5 min per day over another 5 consecutive days. Group E was exposed to +4 Gz for 3 min per day over 5 consecutive days and +10 Gz for 5 min per day over another 5 consecutive days. The damage to the gastric mucosa was then observed grossly and under a microscope to calculate the damage index. The TXB2 and 6-keto-prostaglandin F1α (6-K-PGF1α) contents in the gastric mucosa were detected by ELISA, and the TXB2/6-K-PGF1α ratio was calculated.
RESULTS: On unaided visual and microscopic observations, all groups developed mucosa damage, with the exception of group A. The damage to the gastric mucosa was less in group D than in group B, and in group E than in group C. The harm index was significantly lower in group D than in group B (0.875 ± 0.641 vs 1.750 ± 0.707, P < 0.05), and in group E than in group C (2.250 ± 1.035 vs 5.625 ± 1.767, P < 0.05). The content of TXB2 was significantly lower in group D than in group B (159.588 pg/mL ± 36.216 pg/mL vs 251.018 pg/mL ± 50.845 pg/mL, P < 0.01), and in group E than in group C (150.476 pg/mL ± 48.589 pg/mL vs 331.538 pg/mL ± 79.102 pg/mL, P < 0.01). The content of 6-K-PGF1α was significantly higher in group D than in group B (72.242 pg/mL ± 12.413 pg/mL vs 52.015 pg/mL ± 11.827 pg/mL, P < 0.01), and in group E than in group C (87.426 pg/mL ± 15.833 pg/mL vs 44.726 pg/mL ± 18.867 pg/mL, P < 0.01). The ratio of TXB2/6-K-PGF1α was significantly lower in group D than in group B (2.283 ± 0.705 vs 5.128 ± 1.788, P < 0.01), and in group E than in group C (2.250 ± 1.035 vs 8.599 ± 4.157, P < 0.01).
CONCLUSION: Adaptive training can significantly reduce the gastric mucosal damage caused by high +Gz via mechanisms possibly related to the increase in PGI2 content, decrease in TXA2 content and reduction of the TXA2/PGI2 ratio.
- Citation: Liu H, Chen Y, Xu S, Du B, Tang HL, Qiu J, Yang CM. Effect of positive acceleration adaptive training on PGI2 and TXA2 contents and TXA2/PGI2 ratio in the gastric mucosa of rats. Shijie Huaren Xiaohua Zazhi 2015; 23(29): 4680-4686
- URL: https://www.wjgnet.com/1009-3079/full/v23/i29/4680.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i29.4680
适应性细胞保护在20世纪80年代由Robert等[1]首次提出, 他是指给予胃黏膜温和的低浓度或低剂量的弱刺激物后, 随后能够抵抗较高浓度或高剂量的同类刺激物造成的胃黏膜损伤, 从而发挥胃黏膜的"适应性细胞保护". Robert等[1]和Wallace等[2]在随后的研究中分别指出, 内源性前列腺素物质合成和释放在适应性细胞保护中占有重要地位. 在航空航天医学领域中, 如何减轻正加速度(+Gz)对飞行员全身各系统器官造成的损伤一直以来就是研究的热点. 已有相关研究[3]报道预适应训练可能减轻+Gz暴露下大鼠胃黏膜的损伤, 但其具体作用机制此前尚未报道, 内源性前列腺素物质在这一过程中是否产生作用也尚未明了. 因此, 我们通过大鼠适应性训练试验来观察其胃黏膜损伤情况以及测定大鼠胃黏膜内血栓素A2(thromboxane A2, TXA2)、前列环素(prostacyclin, PGI2)含量的变化, 阐明适应性训练对胃黏膜保护作用的机制, 从而为飞行员建立合理的体能训练计划, 减少飞行环境中对胃肠道的损伤提供理论基础. 由于TXA2和PGI2的生物半衰期(T1/2)均较短, 故通常测定其稳定的代谢产物TXB2和6-酮-前列腺素F1α(6-keto-prostaglandin F1α, 6-K-PGF1α)分别代表TXA2和PGI2的含量[4].
40只健康♂SD大鼠, SPF级, 体质量180 g±10 g, 购自中国军事医学科学院实验动物中心, 许可证号: SCXK-(军)-2012-0004, 食用由中国航空航天医学研究所提供的全营养颗粒饲料, 并安排专人负责喂养, 自由饮食及水. 动物实验室室温由空调控制, 维持在23 ℃±2 ℃. 小动物离心机、小动物手术器械、游标卡尺、试验动物解剖操作台, 由航空航天医学实验室提供; 0.9%氯化钠注射液, 华润双鹤药业股份有限公司, 生产批号Y1502269; 灭菌注射用水, 华润双鹤药业股份有限公司, 生产批号Y150227 10W; 碘伏消毒液, 北京四环卫生药械厂有限公司; 医用消毒乙醇, 北京宏志伟达工贸有限公司朝阳卫生用品分公司, 生产批号10141103; 超低温保存箱, 海尔集团公司; 戊巴比妥钠, Sigma公司提供; TXB2、6-K-PGF1α放射免疫分析盒由北京尚柏生物技术研究所提供; 病理组织切片机及光学显微镜由中国人民解放军空军总医院病理科提供. 其他仪器和设备均由航空航天医学实验室提供.
1.2.1 动物分组: 40只♂SD大鼠随机分为5组, 每组8只, 分别为A组: 正常对照组, B组: +5 Gz值暴露组, C组: +10 Gz值暴露组, D组: 适应性训练后+5 Gz值暴露组, E组: 适应性训练后+10 Gz值暴露组. 所有大鼠均适应性喂养7 d.
1.2.2 +Gz暴露及适应性训练: 采用小动物离心机模拟+Gz值暴露, 离心机半径为1 m, 利用特制的固定盒承载大鼠, 每只大鼠专用一个固定盒, 保证加速度作用的方向, 大鼠头端均朝向离心机轴心, 俯面固定于离心机转臂远端, 采用梯形+Gz作用曲线, G值增长率为1 G/s, 全程由计算机进行加速度程序控制. 适应性训练及+Gz暴露方法参照赵洪礼等[3]、范勤等[5]及前期预实验结果具体如下: A组大鼠为空白对照, 不做处理, B组大鼠+5 Gz值暴露5 min, 1次/d, 连续暴露5 d, C组大鼠+10 Gz值暴露5 min, 1次/d, 连续暴露5 d, D组大鼠适应性训练(即+4 Gz值暴露3 min, 1次/d, 连续暴露5 d)后+5 Gz值暴露5 min, 1次/d, 连续暴露5 d, E组大鼠适应性训练(即+4 Gz值暴露3 min, 1次/d, 连续暴露5 d)后+10 Gz值暴露5 min, 1次/d, 连续暴露5 d.
1.2.3 标本采集及观察: +Gz值暴露完毕下离心机后, 用2%戊巴比妥钠(2.3 mL/kg)腹腔麻醉, 腹部剪毛, 碘伏消毒, 打开腹腔后结扎贲门和幽门, 将胃取出, 沿着胃大弯侧剪开, 冰生理盐水小心冲洗胃黏膜, 平铺于纱布上, 大头针固定, 肉眼观察胃黏膜损伤情况.
1.2.4 胃黏膜损伤指数测定: 观察胃黏膜损伤程度, 用游标卡纸测出损伤长度及宽度(单位为mm), 按Guth等[6]标准积分: 点状出血计1 分; 线状出血, 长度<1 mm计2分; 1 mm≤长度<2 mm计3分; 2 mm≤长度<3 mm计4分; 3 mm≤长度<4 mm计4分, 以此类推; 宽度>1 mm时分值加倍.
1.2.5 病理学观察: 取损伤最严重处胃黏膜组织(10 mm×10 mm)一块, 甲醛固定、脱水透明、浸蜡包埋、切片与贴片、脱蜡、苏木精-伊红(hematoxylin-eosin staining, HE)染色、脱水透明、封固, 光学显微镜下观察胃黏膜损伤的形态学变化.
1.2.6 胃黏膜TXB2、6-K-PGF1α含量检测: 胃黏膜损伤指数测定及留取胃黏膜标本后, 用小刀片轻轻刮取胃黏膜, 置于EP管中, -80 ℃冰箱保存, 采用ELISA法检测TXB2、6-K-PGF1α的含量, 准确称取组织质量, 按照质量(g): 体积(mL) = 1:9的比例加入9倍体积生理盐水, 剪碎组织, 冰水浴制备匀浆, 2500-3000 r/min, 离心10 min, 取上清10%匀浆上清液, 其他具体操作方法分别严格参照TXB2、6-K-PGF1α试剂盒说明书进行操作, 以A值为纵坐标, 以标准品浓度为横坐标, 绘制标准曲线, 根据的样品的A值可在标准曲线上查出其浓度, 以pg/mL表示.
统计学处理 采用SPSS18.0软件对数据进行统计学分析, 首先对数据进行正态性检验和方差齐性分析, 计量资料使用mean±SD表示, 各组间均数比较采用t检验. P<0.05为差异具有统计学意义.
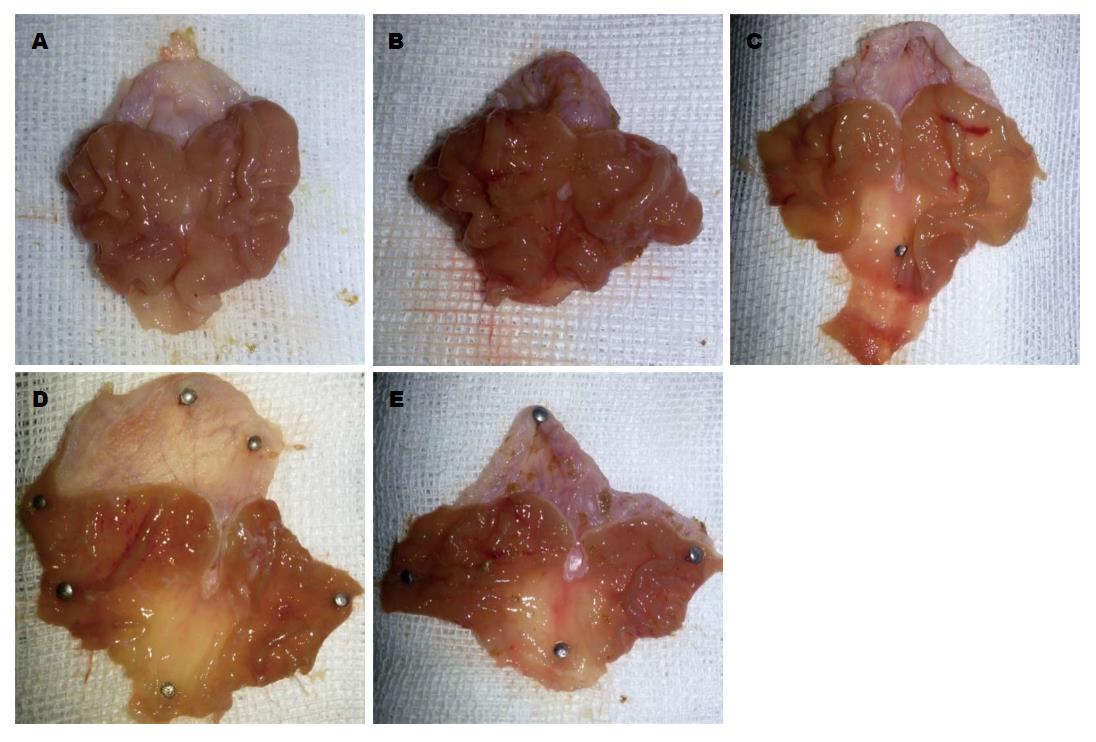
A组: 胃底、胃窦黏膜光滑, 呈淡红色, 胃黏膜组织完整, 无缺损, 无充血、坏死. B组: 胃黏膜潮红, 可见点状及线状出血, 无坏死、糜烂、水肿. C组: 可见数个长条线状及点状出血灶, 周围黏膜欠完整, 无坏死及糜烂形成. D组: 可见散在点状出血灶, 胃黏膜光滑、完整, 无明显水肿、坏死形成. E组: 可见少许线状及点状出血, 胃黏膜光滑呈淡红色, 黏膜皱襞完整, 无水肿及坏死(图1).
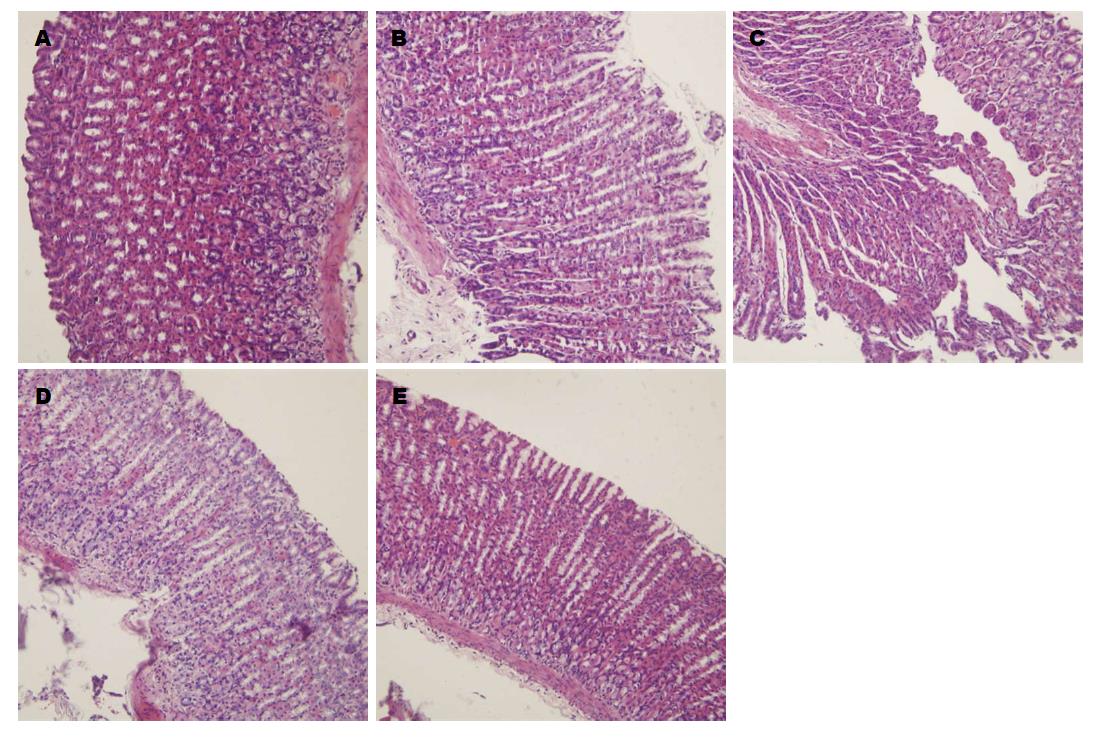
A组: 胃黏膜组织形态正常, 结构完整, 胃小凹、胃底腺、黏膜下层、肌层、浆膜层组织完整. B组: 损伤局限于黏膜层及黏膜下层, 部分绒毛结构脱落, 黏膜层可见中性粒细胞浸润. C组: 损伤达肌层和浆膜层, 黏膜层及黏膜下层组织缺损, 腺体结构破坏严重, 细胞排列紊乱, 极不规则, 组织松散, 大量炎性细胞浸润. D组: 损伤限于黏膜层, 腺体破坏较轻, 部分绒毛破坏, 可见炎性细胞浸润. E组: 损伤达黏膜层, 部分损伤达黏膜下层, 部分腺体结构破坏, 有炎性细胞浸润(图2).
C组损伤指数明显大于B组(5.625±1.767 vs 1.750±0.707)(P<0.05); 适应性训练后, D组损伤指数(0.875±0.641)小于B组(P<0.05), E组损伤指数(2.250±1.035)小于C组(P<0.05).
B、C组TXB2含量均高于A组(P<0.05); 适应性训练后, D组TXB2含量低于B组(P<0.01), E组TXB2含量低于C组(P<0.01). B、C组6-K-PGF1α含量均低于A组(P<0.05); 适应性训练后, D组6-K-PGF1α含量高于B组(P<0.01), E组6-K-PGF1α含量高于C组(P<0.01). B组、C组TXB2/6-K-PGF1α比值均大于A组(P<0.05); 适应性训练后, D组TXB2/6-K-PGF1α比值小于B组(P<0.01), E组TXB2/6-K-PGF1α比值小于C组(P<0.01)(表1).
在航空航天医学领域, 飞行员在飞行环境及平时训练中常处于+Gz环境暴露中, 其胃黏膜损伤的发生率较高, 如何减少+Gz带来的损伤是研究的重要课题, 适应性训练可在一定程度上减轻+Gz造成的胃黏膜损伤, 以往研究仅探讨不同+Gz暴露对胃黏膜的损伤, 而对正加速度适应性训练的研究较少, 内源性前列腺素类物质是否与其相关也尚未明了. 赵洪礼等[3]及范勤等[5]研究发现, 随着+Gz暴露值的增加, 大鼠胃黏膜损伤逐渐加重. 本试验研究结果显示, B组和C组损伤指数均明显高于A组, 且C组损伤指数高于B组, 差异均具有统计学意义(P<0.05), 这与以往研究结果一致[4,7,8]. 大鼠适应性训练后, D组损伤指数低于B组; E组损伤指数低于C组(P<0.05), 说明适应性训练能够明显减少胃黏膜损伤指数. 胃黏膜组织肉眼观及光学显微镜下, 同样可以发现D组损伤轻于B组, E组损伤轻于C组.
前列腺素为广泛存在于人和动物体内的一类不饱和脂肪酸, 具有多种生物活性. 环氧合酶(cyclooxygenase, COX)是合成前列腺素类物质的限速酶, 其催化花生四烯酸生成PGG2、PGH2, 再通过各种细胞专一性酶和异构酶, 生成前列腺素类物质, 包括PGD2、PGE2、PGF2a、PGI2和TXA2[4]. 胃黏膜层中前列腺素类物质含量高于黏膜下层和肌层[9]. 其中, PGE2、PGI2和TXA2在胃黏膜适应性细胞保护中占有重要作用.
有报道[10,11]指出, TXA2和PGI2在急性胃黏膜损伤发生及胃黏膜保护作用中分别发挥不同的生理作用. TXA2主要由血小板合成, 是目前已知生物活性最强的血管收缩和血小板聚集物质[12]. TXA2在急性胃黏膜损伤中扮有重要的作用, 这种作用可能是由于其产生了各种坏死物质[13]. 体外实验表明, TXA2能够对兔胃黏膜直接产生细胞毒性, 抑制TXA2的合成能够减轻牛胆酸诱导的胃黏膜损伤. 研究人员还发现在溃疡组织中TXA2合成增多, 而在正常组织中并非如此. TXA2抑制剂能够加速胃溃疡的愈合. 增高的TXA2能够刺激胃酸的分泌, 对胃黏膜的再生产生抑制作用. 胃黏膜正常功能的维持很大程度上取决于黏膜内血流量, 胃黏膜血流可为黏膜细胞提供氧及营养物质, 带走细胞代谢产物, 从而使黏膜局部微环境保持相对稳定[14,15]. 而TXA2有可能通过减少胃黏膜血流来抑制溃疡的愈合, 其在一定程度上阻碍了溃疡边缘上皮细胞的增殖[16]. 李志军等[17]研究发现, 胃黏膜内TXA2的含量的升高使得胃黏膜下层广泛的微循环障碍, 是家兔应激性溃疡发病的重要机制. 而使用TXA2特异性抑制剂后, 黏膜下层微循环也得到了相应的改善, 从而证实TXA2的显著升高介导了胃黏膜下层微循环的障碍, 促进胃黏膜的损伤. 本实验研究结果同样说明了上述问题, 在+Gz暴露后, B组和C组的TXB2含量明显高于A组; 随着+Gz值的增加, C组的TXB2含量显著高于B组(P<0.05). 然而在适应性训练后, D组的TXB2含量低于B组, E组的TXB2含量明显低于C组(P<0.05), 说明适应性训练可显著降低胃黏膜内TXB2的含量, 具有抗胃黏膜损伤的作用.
PGI2由血管内皮细胞生成, 具有扩张血管、抑制血小板聚集的作用, 同时PGI2是大鼠胃黏膜中含量最丰富的一型前列腺素类物质, 且代谢旺盛, 生物活性强, 具有强烈的细胞保护作用, 内源性含量降低则可造成黏膜损伤[18]. 林进乾等[19]研究表明, 胃黏膜损伤后, PGI2含量降低, 其保护作用减弱. 王国中等[20]发现PGI2能过增加胃黏膜血流量, 为黏膜细胞提供丰富的氧和营养物质, 带走有害物质, 使胃黏膜上皮细胞分泌黏液增多, 从而增强黏膜屏障和黏液屏障作用. 同样有研究人员发现PGI2可通过活化的PGIP受体刺激传入神经释放降钙素基因相关肽(calcitonin gene related peptide, CGRP), 而CGRP是迄今为止发现的最强的舒血管物质, 故PGI2可通过刺激CGRP的释放而发挥舒张胃黏膜血管、保护胃黏膜的作用. 本实验同样说明, 随着+Gz暴露值的增加, 胃黏膜损伤逐渐加重, PGI2含量逐渐降低, 保护作用减弱. 在适应性训练后, D组6-K-PGF1α含量高于B组, E组6-K-PGF1α含量明显高于C组, 且差异均具有统计学意义, 说明适应性训练后, PGI2合成增加, 胃黏膜保护作用加强.
在胃黏膜内, TXA2和PGI2为一对作用相反的物质, 互为拮抗剂. PGI2有细胞保护作用, 而TXA2具有黏膜损伤作用. 正常人胃黏膜内TXA2/PGI2处于动态平衡状态[21]. 严重创伤及应激可使TXA2和PGI2含量迅速发生改变, TXA2/PGI2动态平衡被破坏, 且TXA2/PGI2改变幅度与胃黏膜损伤程度呈正相关, 即TXA2/PGI2比值变化可反映胃黏膜损害情况, TXA2/PGI2比值增大, 表示胃的细胞保护作用减弱, 损伤因素增加[22-24]. 文国容等[12]研究发现, 胃乐散可能通过增加PGI2分泌, 纠正TXA2、PGI2的失衡来达到治疗溃疡的目的. 应激所造成的急性胃黏膜损伤直接表现为花生四烯酸代谢紊乱[25]. 本研究发现, C组TXB2/6-K-PGF1α比值明显高于B组, 差异具有统计学意义, 即胃黏膜损伤越重, TXA2/PGI2比值越大. 而适应性训练后, TXB2/6-K-PGF1α比值降低, 说明适应性训练能够抵抗胃黏膜损伤的发生, 有利于维持TXA2/PGI2的动态平衡.
本实验对正加速度适应性训练后胃黏膜损伤保护作用的机制进行了初步研究, 结果表明, 适应性训练可明显减轻高+Gz值带来的胃黏膜损伤, 其机制与PGI2含量升高、TXA2含量降低以及TXA2/PGI2比值降低有关. 从而为飞行员制定合理的体能训练计划, 减少飞行环境带来的胃肠道损伤提供坚实的理论基础, 同时也为深入研究适应性训练对飞行员胃黏膜的保护作用提供科学依据.
在航空航天医学领域中, 如何减轻正加速度(+Gz)对飞行员全身各系统器官造成的损伤一直以来就是研究的热点. 已有相关研究报道预适应训练能够减轻+Gz暴露下大鼠胃黏膜的损伤, 但其具体作用机制此前尚未报道, 内源性前列腺素物质在这一过程中是否产生作用也尚未明了.
迟雁, 副教授, 北京大学第一医院
飞行人员常处于持续+Gz暴露中, 其全身各器官均可造成一定损害, 而适应性训练可明显减轻+Gz带来的胃黏膜损伤, 胃黏膜中前列环素(prostacyclin, PGI2)、血栓素A2(thromboxane A2, TXA2)含量及TXA2/PGI2比值的变化可能与之相关, 此前尚未有相关文献报道其具体作用机制.
近年来相关研究报道不同+Gz暴露及实验性大鼠胃溃疡下胃黏膜血流量、生长因子(表皮生长因子、转化生长因子)、胃肠激素(胃泌素、生长抑素等)、前列腺素类物质、氧自由基(丙二醛、超氧化物歧化酶)等, 但其与大鼠正加速度适应性训练的相关研究此前尚未见报道.
本研究采用小动物离心机模拟+Gz值暴露, 离心机半径为1 m, 利用特制的固定盒承载大鼠, 每只大鼠专用一个固定盒, 保证加速度作用的方向, 大鼠头端均朝向离心机轴心, 俯面固定于离心机转臂远端, 采用梯形+Gz作用曲线, G值增长率为1 G/s, 全程由计算机进行加速度程序控制. 通过不同+Gz值暴露研究正加速度适应性训练对大鼠胃黏膜PGI2、TXA2含量及TXA2/PGI2比值的影响.
本研究表明, 适应性训练可明显减轻高+Gz值带来的胃黏膜损伤, 从而为飞行员制定合理的体能训练计划, 减少飞行环境带来的胃肠道损伤提供坚实的理论基础, 同时也为深入研究适应性训练对飞行员胃黏膜的保护作用提供科学依据.
适应性细胞保护: 是指给予胃黏膜温和的低浓度或低剂量的弱刺激物后, 随后能够抵抗较高浓度或高剂量的同类刺激物造成的胃黏膜损伤, 从而发挥胃黏膜的"适应性细胞保护".
本研究通过不同加速度及适应性训练对大鼠胃黏膜损伤程度及胃黏膜PGI2、TXA2含量及TXA2/PGI2比值影响, 阐述正加速度适应性训练后胃黏膜损伤保护作用的机制, 从而为减少飞行环境带来的胃肠道损伤提供理论基础. 研究有一定的实际意义, 符合伦理, 研究目的清楚, 材料和方法叙述明确, 统计学方法选用合理.
编辑: 郭鹏 电编:都珍珍
| 1. | Robert A, Nezamis JE, Lancaster C, Davis JP, Field SO, Hanchar AJ. Mild irritants prevent gastric necrosis through "adaptive cytoprotection" mediated by prostaglandins. Am J Physiol. 1983;245:G113-G121. [PubMed] |
| 2. | Wallace JL, Track NS, Cohen MM. Chronic mild restraint protects the rat gastric mucosa from injury by ethanol or cold restraint. Gastroenterology. 1983;85:370-375. [PubMed] |
| 4. | Cathcart MC, O'Byrne KJ, Reynolds JV, O'Sullivan J, Pidgeon GP. COX-derived prostanoid pathways in gastrointestinal cancer development and progression: novel targets for prevention and intervention. Biochim Biophys Acta. 2012;1825:49-63. [PubMed] [DOI] |
| 5. | 范 勤, 陈 英, 杜 斌, 唐 合兰, 杨 春敏. 大鼠胃黏膜SS、EGF、PGE2含量在模拟+Gz值暴露下的变化及机制. 胃肠病学和肝病学杂志. 2014;23:138-42. |
| 6. | Guth PH, Aures D, Paulsen G. Topical aspirin plus HCl gastric lesions in the rat. Cytoprotective effect of prostaglandin, cimetidine, and probanthine. Gastroenterology. 1979;76:88-93. [PubMed] |
| 9. | 常 江, 邓 长生, 沈 佩弟. 前列腺素与胃黏膜保护. 国外医学(内科学分册). 1992;19:169-172. |
| 10. | Claar D, Hartert TV, Peebles RS. The role of prostaglandins in allergic lung inflammation and asthma. Expert Rev Respir Med. 2015;9:55-72. [PubMed] [DOI] |
| 11. | Caughey GE, Cleland LG, Penglis PS, Gamble JR, James MJ. Roles of cyclooxygenase (COX)-1 and COX-2 in prostanoid production by human endothelial cells: selective up-regulation of prostacyclin synthesis by COX-2. J Immunol. 2001;167:2831-2838. [PubMed] [DOI] |
| 13. | Amagase K, Yoshida Y, Hara D, Murakami T, Takeuchi K. Prophylactic effect of egualen sodium, a stable azulene derivative, on gastrointestinal damage induced by ischemia/reperfusion, double antiplatelet therapy and loxoprofen in rats. J Physiol Pharmacol. 2013;64:65-75. [PubMed] |
| 14. | Sato N, Kawano S, Tsuji S, Ogihara T, Yamada S. Gastric blood flow in ulcer diseases. Scand J Gastroenterol Suppl. 1995;208:14-20. [PubMed] [DOI] |
| 16. | Takahashi S, Shigeta J, Ishikawa M, Kobayashi N, Okabe S. Role of thromboxane A2 in healing of gastric ulcers in rats. Jpn J Pharmacol. 1999;79:101-107. [PubMed] [DOI] |
| 18. | Harada N, Okajima K, Murakami K, Isobe H, Liu W. Gastric prostacyclin (PGI2) prevents stress-induced gastric mucosal injury in rats primarily by inhibiting leukocyte activation. Prostaglandins Other Lipid Mediat. 1999;57:291-303. [PubMed] [DOI] |
| 19. | 林 进乾, 潘 光才, 陈 卫东, 许 真, 陈 定光. 应激性胃黏膜出血与血浆血栓素、前列环素和胃泌素水平的关系. 胃肠病学和肝病学杂志. 1999;8:285-286. |
| 20. | 王 国中, 陈 志伟, 潘 洪明, 李 和泉. 丹参抗大鼠乙醇性胃粘膜损伤的作用及机制. 中国中西医结合消化杂志. 2002;10:340-341. |
| 21. | Haubro Andersen P, Jarløv N. Investigation of the possible role of endotoxin, TXA2, PGI2 and PGE2 in experimentally induced rumen acidosis in cattle. Acta Vet Scand. 1990;31:27-38. [PubMed] |
| 25. | Stein TA, Keegan LM, Auguste LJ, Bailey B, Wise L. Stress-induced gastric lesions and the synthesis of prostaglandins and leukotrienes. J Surg Res. 1991;51:368-371. [PubMed] [DOI] |