修回日期: 2015-09-15
接受日期: 2015-09-21
在线出版日期: 2015-10-18
目的: 探讨YWHAE基因表达与结肠癌细胞增殖的关系及其在结肠癌组织中表达的临床意义.
方法: 应用免疫组织化学探讨YWHAE过表达与结肠癌转移、分化及分期的关系; 慢病毒转染小RNA沉默结肠癌HT-29细胞YWHAE基因, RT-PCR、Western blot技术检测沉默效率; 四甲基偶氮唑盐微量酶反应比色法(methyl-thiazolyl-tetrazolium, MTT)技术观察转染前后细胞增殖变化; 流式细胞术检测转染前后细胞周期变化及凋亡情况; 细胞克隆实验检测转染前后细胞克隆形成情况.
结果: YWHAE在结肠癌组织中高表达, 在癌旁5 cm处黏膜正常腺体中低表达或表达缺失(P<0.001), 发生转移的结肠癌YWHAE表达要明显高于未转移的结肠癌组织(P<0.05); 高效转染、沉默YWHAE基因表达后, 结肠癌HT-29细胞长速度明显减慢(P<0.01), 细胞凋亡增加, 细胞周期阻滞于G1期, 细胞克隆形成率显著降低(P<0.01).
结论: 沉默YWHAE基因表达能抑制结肠癌细胞增殖, 可能与促进肿瘤细胞凋亡及细胞周期阻滞有关.
核心提示: YWHAE在结肠癌组织中高表达, 与结肠癌的转移、分期相关; 沉默结肠癌细胞YWHAE基因表达后, 能捕获结肠癌细胞周期在G1期、促进结肠癌细胞凋亡, 抑制结肠癌细胞生长.
引文著录: 解娜, 黄幼生, 罗志飞, 薛逢贵. YWHAE对结肠癌细胞增殖的影响及表达意义. 世界华人消化杂志 2015; 23(29): 4643-4651
Revised: September 15, 2015
Accepted: September 21, 2015
Published online: October 18, 2015
AIM: To investigate the correlation between YWHAE overexpression and colon cancer proliferation.
METHODS: We conducted immunohistochemical analysis of YWHAE overexpression in 87 colon carcinoma specimens and analyzed its relationship with clinical and pathological parameters. YWHAE expression was then silenced by RNA interference in colon cancer cell line HT-29, and the expression levels of YWHAE protein and mRNA were assayed by Western blot and reverse transcription-PCR, respectively. Cell proliferation was evaluated using the MTT method, and cell cycle and apoptosis were examined by flow cytometry. Colony formation assay was used to determine the growth properties of transfected cells.
RESULTS: YWHAE was highly expressed in colon carcinoma, and negative or low expression was observed in colon mucosal epithelial cells (P < 0.001). The expression intensity of YWHAE was significantly higher in colon cancer with metastasis than in colon cancer without metastasis (P < 0.05). The proliferation and colony formation ability of colon cancer cells were significantly reduced after silencing of YWHAE expression. Additional results showed that reduced YWHAE expression in colon cells led to an increased cell apoptosis rate and cell cycle G1 arrest.
CONCLUSION: YWHAE is overexpressed in colon cancer, which may be related to metastasis in colon carcinoma. Silencing of YWHAE inhibited the proliferation ability of colon cancer cells, which may be associated with cell apoptosis and cell cycle arrest.
- Citation: Xie N, Huang YS, Luo ZF, Xue FG. RNA interference based silencing of YWHAE suppresses proliferation of colon cancer cells. Shijie Huaren Xiaohua Zazhi 2015; 23(29): 4643-4651
- URL: https://www.wjgnet.com/1009-3079/full/v23/i29/4643.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i29.4643
结肠癌是我国第四常见的恶性肿瘤, 转移、复发是绝大多数结肠癌患者的首要死亡原因[1,2]. 手术治疗仍是结肠癌最常用的治疗措施, 然而对转移患者缺乏效率. 如何抑制结肠癌转移、复发及提高结肠癌转移患者的生存时间是目前亟需解决的问题. 探讨结肠癌转移机制、寻找结肠癌转移分子靶标对判断预后、设计靶点药物及提高治疗水平具有重要意义.
YWHAE基因编码的蛋白属于14-3-3家族中的一个亚型: 14-3-3ε[3]. 14-3-3蛋白是细胞中含量最丰富的蛋白之一. 在哺乳动物中, 14-3-3蛋白家族是一个由7个亚型(β、ε、η、γ、τ、ζ和σ)组成, 普遍存在又高度保守的酸性蛋白家族[3,4]. 14-3-3蛋白参与细胞多种生理活动. 近年研究[3-6]证实14-3-3蛋白在肿瘤的形成及发展过程中扮演着重要而复杂的角色. 目前研究[5,6]发现在肝癌和肾癌中YWHAE(14-3-3ε)高表达, 高表达的YWHAE可以促进癌细胞增殖、迁移和抑制凋亡, 其机制可能与抑制YWHAE基因可减少胞内线粒体、通过竞争性抑制剂破坏YWHAE蛋白配体关联等相关.
前期研究[7]发现, 用抑癌剂二烯丙基二硫(diallyl disulfide, DADS)处理结肠癌细胞HT-29后, YWHAE基因mRNA转录水平下调. 为了进一步研究YWHAE与结肠癌的关系, 本文在组织学水平上探讨YWHAE表达与结肠癌发生发展的关系; 应用RNA干扰(RNA interference, RNAi)技术沉默YWHAE基因表达, 观察YWHAE基因沉默前后结肠癌细胞功能学变化, 为阐明结肠癌发生发展的分子机制奠定基础.
87例结肠癌及其配对癌旁5 cm处正常黏膜组织均来源于海南医学院附属医院病理科2008-2013年档存蜡块(其中28例含有新鲜结肠癌及其配对组织). 所有病例均是具有完整病史资料的手术切除标本(表1). 所选病例均经2名具有丰富病理诊断经验的病理医师复诊及分型、分级、分期. PV-9000免疫组织化学检测试剂盒、DAB显色液购自福州迈新生物有限公司; YWHAE多克隆、GAPDH单抗及二抗抗体为Abcam公司产品. HT-29及293T细胞系购自上海吉凯生物技术有限公司. 靶向YWHAE基因序列(CTGAGTGAAGAAAGCTATA、TGACAGTTGAAGAAAGAAA)设计YWHAE-shRNA, GV248载体连接及慢病毒包装由上海吉凯生物技术有限公司完成; RT-PCR相关试剂盒购自北京天根生物有限公司. 蛋白裂解液及BCA蛋白定量试剂盒购自杭州碧云天.
| 分组 | n | YWHAE表达情况 | χ2值 | P值 | |
| 高表达 | 低表达 | ||||
| 分化程度 | 0.520 | 0.727 | |||
| 高、中 | 69 | 51 | 18 | ||
| 低 | 18 | 12 | 6 | ||
| 年龄(岁) | 0.530 | 1.000 | |||
| <60 | 31 | 23 | 8 | ||
| ≥60 | 56 | 40 | 16 | ||
| 性别 | 0.321 | 0.759 | |||
| 男 | 53 | 41 | 12 | ||
| 女 | 34 | 22 | 12 | ||
| 转移情况 | 4.607 | 0.037 | |||
| 无 | 50 | 39 | 11 | ||
| 有 | 37 | 35 | 2 | ||
| 部位 | 0.092 | 1.000 | |||
| 右半结肠 | 61 | 60 | 11 | ||
| 左半结肠 | 16 | 14 | 2 | ||
| TNM分期 | 4.607 | 0.037 | |||
| Ⅰ+Ⅱ | 50 | 39 | 11 | ||
| Ⅲ+Ⅳ | 37 | 35 | 2 | ||
1.2.1 组织芯片制作: 组织芯片具体制作步骤按文献[8]进行. 显微镜下选择HE切片中适宜的样本位置, 并对应标记好石蜡标本, 每个标本取两点. 根据实验研究的需要, 受体蜡块设计为18×12点阵. 将各组样本按病理号及分期顺序排放, 阵列孔左上方第1排第1个孔设置为空白标记, 174个蜡块制作成2张组织芯片.
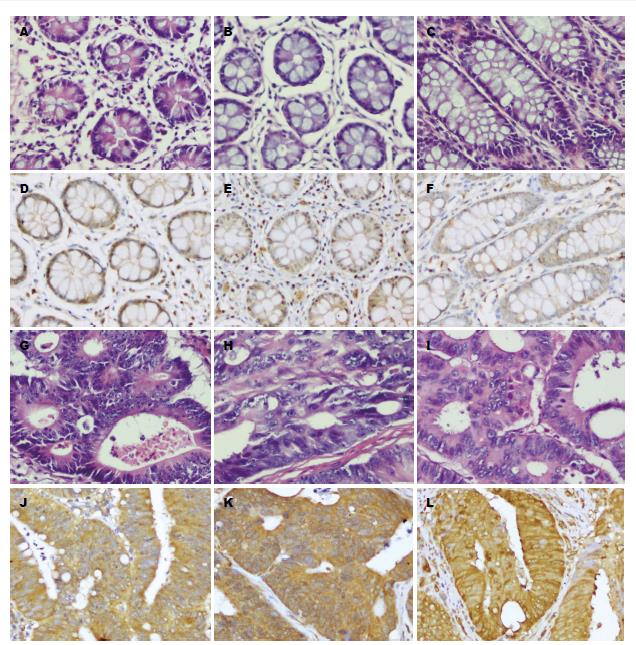
1.2.2 免疫组织化学(SP法): 具体操作步骤按文献[8]进行. 切片二甲苯脱蜡、逐步水化、30%H2O2-甲醇封闭, 枸橼酸(pH 6.0)高压修复10 min, 一抗4 ℃过夜; 次日, 切片恢复室温后, 二抗37 ℃孵育20 min, DAB显色至阳性对照片膜清晰着色, 苏木素衬染1 min. 免疫组织化学结果判定方法参考文献[6], 以癌细胞膜浆着色比例及着色深浅作为判读依据: 没有膜浆着色计0分;<10%的细胞膜浆着色计1分, 微弱着色计1分(4倍镜下不可见着色);≥10%,<50%的肿瘤细胞膜浆着色计2分, 中等强度着色计2分(4倍镜下可见明确的膜浆着色);≥50%肿瘤细胞膜浆着色计3分, 膜浆强着色, 呈棕黄色, 肉眼可见计3分. 为便于统计, 将得分为4分及4分以下的归为低表达组, 高于4分的归为高表达组.
1.2.3 慢病毒包装: 接种293T细胞于6孔板中, 培养至80%融合度, 细胞处于对数生长期. 按吉凯基因慢病毒包装试剂说明书进行包装. 在1.5 mL灭菌EP管内加入1.5 μg包装混合质粒、0.5 μg目标质粒及250 μL的无血清Opti-MEM, 轻柔混匀. 另一支1.5 mL灭菌EP管中, 取9 μL脂质体2000溶于250 μL无血清Opti-MEM培养基中, 轻柔混匀. 室温放置5 min后, 将DNA溶液和脂质体溶液轻柔混匀, 室温孵育20 min. 在六孔板中每孔加入1 mL含血清的生长培养基, 再加入DNA-脂质体复合物. 37 ℃ CO2孵箱中孵育48-72 h收获含病毒的上清. 过滤去除沉淀, -80 ℃贮存待用.
1.2.4 转染人结肠癌细胞: 在37 ℃、50 mL/L CO2饱和湿度培养箱中培养结肠癌HT-29细胞, 培养基为含10%小牛血清的DMEM. 实验分为3组: 空白组(未转染的细胞)、绿色荧光蛋白(green fluorescent protein, GFP)控制组(阴性转染控制组)、shRNA-YWHAE干扰组. 将细胞种于6孔板, 在细胞对数生长期30%满度时进行转染, 具体转染步骤按吉凯基因提供的说明书进行. 在1 mL无血清及抗生素的培养基中加入2×106 TU目标病毒、5 ng Polybrene, 分别转染入干扰组及控制组细胞, 2-3 d后在倒置荧光显微镜下观察细胞转染效率. 在感染效率超过90%, 细胞生长80%满度, 且细胞处于对数生长期时, 大约4 d后, 收集细胞, 进行下一步干扰抑制效率及功能试验检测.
1.2.5 RT-PCR检测: 利用Primer6.0软件设计YWHAE及GAPDH基因mRNA引物, YWHAE引物序列: 上游引物: 5'-TGTGTCGTCTCCGTGCCAGAT-3', 下游引物: 5'-AAGAGGTTGAGCGAGCGAAGGA-3'; 管家基因GAPDH上游引物: 5'-GCCAAAAGGGTCATCATCTC-3', 下游引物: 5'-GTAGAGGCAGGGATGATGTTC-3'. RT-PCR及图像分析参考应用文献[7]进行. 简而言之, 收集各组细胞, 提取总RNA, 总RNA提取参照TRIzol试剂盒说明书进行; 琼脂糖凝胶电泳及分光光度计检测RNA纯度及浓度; 稀释成同一浓度后进行逆转录及PCR, 25 μL PCR反应体系包括: 上下游引物各1 μL(20 μmo1), 2×Mix 12.5 μL(包括反应缓冲液、dNTP、MgCl2、Taq酶), 双蒸水9.5 μL, cDNA标本1 μL. 反应条件: 95 ℃预变性2 min, 94 ℃ 30 s, 56 ℃退火30 s, 72 ℃延伸45 s, 25次循环. 同时设置阴、阳性对照, 每个样本进行3次重复. 将所扩增的PCR产物进行琼脂糖凝胶电泳、凝胶电泳成像仪成像并拍摄. 应用天根5500凝胶成像处理软件进行图像分析.
1.2.6 Western blot检测: 转染后, 收集裂解各组细胞并对其定量, 电泳分离, 转膜, 固定蛋白于PVDF膜上, 漂洗, 5%脱脂奶粉常温封闭2 h, 加入YWHAE(1:1000)、GAPDH兔抗人一抗(1:1000)4 ℃孵育过夜, 洗涤3遍, 加入羊抗兔二抗(1:4000)常温孵育1.5 h, 洗涤3遍, ECL底物显色, 分析其光密度(GAPDH为内参).
1.2.7 四甲基偶氮唑盐微量酶反应比色法检测: 将转染后各组结肠癌消化、吹打, 调整细胞悬液浓度2×103/mL, 置37 ℃, 50 mL/L CO2恒温箱中孵育, 分别于贴壁后0、24、48、72、96 h每孔加入200 μL四甲基偶氮唑盐微量酶反应比色法(methyl-thiazolyl-tetrazolium, MTT)溶液(5 mg/mL), 继续培养4 h, 离心, 小心吸掉上清液, 每孔加入100 μL二甲基亚砜, 置摇床上低速振荡15 min, 使结晶物充分溶解. 在酶联免疫检测仪OD570处测量各孔的吸光值. 以时间为横坐标, OD值为纵坐标, 绘制生长曲线.
1.2.8 细胞克隆实验: 将转染后结肠癌细胞按每组500个细胞种植于6孔板中, 每组3复孔, 置37 ℃, 50 mL/L CO2恒温箱中孵育, 每隔3 d换液1次; 培养至控制组大多数克隆细胞数>50时终止培养, PBS洗涤2次、多聚甲醛固定、GIEMSA染色、拍照、计克隆数.
1.2.9 细胞周期及凋亡检测: 将转染后各组结肠癌消化、吹打、PBS清洗2遍, 去上清, 预备细胞周期检测的细胞重悬于700 mL/L乙醇中, 4 ℃过夜, PI染色; 预备细胞凋亡的细胞1×binding buffer洗涤细胞沉淀1次, 1×staining buffer重悬细胞沉淀, 采用Annexin V-APC染色; FACSCalibur流式细胞仪检测细胞周期及凋亡.
统计学处理 应用SPSS18.0软件进行统计学分析, 免疫组织化学结果与临床病理参数间的比较采用四格表χ2检验或Fisher确切概率计算; 转染前后细胞功能学实验及基因表达变化等各因素相关关系, 采用Spearman等级相关及配对t检测等分析. 所有统计学分析均采用双侧检测, P<0.05差异有统计学意义.
YWHAE在结肠癌及癌旁黏膜组织中核、浆、膜均有着色. 免疫组织化学染色显示YWHAE在大部分癌旁结肠黏膜正常腺体中仅核内表达, 胞浆表达缺失或局灶阳性表达, 结肠癌组织YWHAE胞浆阳性表达(81/87), 表达率及表达强度明显高于配对结肠黏膜组织(14/87, P<0.01); 转移组中YWHAE表达高于未转移组(P = 0.037), 三、四期的病例中YWHAE的表达要高于一、二期(P = 0.037). YWHAE的表达与年龄、性别、分化、部位等没有明显的关系(图1).
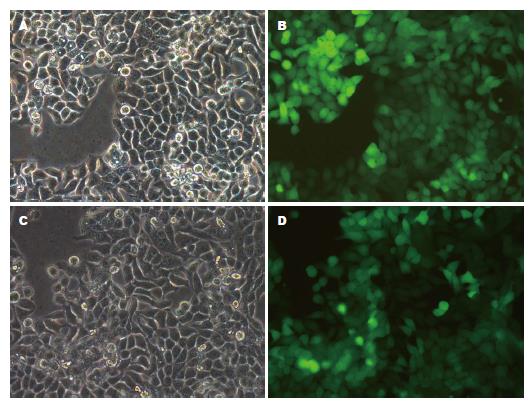
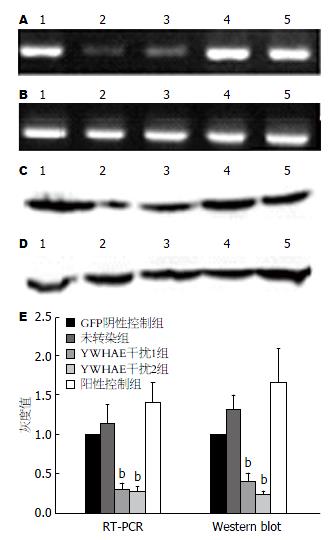
YWHAE干扰质粒及GFP阴性控制质粒慢病毒包装转染结肠癌HT-29细胞3 d后, 倒置荧光显微镜镜下观察, 显示GFP阴性控制组及YWHAE干扰组细胞表面出现绿色荧光表达, 10个高倍视野下仅个别细胞未有表达, 感染效率在98%以上. RT-PCR及Western blot结果显示2个LV-shRNA-YWHAE干扰组均具有明显抑制YWHAE基因表达的效应, 组1、2干扰效率分别为69.8%、71.6%(P<0.01)(图2, 图3). 因而, 本研究选择LV-shYWHAE组2进行下一步实验.
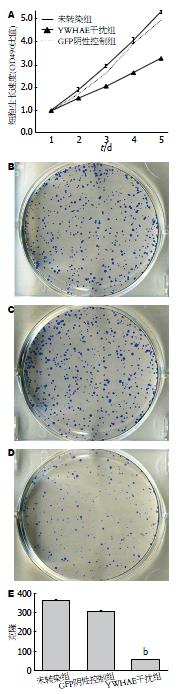
LV-shRNA-YWHAE验证具有显著抑制效率后, 应用MTT检测转染前后HT-29细胞生长变化, 结果显示YWHAE表达沉默组细胞生长速度明显低于对照组, 24 h抑制效率为32%(t = 3.816, P = 0.032). 细胞克隆形成实验同样显示, YWHAE表达抑制后, 细胞克隆形成率明显降低, 干扰组是GFP阴性控制组克隆形成率的20%(t = 15.578, P = 0.004). 表明YWHAE高表达对结肠癌细胞的增殖具有促进作用, 沉默YWHAE的表达能降低细胞的生长速度及肿瘤克隆形成(图4).
YWHAE基因表达沉默后, 流式细胞术检测显示, 干扰组细胞凋亡率为10.73%, 明显高于GFP阴性控制组5.54%(t = 44.01, P = 0.01); 干扰组细胞周期G1占71.21%, 高于对照组61.91%(t = 29.02, P = 0.01), 相比控制组, 干扰组细胞处于S期细胞数目减少(表2).
| 分组 | G1 | S | G2/M | AP |
| 未转染控制组 | 60.06±0.60 | 35.65±0.66 | 4.29±0.13 | 5.54±0.32 |
| GFP转染控制组 | 61.91±0.62 | 28.46±0.72 | 9.63±0.40 | 5,27±0.41 |
| YWHAE干扰组 | 72.14±0.44 | 20.68±0.42 | 7.18±0.16 | 10.73±1.25 |
14-3-3蛋白调控家族普遍存在于真核生物中, 参与了生命活动过程中大部分的生理反应. 14-3-3蛋白是由7个亚基组成丝氨酸及苏氨酸结合蛋白. 这些蛋白能结合多种活性物质, 包括受体, 组蛋白去乙酰化酶(HDAC), 激酶和磷酸酶等, 参与多种细胞信号转导通路包括细胞周期调控, 细胞凋亡, 代谢调控及磷酸化依赖方式蛋白质转运过程等[3,4,9-11], 通过Ras-Raf信号及蛋白激酶(protein kinase)/哺乳动物雷帕霉素靶向蛋白(mammalian target of rapamycin)等多条通路参与肿瘤的发生, 在肿瘤的形成及发展过程中扮演着复杂而重要的角色[3,4,9-13].
14-3-3蛋白在结直肠癌组织中也存在广泛的高表达, 通过调节细胞周期、抑制细胞凋亡等促进肿瘤细胞的生长, 裂解14-3-3蛋白能抑制肿瘤细胞的生长[14-18]. YWHAE是14-3-3蛋白家族中的重要成员之一, 在包括胃癌[19]、肾癌[5]、肝癌[6]、食管癌[20]等在内的多种肿瘤中高表达, 促进癌细胞增殖、迁移和抑制凋亡.
Liang等[5]研究发现YWHAE在肾癌组织中表达上调, 是正常对照肾组织的1.44倍, 体外实验验证YWHAE可促进肾癌细胞的过度增殖. Ko等[6]对114例肝癌患者研究发现, YWHAE在正常肝组织中低表达或不表达, 而肝癌组织中高表达, YWHAE的高表达与肿瘤的迁移有关; 进一步的研究显示高表达的YWHAE与肝癌的侵袭转移相关, 预后不良. 张玉洁等[20]研究了食管鳞癌组织中14-3-3的表达意义, 发现14-3-3在食管癌中表达上调, 且其表达水平与淋巴结转移和预后不良呈正相关. Wang等[16]研究发现, 在结直肠癌组织中, YWHAE发生核表达的丢失或下降, 而胞浆表达提高, 与结直肠癌的预后不良有关. 我们前期研究[7]发现抑癌剂DADS处理结肠癌细胞HT-29后, YWHAE基因mRNA转录水平下调, 本次进一步的实验结果显示YWHAE在结肠癌组织中高表达, 是癌旁配对组织的1.68倍, 与肿瘤的淋巴结转移、分期明显相关, 可能是肿瘤预后不良的危险因素之一.
YWHAE在肿瘤组织中发挥多种生物学效应, 通过控制细胞的凋亡、复制、分化等, 调节肿瘤的生长、浸润、转移[21-27]. Gong等[21]研究发现, 沉默YWHAE的表达能影响胃癌细胞分化, 降低细胞周期蛋白E和p27kip1蛋白的活性, 从而诱导细胞周期捕获, 起到抗肿瘤增生的作用. 研究[22-23]发现, YWHAE在肝癌组织中高表达, 与肝癌预后不良有关, 高表达YWHAE能降低钙黏蛋白的表达, 增加波形蛋白表达, 诱导肝癌细胞上皮间质转化, 促进肝癌细胞转移. 但也有研究[25]显示在喉癌组织中YWHAE水平的降低可能与肿瘤的进展有关, 细胞学实验显示消减YWHAE的表达, 降低了肿瘤细胞的凋亡率, 而增加YWHAE的表达则增加了细胞凋亡及导致细胞周期阻滞; 在肝癌[26]、卵巢癌[27]等组织中, 化疗后YWHAE的表达增加, 激活TAK1(MAP3K7)信号, 导致细胞损伤, 诱导凋亡. YWHAE在肿瘤组织中角色扮演的异同, 可能与个体的差异、实验方法的不用有关, 进一步的研究有助于揭示YWHAE的作用机制.
有限的报道[18,28-30]显示, YWHAE在结直肠癌细胞中高表达, 通过抑制YWHAE的表达或裂解YWHAE蛋白可促进癌细胞的凋亡、抑制结肠癌细胞的增生, 其机制可能与下调过氧化物酶体增生物激活受体, 从而活化Bax和Bad相关. Liou等[31]发现在HT-29细胞中稳定表达YWHAE可抑制细胞凋亡, 并发现了非留体类抗炎药可通过PPARδ/YWHAE途径诱导大肠癌细胞凋亡的新机制. Liou等[32]发现减少细胞内线粒体、增加细胞凋亡与YWHAE的抑制关系密切. Liffers等[33]发现Smad4与YWHAE相互作用, 导致细胞质中YWHAE被隔离, 从而影响YWHAE的信号转导、周期调控以及凋亡等功能. 本研究发现抑制HT-29细胞YWHAE表达后, HT-29细胞生长速度明显降低, 细胞克隆形成数明显减少, 同时细胞周期阻滞在G1期, 细胞凋亡显著增加, 与文献[31,33]报道一致.
总之, 本研究表明, YWHAE在结肠癌组织存在高表达, 与结肠癌的发展、转移相关. 沉默结肠癌YWHAE的表达可抑制癌细胞的生长, 可能与诱导细胞周期阻滞及细胞凋亡相关.
结肠癌是我国常见的恶性肿瘤之一, 侵袭、转移、复发是患者常见的死亡原因. YWHAE基因被发现在多种肿瘤中高表达, 与肿瘤转移、复发相关, 其在肿瘤组织中高表达被认为是患者预后不良的指标之一.
林洁, 副教授, 南方医科大学基础医学院病理学系; 周建奖, 教授, 贵阳医学院分子生物学重点实验室
YWHAE在结直肠癌细胞中高表达, 通过抑制YWHAE的表达或裂解YWHAE蛋白可促进癌细胞的凋亡、抑制癌细胞的增生, 其机制可能与下调过氧化物酶体增生物激活受体, 从而活化Bax和Bad相关. 但YWHAE在结肠癌组织中的表达情况尚不清楚, 是否与肿瘤的转移复发, YWHAE促肿瘤增生、抑制肿瘤凋亡的分子机制等亟待进一步研究.
在结直肠癌组织中, YWHAE发生核表达的丢失或下降, 而胞浆表达的提高, 与结直肠的预后不良有关. Smad4与YWHAE相互作用, 导致细胞质中YWHAE被隔离, 从而影响YWHAE的信号转导、周期调控以及凋亡等功能.
前期报道结肠癌组织中存在YWHAE的表达增高, 与结肠癌预后不良有关; YWHAE表达增高可抑制结肠癌细胞凋亡; 药物抑制结肠癌细胞增生, 发现有YWHAE的表达改变; YWHAE沉默诱导结肠癌细胞周期阻滞及凋亡涉及多种信号通路. 本文系统地从组织学、细胞学两方面探讨结肠癌转移、增殖与YWHAE表达的关系, 初步探讨其内在联系.
14-3-3蛋白家族具有重要的生物学功能, YWHAE是其一个重要的成员, 在多种肿瘤中高表达, 与肿瘤的转移复发相关, 在结肠癌组织中的高表达与结肠癌转移相关, 抑制YWHAE的表达促进了肿瘤细胞的凋亡, 捕获细胞周期阻滞, 抑制了肿瘤细胞增殖及克隆形成, 为阐明YWHAE的促肿瘤发展的分子机制奠定了基础.
RNA干扰: 是指在进化过程中高度保守的、由双链RNA诱发的、同源mRNA高效特异性降解的现象. 他是生物进化过程中遗留下来的一种在转录后通过RNA调控基因表达的机制.
该文通过检测结肠癌组织中YWHAE基因的表达, 分析此基因表达与结肠癌临床病理参数的关系, 并用RNA干扰技术沉默结肠癌细胞中YWHAE基因, 探讨此基因在结肠癌发生发展中的作用. 该文研究内容文献报道较少, 有一定的创新性和实用价值.
编辑: 于明茜 电编:都珍珍
| 2. | Siegel R, Desantis C, Jemal A. Colorectal cancer statistics, 2014. CA Cancer J Clin. 2014;64:104-117. [PubMed] [DOI] |
| 3. | Gardino AK, Yaffe MB. 14-3-3 proteins as signaling integration points for cell cycle control and apoptosis. Semin Cell Dev Biol. 2011;22:688-695. [PubMed] [DOI] |
| 4. | Mori M, Vignaroli G, Botta M. Small molecules modulation of 14-3-3 protein-protein interactions. Drug Discov Today Technol. 2013;10:e541-e547. [PubMed] [DOI] |
| 5. | Liang S, Xu Y, Shen G, Liu Q, Zhao X, Xu Z, Xie X, Gong F, Li R, Wei Y. Quantitative protein expression profiling of 14-3-3 isoforms in human renal carcinoma shows 14-3-3 epsilon is involved in limitedly increasing renal cell proliferation. Electrophoresis. 2009;30:4152-4162. [PubMed] [DOI] |
| 6. | Ko BS, Chang TC, Hsu C, Chen YC, Shen TL, Chen SC, Wang J, Wu KK, Jan YJ, Liou JY. Overexpression of 14-3-3ε predicts tumour metastasis and poor survival in hepatocellular carcinoma. Histopathology. 2011;58:705-711. [PubMed] [DOI] |
| 7. | Huang YS, Xie N, Su Q, Su J, Huang C, Liao QJ. Diallyl disulfide inhibits the proliferation of HT-29 human colon cancer cells by inducing differentially expressed genes. Mol Med Rep. 2011;4:553-559. [PubMed] [DOI] |
| 8. | Wu YB, Huang YS, Xu YP, Sun YF, Yu DL, Zhang XQ, Long X, Zhu SQ, Zhou JL, Xu JJ. A high level of TM4SF5 is associated with human esophageal cancer progression and poor patient survival. Dig Dis Sci. 2013;58:2623-2633. [PubMed] [DOI] |
| 9. | Aitken A. Post-translational modification of 14-3-3 isoforms and regulation of cellular function. Semin Cell Dev Biol. 2011;22:673-680. [PubMed] [DOI] |
| 10. | Yang X, Lee WH, Sobott F, Papagrigoriou E, Robinson CV, Grossmann JG, Sundström M, Doyle DA, Elkins JM. Structural basis for protein-protein interactions in the 14-3-3 protein family. Proc Natl Acad Sci U S A. 2006;103:17237-17242. [PubMed] [DOI] |
| 11. | Tzivion G, Gupta VS, Kaplun L, Balan V. 14-3-3 proteins as potential oncogenes. Semin Cancer Biol. 2006;16:203-213. [PubMed] [DOI] |
| 12. | Morrison DK. The 14-3-3 proteins: integrators of diverse signaling cues that impact cell fate and cancer development. Trends Cell Biol. 2009;19:16-23. [PubMed] [DOI] |
| 13. | Inoue T, Goi T, Hirono Y, Katayama K, Yamaguchi A. RIN1-Ras-ERK pathway plays an important role in carcinogenesis in colon cancer cell line LoVo. Oncol Res. 2011;19:527-534. [PubMed] [DOI] |
| 14. | O'Dwyer D, Ralton LD, O'Shea A, Murray GI. The proteomics of colorectal cancer: identification of a protein signature associated with prognosis. PLoS One. 2011;6:e27718. [PubMed] [DOI] |
| 15. | Pei HP, Ge H, Jiang R, Zhu H. [Expression and clinical significance of 14-3-3 sigma and heat shock protein 27 in colorectal cancer]. Zhonghua Weichang Waike Zazhi. 2010;13:213-215. [PubMed] |
| 16. | Wang H, Huang H, Li W, Jin X, Zeng J, Liu Y, Gu Y, Sun X, Wen G, Ding Y. Nuclear localization of 14-3-3epsilon inversely correlates with poor long-term survival of patients with colorectal cancer. J Surg Oncol. 2012;106:224-231. [PubMed] [DOI] |
| 17. | Zou J, Mi L, Yu XF, Dong J. Interaction of 14-3-3σ with KCMF1 suppresses the proliferation and colony formation of human colon cancer stem cells. World J Gastroenterol. 2013;19:3770-3780. [PubMed] [DOI] |
| 18. | Liu Y, Song F, Wu WK, He M, Zhao L, Sun X, Li H, Jiang Y, Yang Y, Peng K. Triptolide inhibits colon cancer cell proliferation and induces cleavage and translocation of 14-3-3 epsilon. Cell Biochem Funct. 2012;30:271-278. [PubMed] [DOI] |
| 19. | Leal MF, Calcagno DQ, Demachki S, Assumpção PP, Chammas R, Burbano RR, Smith Mde A. Clinical implication of 14-3-3 epsilon expression in gastric cancer. World J Gastroenterol. 2012;18:1531-1537. [PubMed] [DOI] |
| 20. | 张 玉洁, 杜 强, 朱 丽娟, 张 艳, 李 晓梅, 蒲 红伟, 陈 晓. 食管鳞状细胞癌组织中S100A11、14-3-3的表达及临床意义. 世界华人消化杂志. 2014;22:4609-4614. [DOI] |
| 21. | Gong X, Yan L, Gu H, Mu Y, Tong G, Zhang G. 14-3-3ε functions as an oncogene in SGC7901 gastric cancer cells through involvement of cyclin E and p27kip1. Mol Med Rep. 2014;10:3145-3150. [PubMed] [DOI] |
| 22. | Wu YJ, Jan YJ, Ko BS, Liang SM, Liou JY. Involvement of 14-3-3 Proteins in Regulating Tumor Progression of Hepatocellular Carcinoma. Cancers (Basel). 2015;7:1022-1036. [PubMed] [DOI] |
| 23. | Liu TA, Jan YJ, Ko BS, Liang SM, Chen SC, Wang J, Hsu C, Wu YM, Liou JY. 14-3-3ε overexpression contributes to epithelial-mesenchymal transition of hepatocellular carcinoma. PLoS One. 2013;8:e57968. [PubMed] [DOI] |
| 24. | Oh D, Choi MR, Han DM, Chai YG, Choi J. Fluoxetine-induced regulation of heat shock protein 90 and 14-3-3ε in human embryonic carcinoma cells. Neuroreport. 2014;25:1399-1404. [PubMed] [DOI] |
| 25. | Che XH, Chen H, Xu ZM, Shang C, Sun KL, Fu WN. 14-3-3epsilon contributes to tumour suppression in laryngeal carcinoma by affecting apoptosis and invasion. BMC Cancer. 2010;10:306. [PubMed] [DOI] |
| 26. | Tang S, Bao H, Zhang Y, Yao J, Yang P, Chen X. 14-3-3ε mediates the cell fate decision-making pathways in response of hepatocellular carcinoma to Bleomycin-induced DNA damage. PLoS One. 2013;8:e55268. [PubMed] [DOI] |
| 27. | Kim KO, Hsu AC, Lee HG, Patel N, Chandhanayingyong C, Hickernell T, Lee FY. Proteomic identification of 14-3-3ε as a linker protein between pERK1/2 inhibition and BIM upregulation in human osteosarcoma cells. J Orthop Res. 2014;32:848-854. [PubMed] [DOI] |
| 28. | Wu KK, Liou JY. Cyclooxygenase inhibitors induce colon cancer cell apoptosis Via PPARdelta --& gt; 14-3-3epsilon pathway. Methods Mol Biol. 2009;512:295-307. [PubMed] [DOI] |
| 29. | Zuo S, Xue Y, Tang S, Yao J, Du R, Yang P, Chen X. 14-3-3 epsilon dynamically interacts with key components of mitogen-activated protein kinase signal module for selective modulation of the TNF-alpha-induced time course-dependent NF-kappaB activity. J Proteome Res. 2010;9:3465-3478. [PubMed] [DOI] |
| 30. | Rishi AK, Parikh R, Wali A, Durko L, Zhang L, Yu Y, Majumdar AP. EGF receptor-related protein (ERRP) inhibits invasion of colon cancer cells and tubule formation by endothelial cells in vitro. Anticancer Res. 2006;26:1029-1037. [PubMed] |
| 31. | Liou JY, Ghelani D, Yeh S, Wu KK. Nonsteroidal anti-inflammatory drugs induce colorectal cancer cell apoptosis by suppressing 14-3-3epsilon. Cancer Res. 2007;67:3185-3191. [PubMed] |
| 32. | Liou JY, Lee S, Ghelani D, Matijevic-Aleksic N, Wu KK. Protection of endothelial survival by peroxisome proliferator-activated receptor-delta mediated 14-3-3 upregulation. Arterioscler Thromb Vasc Biol. 2006;26:1481-1487. [PubMed] [DOI] |
| 33. | Liffers ST, Maghnouj A, Munding JB, Jackstadt R, Herbrand U, Schulenborg T, Marcus K, Klein-Scory S, Schmiegel W, Schwarte-Waldhoff I. Keratin 23, a novel DPC4/Smad4 target gene which binds 14-3-3ε. BMC Cancer. 2011;11:137. [PubMed] [DOI] |