修回日期: 2015-09-06
接受日期: 2015-09-11
在线出版日期: 2015-10-08
食管颗粒细胞瘤发病罕见, 本文通过对1例典型病例诊疗情况描述以及对国内相关文献检索和回顾, 进一步对此病的临床症状、镜下表现、诊断方法、发病机制、治疗、预后情况进行整理、总结和探讨. 超声内镜的应用有助于提高此疾病的诊断率, 病理是确诊该疾病的金标准. 一般认为直径<2 cm且未侵及肌层者可以采用内镜黏膜切除术(endoscopic mucosal resection), 考虑到少数复发和潜在恶性可能, 透明帽辅助内镜黏膜下剥离术(endoscopic submucosal dissection)具有更高的安全性.
核心提示: 食管颗粒细胞瘤发病罕见, 本文通过对一典型病例诊疗情况描述以及对国内相关文献检索和回顾, 进一步对此病的临床症状、镜下表现、诊断方法、发病机制、治疗、预后情况进行整理、总结和探讨, 以利于临床诊疗.
引文著录: 王龙, 曹杰, 代海萍, 辛毅. 食管颗粒细胞瘤ESD切除1例并国内文献回顾. 世界华人消化杂志 2015; 23(28): 4602-4605
Revised: September 6, 2015
Accepted: September 11, 2015
Published online: October 8, 2015
Esophageal granular cell tumor is a rare disease. Here we report a typical case of esophageal granular cell tumor and review the relevant literature with regards to clinical symptoms, endoscopic manifestations, diagnostic method, nosogenesis, treatment and prognosis. The application of endoscopic ultrasonography is helpful to improve the diagnosis of the disease, and pathology is the gold standard for the diagnosis of the disease. Generally, when tumor diameter is less than 2 cm and there is no muscular layer invasion, endoscopic mucosal resection (EMR) can be used. Considering a low potential of recurrence and malignancy, transparent cap assisted endoscopic submucosal dissection (ESD) has a higher safety.
- Citation: Wang L, Cao J, Dai HP, Xin Y. Endoscopic submucosal dissection excision for esophageal granular cell tumor: A case report and literature review. Shijie Huaren Xiaohua Zazhi 2015; 23(28): 4602-4605
- URL: https://www.wjgnet.com/1009-3079/full/v23/i28/4602.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i28.4602
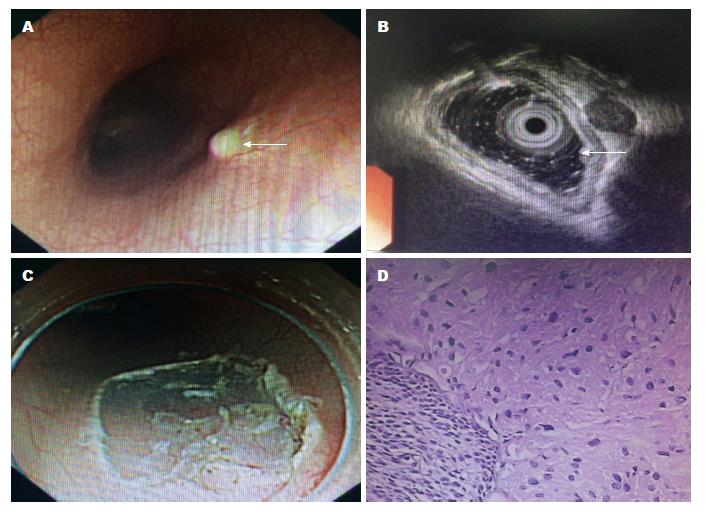
颗粒细胞瘤(granular cell tumor, GCT)一般认为是施万(Schwann)细胞或外周神经来源的新生物, 曾被称为颗粒性肌母细胞瘤(granular cell myoblastoma), 1926年由Abrikossoff在舌部发现并首次报道, 并在1931年又首次报道食管颗粒细胞瘤. 近年来通过免疫组织化学和电镜研究, 证明颗粒细胞瘤来源于神经鞘的施万细胞, 因其细胞质充满分布均匀的嗜酸性颗粒而命名. 免疫组织化学显示细胞质和细胞核外周神经标记S-100蛋白和糖分解烯醇酶(2-phospho-D-glycerate hydrolase, NSE)均阳性, 而肌源性、组织细胞源性及上皮源性等免疫组织化学标记阴性. 食管颗粒细胞瘤发病罕见, 临床上均为散发、个案病例报道. 本文报告1例患者, 男性, 29岁, 因反复上腹不适入院, 内镜检查提示距门齿35 cm处5-6点位见一淡黄色黏膜下隆起, 大小约0.7 cm×0.4 cm, 活检病理提示食管颗粒细胞瘤, 使用透明帽法内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)切除肿物, 并对国内食管颗粒细胞瘤病例报道情况进行检索和回顾.
患者, 男, 29岁, 工人. 系因"反复纳差伴上腹不适5年余, 加重1 wk", 于2015-06-03就诊于安徽省宿州市立医院消化内科, 上腹不适呈阵发性, 并有反复进食不适及胸骨后不适感, 伴有明显焦虑. 2015-06-03电子胃镜示距门齿35 cm处5-6点位见一淡黄色黏膜下隆起, 大小约0.7 cm×0.4 cm, 表面黏膜光滑, 触之不滑动, 活检质硬. 胃镜病理示(食管)颗粒细胞瘤, 免疫组织化学标记S100(3+), CD68(3+), Calretinin(-), SMA(-), Ki-67(-), α-抑制素(+). 大便常规、尿常规未见明显异常, 血常规示白细胞: 11.49×109/L, 中性粒细胞百分比: 76.61%, 肝肾功能、血糖、电解质、肿瘤标志物未见明显异常, 心电图、胸片、肝胆胰脾彩超未见明显异常. 14C呼气试验+, 2015-06-08超声内镜示食管黏膜下隆起(图1). 患者于2015-06-09行内镜下食管颗粒细胞瘤透明帽法ESD术, 以DU刀环周标记后, 予以亚甲蓝+肾上腺素+生理盐水黏膜下注射后, DU刀环周切开, 再次黏膜下注射, DU刀完整剥离病灶, 处理创面裸露血管, 切除组织再次送检, 术后抑制胃酸、补液对症治疗, 未见明显并发症, 治愈出院, 并嘱定期复查电子胃镜及随访.
1926年至1975年, 世界报道食管颗粒细胞瘤13例, 国内1990年前仅报道2例[1], 截至2011年我国发现不足20例, 多为个案病例报道, 近年来由于内镜的广泛应用及病理检查的普及, 发现数量稍有增加, 但对于该疾病的症状、发病机制、良恶性鉴别以及治疗方法尚未形成统一共识. 我们通过对中国知网、万方数据库等进行检索和收集描述较为详细的国内病例报告, 剔除部分模糊数据, 综合相关报道并对数据进行整理后发现: 男性患者多见, 女性约占26.3%, 平均确诊时年龄44.2岁; 症状多为上腹不适、反酸、嗳气等非特异性症状, 瘤体大于1 cm多有进食梗咽、进食不适感, 瘤体小时症状不典型; 病程为数天到数年不等, 多数为1 mo左右; 个别无特殊症状为体检查出; 有3例报告中患者检出合并幽门螺旋杆菌感染, 1例报告中患者有明确的长期、大量饮酒吸烟史; 食管颗粒细胞瘤发病部位平均距门齿30.2 mm, 大小平均0.91 cm; 处置措施包括3例活检后随访观察、7例外科手术、4例ESD切除, 其余多为套扎、电凝电切、内镜黏膜切除术(endoscopic mucosal resection, EMR)等治疗, 无术后复发报道; 国内报告均为良性. 2013年, 江晨等[2]报道1例胃颗粒细胞瘤合并食管鳞状细胞癌和神经鞘瘤, 2008年Saito等[3]报道了食管颗粒细胞瘤合并鳞状细胞癌3例, 但是否同源性以及相关联尚不十分明确.
据报道颗粒细胞瘤发生于消化系者仅占8%-10%, 发生于食管的颗粒细胞瘤占2%, 且多位于食管中下段[4]. 食管颗粒细胞瘤一般较小, 且生长缓慢, 内镜下多呈黄色、灰白色结节状或无蒂的息肉状, 与食管常发的黏膜下平滑肌瘤和间质瘤无法鉴别, 临床常统称为食管隆起性病变. 超声内镜检查对于诊断有一定帮助, 一般表现为低回声实质肿块, 起源于黏膜内层(即黏膜深层和黏膜下层); 有研究表明食管骨巨细胞瘤(giant cell tumour, GCT)和食管平滑肌瘤病灶的超声内镜图像灰度平均值均数分别为67.51和51.76, 通过比较超声内镜图像的灰度平均值可提高诊断率[5]. 病理是确诊该疾病的金标准, 但因为瘤体位于黏膜下, 建议深挖活检或行内镜下细针穿刺吸引细胞学检查确诊食管GCT[6]. 瘤体一般为实性、无包膜、质韧, 切面呈淡黄色或灰黄色. 镜下见瘤细胞胞质丰富, 内含多量嗜双色或嗜酸性颗粒状物质, 紧密排列呈巢团状或片状、条索状, 瘤体大呈多边形, 其间由纤维组织分隔. 细胞核小而一致, 圆形, 居中; 染色质呈固缩状或空泡状, 无异型性, 也无核分裂象; 坏死罕见或缺乏. 免疫组织化学颗粒细胞瘤表达一些神经特异性标记和组织细胞标志物, 如S-100、NSE、髓磷脂蛋白(myelin basic protein, MBP)、CD68(KP-1)和CD57(Leu-7)等. 在病理组织学上良性颗粒细胞瘤和恶性颗粒细胞瘤(malignant granular cell tumor, MGCT)存在一定重叠, MGCT很少见, 于1945年Ravich首次报道[7], 约占1%-2%. Fanburg-Smith等[8]提出MGCT的形态学诊断标准为: 肿瘤性坏死, 细胞形态为梭形细胞, 空泡状核及核仁增大明显, 核分裂象多(>2个/10HPF, 200倍), 高核质比和细胞多形性, 满足≥3个的形态诊断为MGCT, 满足1个或2个上述形态诊断为不典型性颗粒细胞瘤. 国内王坚等[9]建议将MGCT的核分裂计数标准修订为>5个/50HPF. Gamboa[10]曾将MGCT分为Gamboa Ⅰ型(临床恶性而组织学良性)和Gamboa Ⅱ型(临床、组织学均为恶性)2组, 但发现2组的预后未见明显差异. 如果肿瘤生长速度快、直径>5 cm、核分裂象>2个/10HPF、有肿瘤组织坏死特别是出现转移时, 提示为恶性颗粒细胞瘤; 鉴别诊断依然主要依靠病理, 主要与黄色瘤、平滑肌瘤、横纹肌瘤、神经鞘瘤、胃肠道间质瘤想鉴别, 但注意并发和共同存在的可能.
一般认为直径<2 cm且未侵及肌层者可以采用EMR进行治疗. 直径≥2 cm ESD显得更为精确和安全, 术后随访8 mo至6年无复发, 效果比较理想. Canbay等[11]观察到即使内镜下将食管颗粒细胞瘤完整摘除, 上述症状仍将继续存在, 但测试各项运动功能指标均正常, 推测可能是因为颗粒细胞瘤源自于神经外胚层, 永久性地干扰了内脏的感觉系统; 考虑到少数复发和潜在恶性可能, 透明帽辅助ESD术具有更高的安全性. 如瘤体过大或考虑恶性, 需进行手术完整切除, 必要时淋巴结清扫.
结合国内外文献回顾和报道, 食管颗粒细胞瘤多为良性, 但也有恶性肿瘤报道[12,13], 参考其他部位MGCT, 如Ordóñez[14]报道的41例MGCT, 虽经广泛切除, 但复发率高达59%, 且预后很差, 超50%发生转移, 肝、肺、骨是最常见的转移部位, 3年生存率仅为30%-50%, 对放化疗均不敏感且存在争议. 对于良性食管颗粒细胞瘤术后亦有5%-10%的复发率[15], 因此早期积极治疗和术后的密切追踪随访很重要. GCT可发生于任何部位和年龄段, 一般认为女性多于男性, 但食管颗粒细胞瘤男性明显多于女性, 是否与抽烟、饮酒、幽门螺旋杆菌感染、精神压力、饮食习惯等因素有关, 有待于进一步验证.
随着内镜检查的广泛应用, 食管颗粒细胞瘤的发现越来越多, 但良恶性的鉴别和治疗方案仍存在争议, 治疗方式选择也受医疗条件和病变特点的限制, 但早期诊断并积极治疗, 术后长时间的密切随访仍显得重要, 诊疗方面进一步达成共识仍需要更多的病历报道、追踪随访及探索.
颗粒细胞瘤于1926年由Abrikossoff在舌部发现并首次报道, 并在1931年又首次报道食管颗粒细胞瘤. 此病罕见, 我国仅有少量散发病例报道, 缺乏对此疾病的详细描述和统一诊疗标准.
周力, 主任医师, 贵阳医学院附属医院消化内科
分析典型病例和回顾报告文献, 对该疾病的诊疗标准进行整理, 超声内镜的应用有助于提高此疾病的诊断率, 病理是确诊该疾病的金标准. 一般认为直径<2 cm且未侵及肌层者可以采用内镜黏膜切除术(endoscopic mucosal resection, EMR), 考虑到少数复发和潜在恶性可能, 透明帽辅助内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)具有更高的安全性.
1926年至1975年, 世界报道食管颗粒细胞瘤13例, 国内1990年前仅报道2例, 截至2011年我国发现不足20例, 近年来由于内镜的广泛应用, 发现数量稍有增加, 但仍缺乏系统描述和统一诊疗标准.
通过对典型病例描述以及对国内相关文献回顾, 对此病的临床症状、镜下表现、诊断方法、发病机制、治疗、预后情况进行整理、总结, 超声内镜有助于提高诊断率, 病理诊断仍是金标准, 考虑到少数复发和潜在恶性可能, ESD术具有更高的安全性.
通过对少见病的描述和相关病例报告文献进行总结, 整理和探讨此疾病的特点和诊疗标准, 明确超声内镜和ESD术在诊疗过程中的价值, 以利于指导和规范临床诊疗活动.
颗粒细胞瘤: 一般认为是施万(Schwann)细胞或外周神经来源的新生物, 1926年由Abrikossoff在舌部发现并首次报道, 发生于食管更为罕见, 在镜下常被误诊为平滑肌瘤或间质瘤, 临床症状缺乏特异性, 病理诊断为金标准, 有观察随访、电凝电切、套扎、EMR、ESD、手术等多种治疗方式, 缺乏统一标准.
食管颗粒细胞瘤近年报道有所增加, 超声内镜诊断、病理组织化学及内镜治疗的发展使大家对此疾病的认识有一定的提高, 但国内并无大宗报道, 仍需更为充足的临床资料及个案病例报道.
编辑: 于明茜 电编:闫晋利
| 3. | Saito K, Kato H, Fukai Y, Kimura H, Miyazaki T, Kashiwabara K, Nakajima T, Kuwano H. Esophageal granular cell tumor covered by intramucosal squamous cell carcinoma: report of a case. Surg Today. 2008;38:651-655. [PubMed] [DOI] |
| 6. | Prematilleke IV, Piris J, Shah KA. Fine needle aspiration cytology of a granular cell tumour of the oesophagus. Cytopathology. 2004;15:120-121. [PubMed] [DOI] |
| 7. | Ravich A, Stout AP, Ravich RA. Malignant Granular Cell Myoblastoma Involving the Urinary Bladder. Ann Surg. 1945;121:361-372. [PubMed] [DOI] |
| 8. | Fanburg-Smith JC, Meis-Kindblom JM, Fante R, Kindblom LG. Malignant granular cell tumor of soft tissue: diagnostic criteria and clinicopathologic correlation. Am J Surg Pathol. 1998;22:779-794. [PubMed] [DOI] |
| 10. | Gamboa LG. Malignant granular-cell myoblastoma. AMA Arch Pathol. 1955;60:663-668. [PubMed] |
| 11. | Canbay A, Gieseler RK, Hoffmann P, Holtmann G, Rünzi M. Persistently altered visceral perception after resection of an esophageal granular cell myoblastoma: a therapeutic concept revisited. Z Gastroenterol. 2003;41:917-920. [PubMed] [DOI] |
| 12. | Loo CK, Santos LD, Killingsworth MC. Malignant oesophageal granular cell tumour: a case report. Pathology. 2004;36:506-508. [PubMed] [DOI] |
| 13. | Yoshizawa A, Ota H, Sakaguchi N, Kanai S, Nakayama J, Matsuzawa K, Tsuzuki S, Takada R, Miyazawa F, Kasahara H. Malignant granular cell tumor of the esophagus. Virchows Arch. 2004;444:304-306. [PubMed] [DOI] |
| 14. | Ordóñez NG. Granular cell tumor: a review and update. Adv Anat Pathol. 1999;6:186-203. [PubMed] [DOI] |