修回日期: 2015-09-03
接受日期: 2015-09-11
在线出版日期: 2015-10-08
目的: 检测肌动蛋白丝相关蛋白1相似蛋白(actin filament-associated protein 1-like 2, AFAP-1L2)在不同分化程度胰腺癌细胞株中的表达, 并观察其对下游磷脂酰肌醇3激酶/蛋白激酶(phosphatidylinositol 3 kinase/protein kinase B, PI3K/Akt)通路调控作用及对胰腺癌细胞的增殖、周期及凋亡的影响.
方法: 以Western blot及实时定量PCR检测(real-time quantitative PCR, qRT-PCR)法对不同分化程度胰腺癌细胞系PANC-1、MiaPaCa-2、Colo-357、BXPC-3、SW1990及CFPAC-1中AFAP-1L2表达进行检测; 构建靶向AFAP-1L2的干扰质粒siAFAP-1L2, 转染MiaPaCa-2细胞, 以Western blot及qRT-PCR法检测AFAP-1L2下调后PI3K/Akt通路蛋白及mRNA变化; 四甲基偶氮唑盐微量酶反应比色法(methyl-thiazolyl-tetrazolium, MTT)法检测转染后MiaPaCa-2细胞增殖; 流式细胞术检测细胞周期及凋亡.
结果: Western blot及qRT-PCR法显示, AFAP-1L2蛋白及mRNA表达水平在低分化胰腺癌细胞系中表达水平高于中分化及高分化细胞系. siAFAP-1L2转染后磷脂酰肌醇3激酶α亚单位(PI3KCA)蛋白在siAFAP-1L2组的表达量明显低于AFAP-1L2组及小干扰RNA(small interfering RNA, siRNA) control组(F = 9.280, P = 0.0139), α蛋白激酶(α-Akt)在siAFAP-1L2细胞的表达量高于MOCK细胞及siRNA control细胞(F = 7.719, P = 0.0219), 磷酸化α蛋白激酶(α-pAkt)在siAFAP-1L2细胞的表达量低于MOCK细胞及siRNA control细胞(F = 5.507, P = 0.0439). PI3KCAmRNA在siAFAP-1L2组的表达量明显低于AFAP-1L2组及siRNA control组(F = 20.16, P = 0.0022), α-Akt mRNA在siAFAP-1L2细胞的表达量高于MOCK细胞及siRNA control细胞(F = 6.068, P = 0.0362), α-pAkt mRNA在siAFAP-1L2细胞的表达量低于MOCK细胞及siRNA control细胞(F = 10.33, P = 0.0114). MTT检测显示, 在48、72及96 h siAFAP-1L2干扰后MiaPaCa-2细胞增殖能力下降(F = 3.924, P<0.05; F = 6.812, P<0.01; F = 7.003, P<0.01). 流式细胞检测显示, siAFAP-1L2干扰后G1期细胞比例增高, G2及S期比例减少(F = 4.87, F = 5.26, F = 4.94, 均P<0.05), siAFAP-1L2干扰后MiaPaCa-2细胞凋亡率增高(F = 7.231, P<0.01).
结论: 在分化程度低的胰腺癌细胞中AFAP-1L2表达较高, AFAP-1L2通过PI3K/Akt通路影响胰腺癌细胞增殖、细胞周期及凋亡, 可作为胰腺癌治疗新的靶向候选基因.
核心提示: 本研究在分子生物学水平研究不同分化程度胰腺癌细胞系中肌动蛋白丝相关蛋白1相似蛋白(actin filament-associated protein 1-like 2, AFAP-1L2)表达, 并采用小干扰RNA(small interfering RNA, siRNA)干扰AFAP-1L2表达, 检测AFAP-1L2对下游磷脂酰肌醇3激酶/蛋白激酶(phosphatidylinositol 3 kinase/protein kinase)通路的调控作用, 从而影响胰腺癌细胞增殖、细胞周期及凋亡, 探讨其机制.
引文著录: 刘博, 戚诚, 刘学臣, 赵晓东. AFAP-1L2通过PI3K/Akt通路影响胰腺癌细胞增殖及凋亡. 世界华人消化杂志 2015; 23(28): 4490-4498
Revised: September 3, 2015
Accepted: September 11, 2015
Published online: October 8, 2015
AIM: To investigate the expression of actin filament-associated protein 1-like 2 (AFAP-1L2) in different pancreatic cancer cell lines, the effect of AFAP-1L2 on cell proliferation, cell cycle and apoptosis, and the possible mechanism.
METHODS: Western blot and real-time quantitative PCR (qRT-PCR) were used to detect the AFAP-1L2 protein and mRNA expression in PANC-1, MiaPaCa-2, Colo-357, BXPC-3, SW1990 and CFPAC-1 cell lines (having different differentiation degrees). siAFAP-1L2 plasmid was constructed and transfected into MiaPaCa-2 cell to downregulate the expression of AFAP-1L2. Proteins of the phosphatidylinositol 3 kinase/protein kinase B (PI3K/Akt) pathway were detected by Western blot and qRT-PCR after siAFAP-1L2 transfection. Proliferation was detected by MTT assay. Cell cycle and apoptosis were detected by flow cytometry.
RESULTS: Western blot and qRT-PCR analyses showed that AFAP-1L2 was correlated with differentiation degree, and the expression was higher in cell lines with low differentiation than in those with moderate or high differentiation. PI3KCA protein expression in the siAFAP-1L2 group was lower than that in the MOCK and siRNA control groups (F = 20.16, P = 0.0022). α-Akt mRNA expression in the siAFAP-1L2 group was higher than that in the MOCK and siRNA control groups (F = 7.719, P = 0.0219); α-pAkt protein expression in the siAFAP-1L2 group was lower than that in MOCK and siRNA control groups (F = 5.507, P = 0.0439). PI3KCA mRNA expression in the siAFAP-1L2 group was lower than that in the AFAP-1L2 and siRNA control groups (F = 20.16, P = 0.0022). α-Akt mRNA expression in the siAFAP-1L2 group was higher than that in the MOCK and siRNA control groups (F = 6.068, P = 0.0362); α-pAkt mRNA expression in the siAFAP-1L2 group was lower than that in the MOCK and siRNA control groups (F = 10.33, P = 0.0114). MTT assay showed that the proliferation of MiaPaCa-2 cells at 48 h, 72 h, and 96 h was inhibited after siAFAP-1L2 transfection (F = 3.924, P < 0.05; F = 6.812, P < 0.01; F = 7.003, P < 0.01). Flow cytometry showed that cells in G1 phase were increased, but those in G2 and S phases were decreased (F = 4.87, 5.26, 4.94, P < 0.05 for all). The apoptosis rate of MiaPaCa-2 cell was increased after siAFAP-1L2 transfection (F = 7.231, P < 0.01).
CONCLUSION: AFAP-1L2 expression is associated with cell differentiation. AFAP-1L2 modulates cell proliferation, cell cycle and apoptosis via the PI3K/Akt pathway. AFAP-1L2 is a target candidate for pancreatic cancer therapy.
- Citation: Liu B, Qi C, Liu XC, Zhao XD. AFAP-1L2 influences proliferation and apoptosis of pancreatic cancer cells via PI3K/Akt pathway. Shijie Huaren Xiaohua Zazhi 2015; 23(28): 4490-4498
- URL: https://www.wjgnet.com/1009-3079/full/v23/i28/4490.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i28.4490
胰腺癌发病率与病死率在世界范围内呈现明显上升趋势, 作为预后最差的消化系统恶性肿瘤之一, 对胰腺癌发病机制研究深入展开, 对有效的治疗方法寻求也是各研究中心目标[1,2]. 靶基因筛选和治疗靶点选择是研究热点, 也可能成为未来胰腺癌治疗提高生存率的方法[3]. 肌动蛋白丝相关蛋白1相似蛋白(actin filament-associated protein 1-like 2, AFAP-1L2)是一种接头蛋白, 有研究显示其在甲状腺癌、胃癌、肺癌等恶性肿瘤中表达升高, 与这些肿瘤的恶性行为具有相关性[4-6]. 有研究[7]显示, AFAP-1L2在胰腺导管腺癌组织中为高表达并与临床病理指标具有相关性, AFAP-1L2高表达提示胰腺导管腺癌的不良预后, 可以作为评价胰腺癌预后的独立预测因素. 本研究在分子生物学水平进一步研究不同分化程度胰腺癌细胞系中AFAP-1L2表达, 并采用小干扰RNA(small interfering RNA, siRNA)干扰AFAP-1L2表达, 检测AFAP-1L2对下游磷脂酰肌醇3激酶/蛋白激酶(phosphatidylinositol 3 kinase/protein kinase B, PI3K/Akt)通路的调控作用及对, 胰腺癌细胞增殖、细胞周期及凋亡的影响, 并探讨其机制.
人胰腺癌细胞系PANC-1、MiaPaCa-2、Colo-357、BXPC-3、SW1990及CFPAC-1均购自中科院上海细胞库, 采用1640培养基条件下的贴壁细胞培养法. AFAP-1L2山羊多克隆抗体(sc-138089), α-Akt鼠单克隆抗体(sc-377457)、α-pAkt鼠单克隆抗体(sc52940)购自美国Santa Cruz公司. PI3KCA兔单克隆抗体(SAB5500163)购自美国SIGMA公司. DAB显色试剂盒购自大连宝生物公司, BCA定量及ECL发光试剂盒购自南京凯基生物公司. TRIzol、逆转录及扩增试剂盒购自日本Takara公司. miRNA提取分离试剂盒、LipofectamineTM2000、RPIM 1640、TRIzol购自美国Sigma公司. 引物由北京生工生物工程有限公司进行设计并合成(表1). MTT试剂盒购自美国Invitrogen公司, All-in-OneTMqPCR Mix试剂盒、Annexin V-FITC/PI试剂盒购自美国GeneCopoeia公司. siAFAP-1L2及siRNA control质粒购自美国Addgene公司.
| qRT-PCR引物 | 序列 |
| AFAP-1L2 | 5'-CCGGACGTAACGACTGCATCCG-3' 5'-GCCCAGTTCGUUCGUGCCACG-3' |
| GADPH | 5'-GCCGATCCGTAACGCTACGGCGC-3' 5'-CCGGACGTTCGACGGCTCCG-3' |
| siAFAP-1L2 | 5'-CGGCCGACTTCCTAGGCCTCCG-3' 5'-GGCCACGTCCACGGTCCACGC-3' |
| siRNA control | 5'-CGTTACCGCTCCGCAACCCGCC-3' 5'-CGGGCCTTCCGACTTGCCGCCG-3' |
| PI3KCA | 5'-CCCGGACCGTCGAACGTTCCGG-3' 5'-ACGGTCCTTGCCCGACCCGG-3′ |
| α-Akt | 5'- GGCTACCGTACTCCGTCACC-3' 5'-GCCCATGCGTGCACGGCGCGG-3' |
| α-pAkt | 5'-GCTCCACTGGCCGGAACCTCGG-3' 5'-CGGACTCGGGCTACCGGCCGC-3' |
1.2.1 Western blot: 对各个细胞系细胞应用PBS洗涤3次, 离心后弃去上清液, 加入细胞裂解液提取各细胞株总蛋白的提取, 进行BCA法蛋白定量, 取60 μg蛋白加上样缓冲剂进行上样, 采用12%十二烷基磺酸钠-聚丙烯酰胺进行凝胶电泳分离, 转移至PVDF膜. 用含有5%脱脂奶粉的TBST缓冲液室温条件下封闭1.5 h, 加入一抗, 4 ℃条件下孵育过夜. TBST溶液洗膜3次后加入二抗, 37 ℃孵育1 h, TBST溶液清洗3次, 采用化学发光(ECL)凝胶显像仪进行显像, 软件应用QuantityOne进行灰度值分析.
1.2.2 实时定量PCR检测(real-time quantitative PCR, qRT-PCR): 按照RNA分离试剂盒和TRIzol试剂盒说明书的要求步骤进行细胞株RNA的提取及纯化, 按照逆转录和扩增试剂盒说明书要求步骤进行逆转录及扩增. DEPC水调零, 取1.5 μL样品RNA采用全波长紫外/可见光扫描分光光度计进行总RNA纯度检测, 在A260/280为1.8-2.0, 纯度较高, 无DNA及蛋白质等污染. 取RNA样品1 μL采用1%琼脂凝胶电泳20 min, EB染色15 min, 凝胶成像系统下观察显示5、18及28s RNA条带均完整, 总RNA抽取完整. 以各组细胞cDNA作为模板, 每组均设立3个复孔, 反应体系: 2×All-in-One qPCR Mix 10 μL, 45×Syber Green 2 μL, Primer F 1 μL, Primer R 1 μL, cDNA 2 μL, ddH2O 4 μL. 反应条件: 95 ℃ 2 min; 95 ℃ 2 min; 95 ℃ 20 s; 60 ℃30 s; 75 ℃30 s(45个循环), 采用△△Ct法比较不同组别基因表达差异.
1.2.3 siAFAP-1L2及siRNA control转染MiaPaCa-2细胞: 选取AFAP-1L2表达量相对较高的MiaPaCa-2细胞系分为3组: 无干预组即MOCK组、siAFAP-1L2转染组即siAFAP-1L2组及空载对照组即siRNA control组. 选取对数期生长并且24 h内融合达75%-95%的细胞按照LipofectamineTM2000说明书步骤进行转染, 转染48 h后采用Western blot及qRT-PCR法对AFAP-1L2蛋白及mRNA表达水平进行检测, 评价转染效率.
1.2.4 四甲基偶氮唑盐微量酶反应比色法(methyl-thiazolyl-tetrazolium, MTT): 取各组对数期生长MiaPaCa-2细胞制成单细胞悬液, 依照MTT试剂盒操作说明书, 以1×104细胞/孔密度接种到96孔细胞培养板, 并设3个复孔, 进行常规步骤培养24、48、72、96 h后, 每孔内加入5 mg/mL浓度MTT液5 μL, 37 ℃继续进行温育4 h, 弃上清后每孔加入DMSO液150 μL, 水平振荡溶解结晶, 酶联免疫检测仪比色设定为490 nm波长, 测定各孔吸光度, 实验重复3次取平均值, 进行生长曲线绘制.
1.2.5 流式细胞仪检测细胞周期及凋亡: 取转染48 h后的MiaPaCa-2细胞转移至EP管进行消化, 1 mL预冷的PBS液洗涤3次后加入1 mL预冷70%乙醇在4 ℃条件下进行固定12 h. 1000 g离心5 min后弃上清, 1 mL预冷PBS液洗涤3次. 样品采用PBS重悬, 加入0.5%PI染色液25 μL及10 mg/mL RNase A10 μL, 4 ℃避光温浴30 min后用迈瑞BriCyte E6流式细胞仪检测细胞周期. 取转染48 h后的MiaPaCa-2细胞消化为单细胞悬液, 按照Annexin V-FITC/PI试剂盒操作说明步骤进行凋亡检测, 每个样本采集为10000事件, 计算凋亡细胞百分比, 重复3次试验取平均值.
统计学处理 采用GraphPad Prism6.0软件进行统计分析及作图, 计量资料采用mean±SD表示, 组间比较采用t检验, 率的比较采用χ2检验, 多组间比较采用单因素方差分析, P<0.05为差异有统计学意义.
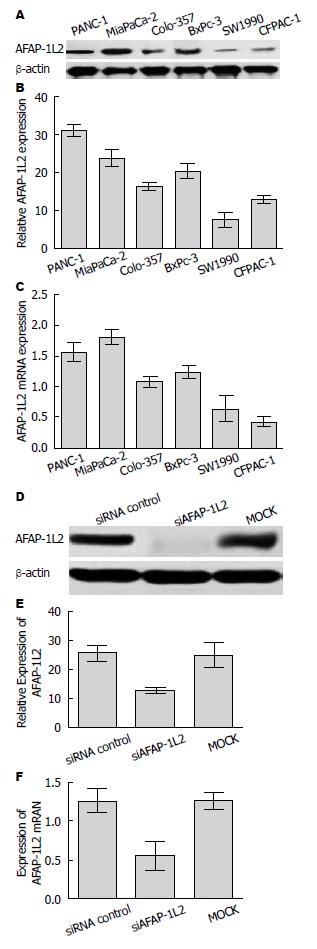
Western blot显示, AFAP-1L2蛋白在PANC-1、MiaPaCa-2、Colo-357、BXPC-3、SW1990及CFPAC-1六株不同分化程度的胰腺癌细胞株[8-10]中表达水平不同(F = 5.193, P = 0.021), 在低分化胰腺癌细胞株(PANC-1、MiaPaCa-2)中表达水平高于中分化(Colo-357、BXPC-3)及高分化(SW1990、CFPAC-1)细胞株. 在中分化胰腺癌细胞株(Colo-357、BXPC-3)AFAP-1L2蛋白表达高于高分化(SW1990、CFPAC-1)细胞株(表2, 图1A, B).
| 不同癌细胞株 | Colo-357 | BXPC-3 | SW1990 | CFPAC-1 | ||||
| t值 | P值 | t值 | P值 | t值 | P值 | t值 | P值 | |
| 蛋白表达 | ||||||||
| PANC-1 | 3.182 | 0.0335 | 1.208 | 0.2934 | 5.689 | 0.0047 | 4.638 | 0.0098 |
| MiaPaCa-2 | 7.910 | 0.0014 | 4.283 | 0.0128 | 9.627 | 0.0070 | 9.909 | 0.0006 |
| Colo-357 | 3.999 | 0.0161 | 2.317 | 0.0814 | ||||
| BXPC-3 | 4.727 | 0.0091 | 3.443 | 0.0262 | ||||
| mRNA表达 | ||||||||
| PANC-1 | 2.698 | 0.0542 | 1.727 | 0.1592 | 3.507 | 0.0025 | 6.567 | 0.0028 |
| MiaPaCa-2 | 4.671 | 0.0095 | 3.365 | 0.0282 | 4.683 | 0.0094 | 9.259 | 0.0008 |
| Colo-357 | 1.918 | 0.1276 | 5.434 | 0.0056 | ||||
| BXPC-3 | 2.447 | 0.0706 | 5.761 | 0.0045 | ||||
qRT-PCR显示AFAP-1L2 mRNA在PANC-1、MiaPaCa-2、Colo-357、BXPC-3、SW1990及CFPAC-1六株不同分化程度胰腺癌细胞株表达水平不同(F = 6.314, P = 0.017), 在低分化胰腺癌细胞株(PANC-1、MiaPaCa-2)中表达水平高于中分化(Colo-357、BXPC-3)及高分化(SW1990、CFPAC-1)细胞株; 在中分化胰腺癌细胞株(Colo-357、BXPC-3)AFAP-1L2蛋白表达高于高分化(SW1990、CFPAC-1)细胞株(表2, 图1C).
Western blot显示siAFAP-1L2转染MiaPaCa-2细胞AFAP-1L2表达条带明显淡于siRNA control组及AFAP-1L2组, 差异有显著性(F = 5.837, P<0.05)(图1D, E).
qRT-PCR显示, siAFAP-1L2转染后AFAP-1L2组AFAP-1L2 mRNA表达明显低于siRNA control组及AFAP-1L2组, 差异有显著性(F = 7.188, P<0.05), 沉默效率约为60%-70%(图1F).
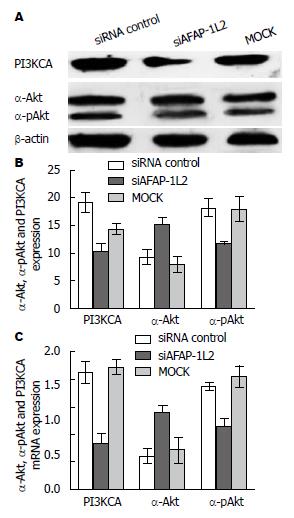
Western blot显示, PI3KCA蛋白在siAFAP-1L2组的表达量明显低于AFAP-1L2组及siRNA control组(F = 9.280, P = 0.0139), α-Akt在siAFAP-1L2细胞的表达量高于MOCK细胞及siRNA control细胞(F = 7.719, P = 0.0219), α-pAkt在siAFAP-1L2细胞的表达量低于MOCK细胞及siRNA control细胞(F = 5.507, P = 0.0439)(图2A, B); qRT-PCR结果显示, PI3KCAmRNA在siAFAP-1L2组的表达量明显低于AFAP-1L2组及siRNA control组(F = 20.16, P =0.0022), α-Akt在siAFAP-1L2细胞的表达量高于MOCK细胞及siRNA control细胞(F = 6.068, P = 0.0362), α-pAkt在siAFAP-1L2细胞的表达量低于MOCK细胞及siRNA control细胞(F = 10.33, P = 0.0114)(图2C).
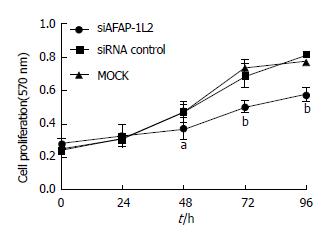
MTT检测显示, siAFAP-1L2组细胞增殖率在48 h(37.31%±11.62% vs 47.70%±7.48%, 47.32%±10.64%), 72 h(50.34%±0.61% vs 73.72%±8.17%, 69.27.43%±12.53%)和96 h(57.73%±7.62% vs 78.01%±3.26%, 81.77%±0.65%)均低于MOCK组及siRNA control组, MiaPaCa-2细胞增殖能力下降, 差异均具有显著性(F = 3.924, P<0.05; F = 6.812, P<0.01; F = 7.003, P<0.01)(图3).
流式细胞检测显示, 转染siAFAP-1L2后G1期细胞比例增高, G2及S期比例减少, 与siRNA control组及MOCK组相比, 差异具有显著性(F = 4.87, F = 5.26, F = 4.94, 均P<0.05)(表3).
| 分组 | G1期 | G2期 | S期 |
| MOCK | 75.36±1.48 | 8.27±1.07 | 14.11±1.31 |
| siAFAP-1L2 | 82.06±2.14 | 7.19±1.28 | 8.52±1.13 |
| siRNA Control | 73.19±2.02 | 8.86±1.51 | 156.00±2.21 |
| F值 | 4.870 | 5.260 | 4.940 |
| P值 | 0.041 | 0.021 | 0.032 |
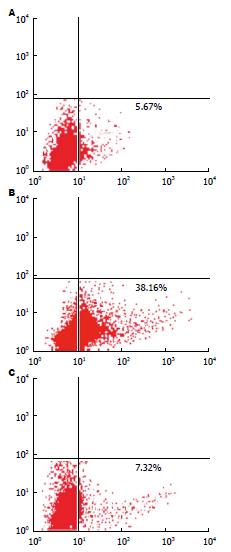
siRNA control、 siAFAP-1L2及MOCK各组凋亡率分别为5.67%、38.16%及7.32%, siAFAP-1L2干扰后MiaPaCa-2细胞凋亡率增高, 差异具有显著性(F = 7.231, P<0.01)(图4).
胰腺癌恶性程度高, 以发现晚, 发展快, 浸润及转移发生早为特点[11], 以手术为主导, 联合放疗、化疗及靶向治疗的现有治疗方式对患者生存期及生存率的改善难和提高以令人满意[12,13]. AFAP-1L2结构与肌动蛋白丝相关蛋白(AFAP)相似, 是一种新型的接头蛋白, 也被称为XB130[14]. AFAP-1L2在甲状腺癌、食道癌及胃癌等恶性肿瘤中具有促进肿瘤生长及转移等作用[15,16]. Zhang等[7]研究发现, AFAP-1L2在胰腺导管腺癌腺癌组织中为高表达, 预示着胰腺癌的不良预后, 可作为胰腺导管腺癌预后的独立预测因素. 本研究在分子生物学水平进一步对AFAP-1L2表达及对胰腺癌细胞分化、增殖、周期及凋亡等功能的影响进行了检测, 并探讨其可能机制. PI3K/Akt信号通路在肝癌、乳腺癌及肺癌等恶性肿瘤的发生发展中起重要作用, 对恶性肿瘤细胞的增殖、转移及浸润等生物学行为具有促进作用[17,18], 对恶性肿瘤细胞凋亡有抑制作用[19]. PI3KCA及α-Akt是PI3K/Akt信号通路中的重要蛋白, α-Akt磷酸化为α-pAkt后PI3K/Akt通路被激活, 从而发挥促癌活性[20]. Lodyga等[21]研究显示, PI3K/Akt信号通路是AFAP-1L2下游的靶基因, 通过对α-Akt磷酸化调控调节PI3K/Akt通路活性.
本研究显示, AFAP-1L2蛋白及mRNA在不同分化程度的六株胰腺癌细胞中均有表达, AFAP-1L2在低分化胰腺癌细胞中表达水平高于中分化及高分化细胞系. AFAP-1L2可能参与胰腺癌细胞的分化过程, 从而影响胰腺癌的恶性程度, 有研究[6,16]显示, 在胃癌中, AFAP-1L2对参与胃癌细胞的分化过程, 并调控其增殖及浸润等恶性行为, 预示着胃癌的不良预后. Snyder等[22]研究发现, AFAP家族另一成员AFAP1L1通过与非受体酪氨酸激酶N端的SH3区域结合对皮层肌动蛋白功能进行调控, 从而使细胞转移及侵袭能力增强, AFAP-1L2可能与其有相同的作用机制. 对AFAP-1L2表达进行干扰下调后, PI3K/Akt信号通路中主要的基因PI3KCA在蛋白水平及mRNA水平均下降, α-Akt升高, 而α-pAkt下降. AFAP-1L2对PI3K/Akt信号通路具有调控作用, 通过促进α-Akt的磷酸化而激活该信号通路, 影响胰腺癌的恶性行为. Shiozaki等[23]研究认为, AFAP-1L2对下游信号通路PI3K/Akt的调控促进α-Akt的磷酸化, 从而该通路进一步磷酸化下游酪氨酸及色氨酸残基, 对细胞周期、恶性增殖及侵袭等恶性行为产生影响. 本研究显示, AFAP-1L2下调后MiaPaCa-2细胞增殖能力下降, G1期细胞比例增高, G2及S期比例减少, 细胞凋亡率增高. 对AFAP-1L2表达进行干扰降低了胰腺癌细胞的增殖能力并促进其停留在G1期细胞增多, 凋亡率升高, 这说明促癌信号通路PI3K/Akt可能受到抑制, 磷酸化的α-Akt降低, 从而胰腺癌细胞的增殖能力减弱, 凋亡数量增加. Zheng等[24]研究也认为PI3K/Akt信号通路被抑制后, 胰腺癌细胞的增殖能力减弱, 凋亡数量增加并增加了肿瘤细胞对厄洛替尼化疗的敏感性. Won等[25]认为, 细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)通路与PI3K信号通路之间存在交叉调节效应, 但AFAP-1L2是否对ERK信号通路具有调控作用, 尚不明确. Zhong等[26]认为, PI3K与丝裂原细胞外信号调节激酶(mitogen extracellular signal regulated kinase, MEK)信号通路在胰腺癌恶性行为中具有协同效应, 增强了胰腺癌浸润及转移能力. 胰腺癌的发生及发展过程是多基因的作用结果, AFAP-1L2对SRE/AP-1和CXCR4-SDF-1α等多条信号通路也可能具有调控作用, 需进一步深入研究[27,28]. 通过对靶基因的筛查, 早期发现肿瘤病灶并进行手术切除是治愈胰腺癌的最主要手段[29,30], 而对于不能手术切除的胰腺癌及姑息治疗病例, 针对靶基因的靶向治疗可能是未来提高胰腺癌生存率的治疗策略[31]. AFAP-1L2作为一种新发现的接头蛋白在胰腺癌转移及浸润等恶性行为中的作用需进一步实验检测.
总之, AFAP-1L2通过对PI3K/Akt通路的调控作用从而影响胰腺癌细胞的增殖及凋亡等恶性行为, AFAP-1L2可能成为胰腺癌治疗的靶基因.
胰腺癌恶性程度高, 以发展快、浸润及转移发生早为特点, 手术、 放疗、化疗及靶向治疗均不能达到满意生存率. 肌动蛋白丝相关蛋白1相似蛋白(actin filament-associated protein 1-like 2, AFAP-1L2)是一种新型的接头蛋白, 有研究认为其在胰腺导管腺癌中为高表达, 但在胰腺癌细胞中的表达情况、对胰腺癌细胞增殖及凋亡等恶性行为的调控机制的研究并不深入, 本研究对AFAP-1L2对胰腺癌离体细胞增殖及凋亡进行了检测, 并探讨可能的作用机制.
刘亮, 副主任医师, 复旦大学胰腺癌研究所; 复旦大学附属肿瘤医院胰腺肝胆外科
对胰腺癌预后评估的靶基因的检测及治疗靶点的探索是胰腺癌靶向治疗的研究热点, 深入探讨靶基因对胰腺癌细胞的调控机制是目前研究的重点, 对治疗靶点的筛查手段及应用于临床的有效性和意义是亟待解决的问题.
在对手术切除的胰腺导管腺癌标本及癌旁组织中AFAP-1L2表达的检测显示, AFAP-1L2在胰腺导管腺癌组织中表达明显高于癌旁组织, 并与胰腺癌TNM分期、直径、淋巴结转移及分化程度具有相关性, AFAP-1L2表达上调提示胰腺癌不良预后, 可以作为胰腺癌预后的独立预测因素. AFAP-1L2可能通过调控下游磷脂酰肌醇3激酶/蛋白激酶(phosphatidylinositol 3 kinase/protein kinase B, PI3K/Akt)信号通路对胃癌、结肠癌及肺癌等恶性肿瘤细胞增殖及凋亡等恶性行为产生作用, AFAP-1L2的直接作用机制可能是通过调控α-Akt磷酸化影响PI3K/Akt通路活性.
对于调控胰腺癌恶性行为靶基因的筛查一直以来是研究的热点, 但对于AFAP-1L2的研究只停留在组织学水平, 本研究第一次对AFAP-1L2在胰腺癌中细胞水平及分子生物学水平进行了检测, 并观察了其对胰腺癌细胞增殖、细胞周期及凋亡的作用, 下调AFAP-1L2表达后对PI3K/Akt信号通路的影响, 探讨了其机制.
在本实验基础上通过在体动物实验观察AFAP-1L2对胰腺癌恶性行为的作用, 并进一步明确其作用机制及是否有其他信号通路参与其作用, 为胰腺癌的预测、预后判断及靶向治疗提供候选基因.
肿瘤细胞分化程度: 指肿瘤细胞接近于正常细胞的程度. 高分化指肿瘤细胞分化接近相应的正常发源组织, 恶性程度相对较低; 而低分化或未分化指细胞分化程度与相应的正常发源组织区别极大, 肿瘤恶性程度相对较大. 二者之间为"中分化". 肿瘤分化程度, 分为3个病理等级, 级别越高表示细胞分化程度越差. G1, 即高分化, 细胞分化程度较好. G2, 即中分化, 细胞分化程度居中. G3, 即低分化, 细胞分化程度较差.
本研究检测了不同分化程度胰腺癌细胞株中AFAP-1L2的表达, 观察了AFAP-1L2下调后胰腺癌细胞增殖、细胞周期及凋亡变化, 并对AFAP-1L2下调后PI3K/Akt信号通路相关蛋白变化进行了检测, 得出AFAP-1L2可能通过PI3K/Akt通路调控胰腺癌细胞增殖、细胞周期及凋亡的结论. 实验设计合理, 结果切实可靠, 对胰腺癌预测及治疗靶基因的筛查有一定价值.
编辑: 于明茜 电编:闫晋利
| 1. | Wada K, Takaori K, Traverso LW. Screening for Pancreatic Cancer. Surg Clin North Am. 2015;95:1041-1052. [PubMed] [DOI] |
| 2. | Liu SX, Xia ZS, Zhong YQ. Gene therapy in pancreatic cancer. World J Gastroenterol. 2014;20:13343-13368. [PubMed] [DOI] |
| 3. | Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, Cruceru ML, Albulescu R. Cancer stem cells: involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics. World J Gastroenterol. 2014;20:10790-10801. [PubMed] [DOI] |
| 4. | Takeshita H, Shiozaki A, Bai XH, Iitaka D, Kim H, Yang BB, Keshavjee S, Liu M. XB130, a new adaptor protein, regulates expression of tumor suppressive microRNAs in cancer cells. PLoS One. 2013;8:e59057. [PubMed] [DOI] |
| 5. | Shiozaki A, Kosuga T, Ichikawa D, Komatsu S, Fujiwara H, Okamoto K, Iitaka D, Nakashima S, Shimizu H, Ishimoto T. XB130 as an independent prognostic factor in human esophageal squamous cell carcinoma. Ann Surg Oncol. 2013;20:3140-3150. [PubMed] [DOI] |
| 6. | Shi M, Zheng D, Sun L, Wang L, Lin L, Wu Y, Zhou M, Liao W, Liao Y, Zuo Q. XB130 promotes proliferation and invasion of gastric cancer cells. J Transl Med. 2014;12:1. [PubMed] [DOI] |
| 7. | Zhang J, Jiang X, Zhang J. Prognostic significance of XB130 expression in surgically resected pancreatic ductal adenocarcinoma. World J Surg Oncol. 2014;12:49. [PubMed] [DOI] |
| 8. | Sheng W, Dong M, Zhou J, Li X, Liu Q, Dong Q, Li F. Cooperation among Numb, MDM2 and p53 in the development and progression of pancreatic cancer. Cell Tissue Res. 2013;354:521-532. [PubMed] [DOI] |
| 9. | Ji H, Lu HW, Li YM, Lu L, Wang JL, Zhang YF, Shang H. Twist promotes invasion and cisplatin resistance in pancreatic cancer cells through growth differentiation factor 15. Mol Med Rep. 2015;12:3841-3848. [PubMed] [DOI] |
| 10. | Kiss K, Baghy K, Spisák S, Szanyi S, Tulassay Z, Zalatnai A, Löhr JM, Jesenofsky R, Kovalszky I, Firneisz G. Chronic hyperglycemia induces trans-differentiation of human pancreatic stellate cells and enhances the malignant molecular communication with human pancreatic cancer cells. PLoS One. 2015;10:e0128059. [PubMed] [DOI] |
| 11. | Chakraborty S, Baine MJ, Sasson AR, Batra SK. Current status of molecular markers for early detection of sporadic pancreatic cancer. Biochim Biophys Acta. 2011;1815:44-64. [PubMed] [DOI] |
| 12. | Frakes JM, Strom T, Springett GM, Hoffe SE, Balducci L, Hodul P, Malafa MP, Shridhar R. Resected pancreatic cancer outcomes in the elderly. J Geriatr Oncol. 2015;6:127-132. [PubMed] [DOI] |
| 13. | Sole CV, Calvo FA, Atahualpa F, Berlin A, Herranz R, Gonzalez-Bayon L, García-Sabrido JL. Role of radiotherapy in the chemotherapy-containing multidisciplinary management of patients with resected pancreatic adenocarcinoma. Strahlenther Onkol. 2015;191:17-25. [PubMed] [DOI] |
| 14. | Shiozaki A, Liu M. Roles of XB130, a novel adaptor protein, in cancer. J Clin Bioinforma. 2011;1:10. [PubMed] [DOI] |
| 15. | Shiozaki A, Lodyga M, Bai XH, Nadesalingam J, Oyaizu T, Winer D, Asa SL, Keshavjee S, Liu M. XB130, a novel adaptor protein, promotes thyroid tumor growth. Am J Pathol. 2011;178:391-401. [PubMed] [DOI] |
| 16. | Shi M, Huang W, Lin L, Zheng D, Zuo Q, Wang L, Wang N, Wu Y, Liao Y, Liao W. Silencing of XB130 is associated with both the prognosis and chemosensitivity of gastric cancer. PLoS One. 2012;7:e41660. [PubMed] [DOI] |
| 17. | Chiang KC, Chen HY, Hsu SY, Pang JH, Wang SY, Hsu JT, Yeh TS, Chen LW, Kuo SF, Sun CC. PTEN insufficiency modulates ER+ breast cancer cell cycle progression and increases cell growth in vitro and in vivo. Drug Des Devel Ther. 2015;9:4631-4638. [PubMed] [DOI] |
| 18. | Feng R, Ye J, Zhou C, Qi L, Fu Z, Yan B, Liang Z, Li R, Zhai W. Calreticulin down-regulation inhibits the cell growth, invasion and cell cycle progression of human hepatocellular carcinoma cells. Diagn Pathol. 2015;10:149. [PubMed] [DOI] |
| 19. | Bai XH, Cho HR, Moodley S, Liu M. XB130-A Novel Adaptor Protein: Gene, Function, and Roles in Tumorigenesis. Scientifica (Cairo). 2014;2014:903014. [PubMed] [DOI] |
| 20. | Fang Y, Yi J, Lizhi L, Qiucheng C. Rho GDP dissociation inhibitor beta promotes cell proliferation and invasion by modulating the AKT pathway in hepatocellular carcinoma. DNA Cell Biol. 2014;33:781-786. [PubMed] [DOI] |
| 21. | Lodyga M, De Falco V, Bai XH, Kapus A, Melillo RM, Santoro M, Liu M. XB130, a tissue-specific adaptor protein that couples the RET/PTC oncogenic kinase to PI 3-kinase pathway. Oncogene. 2009;28:937-949. [PubMed] [DOI] |
| 22. | Snyder BN, Cho Y, Qian Y, Coad JE, Flynn DC, Cunnick JM. AFAP1L1 is a novel adaptor protein of the AFAP family that interacts with cortactin and localizes to invadosomes. Eur J Cell Biol. 2011;90:376-389. [PubMed] [DOI] |
| 23. | Shiozaki A, Shen-Tu G, Bai X, Iitaka D, De Falco V, Santoro M, Keshavjee S, Liu M. XB130 mediates cancer cell proliferation and survival through multiple signaling events downstream of Akt. PLoS One. 2012;7:e43646. [PubMed] [DOI] |
| 24. | Zheng YT, Yang HY, Li T, Zhao B, Shao TF, Xiang XQ, Cai WM. Amiloride sensitizes human pancreatic cancer cells to erlotinib in vitro through inhibition of the PI3K/AKT signaling pathway. Acta Pharmacol Sin. 2015;36:614-626. [PubMed] [DOI] |
| 25. | Won JK, Yang HW, Shin SY, Lee JH, Heo WD, Cho KH. The crossregulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor. J Mol Cell Biol. 2012;4:153-163. [PubMed] [DOI] |
| 26. | Zhong H, Sanchez C, Spitrzer D, Plambeck-Suess S, Gibbs J, Hawkins WG, Denardo D, Gao F, Pufahl RA, Lockhart AC. Correction: Synergistic Effects of Concurrent Blockade of PI3K and MEK Pathways in Pancreatic Cancer Preclinical Models. PLoS One. 2015;10:e0127365. [PubMed] [DOI] |
| 27. | Beloribi-Djefaflia S, Siret C, Lombardo D. Exosomal lipids induce human pancreatic tumoral MiaPaCa-2 cells resistance through the CXCR4-SDF-1α signaling axis. Oncoscience. 2015;2:15-30. [PubMed] |
| 28. | Han B, Xiao H, Xu J, Lodyga M, Bai XH, Jin T, Liu M. Actin filament associated protein mediates c-Src related SRE/AP-1 transcriptional activation. FEBS Lett. 2011;585:471-477. [PubMed] [DOI] |
| 29. | Okano K, Suzuki Y. Strategies for early detection of resectable pancreatic cancer. World J Gastroenterol. 2014;20:11230-11240. [PubMed] [DOI] |
| 30. | Kong X, Li L, Li Z, Xie K. Targeted destruction of the orchestration of the pancreatic stroma and tumor cells in pancreatic cancer cases: molecular basis for therapeutic implications. Cytokine Growth Factor Rev. 2012;23:343-356. [PubMed] [DOI] |
| 31. | Tang SC, Chen YC. Novel therapeutic targets for pancreatic cancer. World J Gastroenterol. 2014;20:10825-10844. [PubMed] [DOI] |