修回日期: 2015-08-25
接受日期: 2015-09-08
在线出版日期: 2015-09-28
目的: 探讨嗜酸性粒细胞趋化因子-3(eosinophil chemotactic factor-3, Eotaxin-3)在嗜酸性粒细胞胃肠炎(eosinophilic gastroenteritis, EG)患者中的表达及糖皮质激素对其表达的影响.
方法: 选取首次确诊的EG患者48例, 随机平均分为未治疗组与强的松(Prednisone)治疗组, 以同期的24例健康者为对照组, 使用酶联免疫吸附测定法(enzyme-linked immunosorbent assay)分别测定研究对象其血清及组织中Eotaxin-3的表达.
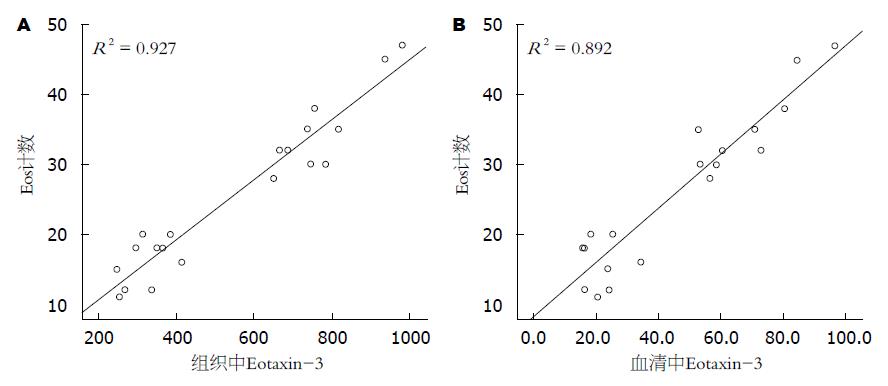
结果: EG各组治疗前同对照组相比, 血清及组织中Eotaxin-3的表达水平明显增高(P<0.05); 未治疗组服用安慰剂前后的血清及组织中Eotaxin-3的表达水平差异无统计学意义, 比较治疗组的治疗前后, 血清及组织中Eotaxin-3的表达水平均有明显下降(P<0.05); EG各组组织中及血清中Eotaxin-3的表达水平与组织中嗜酸性粒细胞(eosinophil)计数均呈正相关关系(r = 0.96、r = 0.94, 均P<0.01).
结论: Eotaxin-3可能参与了EG的病理生理过程, 激素治疗EG可能通过抑制Eotaxin-3的表达水平实现的, 这对EG的临床诊治有一定的指导意义. 血清中Eotaxin-3作为非侵入性指标评价EG的治疗效果有一定的参考价值.
核心提示: 使用激素治疗嗜酸性粒细胞胃肠炎(eosinophilic gastroenteritis, EG)患者, 能显著降低嗜酸性粒细胞趋化因子-3(eosinophil chemotactic factor-3, Eotaxin-3)的表达水平, 从而减弱其对嗜酸性粒细胞(eosinophil)的趋化、激活, 进而减少毒性物质的产生、减少对胃肠道的损害. 血清中Eotaxin-3作为非侵入性指标评价EG的治疗效果有一定的参考价值.
引文著录: 韩莉莉, 张金平, 李东颖, 王浩联, 林姝, 李建生. Eotaxin-3在嗜酸性粒细胞胃肠炎中的表达及糖皮质激素对其表达的影响. 世界华人消化杂志 2015; 23(27): 4428-4432
Revised: August 25, 2015
Accepted: September 8, 2015
Published online: September 28, 2015
AIM: To detect the expression of eosinophil chemotactic factor-3 (Eotaxin-3) in eosinophilic gastroenteritis (EG) and investigate the effect of glucocorticoid on Eotaxin-3 expression.
METHODS: Forty-eight patients with EG and 24 healthy controls were included. Patients with EG were equally divided into two groups, a placebo group and a prednisone group. Eotaxin-3 expression was measured by enzyme-linked immunosorbent assay in the serum and tissue samples of all subjects.
RESULTS: The expression levels of Eotaxin-3 in serum and tissue were significantly elevated in the EG group compared to normal controls (P < 0.05). Eotaxin-3 in serum and tissue significantly decreased after treatment (P < 0.05), although its change had no significance in the placebo group. A positive correlation was observed between eosinophil (Eos) count and Eotaxin-3 in serum and tissue in the EG group.
CONCLUSION: Eotaxin-3 may be involved in the pathophysiological process of EG. Hormone therapy may inhibit the expression of Eotaxin-3. Serum Eotaxin-3 may be used as a non-invasive index for evaluating the treatment effect in EG.
- Citation: Han LL, Zhang JP, Li DY, Wang HL, Lin S, Li JS. Effect of glucocorticoid on expression of Eotaxin-3 in eosinophilic gastroenteritis. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4428-4432
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4428.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4428
嗜酸性粒细胞胃肠炎(eosinophilic gastroenteritis, EG)是一种少见的以嗜酸性粒细胞(eosinophil, Eos)浸润胃肠道为特点的胃肠病, 因Eos浸润的部位及层面不同而使临床表现多种多样. 一项国际统计表明成人和儿童均可发病, 男女发病率无明显差异[1]. 目前国内外对EG的临床表现及病理等已有深入的研究, 但对于其病因及病理生理过程的报道甚少. 现认为其与过敏反应、免疫功能障碍有关. 由于缺乏对病因学和触发因子的认识, EG在治疗上主要应用糖皮质激素, 但其不良反应多且停药后可能复发.
目前对于EG的炎症活动程度和治疗的评估主要是内镜病理, 缺乏有效的非侵入性指标. 现国内外相关研究[2]表明, 一种特殊的嗜酸粒细胞趋化物质嗜酸性粒细胞趋化因子-3(eosinophil chemotactic factor-3, Eotaxin-3)在EG的病理生理过程中起着重要的作用. 相关动物实验研究显示Eotaxin-3在EG模型小鼠血清及组织中也特异性的高表达. 但在EG患者血清及组织中Eotaxin-3的表达情况还少有报道. 本文通过测定EG患者Eotaxin-3的表达水平及强的松(Prednisone, PDN)对其表达的影响, 以探讨Eotaxin-3在EG病理生理过程中的作用, 从而为本病的诊疗提供理论依据.
选取2014-06/2015-04在郑州大学第一附属医院首次确诊的EG患者48例, 入选标准均符合Talley[3]提出的诊断标准: (1)有腹痛、腹泻、恶心及呕吐等胃肠道症状; (2)病理学检查证实为Eos浸润(>25个/高倍视野); (3)仅在胃肠道有Eos, 无别的器官浸润; (4)排除寄生虫感染、变态反应性疾病和自身免疫性疾病. 其中男性28例, 女性20例, 年龄30-45岁, 平均38岁±4.2岁. 随机分为A组: EG未治疗组, 每日给以安慰剂对照; B组: EG治疗组, 口服PDN 40 mg/d, 共2 wk; 对照组选取同期健康成年人, 男性16例, 女性8例, 年龄31-42岁, 平均36岁±3.5岁, 无个人及家族过敏性疾病, 无寄生虫感染史. 所有研究对象近3 mo内未使用过激素及质子泵抑制剂(proton pump inhibitors)类药物, 3组研究对象年龄、性别及症状等一般资料的差异无统计学意义, 且已通过郑州大学第一附属医院伦理委员会的批准, 均签署知情同意书.
研究对象分别行相应的胃肠镜检查, 由于EG的Eos浸润并不是连续的, 尽量在每个部位多次活检, 且多个部位活检, 标本分为2份, 1份标本组织3/44%甲醛固定并常规石蜡包埋, 切片, 行常规苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色. 1份称取质量后保存至-80 ℃, 以行组织Eotaxin-3测定.
1.2.1 组织Eos计数: 光学显微镜下从每张HE切片中随机选取5个炎症细胞浸润明显的视野(×400), 计数Eos个数, 然后计算平均值作为此片的Eos计数.
1.2.2 血清Eotaxin-3测定: 分别取各组研究对象静脉血3 mL, 静置30 min, 2000 r/min离心20 min, 留取血清保存于-80 ℃, 待测. 采用酶联免疫吸附测定法(enzyme-linked immunosorbent assay, ELISA)测定3组血清中Eotaxin-3的表达水平.
1.2.3 组织Eotaxin-3测定: 检测时将收集的冷藏标本融化后保持2 ℃-8 ℃的温度, 加入一定量的PBS(pH 7.4), 用匀浆器将标本匀浆充分. 2000-3000 r/min离心20 min, 仔细收集上清. 用ELISA法检测标本中Eotaxin-3的量. 试剂盒由美国ADL公司生产, 上海恒远生物技术有限公司提供, 标本采用同一批测定. 操作严格按照试剂盒说明书进行, Eotaxin-3试剂盒灵敏度为6.8 pg/mL.
统计学处理 计量资料以mean±SD表示, 采用SPSS13.0软件, 多组间比较采用单因素方差分析, 两两比较方差齐时用LSD检测, 不齐时用Bonferroni检测. 相关性应用Pearson相关分析. 以P<0.05为差异有统计学意义.
同对照组相比, A组及B组治疗前血清Eotaxin-3及组织中Eos、Eotaxin-3水平表达较高(P<0.05); 治疗前后, A组血清及组织中Eotaxin-3的表达水平差异无统计学意义, 组织中Eos计数为35.2个±6.4个 vs 36.8个±3.4个; B组血清及组织中Eotaxin-3的表达水平均有明显下降, 且差异有统计学意义(P<0.05). 组织中Eos计数为34.2个±7.4个 vs 16.0个±3.4个(表1).
| 分组 | 组织中Eos计数(个) | Eotaxin-3的表达 | |
| 血清中(pg/mL) | 组织中(pg/mg) | ||
| A组 | |||
| 治疗前 | 35.2±6.4 | 68.7±14.8 | 775.8±109.3 |
| 治疗后 | 36.8±3.4 | 65.7±14.3 | 796.8±125.3 |
| B组 | |||
| 治疗前 | 34.2±7.4 | 69.7±11.3 | 768.8±95.3 |
| 治疗后 | 16.0±3.4 | 21.0±6.1 | 323.1±56.8 |
| 对照组 | 7.4±3.8 | 8.6±2.0 | 16.1±6.3 |
EG是一种极少见的疾病[4], 据相关文献报道一位学者在1937年首次对该病进行了描述[5]. 1970年Klein等[6]提出了该病的临床分型, 至今延用. 典型的EG以胃肠道的Eos浸润、胃肠道水肿增厚为特点. 相关症状结合外周血Eos升高是诊断EG的主要线索, 胃肠道活检可见Eos浸润, 由于胃肠道Eos浸润常呈局灶性分布, 内镜下黏膜活检可能为阴性表现, 因此应多点多处活检以提高诊断率. 目前根据Eos浸润的程度可将EG分为三型: 黏膜型、肌层型和浆膜型, 因疾病涉及的部位及层次不同使临床表现不同各异, 常见的临床症状有恶心、呕吐、腹痛、腹泻、消化不良等[7,8].
自20世纪90年代以来, EG的发病率不断上升, 引起了国内外的高度重视, 成为近年的研究热点之一. EG的病因及机制尚未完全明确, 因其病理上以大量Eos浸润消化道壁为特征, 目前诸多学者认为其发病机制与Eos浸润及免疫变态反应有关. Gupta等[9]研究后报道Eos质粒中含有细胞毒性物质, 这些物质能诱导组织损伤. Han等[10]建立了嗜酸细胞相关性胃肠疾病的鼠类模型, 模拟EG患者的病理以及病生理过程, 发现Eos在EG的发病中起着核心的作用. Eos被激活后可以通过脱颗粒释放多种细胞毒性物质造成组织损伤, 而胃肠道组织Eos的聚集和浸润主要依赖一些趋化因子的作用. 其中Eotaxin[11]是对Eos有特异选择性趋化作用的细胞因子, 最初在鸡卵白蛋白(ovalbumin)致敏豚鼠的BALF中发现, 属于CC类[12,13]趋化因子, 主要表达于Eos, 通过结合Eos表面的受体, 趋化Eos在组织的聚集, 从而导致一系列级联反应, 引起组织损伤. Eotaxin包含三个亚类, Eotaxin-3是其家族成员之一[14-16]. 国外已有研究[17,18]表明此趋化因子可能参与EG的病理生理过程, 且Eotaxin-3的表达和Th2(helper T cell 2)细胞分泌的细胞因子白介素(interleukin, IL)-4、IL-13密切相关.
本实验通过比较EG患者血清及组织中Eotaxin-3表达水平发现EG患者血清及组织中Eotaxin-3表达水平明显高于对照组, 由此可推断Eotaxin-3可能参与了EG患者胃肠道炎症损伤过程. 糖皮质激素是目前治疗EG最有效的药物, 能减少胃肠道多种炎症细胞数量, 抑制Th2型细胞因子IL-4、IL-13的产生, 但其抑制Eos具体作用的机制尚未完全阐明. 本实验中激素治疗后B组患者组织中及血清中Eotaxin-3的表达水平均显著降低, 且同时与Eotaxin-3相关的Eos计数也明显减少, 而A组服用安慰剂后却未有明显变化, 这表明糖皮质激素可能通过抑制EG组织Eotaxin-3的表达并减少Eos浸润, 以达到治疗EG的目的.
总之, Eotaxin-3水平与Eos高度相关, Eotaxin-3可能参与EG的病理生理过程, 使用激素治疗能显著降低Eotaxin-3的表达水平从而减弱其对Eos的趋化、激活, 进而减少毒性物质的产生、减少对胃肠道的损害, 故对EG的临床诊治有一定的参考意义, 指导我们从抑制Eotaxin-3的产生及Eos浸润环节进行深入研究, 为开发EG治疗的靶向药物提供依据, 从而克服激素治疗的弊端. 且血清中Eotaxin-3水平与组织中Eos计数密切相关, 或许血清中Eotaxin-3可以作为非侵入性指标评估EG患者对治疗的反应.
嗜酸性粒细胞胃肠炎(eosinophilic gastroenteritis, EG)是一种少见的以嗜酸性粒细胞浸润胃肠道为特点的胃肠病, 其病因未明, 目前认为可能与过敏反应、免疫功能障碍有关. 治疗上主要应用糖皮质激素, 且其诊断缺乏有效的无创手段.
高泽立, 副教授, 周浦医院消化科, 上海交通大学医学院九院周浦分院
本实验证实嗜酸性粒细胞趋化因子-3(eosinophil chemotactic factor-3, Eotaxin-3)可能参与EG的病理生理过程, 对EG靶向药物的研制及寻找非侵入性手段评价EG治疗效果提供理论依据.
研究表明Eotaxin-3的表达可引起嗜酸性粒细胞的聚集、脱颗粒, 进而引起组织损伤, 参与多种病理生理过程.
本实验证实Eotaxin-3可能参与EG的病理生理过程, 指导研究者从抑制Eotaxin-3的产生及嗜酸性粒细胞(eosinophil, Eos)趋的环节开发EG治疗的靶向药物提供依据. 且研究表明血清中Eotaxin-3可以作为评估EG患者对治疗的反应的相关指标.
本文结果表明了Eotaxin-3在EG患者中的表达及治疗过程中的变化, 故关于EG靶向药物及相关评价指标的研究有广泛的前景.
Eotaxin-3: 是趋化因子CC亚家族中的一员, 主要参与Eos的募集以及活化作用, 参与多种疾病的病理生理过程.
该论文选题得当, 实验设计及统计方法合理, 讨论较充分, 对临床有一定的指导意义.
编辑: 于明茜 电编: 都珍珍
| 1. | Blackshaw AJ, Levison DA. Eosinophilic infiltrates of the gastrointestinal tract. J Clin Pathol. 1986;39:1-7. [PubMed] [DOI] |
| 2. | Masterson JC, Furuta GT, Lee JJ. Update on clinical and immunological features of eosinophilic gastrointestinal diseases. Curr Opin Gastroenterol. 2011;27:515-522. [PubMed] [DOI] |
| 3. | Talley NJ, Shorter RG, Phillips SF, Zinsmeister AR. Eosinophilic gastroenteritis: a clinicopathological study of patients with disease of the mucosa, muscle layer, and subserosal tissues. Gut. 1990;31:54-58. [PubMed] [DOI] |
| 4. | Ingle SB, Hinge Ingle CR. Eosinophilic gastroenteritis: an unusual type of gastroenteritis. World J Gastroenterol. 2013;19:5061-5066. [PubMed] [DOI] |
| 5. | Aceves S, Hirano I, Furuta GT, Collins MH. Eosinophilic gastrointestinal diseases--clinically diverse and histopathologically confounding. Semin Immunopathol. 2012;34:715-731. [PubMed] [DOI] |
| 6. | Klein NC, Hargrove RL, Sleisenger MH, Jeffries GH. Eosinophilic gastroenteritis. Medicine (Baltimore). 1970;49:299-319. [PubMed] |
| 9. | Gupta N, Aggarwal A, Gupta R, Sule S, Wolf DC. The management of eosinophilic gastroenteritis. Scand J Gastroenterol. 2015;50:1309-1314. [PubMed] [DOI] |
| 10. | Han SG, Chen Y, Qian ZH, Yang L, Yu RS, Zhu XL, Li QH, Chen Q. Eosinophilic gastroenteritis associated with eosinophilic cystitis: Computed tomography and magnetic resonance imaging findings. World J Gastroenterol. 2015;21:3139-3145. [PubMed] [DOI] |
| 11. | Caldwell JM, Collins MH, Stucke EM, Putnam PE, Franciosi JP, Kushner JP, Abonia JP, Rothenberg ME. Histologic eosinophilic gastritis is a systemic disorder associated with blood and extragastric eosinophilia, TH2 immunity, and a unique gastric transcriptome. J Allergy Clin Immunol. 2014;134:1114-1124. [PubMed] [DOI] |
| 12. | Garibay-Vargas OM, Soto-Candía D, Coria-Ramírez E, Castrejón-Vázquez MI, Vargas-Camaño ME, Ramos-Acosta G, Salamanca-García M, Guido-Bayardo RL. [Gastroenteritis eosinofílica]. Rev Alerg Mex. 2014;61:212-218. [PubMed] |
| 13. | Jeon EJ, Lee KM, Jung DY, Kim TH, Ji JS, Kim HK, Choi KY. [Clinical characteristics of 17 cases of eosinophilic gastroenteritis]. Korean J Gastroenterol. 2010;55:361-367. [PubMed] [DOI] |
| 14. | Oh HE, Chetty R. Eosinophilic gastroenteritis: a review. J Gastroenterol. 2008;43:741-750. [PubMed] [DOI] |
| 15. | Powell N, Walker MM, Talley NJ. Gastrointestinal eosinophils in health, disease and functional disorders. Nat Rev Gastroenterol Hepatol. 2010;7:146-156. [PubMed] [DOI] |
| 16. | Lim E, Rothenberg ME. Demethylation of the human eotaxin-3 gene promoter leads to the elevated expression of eotaxin-3. J Immunol. 2014;192:466-474. [PubMed] [DOI] |
| 17. | Takahashi K, Imaeda H, Fujimoto T, Ban H, Bamba S, Tsujikawa T, Sasaki M, Fujiyama Y, Andoh A. Regulation of eotaxin-3/CC chemokine ligand 26 expression by T helper type 2 cytokines in human colonic myofibroblasts. Clin Exp Immunol. 2013;173:323-331. [PubMed] [DOI] |
| 18. | Provost V, Larose MC, Langlois A, Rola-Pleszczynski M, Flamand N, Laviolette M. CCL26/eotaxin-3 is more effective to induce the migration of eosinophils of asthmatics than CCL11/eotaxin-1 and CCL24/eotaxin-2. J Leukoc Biol. 2013;94:213-222. [PubMed] [DOI] |