修回日期: 2015-08-06
接受日期: 2015-08-17
在线出版日期: 2015-09-28
目的: 评价奥曲肽治疗肝硬化合并顽固性腹水的有效性.
方法: 通过计算机检索PubMed、EMBASE、中国生物医学文献数据库(Chinese BioMedical Literature Database, CBM)、中国期刊全文数据库(China National Knowledge Infrastructure, CNKI)、中文科技期刊全文数据库(VIP)和万方数据库发表的有关奥曲肽治疗肝硬化合并顽固性腹水的临床研究, 最终纳入奥曲肽治疗肝硬化合并顽固性腹水的随机对照试验(randomized control trials, RCT). 采用Jadad质量记分法对纳入研究进行严格的方法学质量评价, Meta分析采用Rev Man5.2软件进行.
结果: 共纳入符合标准的RCT 9篇, 样本量为696例. Meta分析结果显示: 与常规治疗组相比, 奥曲肽能明显提高肝硬化合并顽固性腹水治疗的有效率(OR = 3.18, 95%CI: 2.03-4.97, P<0.00001); 同时, 患者体质量(MD = -8.75, 95%CI: -11.25--6.25, P<0.00001)、腹水量(SMD = -31.8, 95%CI: -35.23--28.37, P<0.00001)、腹围(SMD = -8.75, 95%CI: -11.55--5.95, P<0.00001)、24 h尿量(SMD = 8.18, 95%CI: 3.69-12.67, P = 0.0004)及血清尿素氮(MD = -1.18, 95%CI: -2.31--0.06, P = 0.04)等指标均有明显改善, 但在改善门静脉主干内径以及血清肌酐方面无明显优势.
结论: 在常规病因治疗、限制水钠摄入, 白蛋白、利尿剂、预防感染及保肝药物治疗的基础上, 奥曲肽能显著提高肝硬化合并顽固性腹水患者治疗的有效率, 降低患者体质量, 腹水量, 缩小患者腹围, 明显改善患者24 h尿量以及血清尿素氮, 具有较为理想的治疗效果.
核心提示: 肝硬化顽固性腹水是肝硬化失代偿期肝功能明显障碍的表现, 预后差、死亡率高, 目前尚无特效药物治疗难治性腹水; 奥曲肽作为人工合成的八肽环状化合物, 其治疗作用有降低门静脉压力, 抑制肾素-血管紧张素-醛固酮系统, 同时具有抗损伤和肝细胞保护作用, 且较小剂量的在细胞水平减轻脂质过氧化造成的肝损伤, 因此, 在肝硬化腹水治疗的基础上加用小剂量奥曲肽是消除顽固性腹水较理想的治疗方法.
引文著录: 石光英, 袁泽, 杨丽丽, 谢敬东. 奥曲肽治疗肝硬化合并顽固性腹水的Meta分析. 世界华人消化杂志 2015; 23(27): 4411-4417
Revised: August 6, 2015
Accepted: August 17, 2015
Published online: September 28, 2015
AIM: To evaluate the efficacy and safety of octreotide in the treatment of cirrhosis with refractory ascites.
METHODS: PubMed, EMBASE, CBM, CNKI, VIP and Wanfang Database were searched to retrieved studies evaluating the efficacy of octreotide in the treatment of cirrhosis with refractory ascites. All the related data that met our standards were extracted. The quality of the included trials was evaluated according to the Jadad score. RevMan 5.2 software was used for meta-analysis.
RESULTS: A total of 9 randomized controlled trials involving 696 patients were included. The results of meta-analysis showed that the octreotide group was superior to the control group in treatment efficiency (OR = 3.18, 95%CI: 2.03-4.97, P < 0.00001), weight reduction (MD = -8.75, 95%CI: -11.25--6.25, P < 0.00001), ascites reduction (SMD = -31.8, 95%CI: -35.23--28.37, P < 0.00001), decreased abdominal girth (SMD = -8.75, 95%CI: -11.55--5.95, P < 0.00001), increased blood urea nitrogen (BUN) (MD = -1.18, 95%CI: -2.31--0.06, P = 0.04) and 24 h urine volume (SMD = 8.18, 95%CI: 3.69-12.67, P = 0.0004), but there was no statistical difference in serum creatinine (sCr) or portal vein trunk diameter (PVD).
CONCLUSION: Current evidence suggests that octreotide could improve treatment efficiency in terms of weight reduction, ascites reduction, decreased abdominal girth, increased BUN and 24 h urine volume.
- Citation: Shi GY, Yuan Z, Yang LL, Xie JD. Efficacy of octreotide for treatment of cirrhosis with refractory ascites: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4411-4417
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4411.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4411
腹水是肝硬化最常见的并发症, 是严重的肝功能损害和门静脉高压的结果. 肝硬化合并顽固性腹水是指对我们临床上常规使用的利尿剂耐受且腹水量较大并持续3 mo以上, 每日限制钠盐摄入88 mmol(5 g氯化钠), 并且使用最大剂量利尿剂(如螺内酯+呋塞米)仍无效, 尤其是对钠、水均不能耐受, 血钠含量<130 mmol/L, 尿钠含量<10 mmol/L, 尿钠含量/尿钾含量<1, 自由水清除率<1, 且肾血浆血流量及肾小球滤过率均低于正常水平[1]. 近些年来, 在肝硬化合并顽固性腹水的治疗手段方面取得了较大的进步, 如联合经颈静脉门体分流术, 腹腔静脉分流术, 腹水浓缩回输以及肝移植等技术, 然而这些有创性的治疗手段往往因为昂贵的治疗费用及紧缺的肝源而受到限制! 奥曲肽作为一种生长抑素同类物, 具有降低肝门静脉压力的作用, 报道[2,3]也揭示其在治疗胃底静脉曲张破裂等方面疗效甚佳, 但对肝硬化合并顽固性腹水的治疗缺乏高质量文献证据, 本文采用Meta分析系统地评价奥曲肽治疗肝硬化合并顽固性腹水的确切疗效, 为临床治疗提供高质量的循证医学证据.
计算机检索PubMed、EMBASE、中国生物医学文献数据库(Chinese BioMedical Literature Database, CBM)、中国期刊全文数据库(China National Knowledge Infrastructure, CNKI)、中文科技期刊全文数据库(VIP)、万方等数据库发表的有关奥曲肽治疗肝硬化合并顽固性腹水的临床研究. 检索词包括: Liver cirrhosis、Intractable ascite、Octreotide; 肝硬化、顽固性腹水和奥曲肽等.
1.2.1 文献纳入标准: (1)肝硬化合并顽固性腹水的诊断符合2009年美国肝病研究学会实践指南[4], 纳入的肝硬化合并顽固性腹水的患者均符合上述制定的诊断标准; (2)文献为随机对照临床试验(randomized control trials, RCT): 对照组为限制水钠摄入、白蛋白、利尿剂及保肝等常规基础治疗, 实验组是在对照组基础上加用小剂量奥曲肽(0.1 mg/次, 2次/d, 皮下注射14 d); (3)文献中含有治疗有效率、体质量、腹围、腹水量、24 h尿量、血清肌酐、血清尿素氮以及门静脉主干内径.
1.2.2 文献排除标准: (1)文献内容不符合临床治疗性文献或者仅是个案报道; (2)文献干预措施为单一治疗, 无对照; (3)不是关于肝硬化腹水临床研究的文献; (4)重复发表的文献, 选取其中数据最为全面的1篇, 其余排除.
1.2.3 文献的筛选: 所检索到的全部文章, 交由两名评价员依据文献纳入排除标准, 阅读文章标题、内容、摘要及全文后进行初筛, 对选中的文章运用Jadad质量记分法进行评分, 评分后提取所需相关数据资料, 如出现不一致则交由第三方进行处理解决. 若选中文献只有标题、摘要或没有出处, 则扩大数据库查找全文, 如仍无法检索到则放弃. Jadad评分分为1-5分(1-2分为低质量研究, 3-5分为高质量研究). 将≥2分的文献纳入此次研究进行Meta分析.
1.2.4 分析指标: 提高治疗肝硬化合并顽固性腹水的有效率; 体质量、腹围、腹水量、门静脉主干内径、24 h尿量、血清肌酐、血清尿素氮.
统计学处理 本次研究严格遵守制定的文献纳入排除标准, 保持较低临床异质性, 并将数据进行临床异质性分析, 对无明显统计学异质性及临床异质性的文献进行数据整合, 我们采用CochraneÐ作网的RevMan5.2软件进行Meta分析. 计数资料选用比值比(odds ratio, OR)以及95%可信区间(95% confidence interval, 95%CI), 计量资料选用加权均数差(weighted mean difference, WMD)及其95%CI作为治疗结果. 当数据结果显示统计学异质性I2<50%时, 我们选用固定效应模型, 如果I2>50%, 说明统计学异质性较明显, 则选用随机效应模型, 如果研究之间存在明显临床异质性或信息量不足时, 我们则对该研究进行描述性分析. P<0.05为差异有统计学意义.
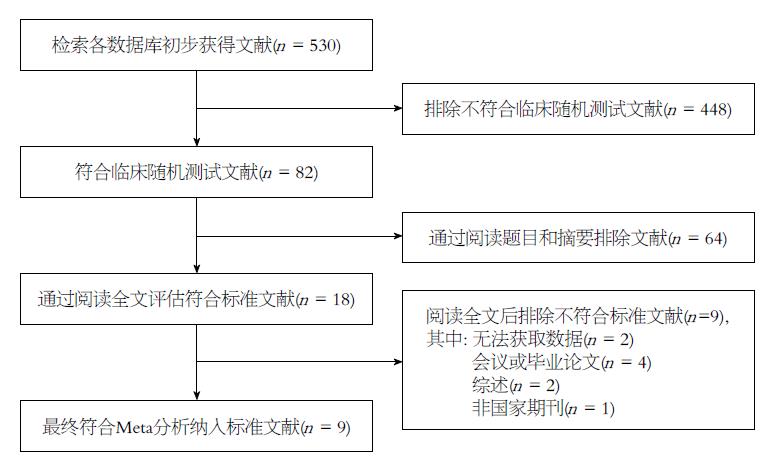
依据方法中阐述的检索方法, 我们共检出关于奥曲肽治疗肝硬化顽固性腹水的中英文文献共530篇, 其中非RCT中英文文献448篇, 还有82篇RCT中英文文献, 我们根据文献纳入排除标准, 阅读文献标题、内容、摘要以及全文, 排除经过Jadad评分法评分<2分的文献, 最终纳入相关RCT中文文献9篇[5-13], 总病患数为696例, 对照组340例, 实验组为356例, 两组基线数据之间无明显统计学差异. 纳入文献的质量评分2分2篇[5,12], 3分7篇[6-11,13]. 文献检索纳入的流程如图1.
纳入的9篇RCT文献中实验组与对照组基线数据之间无明显统计学差异, 对照组采用患者病因治疗, 限制水钠摄入, 白蛋白, 利尿剂及保肝等基础治疗. 纳入的9篇文献中Jadad评分结果为3分有7篇文献, 为高质量研究, 2分有2篇文献, 属于低质量研究, 纳入的9篇研究中的治疗疗程均在2-4 wk, 均缺乏长期有效的随访, 故无法评价药物的长期疗效及不良反应.
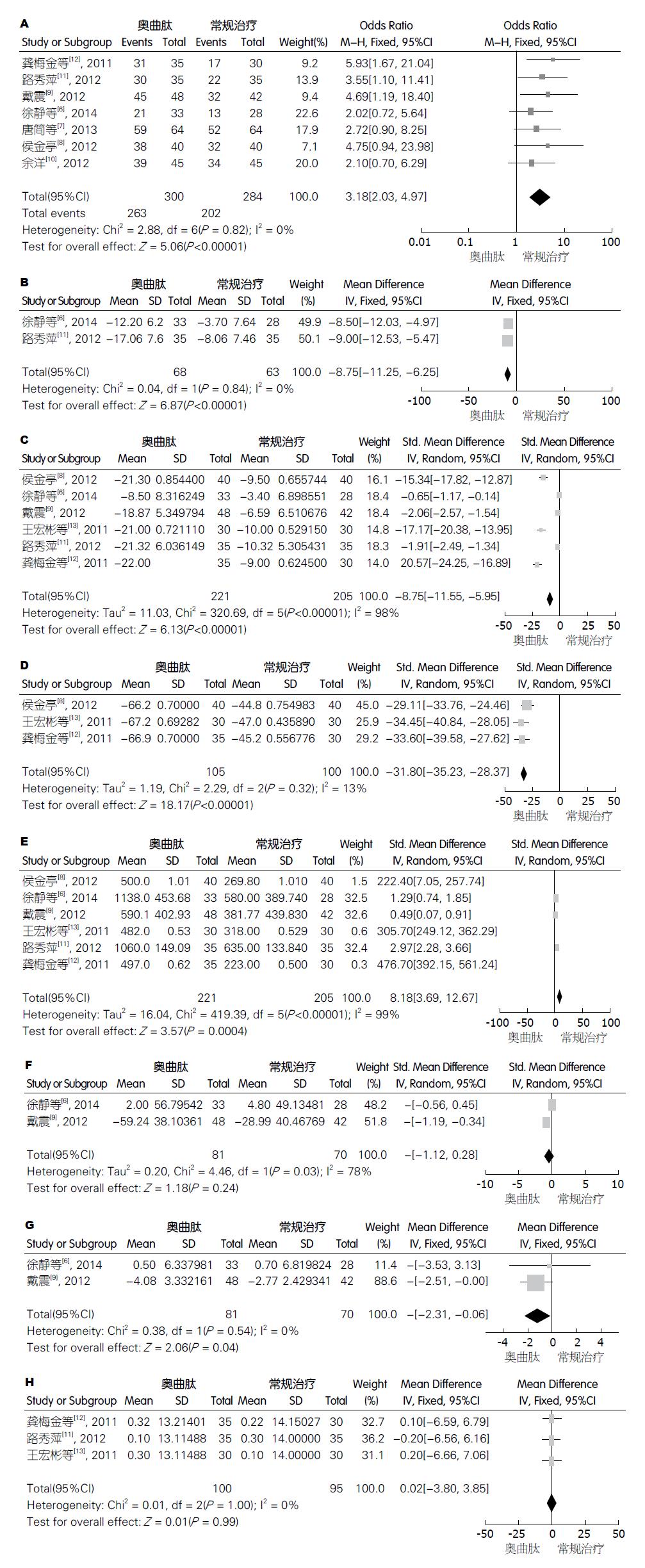
2.3.1 有效率: 纳入文献7篇[6-12], 异质性检验结果为Chi2 = 2.88, df = 6(P = 0.82), I2 = 0%, 表明研究同质性好, 故选用固定效应模型. 实验组的临床有效率明显高于对照组(OR = 3.18, 95%CI: 2.03-4.97, P<0.00001)(图2A)
2.3.2 体质量评价: 纳入文献2篇[6,11], 异质性检验结果为Chi2 = 0.04, df = 1(P = 0.84), I2 = 0%, 说明研究同质性好, 故选用固定效应模型. 实验组对于减轻患者体质量指标上比对照组效果更佳(MD = -8.75, 95%CI: -11.25--6.25, P<0.00001)(图2B), 且为有利结局.
2.3.3 腹围评价: 纳入文献6篇[6,8,9,11-13], 异质性检验Chi2 = 320.69, df = 5(P<0.00001), I2 = 98%, 故采用随机效应模型, 实验组对改善患者腹围指标上比对照组效果更佳(SMD = -8.75, 95%CI: -11.55--5.95, P<0.00001)(图2C), 且为有利结局.
2.3.4 腹水量评价: 纳入文献3篇[8,12,13], 异质性检验结果为Chi2 = 2.29, df = 2(P = 0.32), I2 = 13%, 故选用随机效应模型. 实验组对减轻患者腹水量指标上比对照组效果更佳(SMD = -31.8, 95%CI: -35.23--28.37, P<0.00001)(图2D), 且为有利结局.
2.3.5 24 h尿量评价: 纳入文献6篇[6,8,9,11-13], 异质性检验Chi2 = 419.39, df = 5(P<0.00001), I2 = 99%, 故采用随机效应模型. 实验组对改善患者24 h尿量指标上比对照组效果更佳(SMD = 8.18, 95%CI: 3.69-12.67, P = 0.0004)(图2E), 且为有利结局.
2.3.6 血清肌酐评价: 纳入文献2篇[6,9], 异质性检验结果为Chi2 = 4.46, df = 1(P = 0.03), I2 = 78%, 故选用随机效应模型, 实验组对改善患者血清肌酐指标上和对照组效果无差异(SMD = -0.42, 95%CI: -1.12-0.28, P = 0.24)(图2F).
2.3.7 血清尿素氮评价: 纳入文献2篇[6,9], 异质性检验结果为Chi2 = 0.38, df = 1(P = 0.54), I2 = 0%, 故选用固定效应模型. 实验组对改善患者血清尿素氮指标上比对照组效果更佳(MD = -1.18, 95%CI: -2.31--0.06, P = 0.04)(图2G), 且为有利结局.
2.3.8 门静脉主干内径评价: 纳入文献3篇[11-13], 异质性检验Chi2 = 0.01, df = 2(P = 1.00), I2 = 0%, 故采用固定效应模型. 实验组对改善患者门静脉主干内径指标上与对照组没有明显差异(MD = 0.02, 95%CI: -3.80-3.85, P = 0.99)(图2H).
肝硬化腹水作为肝硬化失代偿期的主要表现, 形成机制极其复杂, 通常是由于醛固酮分泌过多导致水钠潴留、利钠激素减少导致钠潴留、门脉高压、低蛋白血症、肝硬化结节压迫血窦等多种因素共同作用的结果. 顽固性腹水的形成机制主要归因于循环功能的恶化, 主要表现在有效循环血量的下降, 使肾素-血管紧张素-醛固酮系统继发性激活, 收缩肾血管, 促使肾功能恶化, 导致水钠潴留.
肝硬化顽固性腹水包括利尿剂难治性腹水和利尿剂抵抗性腹水, 在治疗上两者均需强化利尿剂治疗近年来顽固性腹水的治疗包括: 经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt, TIPS)、腹腔穿刺放液治疗加白蛋白输注、自体腹水过滤浓缩回输、肝移植等, TIPS在临床上治疗有效, 但肝性脑病的频发限制其在临床工作中的广泛应用; 反复腹腔穿刺放液治疗效果欠佳, 易发生医源性感染和腹水复发, 且部分患者心理难以接受; 自体腹水过滤浓缩回输及肝移植是治疗最有效的办法, 因其价格昂贵, 故而限制了其在临床工作中的广泛应用.
奥曲肽作为一种新型人工合成的生长抑素, 其药理作用与生长抑素相似但作用时间更长久. 其作用机制包括: (1)直接作用于内脏血管平滑肌, 收缩血管[14,15]; (2)通过抑制血管活性肠肽、胰高血糖素的分泌和拮抗胰高血糖素对内脏血管的扩张作用, 收缩胃肠道、门静脉及脾静脉主干血管, 降低门静脉压力, 减少腹水生成, 但其对全身血流动力学不产生明显的影响[16,17]; (3)加强机体对利尿剂的反应同时明显减少肾素-血管紧张素的分泌, 促进水钠排出, 使尿量增加, 减少腹水的生成, 已有诸多研究[5-17]报道了奥曲肽治疗肝硬化合并顽固性腹水的临床研究, 但由于这些临床研究质量不高导致对于临床证据性差, 故本研究采用Meta分析这一定量工具将现目前关于奥曲肽治疗肝硬化顽固性腹水的临床研究的数据进行整合, 运用系统评价来检测奥曲肽治疗肝硬化顽固性腹水的确切疗效, 为临床治疗提供高质量的循证医学证据.
Meta分析结果显示: (1)在常规治疗基础上加用奥曲肽治疗的有效率显著高于常规治疗; (2)加用奥曲肽的实验组在减轻患者体质量、腹水量以及缩小患者腹围的效果均优于常规治疗组; (3)加用奥曲肽的实验组在增加患者24 h尿量以及改善患者、血清尿素氮等指标上均优于常规治疗组; (4)加用奥曲肽的实验组在改善门静脉主干内径及血清肌酐指标上面的效果与常规治疗组相比没有明显差异.
本Meta分析纳入研究中, 在9篇RCT中报告具体随机方法的只有1篇、9篇RCT均未报告分配隐藏以及盲法, 固对于治疗有效率等指标可能存在实施和测量偏倚, 低质量研究的Meta分析也有高估疗效的可能, 根据现目前纳入研究情况来看, 大部分研究在方法学上未严格按照随机对照试验设计方法执行, 希望以后的临床试验应尽量采用正确的随机分配的方法、隐蔽分组及盲法, 此外应尽量规范操作以减少各种偏倚的产生.
总之, 当前证据表明: 奥曲肽提高肝硬化合并顽固性腹水疗效方面具有较好的作用, 安全性较高; 在常规病因治疗, 限制水钠摄入, 采用白蛋白, 利尿剂及保肝药物治疗的基础上, 奥曲肽能显著提高肝硬化合并顽固性腹水患者治疗的有效率, 降低患者体质量、腹水量, 缩小患者腹围, 明显改善患者24 h尿量以及血清尿素氮. 但因本文纳入的研究数量较少, 仍有待大样本的随机试验进一步论证.
肝硬化顽固性腹水通常是晚期肝硬化患者腹水持续不退, 经正规治疗达3 mo以上而无效者, 占肝硬化的并发症约16.1%, 是肝硬化失代偿期肝功能明显障碍的表现, 此阶段易出现各种并发症, 预后差, 死亡率高. 如果能够有效治疗或控制肝硬化顽固性腹水, 对延长患者生命, 提高生存质量, 具有重要的意义.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
肝硬化顽固性腹水的治疗包括多次反复治疗性腹腔穿刺放液、经颈静脉门体分流术、腹水浓缩回输及肝移植. 目前药物治疗主要针对改善肾脏血供以及选择性血管加压素V2受体拮抗剂, 而针对门静脉高压致顽固性腹水的药物研究并不多. 奥曲肽作为人工合成的八肽环状化合物, 具有作用强且持久、不良反应少的特性, 其有效降低门静脉压、收缩内脏血管等作用已收到国内外学者的广泛认同.
国内外相关报道中指出, 顽固性腹水患者皮下注射奥曲肽治疗后能够改善血流动力学和肾功能, 同时增加对利尿剂的反应, 明显减少肾素-血管紧张素的分泌, 从而显著提高肝硬化顽固性腹水患者治疗的有效率, 与本研究结果相似.
奥曲肽联合病因及基础肝硬化腹水的治疗, 能显著提高顽固性腹水患者治疗的有效率, 更有利于腹水的消退.
门静脉主干内径: 采用多普勒超声法来评价. 应用二维超声测定门静脉主干和脾静脉内径后, 观察肝内门静脉声像图特征; 用彩色多普勒超声观察血流方向, 在其引导下取得满意频谱, 测定血流峰值速度、平均速度、门静脉血流量和脾静脉血流量及其他常用评价指标. 门静脉直径正常为1.1 cm±0.2 cm, >1.3 cm为可疑, >1.5 cm诊断为门静脉高压.
本文采用Meta分析方法评估奥曲肽对肝硬化合并顽固性腹水的治疗效果, 对临床工作有一定参考价值.
编辑: 郭鹏 电编: 都珍珍
| 3. | 祝 龙娟. 奥曲肽治疗食管静脉曲张破裂出血临床分析. 中国民族民间医药杂志. 2010;19:137. |
| 4. | Runyon BA. Management of adult patients with ascites due to cirrhosis: an update. Hepatology. 2009;49:2087-2107. [PubMed] [DOI] |
| 14. | Spahr L, Giostra E, Mentha G, Hadengue A. Octreotide bolus injection and azygos blood flow in patients with cirrhosis: is the effect really predictable? J Clin Gastroenterol. 2010;44:e206-e209. [PubMed] [DOI] |
| 16. | Kalambokis G, Fotopoulos A, Economou M, Tsianos EV. Octreotide in the treatment of refractory ascites of cirrhosis. Scand J Gastroenterol. 2006;41:118-121. [PubMed] |