修回日期: 2015-07-16
接受日期: 2015-07-24
在线出版日期: 2015-09-08
目的: 探究建立可复性梗阻性黄疸大鼠模型并评价临床实用价值.
方法: "胆管结扎支撑管拔除法"建立可复性梗阻性黄疸大鼠模型. 将Wistar大鼠32只, 随机分为可复性梗阻性黄疸组(ROJ组)和梗阻性黄疸组(OJ组). ROJ组大鼠将胆总管与PICC导管并行结扎致胆管梗阻, 5 d后拔出PICC导管完成胆管再通, OJ组制成完全梗阻性黄疸模型. 两组大鼠分别于术后5 d和8 d各处死8只, 分别标记为ROJ5组、ROJ8组、OJ5组和OJ8组. 每只大鼠于术前、术后第5天(拔管前)、第6天、第8天分别采血测定血总胆红素(total bilirubin, TBIL)、谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)水平, 肠黏膜组织切片经HE染色, 观察小肠黏膜形态学变化及损害情况.
结果: ROJ5组与OJ5组相比, 模型建立后5 d血TBIL、ALT和ALP变化规律相似, 各时间点两者肝功能指标不存在差异, 模型取出支撑管3 d后, 血TBIL、ALT和ALP迅速恢复, 肠黏膜损害也较前明显减轻; ROJ8组的肠黏膜损伤指数明显低于OJ8组, 差异有统计学意义.
结论: "胆管结扎支撑管拔除法"制作的可复性黄疸模型, 是一种稳定可靠的可复性梗阻性黄疸大鼠模型.
核心提示: "胆管结扎加支撑管拔除法"制作的可复性黄疸模型与传统的梗阻性黄疸模型相比, 更加贴近梗阻性黄疸的临床发展过程和治疗过程, 更加符合梗阻性黄疸研究的需要. 模型制作简便, 解除黄疸不需二次开腹手术, 创伤小、成功率高、死亡率低, 是一种稳定可靠的可复性梗阻性黄疸大鼠模型.
引文著录: 方辉, 陈强谱, 张兴元, 张帆, 张长习, 卢艳敏, 赵亮, 袁帅. 可复性梗阻性黄疸大鼠模型的建立与评价. 世界华人消化杂志 2015; 23(25): 4015-4023
Revised: July 16, 2015
Accepted: July 24, 2015
Published online: September 8, 2015
AIM: To establish a rat model of reversible obstructive jaundice and to evaluate its clinical practical value.
METHODS: Thirty-two Wistar rats were randomly divided into a reversible obstructive jaundice group (ROJ) and an obstructive jaundice group (OJ). In the ROJ group, bile duct obstruction was induced by ligation of the bile duct and a PICC catheter in parallel. After 5 d, the PICC catheter was pulled out to allow the recanalization of the bile duct. In the OJ group, complete obstructive jaundice was induced. Eight rats from each group were sacrificed on days 5 and 8, respectively, which were designated as ROJ5, ROJ8, OJ5 and OJ8, respectively. Serum total bilirubin (TBIL), alanine aminotransferase (ALT) and alkaline phosphatase (ALP) levels were measured before operation and on days 5, 6 and 8 after operation. Intestinal mucosal tissue samples were taken and stained with hematoxylin and eosin to observe the changes in intestinal mucosal morphology and damage.
RESULTS: The changes in serum TBIL, ALT and ALP in the ROJ5 group were similar to those in the OJ5 group on day 5 after the model establishment, and there was no difference in liver function parameters between the two groups at each time point. Three days after the catheter was removed in the ROJ group, serum levels of TBIL, ALT and ALP quickly recovered, and the damage of the intestinal mucosa was significantly reduced. The intestinal mucosal injury index in the ROJ8 group was significantly lower than that in the OJ8 group.
CONCLUSION: The rat model of reversible obstructive jaundice developed by "ligation of the bile duct and removal of support catheter" is a stable and reliable animal model.
- Citation: Fang H, Chen QP, Zhang XY, Zhang F, Zhang CX, Lu YM, Zhao L, Yuan S. Establishment and evaluation of a rat model of reversible obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2015; 23(25): 4015-4023
- URL: https://www.wjgnet.com/1009-3079/full/v23/i25/4015.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i25.4015
梗阻性黄疸是由于肝内外胆管完全或不完全梗阻引起胆汁引流障碍而出现全身病理生理改变的一类临床常见疾病. 常见的原因有肿瘤、结石、炎症、狭窄等. 通过手术或内镜方法解除梗阻、畅通引流是梗阻性黄疸最根本的治疗措施. 梗阻性黄疸时肠黏膜上皮结构的完整性遭到严重破坏, 肠黏膜通透性也发生明显改变[1-4]. 肠黏膜屏障功能已经成为判断梗阻性黄疸患者预后的重要参考指标, 肠道不但是多脏器功能障碍发生的靶器官, 更是多器官功能障碍综合征(multiple organ disfunction syndrome, MODS)的"启动器". 关于梗阻性黄疸与肠黏膜屏障的研究也已经成为临床医学研究的重要领域.
为更好的研究梗阻性黄疸对肠黏膜屏障损害的病理生理机制, 文献报道有多种建立梗阻性黄疸模型的方法, 但这些方法均不能很好地契合临床梗阻性黄疸疾病的发生及发展过程. 为了寻找更加符合临床病理生理改变的梗阻性黄疸模型, 我们经过反复尝试, 最终建立了一种新的可复性梗阻性黄疸大鼠模型.
实验动物选择无特定病原体(specific pathogen free, SPF)♂Wistar大鼠32只, 由山东鲁抗医疗股份有限公司供应, 质量许可证号: SCXK鲁20130001, 约2.5-3.0月龄, 体质量280-330 g. 置于温度22-26 ℃、湿度40%-70%, 12 h白-黑周期的安静、通风标准环境中分笼喂养, 自由进食及饮水. 动物实验严格遵守国家对动物管理的各项规定, 实验过程及手术器械严格遵守无菌技术要求.
实验仪器及试剂有4F外周穿刺中心静脉导管(PICC)(美国BD医疗器械公司), 3-0不可吸收聚丙烯手术缝合线即Proline血管缝线(蓝色, 美国Sharpoint公司生产), 脉动真空高压蒸汽灭菌器(山东新华医疗器械公司), 复尔凯空肠造口穿刺套管针(纽迪希亚制药无锡有限公司), 精细手术器械(滨州医学院附属医院临床医学实验室提供), 10%水合氯醛溶液(滨州医学院附属医院提供).
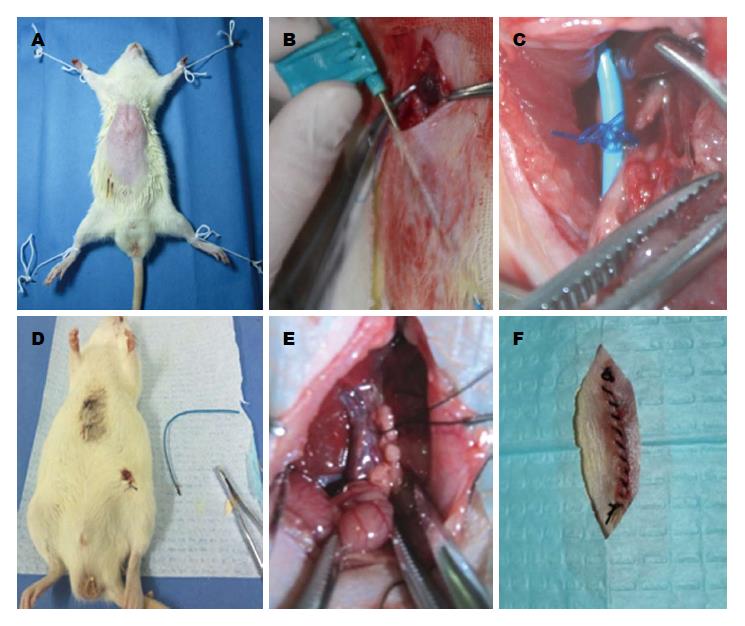
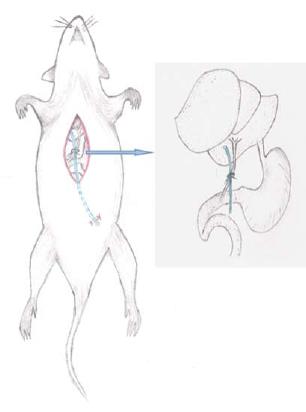
1.2.1 可复性梗阻性黄疸模型的建立: (1)大鼠于实验手术前禁食12 h, 自由饮水, 称质量后以10%水合氯醛(0.3 mL/100 g)行腹腔注射麻醉; (2)将大鼠固定在超净工作台上, 上腹部剑突以下上腹部常规备皮, 无菌条件下以稀碘伏及酒精棉球分别消毒术区3遍(图1A); (3)取剑突下、脐上腹部正中纵行手术切口约2.0-2.5 cm入腹, 自十二指肠与胆管交汇处找到胆管, 进一步显露肝门及门静脉, 仔细游离胆管至肝门, 在胆管远端距肝门约1.0 cm处以3-0不可吸收聚丙烯缝线将胆管与4F PICC导管一并三叠结结扎, 力度适中, 以丝线结扎后所形成的线圈将胆管正好闭合为度; (4)用复尔凯空肠造口穿刺套管针自切口下缘经腹部皮下隧道至左下腹部穿出, 拔出针芯, PICC导管近小肠端导入套管针自切口下部引出潜行至左下腹部, 以2-0慕丝线将PICC导管末端固定在皮下, 关闭切口完成包埋, 其肝门端游离于腹腔(图1B, C); (5)实验动物术中腹腔注射5万单位青霉素预防感染, 依次双层关腹(图1F). 术后5 h进水, 20 h进食, 术后置于标准环境中单笼饲养; (6)大鼠术后第5天, 首先以碘伏、酒精消毒左下腹部皮肤, 自左下腹部切口打开皮下, 拆除固定PICC导管末端的缝线, 以钳子夹住导管末端轻轻向外拔出PICC导管完成胆管再通, 以无菌敷贴覆盖拔管切口, 牢固固定(图1D, 2).
1.2.2 模型评价及观测指标: 研究对象及分组: SPF♂Wistar大鼠32只在标准条件下适应性喂养2 wk, 采用随机数字表法将实验大鼠分成2组: 可复性梗阻性黄疸模型组(ROJ组)和传统梗阻性黄疸模型组(OJ组), 每组16只.
动物模型的建立: 大鼠术前禁食12 h, 自由饮水, 称质量后以10%水合氯醛(0.3 mL/100 g)行腹腔注射麻醉, 将大鼠固定在超净工作台上, 上腹部剑突以下备皮, 以稀碘伏及酒精棉球分别消毒术区3遍, 取脐上腹正中纵行手术切口2.0-2.5 cm入腹, 自十二指肠与胆管交汇处找到胆管, 进一步显露肝门及门静脉, 仔细游离胆管至肝门, ROJ组建成可复性梗阻性黄疸模型. OJ组游离胆管至肝门, 以3-0单慕丝线结扎(图1E). 所有动物术中腹腔注射5万单位青霉素预防感染, 依次双层关腹. 两组大鼠分别于术后5 d和8 d各处死8只, 分别标记为ROJ5组、ROJ8组、OJ5组和OJ8组. 放血法处死, 剖腹探查观察胆管梗阻情况, 并取标本. 术后5 h进水, 20 h进食, 所有动物置于相同标准条件下单笼饲养. ROJ组大鼠术后第5天, 自左下腹部切口打开皮下轻轻拔出PICC导管完成胆管再通(图1D).
1.2.3 观测指标: 一般情况及血液生化分析: 术后观察动物的活动状态, 进食及黄疸出现的时间及变化, 体质量的变化及动物死亡数量. 每只大鼠于术前、术后第5天(拔管前)、第6天、第8天分别采血测定血清胆红素水平, 除开腹时自下腔静脉采血外, 其余均采用断尾取血约2.0 mL. 所取血样均在室温下3000 r/min离心15 min, 取1.0 mL血清用EP管保存. 应用美国Beckman Coulter全自动生化分析仪行血清总胆红素(total bilirubin, TBIL)、谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)生化指标检查.
肠黏膜石蜡切片HE染色及观察: 取小肠黏膜标本制作石蜡切片, 经苏木精-伊红(HE)染色, 光镜下观察大鼠肠黏膜组织形态学变化. 应用Motic医学图像分析系统(MMD6.0A)分别测定肠绒毛的垂直高度及隐窝的深度. 小肠绒毛高度的计算为肠上皮绒毛尖端至绒毛基底部的垂直距离, 隐窝深度为小肠腺基底部至两绒毛之间基底开口处的垂直距离. 每个视野选取连续5个100倍视野下排列的小肠绒毛高度和隐窝深度, 测量后计算其平均值.
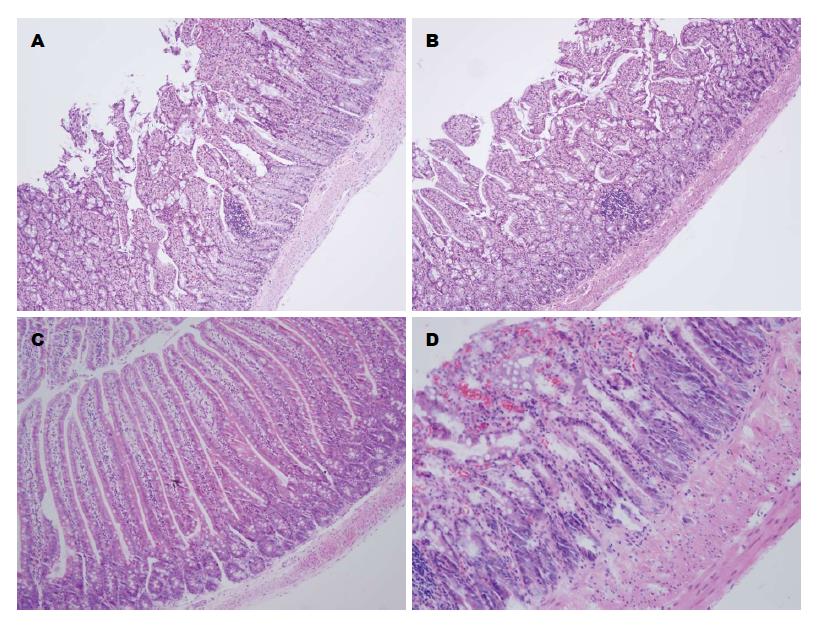
肠上皮损伤指数评估: 石蜡切片HE染色后光镜下根据Chiu等[5]描述的肠黏膜损伤分级进行肠黏膜损伤程度的评估. 评分标准: 0级为正常肠黏膜绒毛; 1级为绒毛顶端上皮下间隙增大伴毛细血管充血; 2级为绒毛顶端上皮下间隙进一步增加, 伴有中等程度上皮层从黏膜固有层分离; 3级为大量上皮层从绒毛侧面分离并伴有有少量绒毛脱落; 4级为大片绒毛脱落和固有膜裸露, 合并暴露的毛细血管, 固有层细胞结构增多较为显著; 5级为固有层的消化、分解, 合并有出血和溃疡改变.
统计学处理 采用SPSS17.0统计软件进行统计分析, 计量资料以mean±SD表示. 采用t检验, P<0.05为差异有统计学意义.
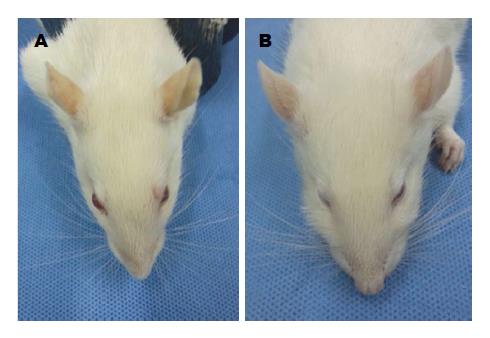
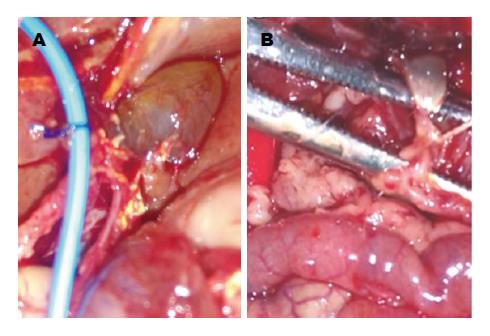
ROJ组及OJ组分别于术后第4、6天各死亡1只, 死因为术后肠梗阻及肠坏死. 实验大鼠术后1-2 h大鼠能够自主活动, 术后1-3 d体质量有明显的下降趋势, 拔管后体质量增加明显. 实验动物术后活动明显受限, 神志较差, ROJ组拔管后有明显好转. 肉眼观大鼠胆管结扎术后第1天即出现轻度黄疸, 以耳朵及皮毛为著, 呈进行性加重, 术后第3天黄染程度较高, 伴有豆油色尿及白色稀便, ROJ组大鼠拔管后黄疸逐步减退, 术后1 wk未见明显黄疸(图3). 术后第5天解剖大鼠发现胆管结扎部位以上扩张明显, 直径约8.0-10.0 mm, 呈半透明囊状. ROJ组大鼠术后第8天发现胆管未见明显扩张, OJ组扩张更明显(图4).
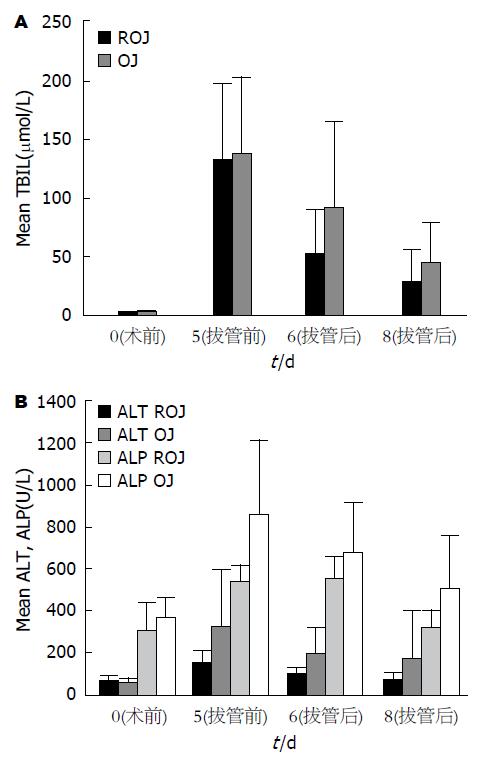
ROJ组和OJ组动物术后血清TBIL水平均有升高, 术后第5天测得值最高, 之后逐渐降低, 术后1 wk略高于正常. ALT及ALP水平变化趋势基本同胆红素变化(图5).
ROJ5组和OJ5组实验大鼠小肠绒毛高柱状结构排列轻度紊乱, 黏膜腺体较稀疏, 少量可见中性粒细胞浸润和间质轻度水肿. ROJ8组大鼠小肠黏膜结构基本完整、连续, 小肠绒毛高柱状结构可见, 排列不整齐, 隐窝间隙轻度增宽, 腺细胞结构欠规整. OJ8组小肠黏膜结构重度紊乱, 小肠绒毛高柱状结构不可见, 大量中性粒细胞及炎细胞浸润, 间质及黏膜固有层局部充血、水肿较重, 可见血管结构破坏(图6). 各组肠黏膜损伤指数、绒毛高度及隐窝深度对比如表1.
近年来关于梗阻性黄疸的研究日益增多, 建立动物模型是实验研究的重要手段, 并且模型设计方案的优劣直接关系到最终实验结论的准确性[6]. 文献报道有多种建立梗阻性黄疸模型的方法, 主要分为传统梗阻性黄疸模型和可复性梗阻性黄疸模型. 传统梗阻性黄疸模型与临床上大多梗阻性黄疸疾病的症状表现不甚相符[7], 而关于可复性梗阻性黄疸模型的研究相对较少.
研究发现, 梗阻性黄疸引起的肠黏膜通透性增加是促使细菌移位和内毒素血症的重要因素. 肝内外胆管的阻塞主要影响肠上皮细胞和紧密连接的正常结构和功能, 继而由于肠腔内胆汁量的减少导致肠黏膜细胞增殖下降和细胞凋亡增加也是引起肠屏障功能障碍的重要原因[8], 此外还伴有多种炎症介质和细胞因子的产生, 若不及时治疗易引起一系列全身病理生理改变, 严重者出现MODS[9]. 由于胆管阻塞引起的梗阻性黄疸对机体的损害在一定程度上是可逆的, 当解除胆管梗阻的因素后, 肝脏等器官能够恢复到接近正常的组织学结构或原来的生物学功能[10], 因此在临床上对于绝大多数胆管梗阻引起的梗阻性黄疸的治疗首选手术或内镜解除梗阻畅通引流, 后期由于黄疸引起的症状或并发症在一定程度上也会得到相应的缓解或治愈.
传统的梗阻性黄疸大鼠模型的建立[11]都是将胆管直接结扎, 以阻断胆汁的排泄导致胆红素迅速入血, 这是一种急性梗阻的黄疸模型, 并在基础实验中被广泛使用[12-15], 而在临床上梗阻性黄疸的进展基本都是呈慢性渐进性过程, 并且随着社会的进步和医疗水平的提高, 很多黄疸患者在发病初期即梗阻性黄疸早期就会及时就诊, 采取相应的措施进行治疗. 因此传统的胆管结扎黄疸模型已经不能满足目前对梗阻性黄疸研究的需求, 也不能很好地反映临床常见黄疸疾病的发生及发展过程[16]. 基于这一问题, 我们设想建立一种可复性梗阻性黄疸大鼠动物模型以更好的模拟临床梗阻性黄疸疾病的病理生理演变过程.
文献报道中已有多种实现梗阻性黄疸逐渐发生或梗阻再通的方法, 主要分为悬吊胆管或胆汁内外引流, 但是这些方案都存在着一些不足和问题. 电凝烧灼胆管[17]或肝门接种瘤株[18]的方式是一种慢性渐进性或恶性胆管梗阻的良好模型, 韩新令等[19]、Heinrich等[20]及陈文斌等[21]部分阻断胆管的方法是一种胆汁淤积的急性模型, 林薇等[22]通过给予狗胆管壁内注射稀释的甲醛溶液建立的是难治性黄疸的动物模型, 这些与完全性胆管结扎模型没有根本的区别, 但是其引起的肝功能的损伤相对较轻. 余水平等[23]采用的慢性梗阻性黄疸模型通过在胆管内置入经碘仿纱布处理的6-0 VICRYL可吸收线, 如此较好的呈现了某些壶腹部肿瘤压迫胆管引起的波动性黄疸, 但不具可恢复性, 虽然一段时间后胆红素水平表现为轻度降低, 但是仍然与正常大鼠的胆红素水平有较大的差距. 通过胆汁外引流的方式建立的黄疸模型, 一方面在实施过程中存在胆管过细插管困难的问题, 另外这种模型与临床患者相比, 并不符合我们胆汁再通的目的, 其实质是胆汁外引流达到减黄的作用[24,25]. 通过插管或胆肠吻合实现胆汁内引流的手术方式存在二次手术的风险, 严重影响实验正常进行及动物的术后生存率; 其次在大鼠胆管结扎一段时间后, 胆管扩张明显, 胆管壁菲薄, 存在插管困难及刺破胆管壁的可能, 也大大降低了模型的可操作性[26]. 而Oruç等[27]建立的模型的创新点在于纵行剖开长约0.5 cm静脉留置针套管附着于胆总管之上, 然后通过丝线将其结扎, 通过再次切断线结达到通畅胆管引流的目的, 一定程度上有效保护了胆管但也同样存在二次开腹的问题. 智绪亭等[28]通过悬吊胆总管而建立的黄疸模型虽具有一定的可复性, 但是由于受动物体位或活动的影响, 其悬吊胶管的紧张度不易控制. 王勇等[29]通过丝线悬吊大鼠胆总管实现胆管梗阻-再通的实验方法也存在同样的问题. Kahramansoy等[30]通过可吸收线结扎胆管, 3 wk后大鼠的肝功能及胆红素水平较对照组有明显缓解, 不施加任何干预即解除梗阻其操作方法简便, 但由于受动物个体差异的影响及其梗阻引起的黄疸过程过长, 并发症相应的增多. 王天然等[31]用止血钳钳夹胆总管形成的兔可逆型梗阻性黄疸模型在钳夹动物胆管的程度不易量化, 并且梗阻性黄疸和再通的程度也因动物个体差异而影响模型的稳定性. 肖敏等[32]通过在健康版纳猪经胆囊内foley尿管将胆道取石球囊由胆囊管送入胆总管, 通过控制球囊的空虚间接达到胆道梗阻和再通的目的, 这种方法科学且合理, 但是因为大鼠无胆囊其胆管直径仅约0.3 cm, 无法达到上述目的, 操作性差, 耗费较高. 总之, 这些模型的主要问题是: (1)不符合临床上梗阻性黄疸发生发展的过程; (2)术后全身并发症多、死亡率高; (3)手术操作过程相对比较复杂、困难.
为了寻找更加符合临床病理生理改变的梗阻性黄疸实验模型, 我们经过反复尝试设计了一种新型的可复性梗阻性黄疸大鼠模型的方法称为"胆管结扎支撑管拔除法". 模型建立的基本原理是先用一支撑物与大鼠胆管并行并结扎胆管和支撑物, 数天后拔出支撑物, 解除对胆管的压迫使其恢复正常, 重新形成通畅的胆汁引流. 在探索的过程中主要克服了如下几个问题: 第一, 关于胆管结扎线的选取, 最先采用普通的手术用慕丝线结扎胆管, 由于大鼠腹腔液的影响使得丝线变涩, 导致导管拔出困难、胆管狭窄梗阻或丝线将胆管切断的后果, 随后采用血管缝合线各种型号来反复摸索, 最终发现用3-0血管缝线以三叠结结扎胆管与支撑管, 丝线结扎后所形成的线圈将胆管正好闭合的方法在结扎胆管形成的线圈紧张度和粗细程度上做到了较好的平衡, 保证最终支撑管既能结扎牢靠形成黄疸又能顺利拔出防止狭窄达到再通的目的; 第二, 关于支撑物的选取, 支撑物开始采用了插管常用的硬膜外导管, 但是由于其材质较硬, 本身大鼠腹腔体积较局限, 极其容易曲折导致胆管不能维持正常的生理位置而影响后期黄疸的观察, 最终我们采用了BD公司生产的4F PICC导管作为支撑物, 该导管为硅胶材质, 韧性较好, 柔软度高, 且直径与胆管相仿, 经过多次结扎线圈与拔管的尝试, 最终顺利用于可复性梗阻性黄疸模型的制作中. 而建立皮下隧道预埋PICC导管的方式则来源于Wang等[33]的设计, 同时我们初期也进行了尝试颈背部埋管的方法, 最后发现, 管道末端位于左下腹部的埋伏更加牢固和易于拔出.
可复性梗阻性黄疽模型与经典阻塞性黄疽模型相比, 在模型建立后5 d TBIL、ALT和ALP变化规律相似, 各时间点两者肝功能指标不存在差异, 提示改进的可复性阻塞性黄疽模型肝功能指标与经典模型相似, 表明梗阻性黄疸模型建立成功; 传统胆管结扎模型对肠黏膜损害较重且呈急性进展, 改进的阻黄模型取出支撑管3 d后, 血清TBIL、ALT和ALP迅速恢复, 肠黏膜损害也较前明显减轻, 说明拔出支撑管后胆总管的通畅性得到一定程度的恢复, 在对肠黏膜损害的进展与临床更为接近. 本实验中ROJ5组与OJ5组在肠黏膜损伤指数的比较上差异无明显统计学意义, 但是在梗阻因素解除后术后第8天ROJ8组与OJ8组的肠黏膜损伤程度有明显统计学意义, 这一实验结果与临床患者行胆总管切开取石、胆肠吻合手术后的机体变化一致性更高, 为临床上胆道再通术后一系列问题的研究提供了良好条件.
总之, "胆管结扎加支撑管拔除法"制作的可复性黄疸模型与传统的梗阻性黄疸模型相比, 本模型更加贴近梗阻性黄疸的临床发展过程和治疗过程, 更加符合梗阻性黄疸研究的需要. 模型制作简便, 解除黄疸不需二次开腹手术, 创伤小、成功率高、死亡率低, 是一种稳定可靠的可复性梗阻性黄疸大鼠模型. 该模型的建立为研究梗阻性黄疸对肠黏膜损害的相关问题提供了一种新的途径和手段.
建立动物模型是实验研究的重要手段, 并且模型设计方案的优劣直接关系到最终实验结论的准确性. 传统梗阻性黄疸模型与临床上大多梗阻性黄疸疾病的症状表现不甚相符, 而关于可复性梗阻性黄疸模型的研究相对较少. 本研究设想建立一种可复性梗阻性黄疸大鼠动物模型更好的模拟临床梗阻性黄疸疾病的病理生理过程.
刘连新, 教授, 哈尔滨医科大学第一临床医学院
梗阻性黄疸是一类临床常见疾病. 梗阻性黄疸时肠黏膜上皮结构的完整性遭到严重破坏, 肠黏膜通透性也发生明显改变. 肠黏膜屏障功能已经成为判断梗阻性黄疸患者预后的重要参考指标, 关于梗阻性黄疸与肠黏膜屏障的研究也已经成为临床医学研究的重要领域.
文献报道有多种建立梗阻性黄疸模型的方法, 主要分为传统梗阻性黄疸模型和可复性梗阻性黄疸模型, 其中也有多种实现梗阻性黄疸逐渐发生或梗阻再通的方法, 主要分为悬吊胆管或胆汁内外引流.
"胆管结扎加支撑管拔除法"制作的可复性黄疸模型制作简便, 解除黄疸不需二次开腹手术, 创伤小、成功率高、死亡率低, 是一种稳定可靠的的可复性梗阻性黄疸大鼠模型.
新建的可复性黄疸模型更加符合临床病理生理改变的梗阻性黄疸实验模型, 该模型的建立为研究梗阻性黄疸对肠黏膜损害相关问题提供了一种新的途径和手段.
"胆管结扎支撑管拔除法": "胆管结扎支撑管拔除法"建立可复性梗阻性黄疸大鼠模型的基本原理是先用一支撑物与大鼠胆管并行并结扎胆管和支撑物, 数天后拔出支撑物, 解除对胆管的压迫使其恢复正常, 重新形成通畅的胆汁引流.
本研究针对大鼠可复性梗阻性黄疸动物模型进行研究, 自行设计了一种支撑管固定胆总管的方法来制作黄疸模型和可复性模型. 文章的设计有一定的科学性和先进性, 是一种有潜在价值的临床研究模型, 对于临床工作有一定的帮助.
编辑: 韦元涛 电编: 都珍珍
| 1. | Abdeldayem H, Ghoneim E, Refaei AA, Abou-Gabal A. Obstructive jaundice promotes intestinal-barrier dysfunction and bacterial translocation: experimental study. Hepatol Int. 2007;1:444-448. [PubMed] [DOI] |
| 2. | Kaya O, Ozdemir F, Atli M, Aslan V, Cağatay M, Anlar M, Alper M. The effects of ciprofloxacin and ursodeoxycholic acid on bacterial translocation in obstructive jaundice. Turk J Gastroenterol. 2009;20:186-191. [PubMed] |
| 5. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 7. | 陈 孝平, 汪 建平. 外科学. 第8版. 北京: 人民卫生出版社 2013; 456. |
| 9. | 吴 鹏, 陈 强谱, 张 兴元, 张 帆, 夏 国华, 林 绪涛, 黄 椠. 梗阻性黄疸对大鼠肠黏膜上皮细胞紧密接蛋白ZO-1和肠黏膜通透性的影响. 中华临床医师杂志. 2010;4:2546-2548. |
| 10. | Tag CG, Weiskirchen S, Hittatiya K, Tacke F, Tolba RH, Weiskirchen R. Induction of experimental obstructive cholestasis in mice. Lab Anim. 2015;49:70-80. [PubMed] [DOI] |
| 11. | Cameron GR, Oakley CL. Obstructive jaundice induced by bile duction ligation in the rat. J Pathol. 1932;35:769-798. [DOI] |
| 12. | Hatipoğlu AR, Oğuz S, Gürcan S, Yalta T, Albayrak D, Erenoğlu C, Sağıroğlu T, Sezer YA. Combined effects of tauroursodeoxycholic Acid and glutamine on bacterial translocation in obstructive jaundiced rats. Balkan Med J. 2013;30:362-368. [PubMed] [DOI] |
| 13. | Cui Y. [Effect of artenisiae scopariae and poriae powder on calpain-2 expression in liver tissue from rats with obstructive jaundice]. Zhongnan Daxue Xuebao Yixueban. 2015;40:511-516. [PubMed] |
| 14. | Chen J, Dong JT, Li XJ, Gu Y, Cheng ZJ, Cai YK. Glucagon-like peptide-2 protects impaired intestinal mucosal barriers in obstructive jaundice rats. World J Gastroenterol. 2015;21:484-490. [PubMed] [DOI] |
| 16. | Assimakopoulos SF, Vagianos CE. Bile duct ligation in rats: a reliable model of hepatorenal syndrome? World J Gastroenterol. 2009;15:121-123. [PubMed] [DOI] |
| 20. | Heinrich S, Georgiev P, Weber A, Vergopoulos A, Graf R, Clavien PA. Partial bile duct ligation in mice: a novel model of acute cholestasis. Surgery. 2011;149:445-451. [PubMed] [DOI] |
| 24. | 陈 东, 梁 力建, 汤 地, 李 绍强, 彭 宝岗, 黄 力, 黄 洁夫. 一种改进的阻塞性黄疽大鼠模型的建立. 消化肿瘤杂志(电子版). 2009;1:122-126. |
| 25. | 崔 乃强, 张 西波, 李 东华, 孙 柏军. 可控性胆道内/外引流及胆道梗阻动物模型的建立. 中国中西医结合外科杂志. 2007;13:115-119. |
| 27. | Oruç MT, Ozmen MM, Han U. A new technique for inducing and releasing obstructive jaundice in rats. Eur Surg Res. 2009;43:354-359. [PubMed] [DOI] |
| 30. | Kahramansoy N, Erkol H, Yilmaz EE, Şit M, Yilmaz F, Tosun M, Çöl C. A new model of reversible obstructive jaundice using rapidly absorbable suture materials. Clin Invest Med. 2012;35:E351-E357. [PubMed] |
| 33. | Wang JB, Liu C, Yeh YC, Liu CP, Chang CJ, Chen CY, Chin T. A novel rat model simulating biliary atresia after a Kasai operation. J Invest Surg. 2014;27:183-190. [PubMed] [DOI] |