修回日期: 2015-07-13
接受日期: 2015-07-24
在线出版日期: 2015-08-28
目的: 探讨内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗消化道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs)的临床疗效及安全性评价.
方法: 对2012-05/2015-02在江苏省中医院内镜中心行内镜下治疗的28例GI-NENs患者的临床资料进行回顾性分析, 所有患者均接受ESD治疗, 对其内镜下表现特点及疗效、并发症等数据进行总结.
结果: 28例GI-NENs患者均成功接受ESD术, 所有剥离标本全部得到病理确诊, 基底和切缘未见病变累及. 共出现术后迟发性大出血2例, 无穿孔、感染等并发症发生. 术后随访3-36 mo无1例患者出现残留或复发.
结论: ESD治疗不超过20 mm的且未侵犯固有肌层的GI-NENs安全、有效.
核心提示: 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗消化道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs), 不仅可以彻底剥离病灶, 而且术中创伤小、术后并发症少、身体机能恢复快、生活质量高. 因此, ESD术可作为不超过2 cm的且未侵犯固有肌层的GI-NENs的首选治疗方法.
引文著录: 金海林, 韩树堂, 肖君, 张其德, 孙仁虎. 内镜黏膜下剥离术治疗消化道神经内分泌肿瘤28例及文献回顾. 世界华人消化杂志 2015; 23(24): 3950-3954
Revised: July 13, 2015
Accepted: July 24, 2015
Published online: August 28, 2015
AIM: To assess the clinical efficacy and safety of endoscopic submucosal dissection (ESD) for gastrointestinal neuroendocrine neoplasms.
METHODS: A retrospective analysis was performed for 28 patients with gastrointestinal neuroendocrine neoplasms who underwent endoscopic therapy between May 2012 and February 2015. All patients underwent ESD. Endoscopic manifestations were summarized, and the related literature was reviewed in terms of curative effects and complications.
RESULTS: Twenty-eight cases were all successfully treated by ESD. All lesions were resected with lateral and basal resection margins free of tumor cells. Among all the cases, two had delayed massive bleeding and the bleeding rate was 7.1% (2/28). No complications such as perforation and infection occurred. No residual lesion or recurrence occurred during the follow-up period of 3-36 mo.
CONCLUSION: ESD is safe and effective in the treatment of patients with gastrointestinal neuroendocrine neoplasms (less than or equal to 20 mm) without muscularis propria invasion.
- Citation: Jin HL, Han ST, Xiao J, Zhang QD, Sun RH. Endoscopic submucosal dissection for treatment of gastrointestinal neuroendocrine neoplasms: Analysis of 28 cases and a literature review. Shijie Huaren Xiaohua Zazhi 2015; 23(24): 3950-3954
- URL: https://www.wjgnet.com/1009-3079/full/v23/i24/3950.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i24.3950
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是一类起源于胚胎的神经内分泌细胞、具有神经内分泌标志物和可以产生多肽激素的肿瘤; 而消化道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs)即指原发于胃、小肠和结肠或直肠等, 能够产生5-羟色胺代谢产物或多肽激素的肿瘤, 欧美等国家以回肠、直肠和阑尾NENs最为常见[1]. 亚洲人群以直肠NENs为主, 占所有GI-NENs的60%-89%[2], 而空、回肠NENs中的年发病率仅为0.20/10万, 与欧美国家的差异较大. 郭林杰等[3]研究表明, 直肠和阑尾NENs在我国GI-NENs中分别占24.3%和11.1%; 其他部位NENs所占比例均未超过10%. 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是目前较为成熟的一项内镜治疗技术. 相对于外科手术, 其优越性主要是创伤小、愈合快、风险低及术后生存质量高. 本文对江苏省中医院消化内镜中心28例接受ESD术的GI-NENs患者的临床病理特征、并发症等进行总结.
收集2012-05/2015-02在江苏省中医院消化内镜中心行内镜检查后诊断为GI-NENs, 并行ESD术且术后确诊的患者28例. 所有患者术前均行超声内镜检查. 器械和设备: 日本Olympus GIF-Q260电子胃镜及CFQ260电子结肠镜, Olympus KD-620LR Hook刀、KD-611L IT刀、ERBE 200S高频电切装置、APC2氩离子凝固器及FD-610LR电凝活检钳等.
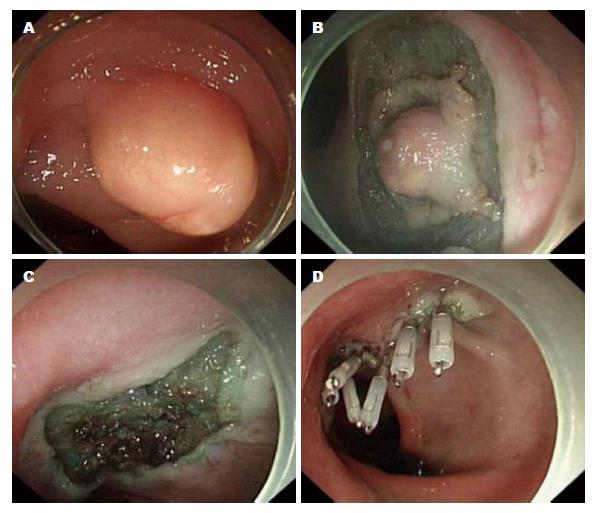
1.2.1 内镜治疗: 手术步骤: (1)标记: 应用APC距病变外缘约0.5 cm处环周电凝标记切开点, 每点间隔距离约0.5 cm; (2)黏膜下层注射: 用1:10000的肾上腺素美蓝生理盐水溶液沿标记处行多点黏膜下注射, 直至病灶明显抬起(如果抬举征阴性则立即停止ESD治疗); (3)病灶分离及剥离: 应用钩形切开刀和IT刀, 于病灶下方对黏膜下层进行分离及剥离, 剥离过程中可行多次黏膜下层注射, 以保持病灶与肌层分离, 直至病灶完整剥离. 剥离过程中及剥离完毕后, 创面和基底部如有明显出血, 应用电凝或热活检钳止血, 必要时采用钛夹止血(图1).
1.2.2 术后处理: 术后常规禁食、禁水、抑酸、止血、防治感染及补液营养支持等治疗. 根据情况3-5 d后予流质饮食, 术后1 wk-1 mo内予无渣半流质饮食(胃十二指肠NEN者术后放置三腔喂养管或鼻胃管).
1.2.3 随访: 术后3、6、12、24、36 mo(此后每年1次)复查胃、肠镜并进行病理学检查.
GI-NENs患者28例, 其中男17例, 女11例, 男女比例为1.55:1, 年龄27-71岁, 平均年龄50.0岁±12.1岁, 年龄分布为20-29岁2例, 30-39岁3例, 40-49岁9例, 50-59岁7例, 60-69岁6例, 70-79岁1例. 肿瘤部位: 直肠26例, 胃及十二指肠各1例, 直肠内肿瘤均位于距肛缘4-10 cm内. 肿瘤最大直径: 0.4-1.2 cm, 平均大小0.70 cm±0.22 cm. 直径<0.5 cm者2例, 0.5-0.9 cm者21例, 1.0-1.2 cm者5例. 超声内镜结果提示所有患者病变均局限于黏膜下层, 未侵及固有肌层.
所有28例GI-NENs患者均成功接受ESD术, 手术时间15-42 min, 平均操作时间27.6 min. 术后出现迟发性创面出血2例, 其中1例术后2次创面出血, 均予内镜下电凝及钛夹成功止血; 无穿孔、感染等其他并发症发生.
术后病理证实所有肿瘤均完整切除, 水平切缘及垂直切缘均无肿瘤累及. 根据2010年世界卫生组织(World Health Organization, WHO)NENs分级标准, 28例患者术后G1期占26例, 另2例为G2期, 0例G3期肿瘤.
所有患者随访3-36 mo, 无1例残留或复发, 仅1例于术后3年死于其他疾病.
1907年德国病理学家Oberndorfer首次提出了"类癌(carcinoid)"或"类癌瘤(carcinoid tumor)"这一术语, 指的是一组发生于胃肠道和其他器官嗜银细胞的新生物, 临床、组织化学和生化特征可因其发生部位不同而异. 1980年WHO曾对NEN进行分类, 把大部分NEN称作"类癌", 这给当时的病理医生和临床医生造成了概念上的分歧, 即前者指所有神经内分泌特点的肿瘤, 后者指分泌5-羟色胺并有类癌综合征的肿瘤. 直至2000年修订的WHO分类, 去除了"类癌"这个词, 引入了NENs和神经内分泌癌. NENs的分型比较混乱, 2010年WHO将其分为神经内分泌瘤G1型(类癌)、神经内分泌瘤G2型和神经内分泌癌(大细胞或小细胞型). 而欧洲神经内分泌肿瘤学会将其分为分化好的神经内分泌瘤、分化差的神经内分泌癌、混合性外分泌-内分泌癌、瘤样病变.
GI-NENs主要发生在胃、十二指肠、空回肠、阑尾、结直肠. 各部位NENs的临床表现和生物学行为有较大差异. 因而, 其治疗也相对复杂. 由于我国临床医师对GI-NENs的认识仍处于起步阶段, 许多问题缺乏国内循证医学的证据, 因此国内的相关指南大多是参考国际指南, 再经过多学科专家反复讨论形成. 目前, GI-NENs的治疗, 欧美指南都是根据肿瘤发生的部位、大小、是否转移等来决定治疗的方法[4]. 如根据病理分级、肿瘤大小、血清胃泌素水平、胃内pH值, 胃神经内分泌肿瘤(g-NENs)可分为3型. 1型g-NENs, 建议内镜下切除, 2型g-NENs, 仅需要行局部切除术, 3型g-NENs, 应当按照胃癌的处理模式进行手术及术后治疗. 而十二指肠神经内分泌肿瘤(d-NENs)则不同, 对于 ≤ 1 cm的d-NENs可行内镜下切除,>2 cm或者存在淋巴结转移的肿瘤, 无论大小均应手术切除; 壶腹周围NENs, 无论大小均应行胰十二指肠切除并清扫周围淋巴结. 直肠NENs, 对于>2 cm、T3/T4、G3或者存在区域淋巴结转移的直肠NENs治疗方法同直肠腺癌. 对于>2 cm无远处转移的直肠NENs, 可考虑全直肠系膜切除的直肠前切除术或腹会阴联合切除术; 对于<2 cm直肠NENs建议行局部切除, 局部切除包括外科手术及内镜下治疗[内镜黏膜切除术(endoscopic mucosal resection, EMR)及ESD]. 另外, GI-NENs的治疗还包括转移灶局部治疗、药物治疗等.
在所有28例患者中, 胃和十二指肠所占比例极少, 而以直肠为绝大多数, 男性稍多于女性, 年龄以40-69岁为主, 亦有年轻患者. 符合国外学者的研究[5]结论, 也符合GI-NENs在亚洲的流行病学特征. 在所有患者的病理分型中, G1、G2和G3期所占比例分别为92.9%、7.1%、0.
长期以来, 临床医师对于NENs的困惑较多. 随着内镜技术的普及, 越来越多的患者接受了胃肠镜的检查. 因此, GI-NENs的发病率和患病率均显著上升[6]. 美国研究[7]表明, NENs发病率为5.25/10万, 而我国也有研究[8]表明GI-NENs发病率较前上升, 且以直肠NENs为首要发病位置. 本组研究28例患者中, 直肠NENs占92.9%, 其他部位共占7.1%, 符合国内学者的研究[9]结果. 直肠NENs一般发生于齿状线上4-13 cm肠段内, 单发多见, 绝大多数位于距肛缘8 cm之内[10]. 直肠NENs肠镜下典型表现为黏膜下淡黄或苍白结节状隆起, 质地较硬, 直径多<1.0 cm, 病变较大者表面可形成糜烂或溃疡. 超声内镜下表现为黏膜下层的边界清晰、回声欠均匀的低回声肿块, 局部固有肌层完整. 直肠NENs的恶性程度与肿瘤大小、浸润深度、组织分化程度、表面情况密切相关, 其中最主要的是前两项. 超声内镜不仅可以准确测量肿瘤大小, 也可以探测肿瘤浸润深度, 如果肿瘤超过2 cm或侵犯固有肌层及外膜层或有区域淋巴结肿大, 提示病变恶性程度较高. 本研究中26例直肠NENs均行超声内镜检查, 所有病变均<2.0 cm且未有侵犯固有肌层者. 对直径 ≤ 2.0 cm, 且浸润深度未超过黏膜下层的类癌应首选内镜治疗[11]. 内镜下治疗方法主要包括EMR和ESD. 近年来, ESD术在国内多家医院开展, 且技术日臻成熟. Choi等[12]在直径<10 mm的直肠类癌中研究表明, EMR-B的完整切除率与ESD相似, 而手术时间明显短于ESD术. 因此, Choi等[12]认为直径较小的直肠类癌治疗首推EMR-B. Zhou等[13]研究亦认为对于直径<10 mm的直肠类癌, EMR不失为一种有效的治疗方法. 但最新研究[14,15]认为: ESD与EMR在治疗直肠类癌时安全性相近, 术后复发率亦无明显差别, 但在完全切除率方面ESD占优. 同样, 在1型胃神经内分泌肿瘤的治疗中, Kim等[16]及Sato等[17]研究认为ESD在完整切除率方面优于EMR. 主要体现在垂直切缘的阳性残留上, EMR的阳性率明显高于ESD, 而水平切缘两者并无差异. 本研究中26例直肠类癌、1例胃NEN及1例十二指肠NEN患者均使用ESD术, 术前常规行超声内镜检查, 病变完整切除率100%, 术后有2例患者发生迟发性出血, 均成功内镜下止血, 无穿孔、感染等其他并发症发生. 与胃肠道早癌相比, GI-NENs的ESD治疗过程中, 须行相对较深的分离与剥离, 以尽可能达到垂直切缘的阴性, 否则一旦肿瘤破坏、残留后, 可能造成迅速的血行转移.
随着内镜技术的进步, ESD手术时间明显缩短, 成功率大幅提高. 本研究中所有肿瘤ESD术成功率达100%, 患者接受ESD治疗后生存质量和术后生存率较高, 且随访3-36 mo后, 无1例残留或复发. 表明对于直径<20 mm且未累及固有肌层的GI-NENs, ESD治疗安全有效, 且复发率低, 值得临床进一步大样本探讨研究, 以建立基于我国自身研究数据的GI-NENs的诊治指南.
随着内镜技术的普及, 越来越多的患者接受了胃肠镜检查, 检测到的消化道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms, GI-NENs)的发病率也随之上升. 但如何正确治疗此类疾病, 国内尚缺乏相关循证医学的证据.
李兆申, 教授, 主任医师, 博士生导师, 上海长海医院消化科
由于GI-NENs往往起源于黏膜下层, 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗此类疾病能否完整切除? 是否易残留、复发? 这些问题不仅患者关心, 消化内镜医生也更为关注. 因此, 内镜治疗后的并发症发生率、术后患者生存质量、生存时间等问题是本文关注的焦点.
文献报道, 国内外内镜专家ESD治疗GI-NENs已取得初步成功, 临床并发症较少, 主要为出血、穿孔.
本文应用内镜微创的方法治疗GI-NENs, 达到了临床症状缓解率高、并发症发生率低及复发率低的良好疗效. 与外科手术治疗相比, 内镜治疗后的患者创伤小、愈合快、术后生活质量高.
本文通过回顾性研究, 使用ESD治疗GI-NENs, 取得了良好的临床疗效, 且并发症少、复发率低, 为内镜治疗此类疾病提供了有力的循证医学的证据.
消化道神经内分泌肿瘤(GI-NENs): 指原发于胃、小肠、结肠或直肠等, 能够产生5-羟色胺代谢产物或多肽激素的肿瘤.
本研究对ESD治疗GI-NENs这一热点问题进行了总结分析, 研究者具有很好的操作水平, 研究的创新性和科学性较好.
编辑: 韦元涛 电编:闫晋利
| 1. | Modlin I, Zikusoka M, Kidd M. The history and epidemiology of neuroendocrine tumors. Handbook of Neuroendocrine Tumors. 1st ed. Bristol, UK: BioScientifica 2006; 7-37. |
| 2. | Ito T, Sasano H, Tanaka M, Osamura RY, Sasaki I, Kimura W, Takano K, Obara T, Ishibashi M, Nakao K. Epidemiological study of gastroenteropancreatic neuroendocrine tumors in Japan. J Gastroenterol. 2010;45:234-243. [PubMed] [DOI] |
| 5. | Memon MA, Nelson H. Gastrointestinal carcinoid tumors: current management strategies. Dis Colon Rectum. 1997;40:1101-1118. [PubMed] |
| 6. | Scherübl H. Rectal carcinoids are on the rise: early detection by screening endoscopy. Endoscopy. 2009;41:162-165. [PubMed] [DOI] |
| 7. | Yao JC, Hassan M, Phan A, Dagohoy C, Leary C, Mares JE, Abdalla EK, Fleming JB, Vauthey JN, Rashid A. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008;26:3063-3072. [PubMed] [DOI] |
| 8. | Wang YH, Lin Y, Xue L, Wang JH, Chen MH, Chen J. Relationship between clinical characteristics and survival of gastroenteropancreatic neuroendocrine neoplasms: A single-institution analysis (1995-2012) in South China. BMC Endocr Disord. 2012;12:30. [PubMed] [DOI] |
| 9. | 陈 文科, 邹 兵, 王 成文, 刘 永革, 郭 海, 郑 爱萍. 消化道类癌43例的临床诊治及预后分析. 中华临床医师杂志(电子版). 2011;5:3628-3630. |
| 10. | Maggard MA, O'Connell JB, Ko CY. Updated population-based review of carcinoid tumors. Ann Surg. 2004;240:117-122. [PubMed] [DOI] |
| 12. | Choi CW, Kang DH, Kim HW, Park SB, Jo WS, Song GA, Cho M. Comparison of endoscopic resection therapies for rectal carcinoid tumor: endoscopic submucosal dissection versus endoscopic mucosal resection using band ligation. J Clin Gastroenterol. 2013;47:432-436. [PubMed] [DOI] |
| 13. | Zhou FR, Huang LY, Wu CR. Endoscopic mucosal resection for rectal carcinoids under micro-probe ultrasound guidance. World J Gastroenterol. 2013;19:2555-2559. [PubMed] [DOI] |
| 14. | Zhong DD, Shao LM, Cai JT. Endoscopic mucosal resection vs endoscopic submucosal dissection for rectal carcinoid tumours: a systematic review and meta-analysis. Colorectal Dis. 2013;15:283-291. [PubMed] [DOI] |
| 16. | Kim HH, Kim GH, Kim JH, Choi MG, Song GA, Kim SE. The efficacy of endoscopic submucosal dissection of type I gastric carcinoid tumors compared with conventional endoscopic mucosal resection. Gastroenterol Res Pract. 2014;2014:253860. [PubMed] [DOI] |
| 17. | Sato Y, Takeuchi M, Hashimoto S, Mizuno K, Kobayashi M, Iwafuchi M, Narisawa R, Aoyagi Y. Usefulness of endoscopic submucosal dissection for type I gastric carcinoid tumors compared with endoscopic mucosal resection. Hepatogastroenterology. 2013;60:1524-1529. [PubMed] [DOI] |