修回日期: 2015-06-01
接受日期: 2015-06-29
在线出版日期: 2015-08-18
目的: 探讨核糖核苷酸还原酶M1(ribonucleotide reductase M1, RRM1)在预测吉西他滨治疗胰腺癌患者的疗效的价值.
方法: 计算机检索在2004-01-01/2014-12-31在Cochrane Library、Medline、Science Direct、Springer link、中国期刊全文数据库、中国知网、万方以及维普数据库公开发表的关于核糖核苷酸还原酶M1在吉西他滨治疗胰腺癌患者疗效的全文为英文的文献, 严格按纳入排除标准由2位研究者独立进行文献筛选(PRISMA标准)、资料提取和方法学质量评价后, 采用Stata12.0软件进行Meta分析.
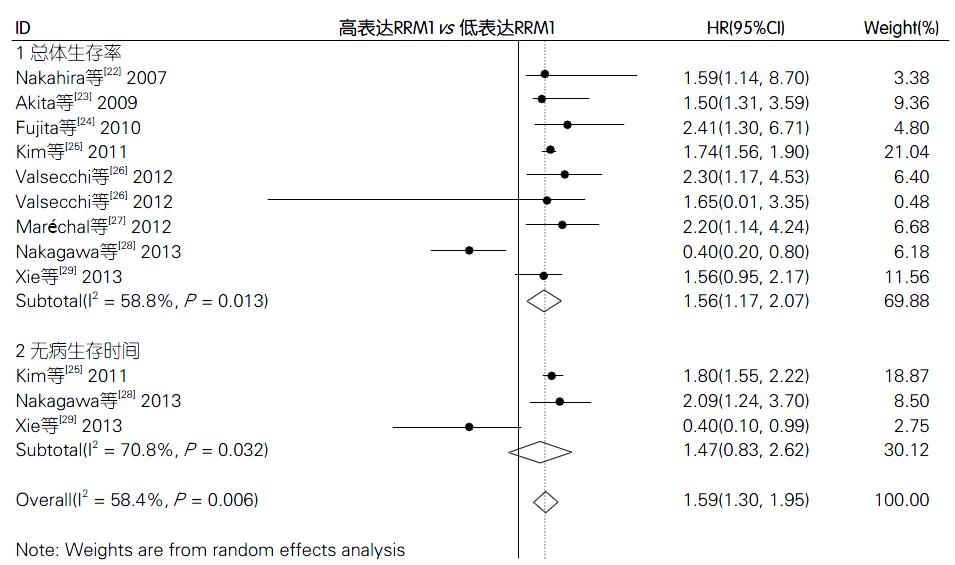
结果: 共纳入8篇文献, 共包含胰腺癌患者556例, 其中高表达的RRM1患者373例, 低表达RRM1的患者293例. Meta分析结果显示: 高表达的RRM1患者的总体生存率(overall survival, OS)(HR = 1.56, 95%CI: 1.17-2.07, P<0.05)和无病生存期(disease free-survival, DFS)(HR = 1.47, 95%CI: 0.83-2.62, P<0.05)均较高.
结论: 在吉西他滨治疗的胰腺癌患者中, 高表达的RRM1较低表达的RRM1能显著性的提高患者的总体生存率和无病生存期, 他们可以作为临床上评估吉西他滨治疗胰腺癌患者预后的指标.
核心提示: 在吉西他滨治疗的胰腺癌患者中, 高表达的核糖核苷酸还原酶M1(ribonucleotide reductase M1, RRM1)较低表达的RRM1能显著性的提高患者的总体生存率和无病生存期, 可以作为临床上评估吉西他滨治疗胰腺癌患者预后的指标.
引文著录: 黄龙, 黎功, 方子燕, 黄璟. 核糖核苷酸还原酶M1在预测吉西他滨治疗胰腺癌患者疗效的Meta分析. 世界华人消化杂志 2015; 23(23): 3789-3796
Revised: June 1, 2015
Accepted: June 29, 2015
Published online: August 18, 2015
AIM: To evaluate the role of ribonucleotide reductase M1 (RRM1) in predicting the survival of patients with resectable pancreatic cancer who receive gemcitabine adjuvant therapy.
METHODS: Cochrane Library, Medline, Science Direct, Springer link, CBM, Cnki, Wan fang and VIP database were searched before December 31, 2014 to collect the articles regarding RRM1 in the treatment of pancreatic cancer. The quality of the included trials was assessed according to the inclusive and exclusive criteria, and the data were extracted and analyzed using Stata12.0 and RevMan 5.2.10 software.
RESULTS: A total of eight clinical studies involving 556 pancreatic cancer patients treated with adjuvant gemcitabine-based chemotherapy were included, including 373 patients with high RRM1 expression and 293 patients with low RRM1 expression. Meta-analysis showed that high RRM1 expression was associated with improved overall survival (OS) of pancreatic cancer patients (HR = 1.56, 95%CI: 1.17-2.07, P < 0.05). High RRM1 expression also was linked to longer disease-free survival (DFS) than low RRM1 expression (HR = 1.47, 95%CI: 0.83-2.62, P < 0.05).
CONCLUSION: This Meta-analysis shows that high RRM1 expression may be associated with improved OS and DFS of pancreatic cancer patients treated with adjuvant gemcitabine-based chemotherapy. The detection of RRM1 expression may be a promising biomarker for predicting the prognosis of pancreatic cancer patients treated with gemcitabine.
- Citation: Huang L, Li G, Fang ZY, Huang J. Predictive and prognostic roles of ribonucleotide reductase M1 in pancreatic cancer: A Meta-analysis. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3789-3796
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3789.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3789
胰腺癌是一种临床发病较隐匿, 且发展迅速, 预后极差的恶性肿瘤. 有相关研究[1,2]表明, 在美国, 胰腺癌的死亡率是占据第4位的恶性肿瘤, 其5年生存率不到5%, 即使对于可切除的胰腺癌患者, 其5年生存率仍为10%-20%[3-6]. 目前对于胰腺癌比较有效的治疗方法是早期手术治疗, 相关研究[7,8]已经证实: 在手术切除术后的辅助放化疗可以延长生存率. 吉西他滨(gemcitabine)是一种广泛用于实体肿瘤(包括胰腺癌等)化疗的核苷酸结构类似物药物[9], 且已有相关研究[10,11]表明, 胰腺癌切除根治术后吉西他滨化疗对于提高预后有很重要的意义, 且现在吉西他滨化疗方案已经作为不可切除的胰腺癌或者根治性切除术术后胰腺癌化疗的一线方案[12,13]. 核糖核苷酸还原酶(ribonucleotide reductase, RR)是DNA合成过程中重要的限速酶, RR中具有调节功能的亚单位称为核糖核苷酸还原酶M1(ribonucleotide reductase M1, RRM1), 是核苷酸的结合位点, 对于底物特异性和整个酶的活性起着控制作用, 对于DNA的聚合和修复具有重要的作用[14-16]. RRM1是吉西他滨等核苷类似物化疗药物的结合位点, RRM1可以作为预测吉西他滨药物化疗的疗效指标[17]. 相关研究[18,19]表明高RRM1基因的表达表明化疗药物的敏感性较高, 化疗的效果较好. 因此高RRM1基因表达(蛋白质或者信使RNA)能延长吉西他滨治疗胰腺癌患者的总体生存率(overall survival, OS)和无病生存期(disease-free survival, DFS). 但目前对于RRM1的表达在吉西他滨治疗胰腺癌患者的作用仍有争议, 为明确RRM1的表达和吉西他滨治疗胰腺癌患者的预后关系, 本研究结合近年来发表(2004-01-01/2014-12-31)的最新相关文献, 采用系统评价的方法来说明RRM1的表达与吉西他滨治疗胰腺癌的预后的关系.
计算机检索自2004-01-01/2014-12-31在Cochrane Library、Medline、Science Direct、Springer link、CBM、中国知网、万方以及维普数据库公开发表的全文为英文的文献, 并手工检索国内相关医学杂志. 检索策略: 采取主题词和关键词结合的检索策略, 检索词中文为: "核糖核苷酸还原酶M1"、"胰腺癌"、"胰腺肿瘤"、"吉西他滨". 英文的检索词为: ["Ribonucleotide reductase M1"、"Ribonucleotide reductase"、 "RRM1"、"RRM-1"、"RNR"]、["pancreatic cancer"、"pancreatic neoplasm"、"pancreatic tumor" "pancreatic carcinoma"、"pancreatic carcinogenesis"] and ["gemcitabine" 、"GEM"、"deoxycytidine analog"], 对于以上检索词采用不同策略检索, 并追查已经纳入文献或者综述文献的参考文献以尽可能全面的收集资料.
1.2.1 文献纳入标准: (1)纳入研究的发表年限在2014-12-31前; (2)纳入文献胰腺癌的诊断明确, 需经术后病理证实的胰腺癌患者; (3)文献研究设计为预测RRM1在吉西他滨治疗胰腺癌患者的临床对照研究(前瞻性、回顾性均可); (4)纳入文献中报告的OS及术后DFS的预测需是有效可计算的; (5)纳入研究中需交代RRM1的测定方法; (6)纳入文献的全文需是英文文献.
1.2.2 文献排除标准: (1)纳入文献中诊断不明确或者无相关病理学结果证实的文献不予以纳入; (2)方法学交代不健全的研究, 资料不全的研究, 重复发表或重复利用数据的研究取其中之一, 其他的不予纳入; (3)文献中未交代OS和DFS的、无高低表达RRM1的对比比较的不予以纳入; (4)文献全文语言非英文书写的不予以纳入.
1.2.3 文献筛选及资料提取: 由两位研究者独立阅读文献进行筛选, 整个筛选过程采用盲法. 先独立阅读所获文献的题目以及摘要, 剔除明显不符合纳入标准的文献, 再对可能符合纳入标准的文献阅读全文, 以确定该文献是否真正符合纳入标准. 在整个筛选过程中, 如果遇到有分歧而难以确定是否纳入的文献通过讨论或由第三个研究者决定其是否纳入. 在纳入文献确定后, 再由两位研究人员独立地对符合纳入标准的试验进行资料提取, 提取内容包括作者、发表年代、病例数等, 并制作填写资料提取表格, 并交叉核对提取的资料, 对于缺乏的资料通过于临床试验人的通讯作者联系予以补充. 整个筛选过程严格按照Cochrane协作组的系统评价文献筛选规范和Meta分析报告规范PRISMA标准[20]进行文献筛选.
1.2.4 文献质量评估: 由于本文缺乏随机对照文献, 所纳入的文献中为病例对照研究和/或队列研究, 文献的质量评估采用NOS量表(Modified Newcastle-Ottawa Scale)[21]进行评价, 具体包含病例的选择、组间的可比性和术后并发症的评价. 评分分为0-9分, 其中≥6分视为高质量文献.
统计学处理 本文采用Cochrane协作网提供的RevMan 5.2.7软件和Stata12.0软件进行统计学分析. 显著性水平设定为P = 0.05, 用I2评估异质性大小, I2<25%提示有轻度异质性, I2在25%和75%之间提示中度异质性, I2>75%以上则提示明显异质性, 若存在异质性则进行亚组分析或者敏感性分析. 使用危险比(hazard ratio, HR)作为效应指标进行分析. 统计结果用95%可信区间(confidence interval, CI)表示, 以漏斗图(funnel plot model)判断发表偏倚. 纳入研究进行异质性检验, 异质性检验P>0.05时表示各研究间无明显异质性, 此时合并分析采用固定效应模型(fixed effects model), 否则采用随机效应模型(random effects model).
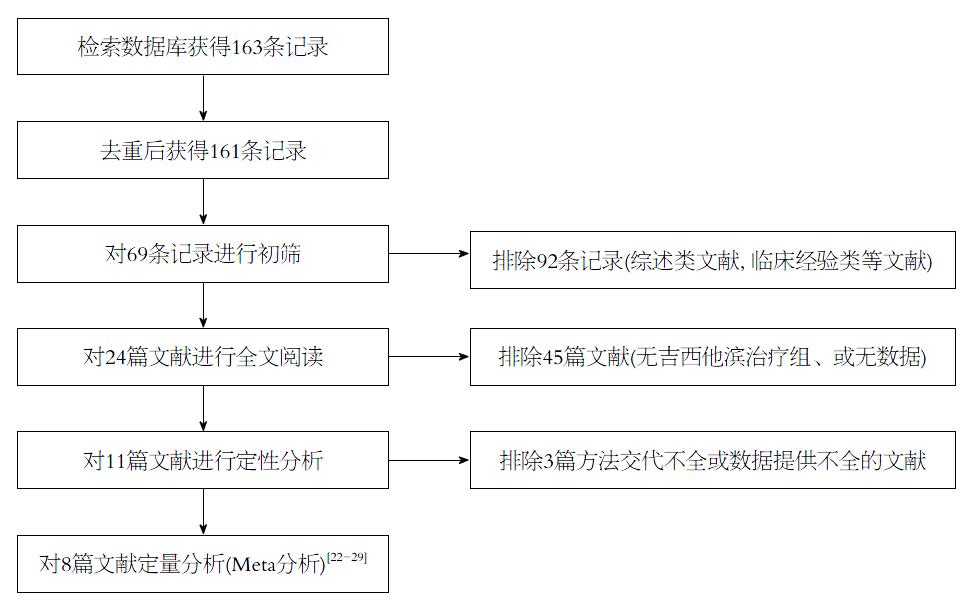
由两位检索人员, 在严格按照纳入排除标准进行筛选和文献阅读后, 最后共纳入8篇研究[22-29], 纳入文献的基本情况如表1, 纳入文献的PRISMA筛选流程图如图1. 本系统评价共纳入胰腺癌病例数566例, 其中高表达吉西他滨治疗胰腺癌患者373例, 低表达例数293例. 其中检测方法为mRNA或者蛋白质检测其表达情况.
| 纳入文献 | 国家 | 人群特征 | 纳入病例数(n) | |
| 高表达RRM1 | 低表达RRM1 | |||
| Nakahira等[22] 2007 | 日本 | 亚洲人 | 9(mRNA) | 9(mRNA) |
| Akita等[23] 2009 | 日本 | 亚洲人 | 14(Protein) | 14(Protein) |
| Fujita等[24] 2010 | 日本 | 亚洲人 | 9(mRNA) | 31(mRNA) |
| Kim等[25] 2011 | 美国 | 高加索人 | 28(mRNA) | 28(mRNA) |
| Valsecchi等[26] 2012 | 美国 | 高加索人 | 32(Protein)/10(mRNA) | 62(Protein)/39(mRNA) |
| Maréchal等[27] 2012 | 比利时 | 高加索人 | 207(Protein) | 30(Protein) |
| Nakagawa等[28] 2013 | 日本 | 亚洲人 | 44(Protein) | 65(Protein) |
| Xie等[29] 2013 | 美国 | 高加索人 | 20(Protein) | 15(Protein) |
| 合计 | 373 | 293 | ||
将所有纳入文献严格按照NOS评分标准, 主要从包含病例的选择、组间的可比性和术后并发症的评价进行评分, 各纳入研究的评分如表2, 由表2可知: 各纳入文献中均交代RRM1的检测方法和比较高低表达的RRM1的在吉西他滨治疗胰腺癌患者的术后的最终结果. 各文献的NOS评分均≥6分, 总体纳入的文献的质量较高.
| 纳入文献 | 纳入病例数(n) | 检测方法 | 结果 | 评分 | |
| 高表达RRM1 | 低表达RRM1 | ||||
| Nakahira等[22] 2007 | 9(mRNA) | 9(mRNA) | PCR | OS | 6 |
| Akita等[23] 2009 | 14(Protein) | 14(Protein) | 免疫组织化学法 | OS | 7 |
| Fujita等[24] 2010 | 9(mRNA) | 31(mRNA) | PCR | OS | 7 |
| Kim等[25] 2011 | 28(mRNA) | 28(mRNA) | PCR | OS/DFS | 6 |
| Valsecchi等[26] 2012 | 32(Protein) | 62(Protein) | 免疫组织化学法 | OS | 8 |
| Valsecchi等[26] 2012 | 10(mRNA) | 39(mRNA) | PCR | OS | 8 |
| Maréchal等[27] 2012 | 207(Protein) | 30(Protein) | 免疫组织化学法 | OS | 7 |
| Nakagawa等[28] 2013 | 44(Protein) | 65(Protein) | 免疫组织化学法 | OS/DFS | 8 |
| Xie等[29] 2013 | 20(Protein) | 15(Protein) | 免疫组织化学法 | OS/DFS | 7 |
| 合计 | 373 | 293 | |||
在阅读全文后, 共有8篇文献[22-29]中研究了高低表达的RRM1在吉西他滨治疗胰腺癌患者后的总体生存率OS的比较, 另有3篇文献研究了高低表达的RRM1与吉西他滨治疗胰腺癌患者预后的比较的无病生存率DFS的比较. 利用Stata12.0统计软件对以上文献进行Meta分析, 具体分析结果的森林图如图2. 由图2结果可知, 总体生存率的比较的森林图示: 各纳入研究间异质性较高(I2 = 58.8%, P<0.05), 使用随机效应模型进行合并, 结果显示高表达的RRM1的总体生存率较低表达RRM1的生存率高(HR = 1.56, 95%CI: 1.17-2.07)(P<0.05). 无病生存率的比较的森林图示: 各纳入研究之间的异质性较高(I2 = 70.8%, P<0.05), 遂采用随机效应模型进行合并分析, 结果显示高表达的RRM1的无病生存率高于低表达的RRM1组(HR = 1.47, 95%CI: 0.83-2.62)(P<0.05).
由图2可知, 高低表达的RRM1与吉西他滨治疗胰腺癌患者的OS和DFS的异质性较高, 为了降低异质性并提高准确性, 我们根据不同的RRM1的检测方法和不同纳入人群进行亚组分析, 具体分析结果如表3. 由表3可知: 亚组分析显示在不同种族的人群中, 高表达的RRM1组的患者吉西他滨治疗后的OS和DFS较低表达的RRM1组高(P<0.05). 说明高表达的RRM1提示着预后较好. 在根据不同的检测方法进行分析, 结果显示: 高表达的mRNA组的OS和DFS较低表达的mRNA高(P<0.05). 高表达的RRM1蛋白质组的OS和DFS较低表达的蛋白质组高(P<0.05).
| 分类 | OS | DFS | ||||
| HR | 95%CI | P值 | HR | 95%CI | P值 | |
| 种族 | ||||||
| 高加索人 | 1.45 | 0.70-2.20 | <0.001 | 1.11 | 0.26-2.48 | 0.013 |
| 亚洲人 | 1.79 | 0.94-2.46 | <0.001 | 2.09 | 0.81-3.24 | 0.001 |
| RRM1检测方法 | ||||||
| mRNA | 1.72 | 1.57-11.88 | <0.001 | 1.80 | 1.47-2.12 | <0.001 |
| 蛋白质 | 1.49 | 0.60-2.32 | 0.001 | 1.14 | 0.50-2.79 | 0.011 |
目前已经证实, 胰腺癌的5年生存率不足5%, 且每年有很多新增的胰腺癌患者, 且很多发现已处于疾病的发展期[1,2,30,31]. 这其中仅有不到20%的患者可以手术切除, 即使手术完全切除术, 其5年生存率仍然很低. 近年来, 术后以吉西他滨药物化疗方案作为治疗胰腺癌的方法被广泛的应用[9-11,32], 且具有较好的疗效. 特别是对于已经行根治术后的患者, 疗效更为肯定. 但即使是有化疗药物作为最新的治疗方案, 仍有很大一部分患者出现肿瘤的复发和转移. 因此需要早起的识别和评估化疗药物后的疗效. 目前已经有相关文献表明[12,13,33]: RRM1的表达可以作为评价吉西他滨药物治疗胰腺癌患者的术后疗效的指标之一. 本系统评价遂结合近年来的国内外的相关的关于RRM1在预测吉西他滨治疗胰腺癌的患者的疗效的相关文献, 研究RRM1的表达的高低与吉西他滨治疗胰腺癌的预后的关系.
本系统评价表明: 高表达的RRM1的患者的预后相关的因素如总体生存率和无病生存率高于低表达的RRM1患者(P<0.05). 在亚组分析中也表明, 在不同的人群中(亚洲人和高加索人), 高表达的RRM1的患者组的预后的总体生存率和无病生存率高于低表达的RRM1患者(P<0.05). 最后在根据不同检测方法分析, 高表达的RRM1(蛋白质、mRNA)的患者组的预后相对较好(P<0.05), 由上述试验结果表明: 在吉西他滨治疗胰腺癌患者中, 如果检测机体的核糖核苷酸还原酶M1的表达较高, 则说明预后较好, 相反, 如果检测机体的RRM1的表达较低, 或者检测不到, 则说明预后相对较差. 这主要的原因可能是[16,17,33]: RRM1是吉西他滨等实体肿瘤化疗药物的细胞结合位点; 在临床和实验室已经得出: 抑制RRM1的表达, 会降低吉西他滨的敏感性. 且本研究的亚组分析也表明应用吉西他滨治疗胰腺癌的患者中, 低表达的RRM1的预后相关较差. 但是目前其具体的影响机制尚不清楚, 这也是目前亟需解决的问题之一.
Meta分析作为一种观察性的研究, 有一定的局限性. 本系统评价有如下局限性: (1)对于本纳入研究, 纳入各研究的病例数, 样本量太少, 病例数不足以提供足够的临床证据来表明高表达的RRM1能显著性的增加吉西他滨治疗胰腺癌后的总体生存率和无病生存期; (2)本文的异质性较高, 即使在亚组分析后, 也有一定的异质性, 因此纳入病例人群地区的选择可能会影响实验结果; (3)不同地区胰腺癌的发病率的不同容易造成选择偏倚, 影响系统评价的结果; (4)RRM1的各地区的实验室检测方法的不同也会影响实验结果; (5)纳入文献中大部分为回顾性研究, 这个存在着实验对象的选择性偏倚, 影响最终试验结果; (6)本系统评价中选择的文献均为英文文献, 存在着文献选择的偏倚, 会影响试验结果.
总之, 在吉西他滨治疗的胰腺癌患者中, 高表达的RRM1较低表达的RRM1能显著性的提高患者的总体生存率和无病生存期. 可以作为临床上评估吉西他滨治疗胰腺癌患者预后的指标之一, 但是未来仍需大样本、多中心、前瞻性的随机对照试验来进一步验证RRM1的表达高低与吉西他滨治疗胰腺癌患者的疗效的关系.
胰腺癌(pancreatic cancer)是一种临床发病较隐匿, 且发展迅速, 预后极差的恶性肿瘤. 目前胰腺癌患者的早期诊断对于预后有重要的临床意义.
郑建明, 教授, 主任医师, 中国人民解放军第二军医大学附属长海医院病理科
本研究表明: 高表达的核糖核苷酸还原酶M1(ribonucleotide reductase M1, RRM1)患者的总体生存率和无病生存期(disease-free survival, DFS)较高, 得出在吉西他滨治疗的胰腺癌患者中, 高表达RRM1患者较低表达者能显著性地提高总体生存率和无病生存期, 所以检测RRM1表达可以作为临床上评估吉西他滨治疗胰腺癌患者预后的指标.
相关研究表明高RRM1基因的表达对化疗药物的敏感性较高, 化疗的效果较好.
在胰腺癌患者进行吉西他滨药物化疗过程中, 可以对RRM1进行监控, 从而可以得知化疗的远期和近期生存率的差别. 检测RRM1的水平是吉西他滨治疗胰腺癌患者重要检测指标之一.
本研究表明: 今后在对于吉西他滨治疗胰腺癌的化疗效果检测中, 应检测血清中RRM1的表达水平, 其能够预测患者的生活质量和预后.
DFS: 通常定义为随机选择某个时间直到肿瘤复发或因各种原因出现死亡. 一个重要的考虑是DFS延长是否意味着本质上的获益或仅仅是生存期延长的一个潜在替代指标.
文章撰写规范, 统计方法正确, 结果可靠, 结论可信, 检测RRM1表达可以作为临床上评估吉西他滨治疗胰腺癌患者预后的指标之一.
编辑: 郭鹏 电编:都珍珍
| 1. | Singh S, Singh PP, Singh AG, Murad MH, McWilliams RR, Chari ST. Anti-diabetic medications and risk of pancreatic cancer in patients with diabetes mellitus: a systematic review and meta-analysis. Am J Gastroenterol. 2013;108:510-519; quiz 520. [PubMed] [DOI] |
| 2. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 3. | Berrino F, De Angelis R, Sant M, Rosso S, Bielska-Lasota M, Coebergh JW, Santaquilani M. Survival for eight major cancers and all cancers combined for European adults diagnosed in 1995-99: results of the EUROCARE-4 study. Lancet Oncol. 2007;8:773-783. [PubMed] [DOI] |
| 4. | Conlon KC, Klimstra DS, Brennan MF. Long-term survival after curative resection for pancreatic ductal adenocarcinoma. Clinicopathologic analysis of 5-year survivors. Ann Surg. 1996;223:273-279. [PubMed] [DOI] |
| 5. | Sohn TA, Yeo CJ, Cameron JL, Koniaris L, Kaushal S, Abrams RA, Sauter PK, Coleman J, Hruban RH, Lillemoe KD. Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg. 2000;4:567-579. [PubMed] [DOI] |
| 6. | Ben Q, Xu M, Ning X, Liu J, Hong S, Huang W, Zhang H, Li Z. Diabetes mellitus and risk of pancreatic cancer: A meta-analysis of cohort studies. Eur J Cancer. 2011;47:1928-1937. [PubMed] [DOI] |
| 7. | Traverso LW. Pancreatic cancer: surgery alone is not sufficient. Surg Endosc. 2006;20 Suppl 2:S446-S449. [PubMed] [DOI] |
| 8. | Hsu CC, Herman JM, Corsini MM, Winter JM, Callister MD, Haddock MG, Cameron JL, Pawlik TM, Schulick RD, Wolfgang CL. Adjuvant chemoradiation for pancreatic adenocarcinoma: the Johns Hopkins Hospital-Mayo Clinic collaborative study. Ann Surg Oncol. 2010;17:981-990. [PubMed] [DOI] |
| 9. | Wonganan P, Chung WG, Zhu S, Kiguchi K, Digiovanni J, Cui Z. Silencing of ribonucleotide reductase subunit M1 potentiates the antitumor activity of gemcitabine in resistant cancer cells. Cancer Biol Ther. 2012;13:908-914. [PubMed] [DOI] |
| 10. | Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, Schramm H, Fahlke J, Zuelke C, Burkart C. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA. 2007;297:267-277. [PubMed] [DOI] |
| 11. | Van Laethem JL, Hammel P, Mornex F, Azria D, Van Tienhoven G, Vergauwe P, Peeters M, Polus M, Praet M, Mauer M. Adjuvant gemcitabine alone versus gemcitabine-based chemoradiotherapy after curative resection for pancreatic cancer: a randomized EORTC-40013-22012/FFCD-9203/GERCOR phase II study. J Clin Oncol. 2010;28:4450-4456. [PubMed] [DOI] |
| 12. | Kanai M, Yoshimura K, Asada M, Imaizumi A, Suzuki C, Matsumoto S, Nishimura T, Mori Y, Masui T, Kawaguchi Y. A phase I/II study of gemcitabine-based chemotherapy plus curcumin for patients with gemcitabine-resistant pancreatic cancer. Cancer Chemother Pharmacol. 2011;68:157-164. [PubMed] [DOI] |
| 13. | Kim ST, Lim do H, Jang KT, Lim T, Lee J, Choi YL, Jang HL, Yi JH, Baek KK, Park SH. Impact of KRAS mutations on clinical outcomes in pancreatic cancer patients treated with first-line gemcitabine-based chemotherapy. Mol Cancer Ther. 2011;10:1993-1999. [PubMed] [DOI] |
| 14. | Smith BD, Karp JE. Ribonucleotide reductase: an old target with new potential. Leuk Res. 2003;27:1075-1076. [PubMed] [DOI] |
| 15. | Kwon WS, Rha SY, Choi YH, Lee JO, Park KH, Jung JJ, Kim TS, Jeung HC, Chung HC. Ribonucleotide reductase M1 (RRM1) 2464G& gt; A polymorphism shows an association with gemcitabine chemosensitivity in cancer cell lines. Pharmacogenet Genomics. 2006;16:429-438. [PubMed] [DOI] |
| 16. | Jordheim LP, Sève P, Trédan O, Dumontet C. The ribonucleotide reductase large subunit (RRM1) as a predictive factor in patients with cancer. Lancet Oncol. 2011;12:693-702. [PubMed] [DOI] |
| 17. | Ohtaka K, Kohya N, Sato K, Kitajima Y, Ide T, Mitsuno M, Miyazaki K. Ribonucleotide reductase subunit M1 is a possible chemoresistance marker to gemcitabine in biliary tract carcinoma. Oncol Rep. 2008;20:279-286. [PubMed] |
| 18. | Bepler G, Kusmartseva I, Sharma S, Gautam A, Cantor A, Sharma A, Simon G. RRM1 modulated in vitro and in vivo efficacy of gemcitabine and platinum in non-small-cell lung cancer. J Clin Oncol. 2006;24:4731-4737. [PubMed] [DOI] |
| 19. | Ueno H, Kiyosawa K, Kaniwa N. Pharmacogenomics of gemcitabine: can genetic studies lead to tailor-made therapy? Br J Cancer. 2007;97:145-151. [PubMed] [DOI] |
| 20. | Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Int J Surg. 2010;8:336-341. [PubMed] [DOI] |
| 21. | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. Eur J Epidemiol. 2010;25:603-605. [PubMed] [DOI] |
| 22. | Nakahira S, Nakamori S, Tsujie M, Takahashi Y, Okami J, Yoshioka S, Yamasaki M, Marubashi S, Takemasa I, Miyamoto A. Involvement of ribonucleotide reductase M1 subunit overexpression in gemcitabine resistance of human pancreatic cancer. Int J Cancer. 2007;120:1355-1363. [PubMed] [DOI] |
| 23. | Akita H, Zheng Z, Takeda Y, Kim C, Kittaka N, Kobayashi S, Marubashi S, Takemasa I, Nagano H, Dono K. Significance of RRM1 and ERCC1 expression in resectable pancreatic adenocarcinoma. Oncogene. 2009;28:2903-2909. [PubMed] [DOI] |
| 24. | Fujita H, Ohuchida K, Mizumoto K, Itaba S, Ito T, Nakata K, Yu J, Kayashima T, Souzaki R, Tajiri T. Gene expression levels as predictive markers of outcome in pancreatic cancer after gemcitabine-based adjuvant chemotherapy. Neoplasia. 2010;12:807-817. [PubMed] [DOI] |
| 25. | Kim R, Tan A, Lai KK, Jiang J, Wang Y, Rybicki LA, Liu X. Prognostic roles of human equilibrative transporter 1 (hENT-1) and ribonucleoside reductase subunit M1 (RRM1) in resected pancreatic cancer. Cancer. 2011;117:3126-3134. [PubMed] [DOI] |
| 26. | Valsecchi ME, Holdbrook T, Leiby BE, Pequignot E, Littman SJ, Yeo CJ, Brody JR, Witkiewicz AK. Is there a role for the quantification of RRM1 and ERCC1 expression in pancreatic ductal adenocarcinoma? BMC Cancer. 2012;12:104. [PubMed] [DOI] |
| 27. | Maréchal R, Bachet JB, Mackey JR, Dalban C, Demetter P, Graham K, Couvelard A, Svrcek M, Bardier-Dupas A, Hammel P. Levels of gemcitabine transport and metabolism proteins predict survival times of patients treated with gemcitabine for pancreatic adenocarcinoma. Gastroenterology. 2012;143:664-674.e1-6. [PubMed] [DOI] |
| 28. | Nakagawa N, Murakami Y, Uemura K, Sudo T, Hashimoto Y, Kondo N, Sueda T. Combined analysis of intratumoral human equilibrative nucleoside transporter 1 (hENT1) and ribonucleotide reductase regulatory subunit M1 (RRM1) expression is a powerful predictor of survival in patients with pancreatic carcinoma treated with adjuvant gemcitabine-based chemotherapy after operative resection. Surgery. 2013;153:565-575. [PubMed] [DOI] |
| 29. | Xie H, Jiang W, Jiang J, Wang Y, Kim R, Liu X, Liu X. Predictive and prognostic roles of ribonucleotide reductase M1 in resectable pancreatic adenocarcinoma. Cancer. 2013;119:173-181. [PubMed] [DOI] |
| 30. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] |
| 31. | Vincent A, Herman J, Schulick R, Hruban RH, Goggins M. Pancreatic cancer. Lancet. 2011;378:607-620. [PubMed] |
| 32. | Regine WF, Winter KA, Abrams RA, Safran H, Hoffman JP, Konski A, Benson AB, Macdonald JS, Kudrimoti MR, Fromm ML. Fluorouracil vs gemcitabine chemotherapy before and after fluorouracil-based chemoradiation following resection of pancreatic adenocarcinoma: a randomized controlled trial. JAMA. 2008;299:1019-1026. [PubMed] [DOI] |
| 33. | Nakano Y, Tanno S, Koizumi K, Nishikawa T, Nakamura K, Minoguchi M, Izawa T, Mizukami Y, Okumura T, Kohgo Y. Gemcitabine chemoresistance and molecular markers associated with gemcitabine transport and metabolism in human pancreatic cancer cells. Br J Cancer. 2007;96:457-463. [PubMed] [DOI] |