修回日期: 2015-06-23
接受日期: 2015-07-06
在线出版日期: 2015-08-18
目的: 探讨Ezrin与Hippo通路下游蛋白YAP(Yes-associated protein)在胃癌侵袭转移中的相互作用机制.
方法: 免疫组织化学检测209例胃癌组织中的Ezrin和YAP的蛋白表达水平. MTT法检测过表达Ezrin及同时干扰YAP后对细胞增殖的影响. Transwell法检测过表达Ezrin及同时干扰YAP后对细胞迁移和侵袭的影响.
结果: 免疫组织化学结果表明Ezrin及YAP在胃癌组织中高表达, 并与肿瘤的发生发展和转移相关, 且两者的表达水平呈正相关的关系. MTT检测结果表明过表达Ezrin后胃癌细胞生长增殖能力增加, 而同时干扰YAP后生长增殖能力受到抑制. Transwell结果表明过表达Ezrin后胃癌细胞迁移侵袭能力增加, 而同时干扰YAP后迁移侵袭能力受到抑制.
结论: Ezrin在胃癌中可能起类似癌基因的作用, 其可能通过上调Hippo通路的下游蛋白YAP促进胃癌的发生发展与侵袭转移.
核心提示: 从患者病理组织切片的免疫组织化学分析及体外相关细胞实验, 证实Ezrin可能通过上调Hippo通路的下游蛋白YAP(Yes-associated protein)促进胃癌的发生、发展.
引文著录: 单汉国, 黄昌浩, 黄笛鸣. Ezrin蛋白通过上调YAP的表达促进胃癌的侵袭转移. 世界华人消化杂志 2015; 23(23): 3683-3690
Revised: June 23, 2015
Accepted: July 6, 2015
Published online: August 18, 2015
AIM: To explore the interactions of Ezrin and Hippo/Yes-associated protein (YAP) in the invasion and metastasis of gastric cancer.
METHODS: Immunohistochemistry (IHC) was used to determine the protein expression of Ezrin and YAP in 209 gastric cancer tissues. MTT assay was carried out to evaluate the effect of Ezrin overexpression with or without siYAP treatment on cell proliferation. Transwell assays were implemented to assess the impact of Ezrin overexpression with or without siYAP on cell migration and invasion.
RESULTS: IHC staining showed that Ezrin and YAP expression was up-regulated in primary gastric cancer compared with their adjacent normal tissues and positively correlated with tumor occurrence, development and metastasis. MTT assay showed that overexpression of Ezrin increased cell proliferation, and knockdown of YAP inhibited cell proliferation. Transwell assays demonstrated that the ectopic expression of Ezrin in SGC7901 cells promoted cell migration and invasion, and knockdown of YAP inhibited cell migration and invasion.
CONCLUSION: Ezrin functions as an oncogene in gastric cancer and can increase YAP protein expression, which in turn up-regulates the expression of the downstream molecules of the Hippo pathway to promote invasion and metastasis of gastric cancer.
- Citation: Shan HG, Huang CH, Huang DM. Ezrin promotes invasion and metastasis of gastric cancer by up-regulating YAP protein expression. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3683-3690
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3683.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3683
胃癌是人类最常见的恶性肿瘤之一, 其发病率和死亡率在所有全球癌症中分别高居第4位和第3位[1]. 由于肿瘤本身的侵袭与淋巴结转移以及术后的复发转移现象, 都给常规治疗带来了极大的困难, 并直接导致了胃癌患者整体的不良预后和较高死亡率[2]. 近来的许多研究已经极大地改善了对胃癌发病机制的认识, 但影响其转移的关键因素还不是很清楚. 因此, 相关的潜在分子调控机制还亟需进一步深入研究, 而这无疑将会促进针对胃癌转移患者早期诊断和有效治疗的技术创新.
ERM(Ezrin-radixin-moesin)为细胞骨架连接蛋白, 对细胞黏附、生长、分化、信号转导等起重要的调节作用[3,4]. 其中Ezrin蛋白在肿瘤的转移中发挥重要作用[5,6]. 目前国内外多项研究[7-15]表明, Ezrin在骨肉瘤、胰腺癌、前列腺癌、皮肤癌、胃癌和乳腺癌等多种肿瘤中高表达, 与肿瘤的发生发展、侵袭转移和预后等密切相关. Hippo通路是近年来在果蝇体内发现的一条新的细胞信号通路, 在细胞增殖与凋亡、组织器官大小及肿瘤发生方面发挥重要作用. 研究[16-18]表明, Hippo通路在肺癌、胃癌、肝癌等多种肿瘤中受到抑制. 从果蝇到哺乳动物体, 大多数Hippo通路分子组成高度保守, 包括Mst、WW45、Mob、Lats、YAP(Yes-associated protein)/TAZ及TEAD[19]. YAP蛋白是Hippo通路中一个起关键作用的下游蛋白, 与转录因子TEAD结合后促进某些基因的表达, 发挥促进细胞生长和抑制细胞凋亡的作用, 最终影响器官的大小以及肿瘤的形成[20]. 虽然Ezrin蛋白及Hippo/YAP通路在胃癌的发生发展中都有重要作用, 但对其双方是否有交互作用及其分子机制尚不明确.
收集2010-01/2014-12南华大学附属第二医院胃癌患者经手术切除的组织样本209例, 其中高分化腺癌65例, 中分化腺癌93例, 低分化腺癌46例, 未分化腺癌5例; 男137例, 平均年龄48.7岁(32-79岁), 女72例, 平均年龄45.7岁(38-77岁). 临床分期根据第七版《AJCC肿瘤分期手册》的标准, Ⅰ期72例, Ⅱ期56例, Ⅲ期42例, Ⅳ期39例. 有淋巴结转移者98例. 所有患者手术治疗前未进行放疗或化疗, 组织取材避开癌块肿瘤中心坏死组织及深部结缔组织、肌组织. 标本临床资料完整并经病理医师诊断为胃癌. 研究经南华大学附属第二医院伦理委员会审核批准, 所有患者均签署知情同意书. 羊抗人Ezrin抗原特异性单克隆抗体购自CST公司; 鼠抗人YAP抗原特异性单克隆抗体购自Santa Cruz公司; SP免疫组织化学试剂盒及DAB显色试剂盒等购自福州迈新(Maixin)生物技术开发公司; 细胞培养基RPMI 1640购自GIBCOBRL公司; 胎牛血清购自GIBCOBRL公司.
1.2.1 细胞培养: 人胃癌细胞系SGC7901(购自上海中科院)贴壁培养于含10%胎牛血清、0.03%L-谷氨酰胺及青、链霉素(各为100000 U/L)的相应培养基中, 于37 ℃, 50 mL/L CO2饱和湿度培养箱中培养, 隔天传代1次.
1.2.2 细胞转染: 转染前1 d, 接种1×105(取决于细胞的类型)细胞于35 mm皿上, 5 mL的培养基. 转染时细胞能覆盖率达40%-80%. 培养细胞24 h. 转染时, 利用Opti-MEM培养基稀释溶解于TE缓冲液(pH 7-8)的2 μg DNA, 最终的体积为200 μL. 加入5 μL转染试剂于DNA溶液中. 振荡混匀10 s. 室温下, 孵育15-30 min. 在复合物孵育的同时, 轻轻的吸弃细胞培养液, 用4 mL PBS洗涤1次. 加入2 mL完全培养基, 立即将转染复合物混匀并转入35 mm培养皿中. 培养孵育细胞和转染复合物6 h, 轻轻吸弃培养基, 用4 mL PBS洗涤1次. 加入新鲜的培养基. 培养48 h后, 检测转染细胞的表达.
1.2.3 逆转录聚合酶链反应: 用RNAiso™ Plus试剂提取细胞内总RNA, 再以RNA为模板逆转录生成单链cDNA. PCR仪设置反应程序为37 ℃, 15 min, 85 ℃, 5 s, -20 ℃保存. 随后以cDNA为模板进行荧光定量PCR(体系为: 95 ℃预变性10 min、95 ℃ 30 s、56 ℃ 20 s、72 ℃ 30 s, 共39个循环). 荧光定量PCR引物: RRM2上游引物: 5'-TGCCTGGCCTCACATTTTCT-3', 下游引物: 5'-TCCCAATGAGCTTCACAGGC-3'; GAPDH上游引物: 5'-ATGGGGAAGGTGAAGGTCGGAGT-3', 下游引物: 5'-TGACAAGCTTCCCGTTCTCAGCC-3'. 以GAPDH为阳性内参基因, 校正cDNA模板的细胞拷贝数, 计算相对量采用2-△△Ct方法, △Ct目标基因 = Ct目标基因-Ct同一样本GAPDH; △△Ct目标基因 = 处理组△Ct目标基因-对照组△Ct目标基因.
1.2.4 Western blot: 用PBS洗3次, 将细胞刮下, 加入100 μL Ripa裂解液. 冰浴20 min, 16000 r/min离心10 min. 取上清液, 采用蛋白质定量试剂盒(Bradford, BioRad)法定量蛋白质浓度. 加入上样缓冲液煮沸5 min. 10%SDS-PAGE电泳分离后转至硝酸纤维素膜上, 5%脱脂牛奶室温封闭2 h. 4 ℃一抗(1:1000稀释)孵育过夜. TBST洗膜后加入二抗(1:15000稀释)室温孵育1 h. 使用Odyssey®Infrared Imaging System进行检测.
1.2.5 MTT法: 于孵育结束前3-4 h, 每孔加入MTT液10 μL. 继续培养3-4 h后, 吸出上清100 μL, 加入二甲基亚砜(DMSO)100 μL. 震荡5 min后, 用酶标仪(BioRAD 450型微孔板判读仪)测吸光度A(测量波长570 nm, 参考波长655 nm).
1.2.6 Transwell实验: 在Transwell小室(Costar公司产品)的反面涂上FN(用PBS 1:100稀释), 倒扣于操作台上; 3 h后于滤膜上包被30 μL Matrigel(购自BD Biosciences, 用培养基稀释1:5后使用), 37 ℃饱和湿度温箱中聚合2 h(做Transwell迁移实验时不加Matrigel); 将状态良好的细胞计数后, 在Transwell小室的上室中加入200 μL细胞悬液(含2×105个细胞); 在Transwell小室的下室中加入600 μL含有10%FBS的RPMI 1640细胞培养液, 作为细胞迁移侵袭的趋化因子; 37 ℃、50 mL/L CO2浓度、饱和湿度的温箱中培养48 h; 去除滤膜上的Matrigel胶和细胞, 4%多聚甲醛固定、结晶紫染色后, 100倍光镜下随机挑取5个视野计滤膜下表面细胞数, 取平均数代表细胞的迁移侵袭能力.
1.2.7 免疫组织化学检测: 采用链霉菌抗生物蛋白-过氧化物酶免疫组织化学法(S-P法)检测Ezrin与YAP的表达. 取石蜡包埋组织, 制作厚度4 μm组织切片, 经常规脱蜡、水化和抗原修复. 以H2O2阻断内源性过氧化物酶活性, 滴加1:100稀释的Ezrin与YAP特异性抗体(一抗), 4 ℃过夜. 次日滴加SP标记二抗, 37 ℃孵育1 h, 依次加入DAB和苏木素染色, 并常规脱水和透明封片. 结果进行乘积法评分标准计数阳性细胞百分率: 每例标本选择10个含有阳性细胞的高倍视野(400×)分别计数100个肿瘤细胞, 取其平均值计算阳性细胞百分率. 0为无阳性细胞; 1为阳性细胞<25%; 2为阳性细胞25%-49%; 3为阳性细胞50%-74%; 4为阳性细胞≥75%. 染色强度: 0为阴性; 1为浅黄色; 2为黄色; 3为棕黄色或棕黑色. 染色指数为阳性细胞百分率和染色强度之积, 0-6分为阴性/低表达, 标记为"-", 7-12分为阳性/高表达, 标记为"+".
统计学处理 实验数据输入SPSS16.0或者Graphpad Prism 5.0统计软件进行统计学分析, 组间差异分析使用独立样本完全随机设计双尾t检验(Student's t test)和Pearson's相关性分析, 多组样本差异分析采用单因素多变量方差分析(ANOVA), P<0.05为差异有统计学意义.
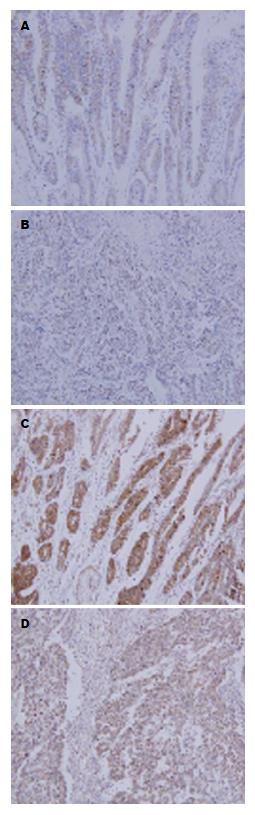
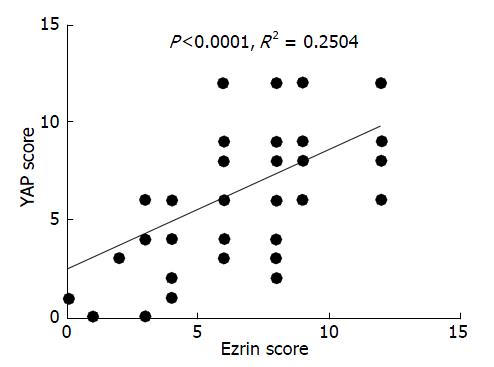
免疫组织化学结果显示, Ezrin蛋白在胃癌组织中高表达, 且主要定位于细胞浆(图1A, B), 其阳性表达与胃癌患者的淋巴结转移, TNM分期及肿瘤远端转移(表1). YAP蛋白在胃癌组织中高表达, 其主要定位于细胞核(图1C, D), 其阳性表达与胃癌患者的分化程度, 淋巴结转移, TNM分期及肿瘤远端转移(表1). 对Ezrin与YAP的蛋白表达水平进一步进行统计分析, 发现两者之间存在正相关的关系(P<0.05)(图2).
| 临床资料 | n | Ezrin | YAP | ||||
| - | + | P值 | - | + | P值 | ||
| n | 209 | 99 | 110 | 96 | 113 | ||
| 性别 | 0.364 | 0.422 | |||||
| 男 | 137 | 64 | 73 | 62 | 75 | ||
| 女 | 72 | 35 | 37 | 34 | 36 | ||
| 年龄(岁) | 0.276 | 0.576 | |||||
| <65 | 95 | 54 | 41 | 46 | 49 | ||
| ≥65 | 114 | 45 | 69 | 50 | 64 | ||
| 分化程度 | 0.134 | 0.012 | |||||
| 高分化 | 65 | 31 | 34 | 38 | 27 | ||
| 中分化 | 93 | 42 | 51 | 48 | 45 | ||
| 低分化 | 46 | 24 | 22 | 10 | 36 | ||
| 未分化 | 5 | 2 | 3 | 0 | 5 | ||
| 淋巴结转移 | 0.008 | 0.036 | |||||
| 无 | 111 | 75 | 36 | 64 | 47 | ||
| 有 | 98 | 24 | 74 | 32 | 66 | ||
| TNM分期 | <0.001 | <0.001 | |||||
| Ⅰ | 72 | 43 | 29 | 38 | 34 | ||
| Ⅱ | 56 | 31 | 25 | 35 | 21 | ||
| Ⅲ | 42 | 19 | 23 | 21 | 21 | ||
| Ⅳ | 39 | 6 | 33 | 2 | 37 | ||
| 远端转移 | <0.001 | <0.001 | |||||
| 无 | 170 | 93 | 77 | 94 | 76 | ||
| 有 | 39 | 6 | 33 | 2 | 37 | ||
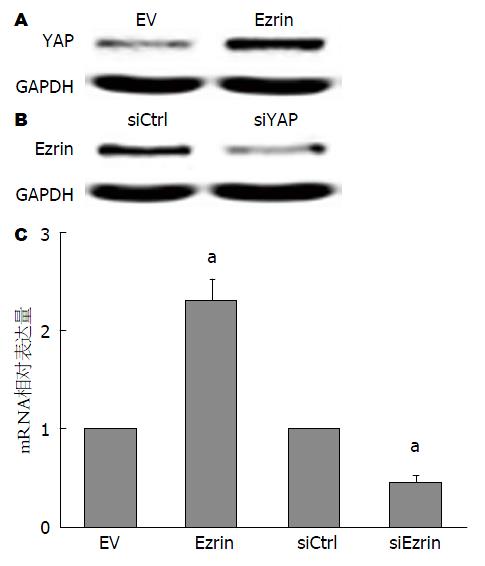
为了进一步验证Ezrin与YAP表达之间的关系并探索其潜在调控机制, 采用过表达和干扰Ezrin处理人胃癌细胞系SGC7901. Western blot和逆转录聚合酶链反应(Real-time PCR, RT-PCR)结果显示: 过表达Ezrin后YAP蛋白和mRNA表达水平上调(图3A, C), 干扰Ezrin后YAP蛋白和mRNA表达水平下调(图3B, C).
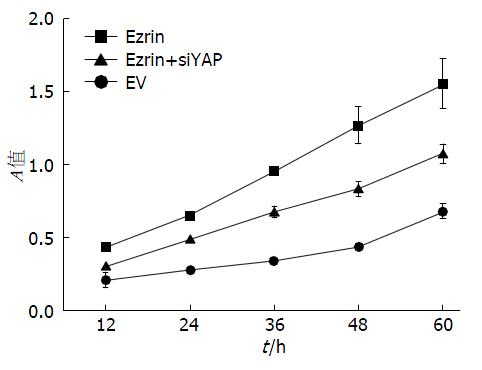
采用MTT法测定胃癌细胞SGC7901生长曲线来检测细胞生长增殖能力, 结果显示: 与对照组相比较, 过表达Ezrin后细胞的生长增殖能力明显升高, 而同时过表达Ezrin和干扰YAP组, 细胞的生长增殖能力较Ezrin组弱(图4).
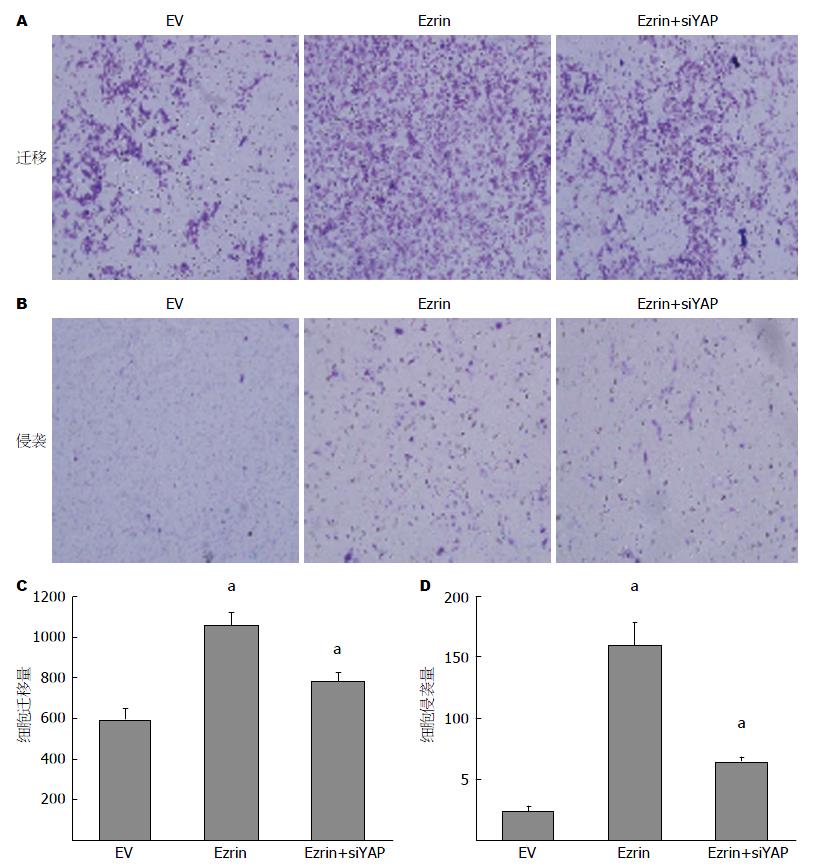
通过Transwell迁移(未铺Matrigel)和侵袭(铺有Matrigel)实验进一步检测了Ezrin和YAP在细胞迁移侵袭中的作用, 结果显示Ezrin能够明显促进胃癌细胞的迁移侵袭能力, 而过表达Ezrin的同时干扰YAP, 其迁移侵袭能力较过表达Ezrin组受到抑制(图5).
侵袭和转移是恶性肿瘤的主要生物学特征, 是导致患者临床治疗失败和死亡的最主要原因. Ezrin是ERM蛋白家族的一份子, 位于染色体上6q25.2-q26, 总长3166 bp, 编码585种氨基酸. 研究[3,4,6]发现, Ezrin主要通过细胞信号份子和跨膜信号转导通路调节细胞的黏附、生长、分化、信号转导等活动, 从而在肿瘤的发生发展和侵袭转移中扮演重要角色. Köbel等[9]研究结果表明, Ezrin的蛋白表达水平较高时, 肿瘤的侵袭和转移能力较强, 反之, 则肿瘤侵袭转移能力较弱. 以往的研究[12,14,21]表明, Ezrin能促进胃癌的发生发展和转移, Jin等[12]发现Ezrin蛋白在胃癌组织中高表达, 其在转移性胃癌细胞中主要定位于细胞浆和细胞膜, 而在非癌细胞中主要定位于细胞浆. Ezrin蛋白的表达水平与胃癌的淋巴结转移和肿瘤临床分期正相关, 高表达的Ezrin将导致患者的不良预后. 与其相似的, 体外研究[22]结果表明, 在胃癌细胞株中抑制Ezrin的表达能够有效抑制细胞的迁移和侵袭能力. 但其对胃癌侵袭转移的具体调控机制报道的尚不多.
Hippo通路是最先在果蝇体内发现的一条新的细胞信号通路, 已有研究[16-18,23-25]表明, 其在抑制细胞增殖和促进细胞凋亡过程中发挥重要作用, 在多种癌症中起肿瘤抑制效果. YAP蛋白作为Hippo通路中一个关键的下游蛋白, 可以与转录因子TEAD结合诱导靶基因表达, 从而促进细胞增殖, 诱导细胞的癌变, 与肿瘤的发生发展密切相关[20,26-30]. 在Hippo通路中, YAP通过活化另一成员Mst, 再经过一系列的级联磷酸化反应磷酸化其他核心成员. 在没有Hippo相关刺激因子刺激的情况下, 非磷酸化状态的YAP入核与转录激活因子TEAD/TEF家族结合, 从而调节靶基因的表达[27]. 另外, Angus等[23]发现YAP蛋白在诱导细胞上皮间质转化中发挥着重要作用. 以往研究[16,25]表明, YAP在胃癌组织中高表达, 并与胃癌的发生发展正相关. 但关于Ezrin与Hippo/YAP之间是否存在联系尚不清楚.
本研究首先检测了Ezrin和YAP蛋白在胃癌组织中的表达, 结果显示Ezrin和YAP蛋白在胃癌组织中高表达. Ezrin蛋白与胃癌患者的淋巴结转移, TNM分期及远端转移相关, YAP蛋白与胃癌患者的分化程度, 淋巴结转移, TNM分期及远端转移相关, 同时Ezrin与YAP蛋白之间存在正相关的关系. 为了进一步研究其相关调控分子机制, 研究组选取了人胃癌细胞系SGC7901进行下一步实验. 首先过表达和干扰Ezrin后, 发现YAP的蛋白和mRNA表达水平出现了相应的升高或降低. 随后通过MTT和Transwell检测发现, 过表达Ezrin后胃癌细胞的增殖、迁移和侵袭能力增加, 而同时干扰YAP时, 其增殖、迁移和侵袭能力受到抑制. 这些结果提示Ezrin能促进胃癌细胞的增殖、迁移、侵袭和转移, 这与以往的研究[12,22]相似, 其对胃癌的恶性能力的影响可能是通过上调Hippo通路中YAP的表达来实现的, 但其与Hippo通路其他的核心组件之间的作用机制还有待进一步研究.
总之, Ezrin蛋白在胃癌中高表达, 其可能通过上调Hippo通路的下游蛋白YAP促进胃癌的发生发展与侵袭转移, 为进一步探讨胃癌的发生发展和侵袭转移机制提供了实验和理论依据.
以往研究表明, Ezrin及YAP(Yes-associated protein)蛋白在多种肿瘤中高表达, 与肿瘤的发生发展、侵袭转移和预后等密切相关, 但对其双方是否有交互作用及其分子机制尚不明确.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
肿瘤的侵袭转移是导致患者不良预后和较高死亡率的重要因素, 但关于其发生机制一直困扰着研究者. 而与其侵袭转移相关的Ezrin蛋白和Hippo/YAP通路一直是生物学和医学领域中的研究热点、重点.
Jin等和Wang等分别从患者组织的免疫组织化学染色分析和体外细胞实验证实了Ezrin蛋白在胃癌的发生发展中起类似癌基因的作用, 其在转移性胃癌细胞中主要定位于细胞浆和细胞膜, 而在非癌细胞中主要定位于细胞浆.
本研究表明Ezrin和YAP蛋白可能成为影响胃癌预后的新靶点, 同时为进一步探讨胃癌的发生发展和侵袭转移机制提供了实验和理论依据.
本研究发现Ezrin和YAP在胃癌组织中高表达, 与肿瘤的侵袭能力明显相关. 证实Ezrin可能通过上调Hippo通路的下游蛋白YAP促进胃癌的发生、发展. 实验设计合理, 结果可靠.
编辑: 韦元涛 电编:都珍珍
| 1. | Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87-108. [PubMed] [DOI] |
| 2. | Youn HG, An JY, Choi MG, Noh JH, Sohn TS, Kim S. Recurrence after curative resection of early gastric cancer. Ann Surg Oncol. 2010;17:448-454. [PubMed] [DOI] |
| 3. | Louvet-Vallée S. ERM proteins: from cellular architecture to cell signaling. Biol Cell. 2000;92:305-316. [PubMed] |
| 4. | Bretscher A, Edwards K, Fehon RG. ERM proteins and merlin: integrators at the cell cortex. Nat Rev Mol Cell Biol. 2002;3:586-599. [PubMed] [DOI] |
| 5. | Yu Y, Khan J, Khanna C, Helman L, Meltzer PS, Merlino G. Expression profiling identifies the cytoskeletal organizer ezrin and the developmental homeoprotein Six-1 as key metastatic regulators. Nat Med. 2004;10:175-181. [PubMed] [DOI] |
| 6. | Khanna C, Wan X, Bose S, Cassaday R, Olomu O, Mendoza A, Yeung C, Gorlick R, Hewitt SM, Helman LJ. The membrane-cytoskeleton linker ezrin is necessary for osteosarcoma metastasis. Nat Med. 2004;10:182-186. [PubMed] [DOI] |
| 7. | Hunter KW. Ezrin, a key component in tumor metastasis. Trends Mol Med. 2004;10:201-204. [PubMed] [DOI] |
| 8. | Valdman A, Fang X, Pang ST, Nilsson B, Ekman P, Egevad L. Ezrin expression in prostate cancer and benign prostatic tissue. Eur Urol. 2005;48:852-857. [PubMed] [DOI] |
| 9. | Köbel M, Gradhand E, Zeng K, Schmitt WD, Kriese K, Lantzsch T, Wolters M, Dittmer J, Strauss HG, Thomssen C. Ezrin promotes ovarian carcinoma cell invasion and its retained expression predicts poor prognosis in ovarian carcinoma. Int J Gynecol Pathol. 2006;25:121-130. [PubMed] [DOI] |
| 10. | Fan LL, Chen DF, Lan CH, Liu KY, Fang DC. Knockdown of ezrin via RNA interference suppresses Helicobacter pylori-enhanced invasion of gastric cancer cells. Cancer Biol Ther. 2011;11:746-752. [PubMed] |
| 11. | Wu B, Li J, Huang D, Wang W, Chen Y, Liao Y, Tang X, Xie H, Tang F. Baicalein mediates inhibition of migration and invasiveness of skin carcinoma through Ezrin in A431 cells. BMC Cancer. 2011;11:527. [PubMed] [DOI] |
| 12. | Jin J, Jin T, Quan M, Piao Y, Lin Z. Ezrin overexpression predicts the poor prognosis of gastric adenocarcinoma. Diagn Pathol. 2012;7:135. [PubMed] [DOI] |
| 13. | Ghaffari A, Hoskin V, Szeto A, Hum M, Liaghati N, Nakatsu K, LeBrun D, Madarnas Y, SenGupta S, Elliott BE. Erratum to: "A novel role for ezrin in breast cancer angio/lymphangiogenesis". Breast Cancer Res. 2015;17:9. [PubMed] [DOI] |
| 14. | Piao J, Liu S, Xu Y, Wang C, Lin Z, Qin Y, Liu S. Ezrin protein overexpression predicts the poor prognosis of pancreatic ductal adenocarcinomas. Exp Mol Pathol. 2015;98:1-6. [PubMed] [DOI] |
| 15. | Zhu J, Feng Y, Ke Z, Yang Z, Zhou J, Huang X, Wang L. Down-regulation of miR-183 promotes migration and invasion of osteosarcoma by targeting Ezrin. Am J Pathol. 2012;180:2440-2451. [PubMed] [DOI] |
| 16. | Zhou GX, Li XY, Zhang Q, Zhao K, Zhang CP, Xue CH, Yang K, Tian ZB. Effects of the hippo signaling pathway in human gastric cancer. Asian Pac J Cancer Prev. 2013;14:5199-5205. [PubMed] |
| 17. | You B, Yang YL, Xu Z, Dai Y, Liu S, Mao JH, Tetsu O, Li H, Jablons DM, You L. Inhibition of ERK1/2 down-regulates the Hippo/YAP signaling pathway in human NSCLC cells. Oncotarget. 2015;6:4357-4368. [PubMed] |
| 18. | Li L, Wang J, Zhang Y, Zhang Y, Ma L, Weng W, Qiao Y, Xiao W, Wang H, Yu W. MEK1 promotes YAP and their interaction is critical for tumorigenesis in liver cancer. FEBS Lett. 2013;587:3921-3927. [PubMed] [DOI] |
| 19. | Zheng T, Wang J, Jiang H, Liu L. Hippo signaling in oval cells and hepatocarcinogenesis. Cancer Lett. 2011;302:91-99. [PubMed] [DOI] |
| 20. | Huang J, Wu S, Barrera J, Matthews K, Pan D. The Hippo signaling pathway coordinately regulates cell proliferation and apoptosis by inactivating Yorkie, the Drosophila Homolog of YAP. Cell. 2005;122:421-434. [PubMed] [DOI] |
| 21. | Li L, Wang YY, Zhao ZS, Ma J. Ezrin is associated with gastric cancer progression and prognosis. Pathol Oncol Res. 2011;17:909-915. [PubMed] [DOI] |
| 22. | Wang HJ, Zhu JS, Zhang Q, Guo H, Dai YH, Xiong XP. RNAi-mediated silencing of ezrin gene reverses malignant behavior of human gastric cancer cell line SGC-7901. J Dig Dis. 2009;10:258-264. [PubMed] [DOI] |
| 23. | Angus L, Moleirinho S, Herron L, Sinha A, Zhang X, Niestrata M, Dholakia K, Prystowsky MB, Harvey KF, Reynolds PA. Willin/FRMD6 expression activates the Hippo signaling pathway kinases in mammals and antagonizes oncogenic YAP. Oncogene. 2012;31:238-250. [PubMed] [DOI] |
| 24. | Yu FX, Zhang Y, Park HW, Jewell JL, Chen Q, Deng Y, Pan D, Taylor SS, Lai ZC, Guan KL. Protein kinase A activates the Hippo pathway to modulate cell proliferation and differentiation. Genes Dev. 2013;27:1223-1232. [PubMed] [DOI] |
| 25. | Xu ZP, Zhu JS, Zhang Q, Wang XY. A breakdown of the Hippo pathway in gastric cancer. Hepatogastroenterology. 2011;58:1611-1617. [PubMed] [DOI] |
| 26. | Dong J, Feldmann G, Huang J, Wu S, Zhang N, Comerford SA, Gayyed MF, Anders RA, Maitra A, Pan D. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 2007;130:1120-1133. [PubMed] [DOI] |
| 27. | Zhao B, Ye X, Yu J, Li L, Li W, Li S, Yu J, Lin JD, Wang CY, Chinnaiyan AM. TEAD mediates YAP-dependent gene induction and growth control. Genes Dev. 2008;22:1962-1971. [PubMed] [DOI] |
| 28. | Goulev Y, Fauny JD, Gonzalez-Marti B, Flagiello D, Silber J, Zider A. SCALLOPED interacts with YORKIE, the nuclear effector of the hippo tumor-suppressor pathway in Drosophila. Curr Biol. 2008;18:435-441. [PubMed] [DOI] |