修回日期: 2015-07-01
接受日期: 2015-07-06
在线出版日期: 2015-08-08
目的: 本研究探讨进展期胃癌患者放疗期间的人体成分变化及其与营养风险筛查评分值(nutrition risk screen 2002, NRS-2002)之间的相关性.
方法: 采用前瞻性的方法, 以2013-06/2014-06在复旦大学附属肿瘤医院放疗科40例胃癌患者作为研究对象. 采用生物电阻抗方法分析患者放疗期间人体成分的变化, 同时进行营养风险筛查及评估.
结果: 放疗期间随着观察时间的变化, 体质量(current weight, CW)、体质量指数(body mass index, BMI)、体质量丢失(weight loss)、脂肪组织指数(fat mass index, FMI)、去脂组织指数(fat-free mass index, FFMI)及体细胞量(body cell mass, BCM)差异均有统计学意义(P<0.05), 骨骼肌量(skeletal muscle mass, SM)及相位角(phase angle, PA)差异均无统计学意义(P>0.05); 无营养风险组(A组)26例, 有营养风险组(B组)14例, 两组在放疗期间体质量丢失, 去脂组织指数, 骨骼肌量, 相位角等人体成分指标变化差异有统计学意义(P<0.05).
结论: 胃癌患者在放疗期间营养状况有不同程度的损伤, 且有营养风险的患者人体成分指标明显下降, 因此, 对放疗期间的患者进行营养风险筛查以及对营养风险的患者实施营养干预极为重要.
核心提示: 胃癌患者在放疗期间营养状况有不同程度的损伤, 且有营养风险的患者人体成分指标明显下降, 因此, 对放疗期间的患者进行营养风险筛查以及对营养风险的患者实施营养干预极为重要.
引文著录: 丁慧萍, 汪琼, 吴焱, 钱泳, 凌轶群. 生物电阻抗分析在胃癌患者放疗期间营养评估中的应用. 世界华人消化杂志 2015; 23(22): 3597-3603
Revised: July 1, 2015
Accepted: July 6, 2015
Published online: August 8, 2015
AIM: To study changes in body composition during radiotherapy for gastric cancer and explore the relationship between nutrition risk screen 2002 (NRS-2002) and changes in body composition.
METHODS: From June 2013 to June 2014, 40 patients with gastric cancer received radioth-
erapy in Department of Radiation, Shanghai Cancer Center. Body composition was evaluated during radiotherapy using multifrequency bioelectrical impedance analysis.
RESULTS: There were significant differences for changes in current weight (CW), body mass index (BMI), weight loss, fat mass index (FMI), fat-free mass index (FFMI), and body cell mass (BCM) during radiotherapy(P < 0.05). There was no significant difference in skeletal muscle mass (SM) or phase angle (PA) (P > 0.05). Changes in weight, FFMI, SM, and PA during radiotherapy significantly differed between patients with nutritional risk and those without.
CONCLUSION: Nutritional deterioration was found during radiotherapy and body composition was significantly decreased in patients with nutritional risk. It is very important to make rational nutritional plan and intervene effectively for gastrointestinal cancer patients.
- Citation: Ding HP, Wang Q, Wu Y, Qian Y, Ling YQ. Validity of bioelectrical impedance analysis to assess nutritional status in patients with gastric cancer during radiotherapy. Shijie Huaren Xiaohua Zazhi 2015; 23(22): 3597-3603
- URL: https://www.wjgnet.com/1009-3079/full/v23/i22/3597.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i22.3597
肿瘤患者常存在营养不良, 约有40%的患者在确诊时已经出现不同程度的营养不良. 胃癌患者由于肿瘤所在位置的特殊性, 其营养不良的发生率较其他肿瘤患者更高. 有研究[1]发现, 营养不良患者的术后病死率、并发症的发生率和住院时间均高于营养状况良好者. 生物电阻抗(bioelectrical impedance analysis, BIA)是评估人体成分安全无创的方法. 近年来研究[2]表明, 人体成分分析对于手术患者的营养状况和预后评判有重要参考意义, 尤其在评价消化系、肺、胸膜和输尿管等肿瘤患者的人体组成和营养状况方面很有价值[3]. 因此, 本研究旨在探讨胃癌患者放疗期间人体成分的变化, 并研究与营养风险筛查(nutrition risk screen 2002, NRS-2002)评分值之间的相关性, 从而为胃癌患者的营养干预提供合理的理论依据.
以2013-06/2014-06在复旦大学附属肿瘤医院放疗科住院行放疗的40例胃癌患者作为研究对象. 其中, 男23例, 女17例, 年龄55.2岁±11.03岁. 入选标准: (1)经病理检查确诊为胃癌, 已行根治性手术; (2)知晓病情; (3)具有良好的理解及沟通能力; (4)自愿参与本研究. 排除标准: (1)合并其他肿瘤; (2)肿瘤复发; (3)心、肺、肾、肝功能不全者; (4)代谢性疾病者. 所有纳入研究的患者均取得知情同意. 所有研究对象在基线调查时进行营养风险筛查, NRS-2002评分值<3分为无营养风险, 分为无营养风险组(A组), NRS-2002评分值≥3分为有营养风险, 分为有营养风险组(B组).
1.2.1 营养风险筛查: 应用欧洲肠外肠内营养学会(European Society of Parenteral Enteral Nutrition, ESPEN)推荐的筛查工具NRS-2002进行营养风险筛查, 由专业调查人员对所有对象进行一般情况调查、人体测量及问诊, 填写营养风险筛查表格.
1.2.2 人体测量: 患者身高(height)测量精确到0.1 cm(赤足), 体质量(weight)精确到0.1 kg(赤足). 体质量指数(body mass index, BMI)(kg/m2) = 体质量/身高2; 体质量丢失(weight loss)(%) = (通常体质量-目前体质量)/以往体质量×100. 放疗前测量1次, 放疗开始后每周固定时间测量1次, 共测量6次.
1.2.3 人体成分分析: 采用韩国Biospace InbodyS10人体成分分析仪进行人体成分检测. 测量指标包括脂肪组织(fat mass, FM)、去脂组织(free fat mass, FFM)、体细胞量(body cell mass, BCM)、骨骼肌量(skeletal muscle mass, SM)及相位角(phase angle, PA)等. 所有研究对象测量前2 h禁食, 平卧5 min开始测量, 测量前用酒精将皮肤和电极接触点擦湿. 本研究的人体成分仪器测定均由专人经过统一培训后进行操作. 同人体测量时间.
脂肪组织指数(fat mass index, FMI), 去脂组织指数(fat-free mass index, FFMI)均用以下公式计算: FFMI(kg/m2) = FFM(kg)/height2(m2), FMI(kg/m2) = FM(kg)/height2(m2)[4].
统计学处理 应用SPSS13.0软件对数据进行统计学分析. 测量方法采用重复测定方差分析, 分别进行组内比较及组间比较, 测量值用mean±SD表示, P<0.05为差异有统计学意义.
研究对象基线资料如表1所示, 共40例胃癌患者纳入本研究, 其中男23例, 女17例, 年龄55.2岁±11.03岁. 身高和体质量分别为: 1.66 cm±0.09 cm和59.5 kg±11.2 kg, BMI为21.53 kg/m2±3.05 kg/m2. 除身高, 体质量男性与女性之间差异有统计学意义(P<0.05)外, 其他差异均无统计学意义(表1). 如表2所示, A组26例, B组14例. 除体质量、BMI在A组和B组之间差异有统计学意义外, 其他差异均无统计学意义.
| 一般资料 | 合计 | 男 | 女 | P值 |
| 人数 | 40 | 23 | 17 | |
| 年龄(岁) | 55.20±11.03 | 57.93±9.18 | 50.78±12.89 | ≥0.05 |
| 身高(m) | 1.66±0.09 | 1.72±0.06 | 1.56±0.04 | <0.05 |
| 体质量(kg) | 59.50±11.27 | 63.50±11.68 | 52.89±6.81 | <0.05 |
| BMI(kg/m2) | 21.53±3.05 | 21.43±3.04 | 21.53±3.05 | ≥0.05 |
| 一般资料 | 合计 | A组 | B组 | P值 |
| 人数 | 40 | 26 | 14 | |
| 年龄(岁) | 55.2±11.03 | 54.67±9.44 | 57.00±15.90 | ≥0.05 |
| 身高(m) | 1.66±0.09 | 1.66±0.10 | 1.65±0.07 | ≥0.05 |
| 体质量(kg) | 59.5±11.27 | 63.22±10.56 | 50.58±7.86 | <0.05 |
| BMI(kg/m2) | 21.53±3.05 | 22.79±2.50 | 18.50±2.24 | <0.05 |
如表3所示, 放疗期间随着观察时间的变化, 体质量(current weight, CW)、BMI、体质量丢失、FMI、FFMI、BCM差异均有统计学意义(P<0.05), SM及PA差异均无统计学意义(P>0.05).
| 变量 | 基线 | 1 wk | 2 wk | 3 wk | 4 wk | 5 wk | P值 |
| 体质量(kg) | 60.06± 11.27 | 59.56± 11.27 | 59.10± 11.29 | 58.75± 11.33 | 58.16± 11.29 | 57.71± 11.23 | <0.01 |
| BMI(kg/m2) | 21.27± 3.05 | 21.33± 3.05 | 21.38± 3.08 | 21.28± 3.07 | 21.07± 3.03 | 20.92± 2.99 | <0.01 |
| 体质量丢失(%) | 0 | 0.86± 0.16 | 1.54± 1.13 | 2.07± 1.55 | 3.28± 1.55 | 4.03± 1.76 | <0.01 |
| 脂肪组织指数(kg/m2) | 6.48± 2.30 | 6.43± 2.12 | 6.40± 2.30 | 6.46± 2.38 | 6.29± 2.12 | 6.02± 2.02 | <0.05 |
| 去脂组织指数(kg/m2) | 15.30± 1.66 | 15.13± 1.66 | 15.08± 1.65 | 15.17± 1.67 | 15.11± 1.68 | 14.95± 1.61 | <0.05 |
| 体细胞量(kg) | 27.86± 5.21 | 27.31± 5.21 | 27.23± 5.20 | 27.37± 5.07 | 27.01± 4.96 | 26.67± 4.86 | <0.05 |
| 骨骼肌量(kg) | 39.78± 7.49 | 39.58± 7.49 | 39.46± 7.48 | 39.68± 7.34 | 39.36± 7.03 | 39.29± 6.83 | ≥0.05 |
| 相位角(碍) | 5.39± 1.03 | 5.35± 0.98 | 5.31± 1.03 | 5.39± 1.06 | 5.29± 0.94 | 5.24± 0.96 | ≥0.05 |
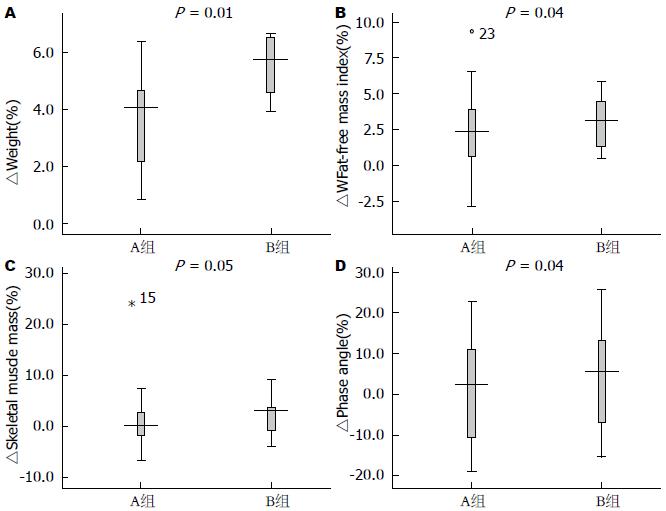
如表4所示, A组与B组在放疗期间人体成分变化整体都呈下降趋势, B组人体成分各指标低于A组. CW、BMI、体质量丢失、FFMI、SM、PA在两组间比较, 差异有统计学意义(P<0.05). 如图1所示, 两组在放疗期间体质量的平均变化分别为: 3.53 kg±1.67 kg和5.53 kg±1.08 kg(P = 0.01); FFMI在放疗期间的平均变化分别为: 2.49 kg/m2±2.91 kg/m2和3.05 kg/m2±1.97 kg/m2(P = 0.04); SM在放疗期间的平均变化分别为1.33 kg±6.83 kg和2.44 kg±4.49 kg(P = 0.05); PA在放疗期间的平均变化分别为: 2.47±12.19和4.53±14.57(P = 0.04). 两组在放疗期间FMI和BCM的平均变化差异无统计学意义, 分别为: 5.33 kg/m2±13.54 kg/m2和4.65 kg/m2±16.49 kg/m2(P = 0.921), 4.28 kg±5.77 kg和3.85 kg±2.27 kg(P = 0.862).
| 变量 | 分组 | 基线 | 1 wk | 2 wk | 3 wk | 4 wk | 5 wk |
| 体质量(kg) | A | 63.62± 10.56 | 62.72± 10.56 | 62.28± 10.47 | 62.00± 10.42 | 61.41± 10.41 | 61.00± 10.32a |
| B | 50.58± 7.86 | 50.58± 7.86 | 49.58± 8.28 | 49.00± 8.34 | 48.42± 8.13 | 47.83± 7.88 | |
| BMI(kg/m2) | |||||||
| A | 22.79± 2.50 | 22.61± 2.50 | 22.45± 2.50 | 22.35± 2.48 | 22.13± 2.46 | 21.99± 2.40a | |
| B | 18.49± 2.24 | 18.30± 2.24 | 18.18± 2.41 | 18.06± 2.42 | 17.87± 2.32 | 17.72± 2.28 | |
| 体质量丢失(%) | A | 0 | 0.81± 0.13 | 1.35± 1.07 | 1.81± 1.36 | 2.90± 1.45 | 3.53± 1.67a |
| B | 0 | 1.01± 0.15 | 2.11± 1.19 | 2.84± 1.96 | 4.42± 1.37 | 5.54± 1.08 | |
| 脂肪组织指数(kg/m2) | |||||||
| A | 7.02± 2.30 | 6.95± 2.30 | 7.04± 2.32 | 6.95± 2.04 | 6.78± 2.08 | 6.50± 2.01 | |
| B | 4.84± 1.43 | 4.77± 1.43 | 4.71± 1.68 | 4.86± 1.60 | 4.81± 1.56 | 4.59± 1.31 | |
| 去脂组织指数(kg/m2) | |||||||
| A | 15.83± 1.46 | 15.66± 1.46 | 15.56± 1.47 | 15.68± 1.54 | 15.62± 1.49 | 15.43± 1.43a | |
| B | 13.70± 1.17 | 13.65± 0.99 | 13.63± 1.32 | 13.60± 1.33 | 13.54± 1.31 | 13.54± 1.17 | |
| 体细胞量(kg) | A | 28.94± 5.32 | 28.39± 5.32 | 28.24± 5.32 | 28.43± 5.19 | 27.96± 5.04 | 27.61± 4.93 |
| B | 24.63± 3.47 | 24.17± 3.67 | 24.17± 3.20 | 24.15± 3.71 | 24.08± 3.47 | 23.85± 2.66 | |
| 骨骼肌量(kg) | A | 41.33± 7.63 | 41.13± 7.63 | 40.88± 7.62 | 41.14± 7.53 | 40.68± 7.11 | 40.57± 6.97a |
| B | 35.44± 5.06 | 35.41± 5.51 | 35.27± 4.91 | 35.20± 5.53 | 35.15± 5.10 | 33.95± 5.10 | |
| 相位角(度) | A | 5.53± 1.09 | 5.45± 1.09 | 5.58± 1.12 | 5.48± 1.04 | 5.36± 0.94 | 5.34± 1.01a |
| B | 5.10± 1.01 | 5.00± 0.71 | 4.98± 0.73 | 4.95± 0.81 | 4.90± 0.73 | 4.82± 0.63 |
目前大多数肿瘤的各阶段标准治疗都需要化疗、放疗或者放化疗联合治疗的介入. 然而这两种治疗方法都存在各自不可避免的不良反应, 这些不良反应可直接或间接地进一步损害患者的营养状态. 患者的营养状态和放、化疗互为影响, 在放疗、化疗同时, 将难以避免地产生急性和慢性毒性反应, 部分不良反应与营养的摄取、吸收和利用障碍相关, 导致肿瘤患者的营养不良. 而营养状态不良的患者倾向出现更为严重的放化疗不良反应和较差的治疗效果[5]. 因此, 我们前瞻性地观察了胃癌患者在放疗期间人体成分的变化, 通过重复测定人体成分, 探讨人体成分中评价营养状况最为合适的指标, 并比较营养风险评分值与人体成分的相关性, 为下一步实施营养干预提供依据.
在本项研究中应用BIA观察A组和B组两组患者在放疗期间人体成分的变化. BIA是目前临床测量人体成分分析的常用技术, 在所观察的人体成分指标中, BCM和FFM通常被认为是评价营养不良最有意义的指标[6]. BCM是细胞内液体和蛋白质的总和, FFM指人体所有的无脂组织, 包括骨骼肌和水分. 研究[7]表明, FFM的降低与营养不良和年龄有关, 而且可作为肿瘤恶病质的风险因子. 但是, FFM和FM会随着年龄、身高、体质量发生变化, 很难确定研究对象是否属于高或者低FFM和FM[8]. VanItallie等[9]表明未经身高校正的FFM和FM不足以评估营养状况. Kyle等[8]研究发现, FFMI和FMI不同于FFM和FM, 消除了身高和体质量的影响, 而且设立了推荐范围. 近年研究表明, FFMI和FMI在评价营养状况方面更为准确. 因此, 本研究采用FFMI和FMI来评价胃癌患者在放疗期间的营养状况. 本研究观察显示, FFMI在放疗期间, 随着观察时间的变化, 第1周开始下降, 第3周有上升, 之后又逐渐下降, 到第5周达到最低, 整个趋势差异有统计学意义, 而FMI在整个放疗期间呈现与FFMI同样的变化. BCM在整个放疗期间, 整体变化趋势与FFMI相同, 差异有统计学意义. 组间比较观察显示, FFMI平均变化率在两组间差异有统计学意义, B组平均变化率明显高于A组.
放疗期间的体质量丢失是营养状况降低的早期信号[10]. 本研究中, 体质量丢失在整个放疗期间, 呈现上升的趋势, 到放疗第5周达到最高. 我们的研究结果与Guren等[11]的研究一致. FFMI、FMI、BCM在整体变化趋势中, 放疗第3周有上升趋势, 可能与在放疗初期, 患者的食欲减退和胃肠道的不良反应尚未出现, 饮食过程中会有意识地增加高蛋白高能量食物的摄入量, 因此在一定程度上补充了机体蛋白质的消耗有关.
不光FFMI和BCM在评估营养状况方面有意义, SM也是非常有价值的指标. Gonzalez等[7]研究证明, 肌少症是较高死亡率的独立风险因子, 而这个结论是在多元COX分析中调整了其他公认的危险因素得出的. 其他研究[12,13]表明, 低SM肿瘤患者在化疗过程中更易出现药物聚集及不良反应. 在肝硬化合并肝细胞癌患者中, 肌少症在控制了其他影响疾病严重程度的因素之后还是死亡率独立的风险因子[14,15]. 因此, 研究[16]一致推断, 与BMI相比, SM可更好的决定死亡率. 本研究中, SM的变化趋势与FFMI一致, 在放疗第1周开始下降, 第3周后开始上升, 然后又逐渐下降, 但是整个变化趋势差异无统计学意义. 组间比较显示, B组SM平均变化率要高于A组, 两者之间差异有统计学意义, 这与FFMI的变化一致. 因此, 有必要在放疗之前对有营养风险的患者实施营养干预, 以减缓在放疗期间营养指标的下降, 改善营养状况, 降低放疗的不良反应.
PA也是近年较热门的研究指标之一. PA可以反映细胞膜能力、细胞内外水分分布情况和BCM水平, 可以用来作为人体的营养指标, 且专业研究[17]显示, 使用PA来预测艾滋病患者、肺癌患者、血透患者、恶质病患者的存活率和监测其疾病进程的能力要优于其他血清或营养体检指标. Paixão等[18]对放疗期间的肿瘤患者做了一项前瞻性的研究, 与BMI相比, 发现体质量丢失与放疗期间PA的变化有密切的联系. 本研究中, PA在放疗期间的变化趋势与上述指标相似, 但是在我们的研究中整个趋势差异无统计学意义. 此项结论可能与本研究样本量过少有关, 而且此次研究中未校正性别和年龄对PA的差异, 可在今后扩大样本量进一步深入地研究. B组在放疗期间PA平均变化率要高于A组, 差异有统计学意义. 整个放疗期间, 体质量、FFMI、SM、PA在两组之间差异有统计学意义, 有营养风险组人体成分平均变化率明显高于无营养风险组. 因此, 人体成分指标如PA、SM等均能作为营养不良评价的参考指标, 但有必要在今后进一步研究中增加样本量, 并判定上述指标评价营养不良的临界值.
总之, 本研究显示, 胃癌患者在放疗期间营养状况有不同程度的损伤, 人体成分指标在放疗期间总体都存在下降趋势, 这与国外很多研究结果相似. 有营养风险的患者人体成分指标明显下降. 因此, 对放疗期间的患者进行营养风险筛查以及对有营养风险和营养不良的患者实施营养干预极为重要.
胃癌患者的营养不良发生率很高, 营养不良患者的术后病死率、并发症的发生率和住院时间均高于营养状况良好者. 人体成分分析对于手术患者的营养状况和预后评判有重要参考意义. 本研究探讨胃癌患者放疗期间人体成分的变化, 以期为胃癌患者的营养干预提供合理的理论依据.
郝丽萍, 副教授, 华中科技大学同济医学院公共卫生学院营养与食品卫生学系
生物电阻抗(bioelectrical impedance analysis, BIA)是评估人体成分安全无创的方法. 近年来研究表明, 人体成分分析对于手术患者的营养状况和预后评判有重要参考意义, 尤其在评价消化系、肺、胸膜和输尿管等肿瘤患者的人体组成和营养状况方面很有价值.
BIA是目前临床测量人体成分分析的常用技术, 在所观察的人体成分指标中, 体细胞量(body cell mass, BCM)和去脂组织(free fat mass, FFM)通常被认为是评价营养不良最有意义的指标. BCM是细胞内液体和蛋白质的总和, FFM指人体所有的无脂组织, 包括骨骼肌和水分.
本研究采用韩国Biospace InbodyS10人体成分分析仪进行人体成分检测, 旨在探讨胃癌患者放疗期间人体成分的变化, 并研究与营养风险筛查评分值之间的相关性, 从而为胃癌患者的营养干预提供合理的理论依据.
本文研究BIA分析在胃癌患者放疗期间营养评估中的应用, 研究结果显示人体成分指标如骨骼肌量(skeletal muscle mass)、相位角(phase angle)等均能作为营养不良评价的参考指标. 本研究选题切合实际, 为后续研究上述指标评价营养不良的临界值奠定基础.
编辑: 韦元涛 电编:闫晋利; BMI: 体质量指数.; 表4 A组与B组人体成分变化比较 (mean±SD); A组: 无营养风险组; B组: 有营养风险组. BMI: 体质量指数..
| 2. | Malecka-Massalska T, Smolen A, Morshed K. Body composition analysis in head and neck squamous cell carcinoma. Eur Arch Otorhinolaryngol. 2014;271:2775-2779. [PubMed] [DOI] |
| 3. | Desport JC, Preux PM, Bouteloup-Demange C, Clavelou P, Beaufrère B, Bonnet C, Couratier PP. Validation of bioelectrical impedance analysis in patients with amyotrophic lateral sclerosis. Am J Clin Nutr. 2003;77:1179-1185. [PubMed] |
| 4. | Kyle UG, Pirlich M, Lochs H, Schuetz T, Pichard C. Increased length of hospital stay in underweight and overweight patients at hospital admission: a controlled population study. Clin Nutr. 2005;24:133-142. [PubMed] [DOI] |
| 6. | Kawaguchi T, Taniguchi E, Itou M, Ibi R, Okada T, Mutou M, Shiraishi S, Uchida Y, Otsuka M, Umeki Y. Body cell mass is a useful parameter for assessing malnutrition and severity of disease in non-ascitic cirrhotic patients with hepatocellular carcinoma or esophageal varices. Int J Mol Med. 2008;22:589-594. [PubMed] |
| 7. | Gonzalez MC, Pastore CA, Orlandi SP, Heymsfield SB. Obesity paradox in cancer: new insights provided by body composition. Am J Clin Nutr. 2014;99:999-1005. [PubMed] [DOI] |
| 8. | Kyle UG, Schutz Y, Dupertuis YM, Pichard C. Body composition interpretation. Contributions of the fat-free mass index and the body fat mass index. Nutrition. 2003;19:597-604. [PubMed] [DOI] |
| 9. | VanItallie TB, Yang MU, Heymsfield SB, Funk RC, Boileau RA. Height-normalized indices of the body's fat-free mass and fat mass: potentially useful indicators of nutritional status. Am J Clin Nutr. 1990;52:953-959. [PubMed] |
| 10. | Ravasco P, Monteiro-Grillo I, Vidal PM, Camilo ME. Dietary counseling improves patient outcomes: a prospective, randomized, controlled trial in colorectal cancer patients undergoing radiotherapy. J Clin Oncol. 2005;23:1431-1438. [PubMed] [DOI] |
| 11. | Guren MG, Tobiassen LB, Trygg KU, Drevon CA, Dueland S. Dietary intake and nutritional indicators are transiently compromised during radiotherapy for rectal cancer. Eur J Clin Nutr. 2006;60:113-119. [PubMed] |
| 12. | Massicotte MH, Borget I, Broutin S, Baracos VE, Leboulleux S, Baudin E, Paci A, Deroussent A, Schlumberger M, Antoun S. Body composition variation and impact of low skeletal muscle mass in patients with advanced medullary thyroid carcinoma treated with vandetanib: results from a placebo-controlled study. J Clin Endocrinol Metab. 2013;98:2401-2408. [PubMed] [DOI] |
| 13. | Prado CM, Lieffers JR, McCargar LJ, Reiman T, Sawyer MB, Martin L, Baracos VE. Prevalence and clinical implications of sarcopenic obesity in patients with solid tumours of the respiratory and gastrointestinal tracts: a population-based study. Lancet Oncol. 2008;9:629-635. [PubMed] [DOI] |
| 14. | Montano-Loza AJ, Meza-Junco J, Prado CM, Lieffers JR, Baracos VE, Bain VG, Sawyer MB. Muscle wasting is associated with mortality in patients with cirrhosis. Clin Gastroenterol Hepatol. 2012;10:166-173, 173.e1. [PubMed] [DOI] |
| 15. | Meza-Junco J, Montano-Loza AJ, Baracos VE, Prado CM, Bain VG, Beaumont C, Esfandiari N, Lieffers JR, Sawyer MB. Sarcopenia as a prognostic index of nutritional status in concurrent cirrhosis and hepatocellular carcinoma. J Clin Gastroenterol. 2013;47:861-870. [PubMed] [DOI] |
| 16. | Kalantar-Zadeh K, Streja E, Molnar MZ, Lukowsky LR, Krishnan M, Kovesdy CP, Greenland S. Mortality prediction by surrogates of body composition: an examination of the obesity paradox in hemodialysis patients using composite ranking score analysis. Am J Epidemiol. 2012;175:793-803. [PubMed] [DOI] |
| 17. | Barbosa-Silva MC, Barros AJ, Wang J, Heymsfield SB, Pierson RN. Bioelectrical impedance analysis: population reference values for phase angle by age and sex. Am J Clin Nutr. 2005;82:49-52. [PubMed] |