修回日期: 2015-05-28
接受日期: 2015-06-10
在线出版日期: 2015-07-28
目的: 探讨低剂量能谱计算机断层扫描(computed tomography, CT)单能量成像联合自适应统计迭代重建(adaptive statistical iterative reconstruction, ASiR)技术在兔VX2肝癌模型中的图像质量及对他的检出价值.
方法: 采用CT引导下穿刺法将VX2肝癌移植瘤植入24只新西兰大白兔肝左叶, 于种植后14 d行能谱CT腹部增强扫描, 采用40%ASiR重建动静脉期70 keV单能量图像, 得到A组和B组图像. 24 h后再对此批兔子行常规100 kV腹部增强扫描, 动静脉期图像使用滤波反投影(filtered back projection, FBP)算法重建, 得到C组和D组图像. 由两名放射学家对4组图像质量采用5分评分制法进行主观评分, 观察者间一致性采用Kappa检验. 测量4组图像背部肌肉标准差作为图像噪声, 测量肝脏肿瘤信噪比(signal to noise ratio, SNR)和对比噪声比(contrast to noise ratio, CNR), A组与C组、B组与D组间均采用配对t检验比较. 并记录两次扫描的CT剂量指数(CT dose index volume, CTDIvol)和有效辐射剂量(effective dose, ED), 亦采用配对t检验比较.
结果: 22只大白兔种植成功, 种植14 d后两种CT扫描均检出肿瘤24个. GSI模式扫描组有效辐射剂量较常规扫描组降低约27%(1.30 mSv±0.09 mSv vs 1.78 mSv±0.13 mSv, P = 0.021). 动脉期图像A组主观评分高于C组(4.09分±0.71分 vs 3.80分±0.67分, P = 0.049). 静脉期图像B组主观评分高于D组(4.16分±0.67分 vs 4.75分±0.65分, P = 0.005). 动脉期A组图像噪声低于C组(7.52 HU±1.12 HU vs 10.83 HU±2.17 HU, P<0.001). 静脉期B组图像噪声低于D组(8.25 HU±1.74 HU vs 11.55 HU±2.86 HU, P<0.001). A组肝肿瘤SNR和CNR均高于C组(P<0.05). B组肝肿瘤CNR高于D组, 两组间SNR差异无统计学意义.
结论: 在兔VX2肝癌模型中, 能谱CT单能量成像联合ASiR技术与常规扫描相比可降低辐射剂量, 并提供良好的图像质量和肝癌病灶显示.
核心提示: 能谱计算机断层扫描(computed tomography)单能量成像可以提高图像对比度并降低伪影, 自适应统计迭代重建算法(adaptive statistical iterative reconstruction, ASiR)重建具有降低噪声的功能, 单能量成像联合ASiR重建可以降低辐射剂量并提供良好的图像质量.
引文著录: 柴亚如, 吕培杰, 高剑波, 刘杰, 阎晓朋. 低剂量能谱计算机断层扫描成像联合迭代重建对兔VX2肝癌模型的应用. 世界华人消化杂志 2015; 23(21): 3421-3426
Revised: May 28, 2015
Accepted: June 10, 2015
Published online: July 28, 2015
AIM: To assess the image quality and lesion detectability of low dose computed tomography spectral imaging combined with adaptive statistical iterative reconstruction (ASiR) in the rabbit VX2 liver tumor model.
METHODS: VX2 liver tumor masses were implanted into the left liver lobe of 24 rabbits by CT guided puncture. Abdominal contrast enhanced CT in spectral imaging mode was performed in these rabbits 14 d after implantation. Twenty-four hours later, contrast enhanced CT in 100-kV tube voltage mode was performed. The images obtained in the first scan were reconstructed with 40% ASiR at 70 keV in arterial phase (group A) and venous phase (group B). The images obtained in the second scan were reconstructed with filtered back projection (FBP) in arterial phase (group C) and venous phase (group D). Two abdominal radiologists independently analyzed the image quality for the four groups using a 5-point scale. Interobserver agreement with regard to image quality was assessed using Cohen's kappa. The image noise of back muscle, signal to noise ratio (SNR) of liver tumor and contrast to noise ratio (CNR) of tumor-normal liver were measured and compared between groups A and C, and groups B and D.
RESULTS: Twenty-two rabbits were successfully implanted with the tumor. Both scans found 24 tumors 14 d after tumor implantation. The effective dose (ED) for the GSI mode and 100 kV mode was 1.30 mSv ± 0.09 mSv and 1.78 mSv ± 0.13 mSv, respectively, which had a significant difference (P = 0.021). The image quality scores in groups A (4.09 ± 0.71) and B (4.16 ± 0.67) were significantly higher than those in groups C (3.80 ± 0.67) and D (4.75 ± 0.65) (P = 0.049, 0.005). The image noise in groups A (7.52 HU ± 1.12 HU) and B (8.25 HU ± 1.74 HU) were significantly lower than those in groups C (10.83 HU ± 2.17 HU) and D (11.55 HU ± 2.86 HU), receptively (P < 0.001 for both). The SNR and CNR in group A were significantly higher than those in group C (P < 0.05 for both). The CNR in group B was significantly higher than in that in group D (P < 0.05). No significant difference was shown between groups B and D with regard to SNR (P > 0.05).
CONCLUSION: CT spectral imaging combined with adaptive statistical iterative reconstruction can reduce radiation dose and provide good image quality and legible lesion display in the rabbit VX2 liver tumor model.
- Citation: Chai YR, Lv PJ, Gao JB, Liu J, Yan XP. Application of low dose computed tomography spectral imaging combined with adaptive statistical iterative reconstruction techniques in rabbit VX2 liver tumor model. Shijie Huaren Xiaohua Zazhi 2015; 23(21): 3421-3426
- URL: https://www.wjgnet.com/1009-3079/full/v23/i21/3421.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i21.3421
固定管电压(100或120 kV)是自计算机断层扫描(computed tomography, CT)进入临床应用以来被广泛采用的标准扫描条件. 2009年能谱CT诞生以来, 能谱成像(gemstone spectral imaging, GSI)成为CT成像领域中最为热门的技术, 通过瞬时双kV切换实现单源同向双能成像, 可以获得物质分离的基物质图像及一系列能量水平的单能量(keV)图像. 单能量图像与常规管电压混能图像相比能够提高图像的对比噪声比(contrast to noise ratio, CNR), 并避免射线硬化伪影[1,2]. 但低keV图像会增加图像噪声[3,4], 影响图像质量. 国内外研究[5-7]显示自适应统计迭代重建算法(adaptive statistical iterative reconstruction, ASiR)可以明显降低图像噪声, 提高图像质量. ASiR技术已在临床中成熟开展, 但利用能谱CT单能量成像联合ASiR技术来降低辐射剂量的相关研究目前尚少. 本文探讨使用低剂量能谱成像扫描参数的单能量成像联合ASiR重建的图像质量及对兔VX2肝癌模型的检出与显示能力, 并与常规扫描图像相比较.
健康新西兰大白兔24只, 由郑州大学医学院动物实验中心提供, 体质量1.8-2.5 kg, 平均2.1 kg, 雌雄不限. VX2肝癌荷瘤兔由生物医学公司购买, 均为生长于大腿根部肌肉内14 d瘤株. 麻醉药物为速眠新Ⅱ, 肌肉注射0.4 mL/kg. 实验流程及操作符合动物实验伦理道德规范.
1.2.1 VX2细胞株及兔肝癌模型的制备: VX2肝癌荷瘤兔麻醉后无菌条件下剥离大腿根部肿瘤, 选取生长旺盛鱼肉样组织, 用生理盐水冲洗后剪成1-2 mm3碎块备用. 24只新西兰大白兔全麻后固定于CT检查床上, 穿刺针从剑突左侧插入2 cm, 行CT扫描确定位于肝左叶合适位置, 将剪好肿瘤块植入2-3块后用明胶海绵封堵穿刺口. 术后肌注庆大霉素4000 U.
1.2.2 扫描与重建: (1)扫描方案: 种植后14 d, 兔子麻醉后采用美国GE公司Discovery CT机对每只兔子行两次肝脏双期增强扫描, 扫描前禁食12 h, 扫描范围包括兔子整个肝脏. 先采用GSI模式扫描, 扫描参数: 80-140 kVp, 0.5 ms瞬时切换, SFOV medium body, 选用mode55, 电流上限275 mA. 间隔24 h后, 采用100 kV常规扫描, 管电流320 mA. 两次扫描层厚和层间距均为5 mm, 螺距1.375:1, 转速0.6 s; 均以0.5 mL/s的速度经耳缘静脉注射非离子型造影剂碘佛醇(碘含量320 mg/mL)5 mL, 开始注射后17、35 s分别行动脉期和门静脉期扫描; (2)图像重建: 图像重建均采用标准算法. GSI扫描数据使用40%ASiR重建70 keV水平单能量图像, 动脉期图像作为A组、静脉期图像作为B组. 100 kV常规扫描数据使用滤波反投影(filtered back projection, FBP)算法重建, 得到C组和D组图像. 重建层厚及层间距均为1.25 mm.
1.2.3 图像分析: (1)主观评分: 由两名放射科医师(工作经验分别为6、18年)对4组重建后的图像质量采用5分制法[8]进行评估, 达成一致意见. 评分标准如下: 5分, 解剖细节清晰, 无明显噪声及伪影; 4分, 解剖结构和细节较清楚, 轻度噪声和伪影; 3分, 大部分解剖结构可以满足诊断, 噪声及伪影明显但可接受; 2分, 解剖结构不清楚, 解剖细节不足以被发现, 噪声及伪影非常明显; 1分, 解剖结构不清楚, 不能诊断, 噪声及伪影严重; (2)客观测量: 将所有图像传至GE ADW 4.6工作站进行分析, 所有数据测量均有同1名放射科医生完成. 使用GSI Viewer软件将ROI分别置于肝脏肿瘤及正常肝脏背景中, 自动得出显示动脉期肿瘤的最佳CNR单能水平及CNR随能量变化曲线. 画ROI时避开血管及伪影明显区域. 尽量保证4组图像ROI形状、大小及层面的一致性. 所有数据均测量3次并取平均值. 记录肝肿瘤、正常肝脏和背部肌肉的CT值和标准差(standard deviation, SD), 计算肝肿瘤动脉期和静脉期的信噪比(signal to noise, SNR) = CT值肝肿瘤/SD值肝肿瘤和对比噪声比(CNR = CT值肝肿瘤-CT值肝脏/SD值肝脏), 其中背景肌肉的SD值代表图像噪声; (3)辐射剂量: 记录GSI模式扫描组及100 kV常规扫描组CT剂量指数(CT dose index volume, CTDIvol)及剂量长度乘积(dose-length product, DLP), 并计算有效辐射剂量(effective dose, ED): ED = DLP×w, w为不同部位权重因子, 国际放射防护委员会[9]推荐腹部w = 0.015.
统计学处理 所有数据均采用SPSS17.0软件包进行统计学分析. 定量变量采用mean±SD, 定性变量采用频率或百分比表示. 图像主观评分采用秩和检验比较, 观察者间的一致性采用Kappa检验, Kappa值分为5个等级[10]: 0.00-0.20一致性极低、0.21-0.40一致性一般、0.41-0.60一致性中等、0.61-0.80高度的一致性和0.81-1.00几乎完全一致. A组与C组, B组与D组图像客观测量数据及两次扫描辐射剂量比较采用配对t检验. P<0.05为差异有统计学意义.
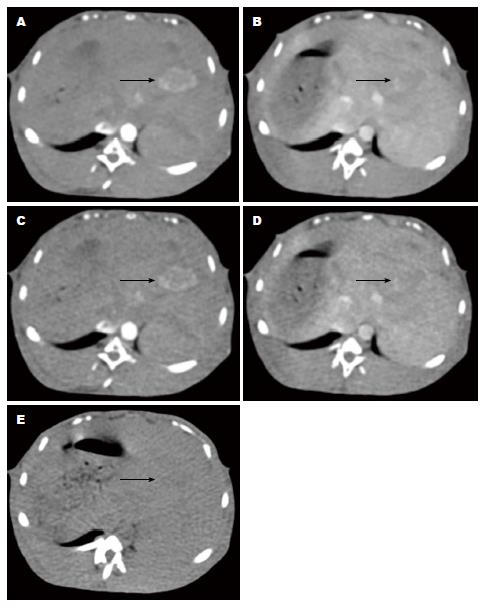
24只新西兰大白兔22只种植成功, 2只未成功, 其中1只死于麻醉过量, 1只死于感染. 14 d两次CT扫描均发现肿瘤24个, 20个位于肝左叶(图1), 4个位于肝右叶; 2个因穿刺位置出现偏差, 2个转移至肝右叶, 直径1.5-3.0 cm.
两种扫描方案实验对象相同, 为配对数据. GSI模式扫描组CTDIvol为6.92 mGy, 100 kV常规扫描组的CTDIvol为9.28 mGy. GSI模式扫描组和常规扫描组有效辐射剂量分别为1.30 mSv±0.09 mSv和1.78 mSv±0.13 mSv(t = 2.581, P = 0.021), GSI模式扫描组较常规扫描组降低约27%.
2.3.1 主观评分: 两位观察者对4组图像评分结果如表1. GSI扫描组动脉期最佳CNR位于63-72 keV. 动脉期A组图像主观评分(4.09分±0.71分)高于C组(3.80分±0.67分)(Z = 1.967, P = 0.049). 静脉期B组图像主观评分(4.16分±0.67分)高于D组(4.75分±0.65分)(Z = 2.840, P = 0.005)(表2).
| 图像分组 | 观察者1 | 观察者2 | Kappa值 | ||||||||
| 1分 | 2分 | 3分 | 4分 | 5分 | 1分 | 2分 | 3分 | 4分 | 5分 | ||
| GSI组 | |||||||||||
| A组 | 0 | 0 | 4 | 11 | 7 | 0 | 0 | 5 | 11 | 6 | 0.855 |
| B组 | 0 | 0 | 3 | 12 | 7 | 0 | 0 | 3 | 13 | 6 | 0.917 |
| 常规组 | |||||||||||
| C组 | 0 | 0 | 7 | 12 | 3 | 0 | 0 | 8 | 11 | 3 | 0.921 |
| D组 | 0 | 0 | 7 | 12 | 3 | 0 | 0 | 9 | 11 | 2 | 0.865 |
| 分组 | SD(HU) | SNR | CNR |
| A组 | 7.52±1.12 | 14.54±3.52 | 6.37±1.82 |
| B组 | 8.25±1.74 | 12.95±2.76 | -3.25±1.17 |
| C组 | 10.83±2.17 | 9.12±2.14 | 4.11±1.34 |
| D组 | 11.55±2.86 | 11.62±2.15 | -2.06±1.7 |
| P1值 | <0.001 | <0.001 | 0.003 |
| P2值 | <0.001 | 0.086 | 0.009 |
2.3.2 图像噪声: A组图像噪声低于C组, B组图像噪声低于D组(P<0.05)(表2).
2.3.3 肝肿瘤SNR和CNR: A、C两组图像相比较, A组图像肝肿瘤SNR和CNR均高于C组图像(P<0.05). B、D两组图像相比较, 肝肿瘤SNR值两组间差异无统计学意义(P>0.05); B组图像肝肿瘤CNR高于D组图像CNR(P<0.05)(表2).
兔VX2肝癌影像学模型是由Shope病毒在兔皮肤诱发的鳞状细胞癌经72次传代而建立的转移性瘤细胞株, 以肝动脉供血为主[11]. 因其肿瘤血供丰富, 易出血坏死, 表现与人类原发性肝癌类似, 容易制成原位肿瘤模型. 在肿瘤种植后2-3 wk, 为肿瘤生长旺盛、肿瘤血管形成期, 可建立早期肝癌动物模型[12].
肝癌是能谱CT应用最早且价值最大的疾病之一[2], 获得更优的图像质量及更低的辐射剂量一直是CT技术研究的热门课题. 能谱扫描低能量水平图像可以提高CNR, 但会引起噪声升高, 影响图像质量. 本研究通过GSI viewer软件获得的显示兔VX2肝癌模型最佳CNR位于63-72 keV, 与以往研究[13]大致相符, 70 keV水平图像噪声较低, 故选用70 keV水平单能图像. 迭代重建算法具有降低图像噪声和伪影、提高分辨率的优势, 但完全迭代重建因其耗时长及对计算机的硬件要求较高而未能在临床中开展. 目前使用的ASiR重建是ASiR和FBP两种算法不同比例组合而成, 重建速度比单纯迭代重建快并可以明显降低图像噪声和伪影, 在年轻及肥胖患者更为明显[14]. 以往研究[15-18]显示随着ASiR比例的增加, 图像噪声逐渐降低、SNR和CNR逐渐增加, 但高比例ASiR重建(腹部超过50%)会使图像失去原有的质地和特性, "模糊"度增加, 存在一定的虚幻和失真. 故本研究选用40%ASiR(即40%ASiR和60%FBP)重建方法, 采用低剂量的能谱参数扫描, 将能谱单能量成像与迭代重建方法相结合, 优化图像质量.
研究结果显示GSI扫描组动静脉期图像(A组和B组)主观评分均高于常规100 kV扫描组(C组和D组), 虽然GSI扫描组设置的扫描参数及辐射剂量较低. 好的图像质量应归功于能谱单能量成像对CNR的提高及ASiR重建的降噪功能. GSI扫描组动静脉期图像噪声均低于100 kV扫描组, 肝肿瘤CNR均高于100 kV扫描组, 说明能谱CT单能量成像联合ASiR重建可以弥补能谱扫描参数的降低, 在降低扫描剂量的情况下提供良好的图像质量及肝癌病灶显示.
本研究创新之处在于将GSI单能量成像与ASiR重建算法相联合, ASiR重建可以降低单能成像的图像噪声, 提高SNR、CNR, 与以往ASiR重建用于常规扫描时[17,18]结果相符合. 单能量成像联合ASiR重建算法优化图像质量已有临床研究[1], 但是与常规扫描辐射剂量相当, 并没有探讨其对辐射剂量的降低的应用. 本研究在同只兔子间隔24 h行GSI及100 kV常规管电压增强扫描, 避免了个体差异及时间因素的影响, 并采用了低剂量的能谱扫描参数, 结果表明GSI扫描组70 keV单能成像联合40%ASiR重建在辐射剂量降低的条件下仍然具有较高的主观图像质量, 且肝肿瘤显示SNR、CNR亦较高. 既发挥了能谱CT单能量成像最佳CNR的优势, 又发挥了ASiR重建降低噪声的功能, 说明单能量成像联合ASiR重建可以降低辐射剂量并提供良好的图像质量.
本研究尚存在如下不足: 首先, 样本含量较少, 需要进一步大样本的临床研究; 其次, 本实验为动物实验, 兔胃肠道气体的干扰及麻醉效果不佳呼吸无法控制时会对CT图像产生干扰. 总之, 单能量成像联合ASiR重建可以降低辐射剂量并提供良好的图像质量及病灶检出显示能力, 推荐在临床实践中研究及应用.
能谱成像是计算机断层扫描(computed tomography, CT)成像领域中最为热门的技术, 单能量图像与常规管电压混能图像相比能够提高图像的对比噪声比并避免射线硬化伪影. 自适应统计迭代重建算法可以明显降低图像噪声, 已在临床中成熟开展, 利用能谱CT单能量成像联合自适应统计迭代重建算法(adaptive statistical iterative reconstruction, ASiR)技术来降低辐射剂量有广阔的研究前景.
徐泱, 副主任医师, 上海复旦大学附属中山医院
单能量成像联合ASiR重建算法优化图像质量已有临床研究, 但以往均是图像质量的比较, 并没有探讨其对辐射剂量的降低应用. 本研究采用了低剂量的能谱扫描参数, 研究单能量成像联合ASiR重建算法在低剂量条件下图像质量情况.
有关能谱CT在肝癌中的应用已有大量文献报道. 迭代重建算已在临床中使用, 但与能谱单能量成像联合的相关报道尚少.
GSI单能量成像与ASiR重建算法相联合, ASiR重建可以降低单能成像的图像噪声, 提高信噪比(signal to noise ratio, SNR)、CNR, 采用低剂量的能谱扫描参数是本文最大创新点.
本文将单能量成像与ASiR重建算法相联合, 并采用了低剂量的能谱扫描参数, 探讨与常规剂量扫描图像质量的差异, 具有较大的研究及临床应用价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Matsumoto K, Jinzaki M, Tanami Y, Ueno A, Yamada M, Kuribayashi S. Virtual monochromatic spectral imaging with fast kilovoltage switching: improved image quality as compared with that obtained with conventional 120-kVp CT. Radiology. 2011;259:257-262. [PubMed] [DOI] |
| 3. | Silva AC, Morse BG, Hara AK, Paden RG, Hongo N, Pavlicek W. Dual-energy (spectral) CT: applications in abdominal imaging. Radiographics. 2011;31:1031-1046; discussion 1047-1050. [PubMed] [DOI] |
| 4. | Yamada Y, Jinzaki M, Tanami Y, Abe T, Kuribayashi S. Virtual monochromatic spectral imaging for the evaluation of hypovascular hepatic metastases: the optimal monochromatic level with fast kilovoltage switching dual-energy computed tomography. Invest Radiol. 2012;47:292-298. [PubMed] [DOI] |
| 5. | 石 清磊, 赵 红梅, 张 玲, 马 亚光, 李 晓婷, 崔 涌, 孙 应实, 张 晓鹏. 自适应统计迭代重建算法对腹部CT扫描中图像质量和辐射剂量影响的模体研究. 中华放射学杂志. 2013;47:326-329. |
| 6. | Kalra MK, Maher MM, Sahani DV, Blake MA, Hahn PF, Avinash GB, Toth TL, Halpern E, Saini S. Low-dose CT of the abdomen: evaluation of image improvement with use of noise reduction filters pilot study. Radiology. 2003;228:251-256. [PubMed] |
| 7. | Leipsic J, Labounty TM, Heilbron B, Min JK, Mancini GB, Lin FY, Taylor C, Dunning A, Earls JP. Adaptive statistical iterative reconstruction: assessment of image noise and image quality in coronary CT angiography. AJR Am J Roentgenol. 2010;195:649-654. [PubMed] [DOI] |
| 8. | Guimarães LS, Fletcher JG, Harmsen WS, Yu L, Siddiki H, Melton Z, Huprich JE, Hough D, Hartman R, McCollough CH. Appropriate patient selection at abdominal dual-energy CT using 80 kV: relationship between patient size, image noise, and image quality. Radiology. 2010;257:732-742. [PubMed] [DOI] |
| 9. | McCollough C, Cody D, Edyvean S, Geise R, Gould B, Keat N, Huda W, Judy P, Kalender W, McNitt-Gray M. The measurement, reporting, and management of radiation dose in CT. American: American Association of Physicists in Medicine 2008; (Report NO 96). |
| 10. | Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics. 1977;33:159-174. [PubMed] |
| 11. | 闫 庆, 王 朝华, 李 江涛, 谢 晓东. 兔肝VX2肿瘤模型的建立及影像学研究现状. 中国介入影像与治疗学. 2007;4:404-407. |
| 12. | Kuszyk BS, Boitnott JK, Choti MA, Bluemke DA, Sheth S, Magee CA, Horton KM, Eng J, Fishman EK. Local tumor recurrence following hepatic cryoablation: radiologic-histopathologic correlation in a rabbit model. Radiology. 2000;217:477-486. [PubMed] |
| 13. | Lv P, Lin XZ, Chen K, Gao J. Spectral CT in patients with small HCC: investigation of image quality and diagnostic accuracy. Eur Radiol. 2012;22:2117-2124. [PubMed] [DOI] |
| 15. | Fuchs TA, Stehli J, Fiechter M, Dougoud S, Gebhard C, Ghadri JR, Husmann L, Gaemperli O, Kaufmann PA. First experience with monochromatic coronary computed tomography angiography from a 64-slice CT scanner with Gemstone Spectral Imaging (GSI). J Cardiovasc Comput Tomogr. 2013;7:25-31. [PubMed] [DOI] |
| 16. | Yamada Y, Jinzaki M, Hosokawa T, Tanami Y, Abe T, Kuribayashi S. Abdominal CT: an intra-individual comparison between virtual monochromatic spectral and polychromatic 120-kVp images obtained during the same examination. Eur J Radiol. 2014;83:1715-1722. [PubMed] [DOI] |
| 17. | Singh S, Kalra MK, Hsieh J, Licato PE, Do S, Pien HH, Blake MA. Abdominal CT: comparison of adaptive statistical iterative and filtered back projection reconstruction techniques. Radiology. 2010;257:373-383. [PubMed] [DOI] |
| 18. | Silva AC, Lawder HJ, Hara A, Kujak J, Pavlicek W. Innovations in CT dose reduction strategy: application of the adaptive statistical iterative reconstruction algorithm. AJR Am J Roentgenol. 2010;194:191-199. [PubMed] [DOI] |