修回日期: 2015-05-18
接受日期: 2015-06-01
在线出版日期: 2015-07-18
目的: 检测大肠癌原发灶与淋巴结(lymph node, LN)转移灶中磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)p110α、PI3Kp110β与B细胞淋巴瘤基因-2(B cell lymphoma 2, Bcl-2)、CyclinD1的表达情况, 探讨在大肠癌发生及转移中的相关性及其与临床病理因素及预后的关系.
方法: 采用免疫组织化学方法在30例正常大肠黏膜组织, 52例未发生LN转移的大肠癌组织, 50例发生LN转移的大肠癌原发灶及其转移灶中检测PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1的表达情况及其差异, 分析PI3Kp110α、PI3Kp110β与Bcl-2和CyclinD1之间的相关性以及与临床病理因素及其预后的关系.
结果: (1)PI3Kp110α与Bcl-2在无LN转移组、有LN转移组的原发灶和其相应LN转移灶中的表达均高于正常肠黏膜组(P<0.05); PI3Kp110β与CyclinD1在无LN转移组、有LN转移组的原发灶和其相应LN转移灶中的表达均高于正常肠黏膜组, 且在有LN转移的原发灶中的表达均高于其相应LN转移灶和无LN转移组肠癌中的表达(P<0.05); (2)PI3Kp110α与Bcl-2在4组中均呈正相关(P<0.05); PI3Kp110α与CyclinD1在正常肠黏膜组, 无LN转移组和有LN转移组中均呈正相关(P<0.05); PI3Kp110β与Bcl-2和CyclinD1在4组中均呈正相关(P<0.05); (3)PI3Kp110α、PI3Kp110β和CyclinD1蛋白的表达与肿瘤分化程度及LN转移相关, Bcl-2的表达与肿瘤分化程度相关; (4)Kaplan-Meier分析显示: PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1为影响大肠癌预后的因素之一; Cox比例风险模型分析显示: PI3Kp110α、PI3Kp110β是影响大肠癌患者预后的独立因素.
结论: (1)PI3Kp110α、PI3Kp110β与Bcl-2、CyclinD1在大肠癌原发灶及转移灶中的表达均高于正常黏膜, 在肿瘤的发生发展中发挥重要作用; (2)大肠癌LN转移灶中, PI3Kp110α与PI3Kp110β分别通过影响Bcl-2及CyclinD1对转移灶中的肿瘤生长起促进作用; (3)PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1与大肠癌的分化程度有关, 且PI3Kp110α、PI3Kp110β和CyclinD1与大肠癌的转移密切相关; (4)PI3Kp110α和PI3Kp110β是影响大肠癌预后的独立危险因素.
核心提示: 本实验表明磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)p110α、PI3Kp110β与细胞的凋亡及周期蛋白在大肠癌的发生与转移中发挥重要作用, 大肠癌淋巴结(lymph node)转移灶与原发灶之间存在肿瘤的异质性改变与PI3Kp110α、PI3Kp110β的异常表达密切相关.
引文著录: 姜涛, 吴淑华, 何双, 温菲菲, 高向前, 李扬扬. 大肠癌原发灶与淋巴结转移灶中PI3Kp110α、PI3Kp110β与Bcl-2、CyclinD1表达的相关性及其意义. 世界华人消化杂志 2015; 23(20): 3226-3234
Revised: May 18, 2015
Accepted: June 1, 2015
Published online: July 18, 2015
AIM: To investigate the expression of phosphatidylinositol 3-kinase (PI3K)p110α, PI3Kp110β, B-cell lymphoma-2 (Bcl-2) and CyclinD1 in primary colorectal cancer (CRC) and lymph node metastases, and to analyze their correlations with clinicopathologic characteristics and prognosis of CRC.
METHODS: Immunohistochemistry was used to detect expression of PI3Kp110α, PI3Kp110β, Bcl-2 and CyclinD1 in 30 cases of normal colorectal mucosa, 52 cases of CRC without lymph node metastasis, 50 cases of primary CRC tissues and corresponding lymph node metastases. The correlations between PI3Kp110α, PI3Kp110β, Bcl-2, and CyclinD1 expression as well as their relationship with clinicopathologic characteristics and prognosis of CRC were analyzed.
RESULTS: The expression of PI3Kp110α and Bcl-2 in CRC without lymph node metastasis, primary CRC tissues and corresponding lymph node metastases was significantly higher than that in normal colorectal mucosa (P < 0.05). PI3Kp110β and CyclinD1 expression was also significantly increased in CRC without lymph node metastasis, primary CRC tissues, and corresponding lymph node metastases compared with the normal colorectal mucosa. What's more, PI3Kp110β and CyclinD1 expression was significantly increased in CRC with lymph node metastases compared with CRC without lymph node metastases (P < 0.05). Spearman analysis showed that PI3Kp110α expression was positively associated with Bcl-2 expression in the four groups (P < 0.05), PI3Kp110α expression was positively associated with CyclinD1 expression in normal colorectal mucosa, CRC without lymph node metastasis, and CRC with lymph node metastasis (P < 0.05), and PI3Kp110β expression was positively correlated with Bcl-2 and CyclinD1 expression in the four groups (P < 0.05). PI3Kp110α, PI3Kp110β and CyclinD1 expression was related to cancer cell differentiation and lymph node metastasis, and Bcl-2 expression was associated with cancer cell differentiation. Kaplan-Meier analysis showed that PI3Kp110α, PI3Kp110β, Bcl-2 and CyclinD1 were prognostic factors for CRC, and Cox proportional hazards regression analysis showed that PI3Kp110α and PI3Kp110β were independent prognostic factors for CRC.
CONCLUSION: PI3Kp110α, PI3Kp110β, Bcl-2, and CyclinD1 expression is increased in primary CRC tissues and lymph node metastases compared with normal mucosa, suggesting that they may play important roles in the development and progression of CRC. PI3Kp110α and PI3Kp110β promote cancer cell growth via Bcl-2 and CyclinD1 in CRC with lymph node metastases. PI3Kp110α, PI3Kp110β, Bcl-2 and CyclinD1 are associated with tumor cell differentiation and CRC metastasis. PI3Kp110α and PI3Kp110β are independent prognostic factors for CRC.
- Citation: Jiang T, Wu SH, He S, Wen FF, Gao XQ, Li YY. Clinical significance of expression of PI3Kp110α, PI3Kp110β, Bcl-2 and CyclinD1 in primary colorectal cancer and lymph node metastases. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3226-3234
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3226.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3226
大肠癌是人类消化系常见的恶性肿瘤, 在我国其发病率呈上升趋势. 由于大肠癌的起病隐匿, 许多患者在发现时多为中晚期. 肿瘤的浸润和转移, 则是术后复发及不良预后的重要原因[1]. 而淋巴结(lymph node, LN)转移是大肠癌转移的主要途径, 也是导致术后复发的主要原因[2]. 因此, 深入研究大肠癌的侵袭和转移机制, 对于有效防止肿瘤复发、转移及判断预后均具有重要的意义. 本文通过在大肠癌原发灶及其LN转移灶中检测磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)p110α、PI3Kp110β、B细胞淋巴瘤基因-2(B cell lymphoma 2, Bcl-2)和CyclinD1的表达情况, 分析其表达差异与相关性, 探讨PI3Kp110α、PI3Kp110β在大肠癌转移中的相关性及与预后的关系.
收集滨州医学院附属医院2007-01/2009-01经手术切除的52例无LN转移的大肠癌标本, 50例有LN转移的大肠癌及其相应的LN转移灶, 30例正常大肠黏膜(距肿瘤5 cm以上). 所选病例均由2位病理学专家重新阅片分类, 均为首次发现, 术前未经放疗及化疗, 且有完整的随访资料. 大肠癌病例中, 男69例, 女33例, 平均年龄63.2岁; 按世界卫生组织病理学分级标准分为高-中分化腺癌65例, 低分化腺癌37例. 按照Dukes分期分为A+B期52例, C+D期50例. 全部标本均经40 g/L中性甲醛固定, 石蜡包埋, 4 μm连续切片. 兔多克隆抗体PI3Kp110α(YT3709)、Bcl-2(YT0470)、CyclinD1(YT1173)购自ImmunoWay公司, 稀释浓度均为1:100, PI3Kp110β(ab151549)兔多克隆抗体购自Abcam公司, 稀释浓度为1:200. 柠檬酸, 通用型二抗及DAB显色液购自北京中杉金桥生物技术有限公司. 使用已知阳性片为阳性对照, 以PBS代替一抗作为阴性对照.
1.2.1 免疫组织化学: 采用EnVision法免疫组织化学步骤进行. 方法如下: 4 μm厚切片经脱蜡至水化, 柠檬酸高压热修复2 min, 滴加一抗并4 ℃过夜. PBS洗涤后滴加通用型二抗, 37 ℃孵育30 min, DAB镜下显色2 min, 苏木素复染, 盐酸酒精分化, 脱水后中性树胶封片.
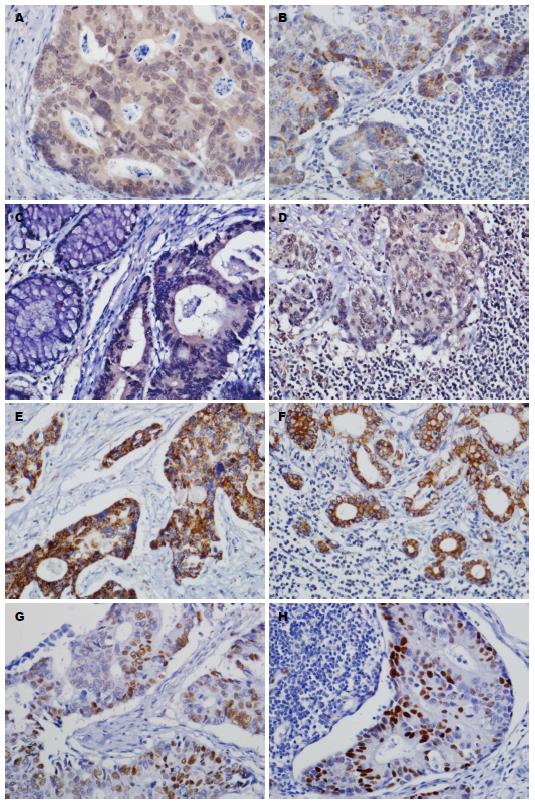
1.2.2 结果判定: PI3Kp110α、PI3Kp110β和Bcl-2阳性时为细胞质黄色-黄褐色颗粒, CyclinD1阳性时为细胞核黄色-棕褐色颗粒. 采用染色强度与阳性细胞百分率相结合的判定标准. 染色强度: 不着色为0分, 淡黄色1分, 棕黄色2分, 黄褐色3分. 阳性细胞所占百分比: 阳性细胞数<5%计为0分, 5%-30%计为1分, 31%-60%计为2分, >60%计为3分. 染色总分为两者的乘积, 阴性(-): 0分, 弱阳性(+): 1-4分, 中度阳性(++): 5-8分, 强阳性(+++): 9-12分.
统计学处理 使用SPSS19.0统计软件, 不同分组之间蛋白的表达差异采用χ2检验; 蛋白表达相关性采用Spearman相关性分析, 采用Kaplan-Meier法进行单因素生存分析, 并进行Log-rank法检验, Cox风险模型进行多因素生存分析, P<0.05为差异具有统计学意义.
PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1在正常肠黏膜组、无LN转移组、有LN转移的原发灶及相应LN转移灶中的表达如表1、图1(图1为其阳性表达). 多组二分类资料的两两χ2检验比较结果显示, PI3Kp110α与Bcl-2在无LN转移组、有LN转移的原发灶及相应的LN转移灶中的表达均高于正常肠黏膜组(P<0.05), 但3组间表达差异无统计学意义(P>0.05). PI3Kp110β与CyclinD1在无LN转移组、有LN转移的原发灶及相应的LN转移灶中的表达均高于正常肠黏膜组, 且在有LN转移的原发灶中的表达均高于相应的LN转移灶及无LN转移组中的表达(P<0.05).
Spearman相关性分析结果显示: PI3Kp110α与Bcl-2在正常肠黏膜组、无LN转移组、有LN转移的原发灶及相应的LN转移灶中的表达均呈正相关; PI3Kp110α与CyclinD1在正常肠黏膜组、无LN转移组和有LN转移的原发灶中的表达均呈正相关, 而在LN转移灶中的表达无相关性(P>0.05)(表2). PI3Kp110β与Bcl-2和CyclinD1在正常肠黏膜组、无LN转移组、有LN转移的原发灶及相应的LN转移灶中均呈正相关关系(表3).
| 指标 | 正常黏膜组 | 无LN转移组 | 有LN转移组 | LN转移灶组 | ||||
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| PI3Kp110α与Bcl-2 | 0.539 | 0.002 | 0.678 | 0.000 | 0.332 | 0.019 | 0.402 | 0.004 |
| PI3Kp110α与CyclinD1 | 0.523 | 0.050 | 0.342 | 0.001 | 0.735 | 0.000 | 0.229 | 0.108 |
| 指标 | 正常黏膜组 | 无LN转移组 | 有LN转移组 | LN转移灶组 | ||||
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| PI3Kp110β与Bcl-2 | 0.447 | 0.013 | 0.551 | 0.000 | 0.345 | 0.014 | 0.594 | 0.001 |
| PI3Kp110β与CyclinD1 | 0.745 | 0.000 | 0.536 | 0.000 | 0.342 | 0.015 | 0.388 | 0.005 |
本实验免疫组织化学结果显示: PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1在大肠癌中均表达增高(P<0.05), 临床病理因素分析显示: Bcl-2的表达与分化程度相关, 在低分化大肠癌中的表达均高于高-中分化大肠癌; PI3Kp110α、PI3Kp110β和CyclinD1蛋白表达与分化程度和LN转移均有关, 三者在低分化大肠癌组织中的表达均高于高-中分化大肠癌组织, 在伴有LN转移的大肠癌组织中的表达均高于无LN转移组(表4).
| 临床病理因素 | n | PI3Kp110α(+) | P值 | PI3Kp110β(+) | P值 | Bcl-2(+) | P值 | CyclinD1(+) | P值 |
| 性别 | 0.491 | 0.818 | 0.726 | ||||||
| 男 | 68 | 39 | 41 | 0.498 | 42 | 40 | |||
| 女 | 34 | 16 | 17 | 19 | 20 | ||||
| 年龄(岁) | 0.573 | 0.702 | 0.627 | ||||||
| <60 | 46 | 22 | 20 | 0.235 | 22 | 24 | |||
| ≥60 | 56 | 30 | 31 | 29 | 32 | ||||
| 肿瘤直径(cm) | 0.579 | 0.715 | 0.784 | ||||||
| <3 | 48 | 24 | 26 | 0.803 | 24 | 27 | |||
| ≥3 | 54 | 30 | 28 | 29 | 29 | ||||
| 肿瘤部位 | 0.543 | 0.543 | 0.701 | ||||||
| 结肠 | 53 | 25 | 27 | 0.689 | 27 | 28 | |||
| 直肠 | 49 | 26 | 23 | 22 | 24 | ||||
| 分化程度 | 0.028 | 0.040 | 0.037 | ||||||
| 高-中 | 65 | 30 | 32 | 0.029 | 31 | 29 | |||
| 低 | 37 | 26 | 27 | 26 | 25 | ||||
| LNM1 | 0.019 | 0.331 | 0.011 | ||||||
| 否 | 52 | 33 | 32 | 0.002 | 29 | 26 | |||
| 是 | 50 | 42 | 44 | 31 | 37 |
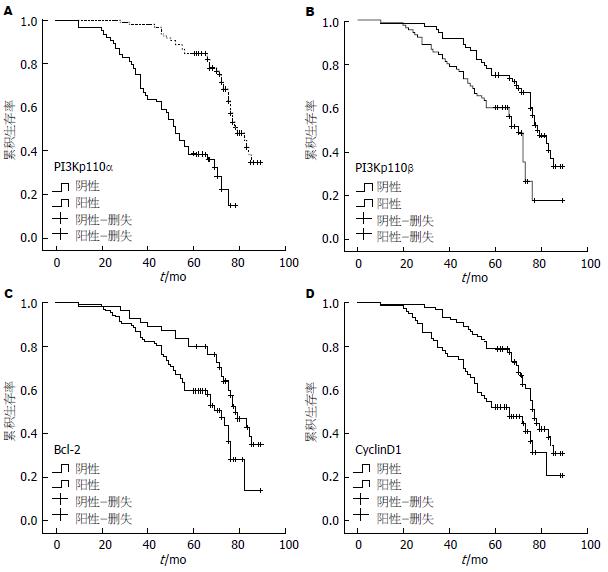
102例大肠癌患者的中位生存时间为57.5 mo, 5年生存率为52.0%(53/102). Kaplan-Meier分析显示, PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1是大肠癌预后相关因素(P<0.05)(图2), PI3Kp110α阳性患者的5年生存率为41.5%, 阴性患者5年生存率为56.8%; PI3Kp110β阳性患者5年生存率为38.3%, 阴性患者5年生存率为60.3%; Bcl-2阳性患者5年生存率为42.5%; 阴性患者5年生存率为53.6%, CyclinD1阳性患者5年生存率为40.5%; 阴性患者5年生存率为56.5%, 差异有统计学意义(P<0.05). Cox比例风险模型分析显示: PI3Kp110α、PI3Kp110β是影响大肠癌患者预后的独立因素(表5).
| 参数 | B | SE | Wald | df | Exp(B) | 95.0%CI | P值 |
| PI3Kp110α | 0.755 | 0.206 | 13.723 | 1 | 2.355 | 1.659-3.370 | <0.001 |
| PI3Kp110β | 0.839 | 0.155 | 16.234 | 1 | 2.667 | 1.762-4.536 | <0.001 |
大肠癌是常见的恶性肿瘤之一, 世界范围内, 女性和男性发病率分别高居消化系肿瘤第2位和第3位, 且每年新发患者约120万例, 死亡患者约有60万例[3]. 在我国, 大肠癌的发病率和死亡率每年均有升高, 且不断年轻化[4]. 临床研究[5]发现, 早期发生LN转移是大肠癌的一个特征, 而大肠癌生存相关分析结果显示, 发生LN转移及远处转移患者生存率明显减低. 因此深入研究大肠癌的发生及转移机制具有重要的临床意义.
近年研究[6-13]发现, PI3K/AKT(protein kinase B)信号通路在甲状腺癌、卵巢癌、前列腺癌、子宫内膜癌、乳腺癌、恶性胶质瘤、成神经管细胞瘤、鼻咽癌及骨髓增生异常综合征等多种肿瘤中存在异常激活, 该通路不仅与肿瘤的发生、增殖、存活等方面密切相关, 而且在肿瘤细胞抵抗凋亡、血管发生以及细胞迁徙中也发挥了重要作用[7,14,15]. PI3Kp110α、PI3Kp110β是PI3K亚基p110的催化亚单位, 二者的表达增多, 可以上调PI3Ks的活性, 进一步激活PI3K/AKT信号转导通路, 通过影响下游分子活性, 致使细胞代谢及细胞周期的失调和紊乱, 从而导致细胞的癌变. 本课题组前期研究结果已经证明, PI3Kp110α、PI3Kp110β在大肠黏膜恶变过程中的表达均有不同程度升高, 在大肠癌的发生过程中发挥重要作用[16-22]. 但在大肠癌转移中所发挥的作用以及在原发灶及转移灶中的表达差异及意义鲜见报道. 肿瘤的转移机制十分复杂, 事实上, 在肿瘤的转移过程中, 有大量肿瘤细胞发生迁徙, 但仅有少数肿瘤细胞通过免疫逃逸, 避免环境干扰能在新的环境中生存, 并且继续生长增殖形成转移瘤. 因此, 探讨PI3Kp110α和PI3Kp110β在肿瘤细胞转移中的作用及其机制具有重要意义. 本研究发现, PI3Kp110α与PI3Kp110β在大肠癌原发灶及转移灶中的表达均高于正常肠黏膜, 且PI3Kp110β在有LN转移组中的表达高于无淋巴转移组及LN转移灶, 提示PI3Kp110α与PI3Kp110β在大肠癌的发生过程中发挥了重要的作用, 并且PI3Kp110β与LN的转移密切相关.
肿瘤细胞在转移灶中的生存机制是转移性肿瘤赖以生存的基础. Bcl-2是重要的凋亡抑制基因, 研究[23-27]表明, Bcl-2在多种恶性肿瘤如鳞状细胞癌、肝癌、软骨肉瘤和乳腺癌中呈高表达, 且与肿瘤的发生发展及预后密切相关. 本实验结果显示, Bcl-2在大肠癌原发灶与转移灶中表达均增高, 提示在大肠癌发生过程中Bcl-2发挥了重要作用. CyclinD1是细胞周期调控的重要的正向调控因子, 在肿瘤的发生发展过程中发挥重要的作用. 当CyclinD1基因呈激活状态时, CyclinD1持续高表达, 将导致G1期缩短, 细胞提前进入S期, 使正常调节紊乱, 导致细胞周期进程加快、增殖失控, 最终导致肿瘤形成[28-30]. 本研究发现, CyclinD1在大肠癌原发灶与转移灶中表达均增高, 并且CyclinD1在有LN转移的大肠癌中表达高于无LN转移组大肠癌及LN转移灶, 提示CyclinD1不仅与大肠癌的发生发展有关, 同时与LN的转移及其异位生长密切相关.
本实验相关性分析结果提示, 在大肠癌原发灶中, PI3Kp110α与Bcl-2、CyclinD1以及PI3Kp110β与Bcl-2、CyclinD1之间均呈正相关关系, 提示在大肠癌的发生过程中, PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1发挥协同作用, 亦证实了大肠癌的发生是多基因及其表达产物顺序变化, 发挥协同作用的多环节过程. 而在大肠癌LN转移灶中, PI3Kp110α、PI3Kp110β均与Bcl-2的表达密切相关, PI3Kp110β与CyclinD1表达呈正相关, 而PI3Kp110α与CyclinD1两者之间无明显相关. 提示PI3K/AKT信号通路激活的肿瘤细胞抗凋亡在肿瘤的转移过程中发挥了重要作用, 而PI3Kp110β所调控的细胞增殖周期进程加速又进一步促进了肿瘤的异位生长. 结合LN转移灶与原发病灶中PI3Kp110β和CyclinD1表达的差异, 提示恶性肿瘤虽然是由一个发生恶变的细胞单克隆增殖而来, 但是其演进过程中可能出现某些基因或大分子的改变, 表现出各自特性的"亚克隆", 而肿瘤细胞的这些异质性是促使肿瘤细胞侵袭、迁徙、转移以及转以后异位生存的重要因素. 而关于PI3Kp110α、PI3Kp110β引起细胞凋亡与增殖的分子机制尚需进一步研究.
准确判断肿瘤患者预后, 合理选择治疗方案对于肿瘤的临床治疗十分重要. 众多因素可影响患者的预后, 而目前关于PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1与大肠癌患者预后的研究较少. 本研究随访102例大肠癌根治术患者术后生存情况, 并对PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1与生存进行多因素生存分析. 研究结果显示, 大肠癌患者5年总体生存率为52%, 生存分析发现PI3Kp110α、PI3Kp110β、Bcl-2和CyclinD1阳性患者的5年生存率均低于阴性患者. Cox比例风险模型分析显示: PI3Kp110α、PI3Kp110β是影响大肠癌患者预后的独立因素. 我们认为, PI3Kp110α、PI3Kp110β可上调Bcl-2和CyclinD1高表达, 导致肿瘤细胞抗凋亡和细胞周期进程加快, 在促进肿瘤细胞生长、转移及异位生长中发挥作用, 检测PI3Kp110α、PI3Kp110β对于判断肿瘤的转移及预后具有重要价值.
总之, 本实验表明PI3Kp110α、PI3Kp110β与细胞的凋亡及周期蛋白在大肠癌的发生与转移中发挥重要作用, 大肠癌LN转移灶与原发灶之间存在肿瘤的异质性改变与PI3Kp110α、PI3Kp110β的异常表达密切相关. 深入研究PI3Kp110α、PI3Kp110β与大肠癌转移的相关性以及与LN转移灶中肿瘤的异质性改变的关系及其调控机制, 对于临床预测肿瘤的发生、发展、判断预后以及肿瘤的基因治疗具有积极意义.
大肠癌是人类消化系常见的恶性肿瘤, 而肿瘤的浸润和转移则是术后复发及不良预后的重要原因. 因此, 深入研究大肠癌的侵袭和转移机制, 对于有效防止肿瘤复发、转移及判断预后均具有重要的意义.
程英升, 教授, 上海交通大学附属第六人民医院放射科
临床研究发现, 早期发生淋巴结(lymph node, LN)转移是大肠癌的一个特征, 而大肠癌生存相关分析结果显示, 发生LN转移及远处转移患者生存率明显减低. 因此深入研究大肠癌的发生及转移机制具有重要的临床意义.
研究发现, 磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/AKT信号通路在多种肿瘤中存在异常激活, 该通路不仅与肿瘤的发生、增殖、存活等方面密切相关, 而且在肿瘤细胞抵抗凋亡、血管发生以及细胞迁徙中也发挥了重要作用.
本文通过在大肠癌原发灶及其LN转移灶中检测PI3Kp110α、PI3Kp110β、B细胞淋巴瘤基因-2(B cell lymphoma 2, Bcl-2)和CyclinD1的表达情况, 分析其表达差异与相关性, 探讨PI3Kp110α、PI3Kp110β在大肠癌转移中的相关性及与预后的关系.
本文研究发现同步检测PI3Kp110α、PI3Kp110β与细胞的凋亡及周期蛋白对于临床预测肿瘤的发生、发展、判断预后以及肿瘤的基因治疗具有积极意义.
本文研究大肠癌原发灶与LN转移灶中PI3Kp110α、PI3Kp110β与Bcl-2、CyclinD1表达差异性和相关性有一定价值, 其在大肠癌的发生与转移中发挥重要作用, 且大肠癌LN转移灶与原发灶之间的异质性改变与PI3Kp110α、PI3Kp110β的异常表达密切相关.
编辑: 韦元涛 电编:闫晋利
| 3. | Jemal A, Center MM, DeSantis C, Ward EM. Global patterns of cancer incidence and mortality rates and trends. Cancer Epidemiol Biomarkers Prev. 2010;19:1893-1907. [PubMed] [DOI] |
| 5. | Javed MA, Sheel AR, Sheikh AA, Page RD, Rooney PS. Size of metastatic deposits affects prognosis in patients undergoing pulmonary metastectomy for colorectal cancer. Ann R Coll Surg Engl. 2014;96:32-36. [PubMed] [DOI] |
| 6. | Xing M. Recent advances in molecular biology of thyroid cancer and their clinical implications. Otolaryngol Clin North Am. 2008;41:1135-1146, ix. [PubMed] [DOI] |
| 7. | Janku F, Wheler JJ, Westin SN, Moulder SL, Naing A, Tsimberidou AM, Fu S, Falchook GS, Hong DS, Garrido-Laguna I. PI3K/AKT/mTOR inhibitors in patients with breast and gynecologic malignancies harboring PIK3CA mutations. J Clin Oncol. 2012;30:777-782. [PubMed] [DOI] |
| 8. | Wang LE, Ma H, Hale KS, Yin M, Meyer LA, Liu H, Li J, Lu KH, Hennessy BT, Li X. Roles of genetic variants in the PI3K and RAS/RAF pathways in susceptibility to endometrial cancer and clinical outcomes. J Cancer Res Clin Oncol. 2012;138:377-385. [PubMed] [DOI] |
| 9. | Levine DA, Bogomolniy F, Yee CJ, Lash A, Barakat RR, Borgen PI, Boyd J. Frequent mutation of the PIK3CA gene in ovarian and breast cancers. Clin Cancer Res. 2005;11:2875-2878. [PubMed] [DOI] |
| 10. | Knobbe CB, Trampe-Kieslich A, Reifenberger G. Genetic alteration and expression of the phosphoinositol-3-kinase/Akt pathway genes PIK3CA and PIKE in human glioblastomas. Neuropathol Appl Neurobiol. 2005;31:486-490. [PubMed] [DOI] |
| 11. | Hartmann W, Digon-Söntgerath B, Koch A, Waha A, Endl E, Dani I, Denkhaus D, Goodyer CG, Sörensen N, Wiestler OD. Phosphatidylinositol 3'-kinase/AKT signaling is activated in medulloblastoma cell proliferation and is associated with reduced expression of PTEN. Clin Cancer Res. 2006;12:3019-3027. [PubMed] [DOI] |
| 12. | Or YY, Hui AB, Tam KY, Huang DP, Lo KW. Characterization of chromosome 3q and 12q amplicons in nasopharyngeal carcinoma cell lines. Int J Oncol. 2005;26:49-56. [PubMed] |
| 13. | Nyåkern M, Tazzari PL, Finelli C, Bosi C, Follo MY, Grafone T, Piccaluga PP, Martinelli G, Cocco L, Martelli AM. Frequent elevation of Akt kinase phosphorylation in blood marrow and peripheral blood mononuclear cells from high-risk myelodysplastic syndrome patients. Leukemia. 2006;20:230-238. [PubMed] [DOI] |
| 14. | Yuan TL, Cantley LC. PI3K pathway alterations in cancer: variations on a theme. Oncogene. 2008;27:5497-5510. [PubMed] [DOI] |
| 15. | Li J, Davies BR, Han S, Zhou M, Bai Y, Zhang J, Xu Y, Tang L, Wang H, Liu YJ. The AKT inhibitor AZD5363 is selectively active in PI3KCA mutant gastric cancer, and sensitizes a patient-derived gastric cancer xenograft model with PTEN loss to Taxotere. J Transl Med. 2013;11:241. [PubMed] [DOI] |
| 18. | 高 向前, 吴 淑华, 李 扬扬, 曹 璋, 纪 洪. 结直肠癌与不同上皮内瘤变腺瘤中PI3Kp110β的表达及临床意义. 临床与实验病理学杂志. 2012;28:518-521. |
| 19. | 燕 炜, 吴 淑华, 李 扬扬, 高 向前, 孟 晓. 大肠癌组织中PIK3CA和PIK3CB的表达及意义. 临床与实验病理学杂志. 2013;29:18-22. |
| 21. | 温 菲菲, 吴 淑华, 李 扬扬, 高 向前, 何 双. 大肠癌组织中PIK3CA、PIK3CB蛋白与多药耐药基因产物表达的相关性及其临床意义. 世界华人消化杂志. 2015;23:202-209. |
| 22. | Wen F, He S, Sun C, Li T, Wu S. PIK3CA and PIK3CB expression and relationship with multidrug resistance in colorectal carcinoma. Int J Clin Exp Pathol. 2014;7:8295-8303. [PubMed] |
| 23. | van Oosterwijk JG, Meijer D, van Ruler MA, van den Akker BE, Oosting J, Krenács T, Picci P, Flanagan AM, Liegl-Atzwanger B, Leithner A. Screening for potential targets for therapy in mesenchymal, clear cell, and dedifferentiated chondrosarcoma reveals Bcl-2 family members and TGFβ as potential targets. Am J Pathol. 2013;182:1347-1356. [PubMed] [DOI] |
| 24. | Adams JM. Therapeutic potential of a peptide targeting BCL-2 cell guardians in cancer. J Clin Invest. 2012;122:1965-1967. [PubMed] [DOI] |
| 26. | Soriano ME, Scorrano L. Traveling Bax and forth from mitochondria to control apoptosis. Cell. 2011;145:15-17. [PubMed] [DOI] |
| 27. | Marquez RT, Xu L. Bcl-2: Beclin 1 complex: multiple, mechanisms regulating autophagy/apoptosis toggle switch. Am J Cancer Res. 2012;2:214-221. [PubMed] |
| 28. | Shirali S, Aghaei M, Shabani M, Fathi M, Sohrabi M, Moeinifard M. Adenosine induces cell cycle arrest and apoptosis via cyclinD1/Cdk4 and Bcl-2/Bax pathways in human ovarian cancer cell line OVCAR-3. Tumour Biol. 2013;34:1085-1095. [PubMed] [DOI] |
| 29. | Wang MT, Chen G, An SJ, Chen ZH, Huang ZM, Xiao P, Ben XS, Xie Z, Chen SL, Luo DL. Prognostic significance of cyclinD1 amplification and the co-alteration of cyclinD1/pRb/ppRb in patients with esophageal squamous cell carcinoma. Dis Esophagus. 2012;25:664-670. [PubMed] [DOI] |
| 30. | Chen B, Zhang C, Dong P, Guo Y, Mu N. Molecular regulation of cervical cancer growth and invasion by VEGFa. Tumour Biol. 2014;35:11587-11593. [PubMed] [DOI] |