修回日期: 2015-05-26
接受日期: 2015-06-10
在线出版日期: 2015-07-18
目的: 研究模拟失重环境对腹腔感染大鼠肠黏膜屏障的损害作用及抗感染治疗效果.
方法: 健康♂成年Wistar大鼠60只, 随机分为6组(n = 10), 分别为模拟失重并腹腔感染组(microgravity+abdominal-infection, MAI)、模拟失重并腹腔感染治疗组(microgravity+abdominal-infection+moxifloxacin, MAIM)、模拟失重并腹腔假手术组(microgravity+sham-operation, MSO)、正常重力腹腔感染组(normal-gravity+abdominal-infection, NGAI)、正常重力腹腔感染治疗组(normal-gravity+abdominal-infection+ moxifloxacin, NGAIM)和正常重力腹腔假手术组(normal-gravity+sham-operation, NGSO). 采用尾悬吊法建立模拟失重动物模型, 盲肠结扎穿孔术(cecal ligation and puncture, CLP)建立腹腔感染模型. 根据分组要求, 尾悬吊模拟失重48 h时, 建立腹腔感染动物模型. MAIM组和NGAIM组动物分别于CLP后0、24及48 h经尾静脉注射盐酸莫西沙星氯化钠注射液(30 mg/kg), 其余组注射等量体积的生理盐水. CLP后60 h取材, 采用放免法测定血清二胺氧化酶(diamine oxidase, DAO)、D-乳酸(D-lactate, D-LA), 动态浊度法鲎试验检测门静脉血内毒素含量, 免疫组织化学和Western blot法测定肠黏膜紧密连接蛋白Occludin和ZO-1表达, Real-time PCR检测肠黏膜Fas、Fasl和Bax mRNA表达水平, 并光镜下观察回肠黏膜组织病理变化.
结果: MAI和NGAI组大鼠回肠黏膜和黏膜下层出现明显的间质水肿和血管充血, 黏膜层炎性细胞浸润, 肠绒毛排列紊乱, 黏膜上皮脱落, 部分黏膜固有层腺体局灶性坏死. MAIM和NGAIM组大鼠回肠黏膜病变较MAI和NGAI组减轻. 大鼠血清DAO活性和D-LA及门静脉内毒素含量结果显示感染组最高、治疗组下降、假手术组最低(P<0.05). 并且, MAI、MAIM、MSO组血清DAO活性和门静脉内毒素含量均高于相对应的正常重力组(P<0.05). 免疫组织化学结果显示, Occludin和ZO-1蛋白染色为为棕色颗粒, 位于回肠黏膜细胞膜上和细胞质中, 沿肠黏膜上皮连续分布. 在MAI和NGAI组回肠黏膜表达稀少, MAIM和NGAIM组染色加深, MSO和NGSO组最深. Western blot测定结果显示, MAI和NGAI组大鼠回肠黏膜Occludin和ZO-1蛋白表达量最低, MAIM和NGAIM组表达量上升, MSO和NGSO组表达量最高, 各组间差异显著(P<0.05). 模拟失重各组的Occludin和ZO-1蛋白表达较相对应的正常重力各组的表达明显下降(P<0.05). RT-PCR检测发现, MAI和NGAI组回肠黏膜Fas、Fasl和Bax mRNA表达量最高, MAIM和NGAIM组表达量下降, MSO和NGSO组表达量最低, 各组间差异显著(P<0.05). 除MSO和NGSO组的Fasl, 模拟失重各组的Fas、Fasl和Bax mRNA表达较相对应的正常重力各组的表达明显上调(P<0.05).
结论: 模拟失重环境导致CLP所致腹腔感染大鼠肠黏膜屏障损害进一步加剧, 静脉用盐酸莫西沙星对其有确定治疗效果.
核心提示: 本研究发现, 模拟失重环境下的腹腔感染及脓毒反应进一步对肠黏膜屏障造成破坏, 血清二胺氧化酶(diamine oxidase)活性和D-乳酸(D-lactate)值及门静脉内毒素含量显著升高, 回肠黏膜组织中Occludin和ZO-1蛋白表达下降, Fas、Fasl和Bax mRNA表达上调, 经静脉途径应用盐酸莫西沙星治疗后各项指标明显改善.
引文著录: 鲍时明, 邓忠伟, 杨建武, 李晓鸥, 董满库, 周金莲, 杨鹤鸣, 李成林, 崔彦. 模拟微重力环境下腹腔感染大鼠肠黏膜屏障损害及抗感染疗效. 世界华人消化杂志 2015; 23(20): 3203-3212
Revised: May 26, 2015
Accepted: June 10, 2015
Published online: July 18, 2015
AIM: To investigate the effects of simulated microgravity and intravenous moxifloxacin on intestinal mucosal barrier in rats with abdominal infection.
METHODS: Sixty healthy adult male Wistar rats were randomly divided into six groups (n = 10 each): microgravity + abdominal infection (MAI), microgravity + abdominal infection + moxifloxacin (MAIM), microgravity + sham operation (MSO), normal gravity + abdominal infection (NGAI), normal gravity + abdominal infection + moxifloxacin (NGAIM), and normal gravity + sham operation (NGSO). Tail suspension was used to simulate the weightlessness animal model, and cecal ligation and puncture (CLP) model was used to mimic abdominal infection. The CLP procedure was performed in rats under simulated weightlessness for 48 h. Moxifloxacin hydrochloride (30 mg/kg) was injected via the tail vein for animals in the MAIM and GAIM groups at 0, 24 and 48 h post-CLP. At 60 h post-CLP, blood and ileal samples were collected for measurement of serum diamine oxidase (DAO) and D-lactate (D-LA) by radioimmunoassay, portal endotoxin by kinetic turbidimetric limulus test, Occludin and ZO-1 expression in the ileal mucosa by immunohistochemistry and Western blot, and Fas, Fasl and Bax mRNA expression by real-time PCR. The pathological changes in the ileum were observed under a light microscope.
RESULTS: Light microscopy revealed interstitial edema and vascular congestion in the ileal mucosa and submucosa with focal necrosis and inflammatory cell infiltration in animals with abdominal infection upon simulated microgravity. The pathological alterations in the MAIM and NGAIM groups were alleviated compared with the MAI and NGAI groups. DAO activity, serum D-LA level and portal endotoxin were significantly increased in the MAI and NGAI groups, but significantly decreased in the moxifloxacin treatment groups, with the lowest level in the sham operation groups (P < 0.05). These parameters were significantly higher in animals under simulated microgravity than in animals under normal gravity (P < 0.05). Immunohistochemistry showed that Occludin and ZO-1 proteins stained as brown particles were mainly located in the cell membrane and cytoplasm with a continuous distribution in the normal intestinal mucosa. Their staining was sparse in the MAI and NGAI groups, which was improved in the moxifloxacin treatment groups, especially in the MSO and NGSO groups. Western blot analysis showed that Occludin and ZO-1 proteins were expressed at a low level in the MAI and NGAI groups, up-regulated after moxifloxacin treatment, and highest in the MSO and NGSO groups (P < 0.05). Real-time PCR showed that Fas, Fasl and Bax mRNAs were expressed abundantly in the ileal mucosa in the MAI and NGAI groups, down-regulated in the MAIM and NGAIM groups, and lowest in the MSO and NGSO groups (P < 0.05).
CONCLUSION: Simulated microgravity aggravates the damage to intestinal mucosal barrier in rats with CLP-induced abdominal infection, and intravenous moxifloxacin could exert an unambiguous therapeutic effect on the pathological changes in the intestinal mucosal barrier.
- Citation: Bao SM, Deng ZW, Yang JW, Li XO, Dong MK, Zhou JL, Yang HM, Li CL, Cui Y. Effects of simulated microgravity and intravenous moxifloxacin on intestinal mucosal barrier in rats with abdominal infection. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3203-3212
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3203.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3203
随着我国载人航天计划第三步实施目标的逼近和航天员长期驻留空间站的要求, 航天医学保障和研究工作亟待加强[1,2]. 航天员在航天飞行环境以及地面特殊条件下进行模拟失重训练过程中受到多种不利因素的影响, 一旦发生各种感染, 其病情特点和处置要求均有一定特殊性, 并且微重力环境可导致微生物的生物学特性改变, 增加了航天飞行中感染性疾病防治的复杂性[3-5]. 肠道是人体最大的细菌库和内毒素池, 肠黏膜屏障功能的有效防护至关重要[6,7]. 有关失重环境下腹腔感染及抗感染治疗过程中肠黏膜屏障病理生理变化的研究尚未见报道. 本实验通过研究尾悬吊模拟失重及腹腔感染大鼠血清二胺氧化酶(diamine oxidase, DAO)和D-乳酸(D-lactate, D-LA)、门静脉内毒素、回肠黏膜Occludin、ZO-1蛋白以及Fas、Fasl和Bax基因表达水平, 结合肠黏膜组织病理学变化, 探讨在模拟失重环境下腹腔感染大鼠肠黏膜屏障损害情况及抗感染治疗效果, 为航天失重环境中感染性疾病的防治措施提供参考依据.
动物实验经医院伦理委员会批准后进行. 实验动物为SPF级健康♂成年Wistar大鼠60只, 体质量260 g±20 g, 由军事医学科学院实验动物中心提供. 动物饲养条件为人工控温(23 ℃±2 ℃), 保持12 h光照与黑暗交替, 自由活动、饮水、采食. 适应性饲养7 d 后, 采用随机数表法将实验动物分为6组(n = 10), 分别为失重并腹腔感染组(microgravity+abdominal-
infection, MAI)、失重并腹腔感染治疗组(microgravity+abdominal-infection+moxifloxacin, MAIM)、失重并腹腔假手术组(microgravity+sham-operation, MSO)、正常重力腹腔感染组(normal-gravity+abdominal-infection, NGAI)、正常重力腹腔感染治疗组(normal-gravity+abdominal-infection+moxifloxacin, NGAIM)及正常重力腹腔假手术组(normal-gravity+sham-operation, NGSO). 实验用药品盐酸莫西沙星氯化钠注射液(moxifloxacin hydrochloride and sodium chloride injection)为Bayer Vital GmbH产品.
1.2.1 实验模型的建立与取材: 参照Morey-Holten等的方法[8], 采用尾悬吊法建立模拟失重大鼠模型. 对照各组大鼠尾部不悬吊, 置同样环境中. 模拟失重48 h后, 按分组要求进行手术造模, 采用盲肠结扎穿孔术(cecal ligation and puncture, CLP)建立腹腔感染模型[9]. 腹腔注射10%水合氯醛(300 mg/kg)麻醉动物, 备皮消毒, 经腹正中纵行切口, 进腹后寻找盲肠, 分离系膜, 避免损伤主要血管. 将盲肠内容物推至盲肠远端, 在盲肠远端与盲肠根部1/2处用1号丝线结扎. 避开主要血管, 用20 G针头在盲肠游离端贯通穿刺2次, 轻压见肠内容物溢出, 以保证穿孔开放. 关闭腹腔. 假手术组开腹后找到盲肠, 不作结扎和穿孔, 其他处理同上. 术后各组动物均自由进食饮水, 皮下注射预热37 ℃生理盐水(5 mL/kg)补充液体. 模拟失重组动物待麻醉苏醒后继续尾悬吊处理. 治疗组分别于术后0、24及48 h经尾静脉注射盐酸莫西沙星氯化钠注射液(30 mg/kg), 其余组注射等量体积的生理盐水. CLP后60 h进行实验取材, 动物麻醉后经原切口进腹, 眼球取血的同时, 剖腹取门静脉血, 距回盲部5 cm处取回肠组织2份, 洗净, 分别置-80 ℃冰箱保存和浸于4%多聚甲醛(pH 7.4)中固定备用. 血标本4 ℃过夜, 3000 r/min离心10 min, 分离血清, -80 ℃保存备用.
1.2.2 放射免疫测定血清DAO、D-LA及门静脉内毒素含量: 取血清, 离心5000 r/min×3 min, 取上清液, 放射免疫法测定血清中DAO和D-LA, 动态浊度法鲎试验(kinetic turbidimetric limulus test)检测门静脉血毒素含量. 按DAO和D-LA放免试剂盒(南京建成生物工程研究所)以及鲎试验试剂盒(厦门鲎试剂试验厂有限公司)说明书进行检测.
1.2.3 免疫组织化学法检测Occludin、ZO-1蛋白表达: 取固定于4%多聚甲醛中的小肠标本, 经梯度乙醇脱水、浸蜡、包埋、5 μm连续切片、烤干、脱蜡等步骤, 微波抗原修复, 3%过氧化氢滴加于切片组织上以阻断内源性过氧化物酶.滴加稀释好的一抗, 4 ℃湿盒中孵育过夜, PBS冲洗切片3次, 每次3 min, 滴加聚合物辅助剂, 37 ℃孵育20 min. PBS冲洗切片3次, 每次2 min, 滴加辣根过氧化物酶标记的二抗IgG多聚体, 37 ℃孵育20-30 min. DAB溶液显色, 蒸馏水冲洗, 苏木素复染, 脱水、封片. Occludin、ZO-1蛋白染色阳性判定: 肠黏膜上皮细胞间染棕黄色或棕褐色, 颜色越浅表达量越低.
1.2.4 Western blot测定肠黏膜Occludin和ZO-1蛋白表达: 按照全蛋白提取试剂盒说明书进行回肠黏膜蛋白提取和定量. 取适量RIPA裂解液匀浆组织, 测蛋白浓度后, 各样品取50 μg总蛋白并根据蛋白分子量配制10%的PAGE胶电泳. 将聚丙烯酰胺凝胶上的蛋白质通过电转移并印记至聚偏二氟乙烯(PVDF)膜. 用含5%脱脂奶粉的TBST封闭液浸泡PVDF膜, 室温摇床封闭2 h. 稀释相应的一抗, 使PVDF膜浸泡于一抗孵育液中, 4 ℃孵育过夜. TBST充分洗涤PVDF膜5-6次, 每次5 min. 用封闭液稀释相应的HRP标记二抗, 根据抗体说明书稀释相应倍数, 室温摇床孵育2 h. 洗膜后显色曝光. BandScan分析胶片灰度值.
1.2.5 Real-time PCR检测回肠黏膜Fas、Fasl和Bax mRNA表达水平: 通过文献检索和Genbank比对设计引物, 引物序列分别为: Fas上游: 5'-ACCTCATCACTAGAAGCCACCAG-3', 下游: 5'-GTGGTACTTGGCCTTGGGTTTA-3', 扩增片段长度116 bp; Fasl上游: 5'-CCGTGAGTTCACCAACCACA-3', 下游: 5'-CGGGGGTTCCCTGTTAAGTG-3', 扩增片段长度120 bp; Bax上游: 5'-CAGGCGAATTGGCGATGAAC-3', 下游: 5'-CCCAGTTGAAGTTGCCGTCT-3', 扩增片段长度134 bp; β-actin上游: 5'-CACGAT
GGAGGGGCCGGACTCATC-3', 下游: 5'-TAAAGACCTCTATGCCAACACAGT-3', 扩增片段长度240 bp. 按照RNA提取试剂盒说明书提取组织总RNA, 测定RNA纯度、含量及完整性. 按照逆转录试剂盒操作说明合成cDNA, 以cDNA为模板进行荧光RT-PCR扩增, 分别检测Fas、Fasl和Bax mRNA的表达. PCR反应条件为预变性95 ℃ 10 min, 变性95 ℃ 15 s, 退火60 ℃ 15 s, 延伸72 ℃ 15 s, 经35个循环. 各基因相对含量用2-△△Ct, 扩增不同基因得到Ct值, △Ct = Ct实验组-Ctβ-actin, 根据△△Ct = △Ct实验组-△Ct对照组, 得到实验组目的基因的相对含量2-△△Ct.
统计学处理 采用SPSS20.0统计软件进行数据分析, 数据用mean±SD表示, 多组样本均数比较采用单因素方差分析(One way-ANOVA), 组间两两比较采用t检验, 以P<0.05为差异有统计学意义.
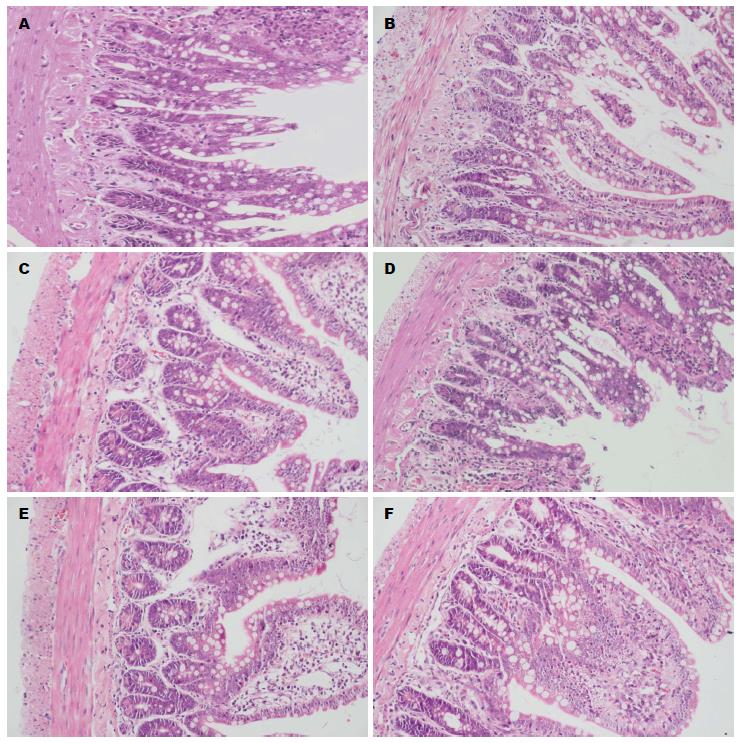
MAI、NGAI组大鼠回肠黏膜和黏膜下层出现明显的间质水肿和血管充血, 黏膜层炎性细胞浸润, 肠绒毛排列紊乱, 高矮不一, 部分倒伏、融合, 部分绒毛尖端破溃, 黏膜上皮脱落, 部分黏膜固有层腺体局灶性坏死. MAIM、NGAIM组大鼠回肠黏膜的上述病变减轻. MSO、NGSO组大鼠回肠黏膜各层结构基本完整, 肠绒毛排列整齐, 仅有少量淋巴细胞增生及炎细胞浸润. 模拟失重组和正常重力组之间的差异不明显(图1).
放射免疫测定的大鼠血清DAO活性、D-LA及门静脉内毒素含量结果为感染组最高, 治疗组下降, 假手术组最低(P<0.05). 同时发现, MAI、MAIM、MSO组血清DAO活性和门静脉内毒素含量均高于相对应的正常重力组(P<0.05). MAI和MAIM组血清D-LA含量高于相对应的正常重力组(P<0.05)(表1).
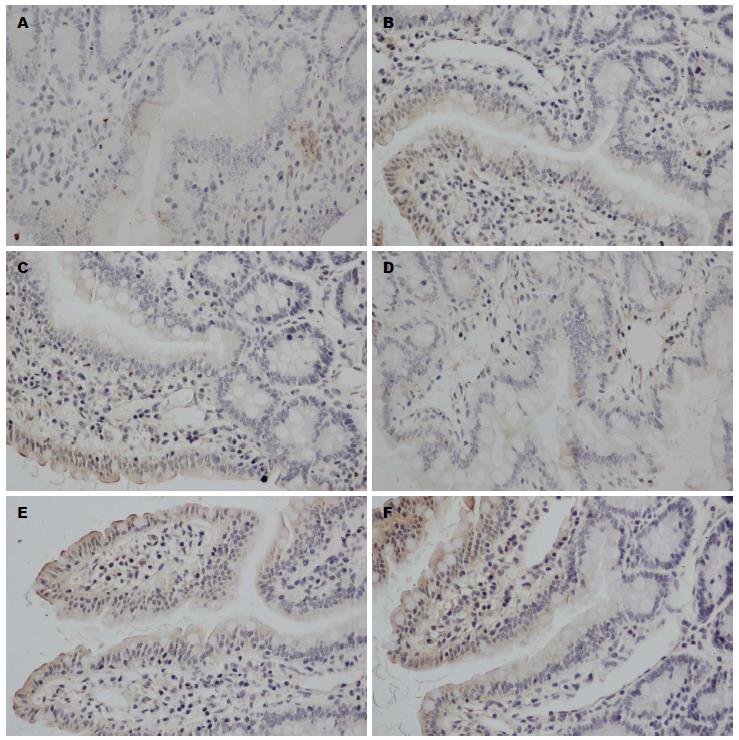
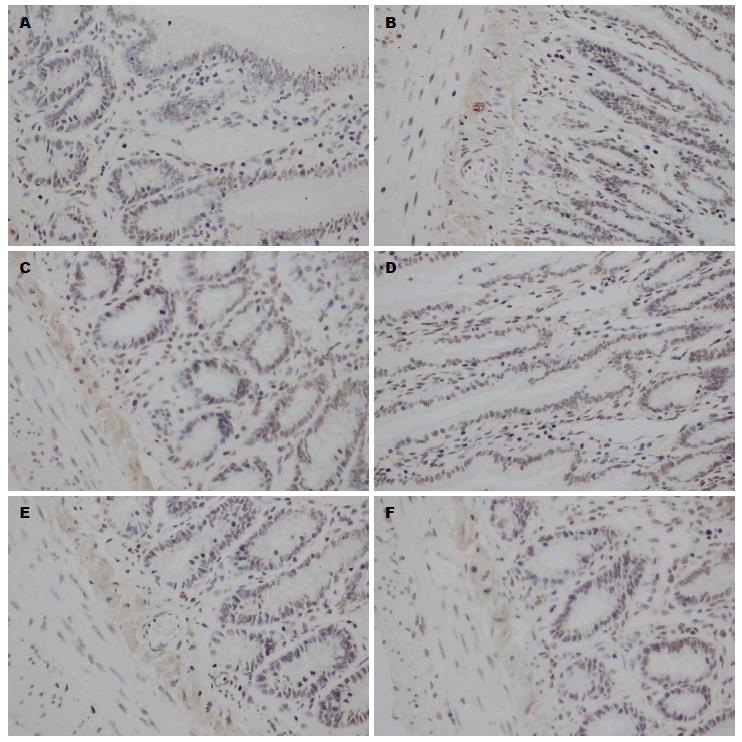
Occludin和ZO-1蛋白免疫反应沉淀物均为棕色颗粒, 位于回肠黏膜细胞膜上和细胞质中, 沿肠黏膜上皮连续分布. 实验各组大鼠回肠黏膜上均有Occludin和ZO-1蛋白表达, MAI和NGAI组回肠黏膜Occludin和ZO-1蛋白表达稀少, MAIM和NGAIM组染色加深, MSO和NGSO组最深. 模拟失重组与正常重力组之间的差异不明显(图2, 3).
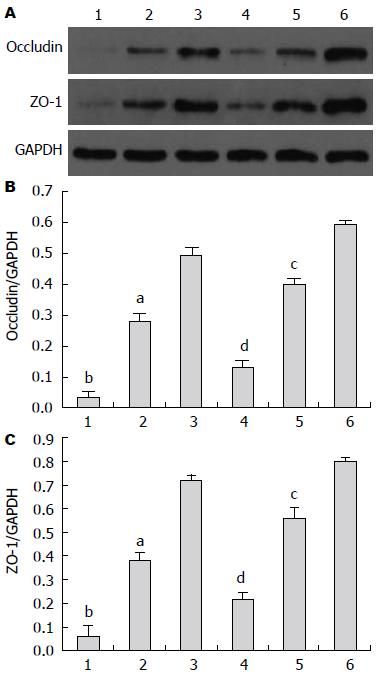
实验各组动物回肠黏膜Occludin和ZO-1蛋白表达特点基本一致, MAI和NGAI组表达量最低, MAIM和NGAIM组表达量上升, MSO和NGSO组表达量最高, 各组间差异显著(P<0.05). 模拟失重各组的Occludin和ZO-1蛋白表达较相对应的正常重力各组的表达明显下降(P<0.05)(图4).
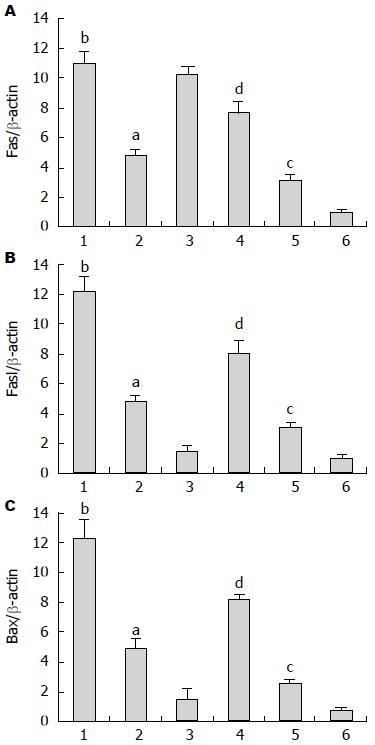
检测结果显示, 实验各组肠黏膜都有Fas、Fasl和Bax mRNA表达, MAI和NGAI组表达量最高, MAIM和NGAIM组表达量下降, MSO和NGSO组表达量最低, 各组间差异显著(P<0.05). 除MSO和NGSO组的Fasl, 模拟失重各组的Fas、Fasl和Bax mRNA表达较相对应的正常重力各组的表达明显上调(P<0.05)(图5).
航天员在航天失重环境中罹患感染性疾病的问题, 已受到学术界的关注. 相关研究[4,5,10-12]表明, 在失重环境中机体各系统发生的一系列生理病理变化以及微生物性状和致病性的改变, 给航天医学研究和实施带来重大挑战. 腹腔感染是临床上最常见的一种急腹症[13], 一旦航天员在航天飞行过程中发生类似情况, 由于环境极为特殊, 病情演变充满未知数, 救治条件极度受限, 防控不当则严重威胁航天员健康和生命, 并影响航天任务. 如何合理处置, 亟待深入研究.
研究[14]证实, 失重对胃肠黏膜屏障功能可造成一定影响. 白树民等[15]进行模拟失重对大鼠肠道菌群影响的研究, 扫描电镜发现大鼠盲肠上皮出现明显的病理性改变, 包括细胞肿胀、上皮细胞绒毛排列紊乱、稀疏等, 认为这种病理性损害可能与肠道通透性改变密切相关, 进而引起肠道微生态失调. 李成林等[16]进行大鼠尾悬吊实验, 发现在模拟失重早期应激阶段, 大鼠回肠黏膜组织中核因子κB(nuclear factor kappa B, NF-κB)蛋白表达水平明显增强, NF-κB被激活并调控下游基因, 可能是加重肠黏膜屏障损伤的机制之一. 陈英等[17,18]研究发现, 尾悬吊模拟失重大鼠小肠黏膜的光镜和电镜结果均显示小肠黏膜绒毛和微绒毛变稀少, 变短变宽, 表面积减小; 小肠黏膜紧密连接蛋白表达减少, 小肠黏膜通透性增加, 认为小肠黏膜微观结构的改变可能是造成航天员在航空飞行中出现腹泻、腹胀等消化和吸收不良症状的重要原因之一.
肠黏膜屏障在抵御腹腔感染过程中发挥重要作用[6,19]. 腹腔感染及全身脓毒反应过程中, 机体释放大量细胞因子和炎性介质, 对肠黏膜生物屏障、机械屏障、化学屏障和免疫屏障造成一系列直接和间接的损伤效应[10,19,20]. 在失重环境对肠黏膜屏障结构和功能造成一定影响的基础上, 再遭受腹腔感染及脓毒反应, 势必对肠黏膜屏障造成进一步破坏.
DAO是哺乳动物肠黏膜上皮绒毛细胞胞质中具有高度活性的细胞内酶. 肠黏膜上皮细胞受损后其被释放至肠细胞间隙并进入血管和淋巴管, 导致血DAO升高, 因而血液循环中和肠黏膜DAO活性可作为反映肠黏膜屏障通透性及结构损伤与修复情况的标志物[21]. D-LA是胃肠道固有细菌的代谢终产物, 肠黏膜一旦受损, 大量D-LA会通过损伤的肠黏膜入血, 并且血D-LA含量越高, 导致肠黏膜通透性越大, 造成恶性循环[6,19]. 跨膜蛋白Occludin和胞质黏附蛋白ZO-l是紧密连接蛋白和肠黏膜屏障最重要的组成部分, 主要集中于紧密连接纤维内, 上皮细胞通过Occludin蛋白封闭细胞间隙, 并与ZO-1等结合形成紧密连接的基础结构. 紧密连接一旦遭到破坏, 肠通透性即升高, 屏障功能受损[22]. 另外, 炎症因子和氧化应激导致促凋亡蛋白Bax蛋白在回肠黏膜上皮细胞表达增加, 主要机制包括激活Fas、Fasl信号转导途径和Bax调节途径而发挥作用[23]. 本研究结果显示, 模拟微重力基础上腹腔感染动物的血清DAO活性和D-LA含量显著升高, Occludin和ZO-l蛋白表达量明显下降, Fas mRNA、Fasl mRNA和Bax mRNA表达上调, 上皮细胞凋亡增加. 上述多项检测指标均提示, 模拟微重力基础上腹腔感染动物的肠黏膜屏障完整性遭到破坏, 功能明显受损.
内毒素是革兰氏阴性细菌细胞壁内的脂多糖, 细菌死亡、细胞壁崩解时释出. 机体受到严重细菌感染时, 细菌过度繁殖, 定植机会增大, 产生大量代谢产物和毒素. 内毒素入血则造成广泛的损伤作用, 包括损害肠黏膜上皮细胞线粒体和溶酶体, 抑制氧化过程, 导致上皮细胞自溶, 破坏紧密连接蛋白的磷酸化或去磷酸化过程, 破坏肠黏膜屏障功能[24,25]. 本实验研究发现, 模拟失重环境中腹腔感染大鼠门静脉内毒素含量显著高于假手术组, 亦高于相对应的正常重力组.提示大鼠腹腔感染加重了模拟失重环境下的肠黏膜屏障损害. Rivera等[26]进行大鼠和小鼠进行4 wk模拟失重实验, 发现实验动物的门静脉内毒素含量明显升高(>50%). 周金莲等[27]的研究亦发现, 尾悬吊模拟失重可导致大鼠门静脉内毒素血症. 显然, 失重应激作用造成胃肠道蠕动紊乱、血液瘀滞、微生态失调等一系列情况. 失重环境下的腹腔感染及脓毒反应进一步对肠黏膜屏障造成破坏, 通透性增加, 加剧门静脉内毒素血症, 对肝脏及全身产生广泛影响.
腹腔脏器破裂穿孔或者化脓性炎症向腹腔扩散, 往往导致腹膜炎或脓肿的继发改变, 这种复杂性腹腔感染多合并多种病原菌的混合感染, 外科干预和应用抗生素是最基本的治疗措施[13]. 本研究选用盐酸莫西沙星经静脉途径治疗模拟失重和正常重力环境下的腹腔感染动物, 实验结果显示, 盐酸莫西沙星治疗组大鼠回肠黏膜水肿、充血和炎细胞浸润及渗出明显减轻, 血清DAO活性和血清D-LA及门静脉内毒素含量明显下降, Occludin和ZO-1蛋白表达上调, Bax、Fas和Fasl mRNA表达量下调; 模拟失重和正常重力组之间各指标无明显差异. 实验结果说明静脉用盐酸莫西沙星对控制失重环境下大鼠腹腔感染和肠黏膜损害有确定效果, 模拟失重因素并未明显影响其治疗效果. 模拟失重条件下肠蠕动减缓和肠内容物向心性漂移等因素理应对腹腔感染有一定影响; 另外, 由于本实验周期短, 模拟失重对盲肠结扎穿孔术后所溢出病原菌的影响可能不大, 但均有待进一步探讨. 本实验研究提示, 鉴于航天飞行过程中极为特殊的环境, 航天员一旦发生腹腔感染性疾病, 当首选积极的抗感染药物治疗; 盐酸莫西沙星抗菌谱广, 穿透性强, 药效稳定, 可作为航天医疗保障备选抗生素[28]. 尽管如此, 必须加强研究航天外科手术技术的应用以应对严重腹腔感染及其他急腹症等情况. 国外已有学者开展了太空腹腔镜手术、超声引导腹腔穿刺引流甚至太空机器人手术等的研究[29,30]. 我们在该领域的研究亟待加强, 以跟进保障我国载人航天事业的新发展新突破.
腹腔感染是临床上最常见的一种急腹症, 一旦航天员在航天飞行过程中发生类似情况, 由于环境极为特殊, 病情演变充满未知数, 救治条件极度受限, 防控不当则严重威胁航天员健康和生命, 并影响航天任务. 如何合理处置, 亟待深入研究.
董玉兰, 副教授, 中国农业大学
随着我国载人航天计划第三步实施目标的逼近和航天员长期驻留空间站的要求, 航天医学保障和研究工作亟待加强. 有关失重环境下腹腔感染及抗感染治疗过程中肠黏膜屏障病理生理变化的研究尚未见报道.
本研究证实, 失重环境下的腹腔感染及脓毒反应对肠黏膜屏障造成进一步损害, 经静脉途径应用盐酸莫西沙星对控制腹腔感染进而维护肠黏膜屏障具有明确疗效, 未见类似研究报道.
本文探讨模拟失重环境下腹腔感染大鼠肠黏膜屏障损害情况及抗感染治疗效果, 为航天失重环境中感染性疾病的防治措施提供参考依据.
本文研究模拟失重环境对腹腔感染大鼠肠黏膜屏障的损害作用及抗感染治疗效果, 具有一定的理论意义和应用参考价值. 方案设计合理, 实验方法科学, 数据可靠, 结果明确.
编辑: 郭鹏 电编:闫晋利
| 4. | 朱 敏立, 王 萍, 崔 彦, 裴 士杰, 王 小辉. 模拟失重大鼠肺组织肺炎链球菌感染的病理改变. 中华航空航天医学杂志. 2014;25:194-197, 封4. |
| 5. | Mermel LA. Infection prevention and control during prolonged human space travel. Clin Infect Dis. 2013;56:123-130. [PubMed] [DOI] |
| 6. | Lopetuso LR, Scaldaferri F, Bruno G, Petito V, Franceschi F, Gasbarrini A. The therapeutic management of gut barrier leaking: the emerging role for mucosal barrier protectors. Eur Rev Med Pharmacol Sci. 2015;19:1068-1076. [PubMed] |
| 7. | Iizuka M, Konno S. Wound healing of intestinal epithelial cells. World J Gastroenterol. 2011;17:2161-2171. [PubMed] [DOI] |
| 8. | Morey-Holton ER, Globus RK. Hindlimb unloading rodent model: technical aspects. J Appl Physiol (1985). 2002;92:1367-1377. [PubMed] |
| 9. | Rittirsch D, Huber-Lang MS, Flierl MA, Ward PA. Immunodesign of experimental sepsis by cecal ligation and puncture. Nat Protoc. 2009;4:31-36. [PubMed] [DOI] |
| 10. | Li M, Holmes V, Zhou Y, Ni H, Sanzari JK, Kennedy AR, Weissman D. Hindlimb suspension and SPE-like radiation impairs clearance of bacterial infections. PLoS One. 2014;9:e85665. [PubMed] [DOI] |
| 13. | Shirah GR, O'Neill PJ. Intra-abdominal Infections. Surg Clin North Am. 2014;94:1319-1333. [PubMed] [DOI] |
| 14. | 郭 彪, 李 成林, 崔 彦. 失重对消化系统影响的研究进展. 胃肠病学和肝病学杂志. 2013;22:482-487. |
| 17. | 陈 英, 杨 春敏, 王 萍, 毛 高平, 任 力. 模拟失重状态下大鼠小肠黏膜光镜及电镜的形态学改变. 中华航空航天医学杂志. 2008;19:124-128. |
| 21. | Luk GD, Bayless TM, Baylin SB. Diamine oxidase (histaminase). A circulating marker for rat intestinal mucosal maturation and integrity. J Clin Invest. 1980;66:66-70. [PubMed] |
| 22. | Suzuki T. Regulation of intestinal epithelial permeability by tight junctions. Cell Mol Life Sci. 2013;70:631-659. [PubMed] [DOI] |
| 23. | Weber CR, Raleigh DR, Su L, Shen L, Sullivan EA, Wang Y, Turner JR. Epithelial myosin light chain kinase activation induces mucosal interleukin-13 expression to alter tight junction ion selectivity. J Biol Chem. 2010;285:12037-12046. [PubMed] [DOI] |
| 24. | Ronco C. Endotoxin removal: history of a mission. Blood Purif. 2014;37 Suppl 1:5-8. [PubMed] [DOI] |
| 26. | Rivera CA, Tcharmtchi MH, Mendoza L, Smith CW. Endotoxemia and hepatic injury in a rodent model of hindlimb unloading. J Appl Physiol (1985). 2003;95:1656-1663. [PubMed] |
| 27. | 周 金莲, 李 成林, 易 勇, 周 立艳, 段 育忠, 刘 子沛, 吉 敏, 张 涛, 崔 彦. 模拟失重导致门静脉内毒素血症和肝脏超微结构改变. 胃肠病学和肝病学杂志. 2011;20:1140-1143. |
| 28. | Al Omari MM, Jaafari DS, Al-Sou'od KA, Badwan AA. Moxifloxacin hydrochloride. Profiles Drug Subst Excip Relat Methodol. 2014;39:299-431. [PubMed] [DOI] |
| 29. | Kirkpatrick AW, Nicolaou S, Campbell MR, Sargsyan AE, Dulchavsky SA, Melton S, Beck G, Dawson DL, Billica RD, Johnston SL. Percutaneous aspiration of fluid for management of peritonitis in space. Aviat Space Environ Med. 2002;73:925-930. [PubMed] |
| 30. | Haidegger T, Sándor J, Benyó Z. Surgery in space: the future of robotic telesurgery. Surg Endosc. 2011;25:681-690. [PubMed] [DOI] |