修回日期: 2015-05-20
接受日期: 2015-06-01
在线出版日期: 2015-07-18
目的: 观察不同剂量的槲皮素对高甘油三酯血症(hypertriglyceridemia, HTG)相关性急性胰腺炎(acute pancreatitis, AP)大鼠胰腺病理的影响.
方法: 72只♂SD大鼠, 随机分为12组: HTG组(n = 6, 高脂饮食2 wk: 77%普通饲料+3%胆固醇+20%猪油)、HTG+AP组(n = 6, 高脂饮食2 wk, 腹腔内注射雨蛙肽50 μg/kg×2次, 间隔1 h)、HTG+AP+槲皮素组(n = 24, 高脂饮食2 wk后再分为4组, 诱发AP后分别给予50、100、150、200 mg/kg槲皮素腹腔注射)、正常血脂组(n = 6, 正常饮食2 wk)、正常血脂+AP组(n = 6, 正常饮食2 wk, 腹腔内注射雨蛙肽50 μg/kg×2次, 间隔1 h)、正常血脂+AP+槲皮素组(n = 24, 正常饮食2 wk后再分为4组, 诱发AP后分别给予50、100、150、200 mg/kg槲皮素腹腔注射). 所有大鼠均于AP造模后9 h处死, 测定血浆淀粉酶活性, 评价胰腺病理变化.
结果: 大鼠高脂饮食2 wk后, 血清甘油三酯和总胆固醇均较正常饮食组明显升高, 且差异有统计学意义(P<0.001). 与正常血脂+AP组相比, HTG+AP组的血浆淀粉酶活性(23670.00 U/L±2053.13 U/L vs 13136.00 U/L±3536.95 U/L)和胰腺病理学评分(9.75分±0.94分 vs 5.92分±1.32分)均明显升高, 且差异有统计学意义(P = 0.022; P<0.001). 正常血脂+AP+槲皮素组和HTG+AP+槲皮素组的血浆淀粉酶活性均呈剂量依赖性地下降, 胰腺病理损伤也相应地减轻, 槲皮素的这种保护效应对HTG+AP组尤为明显(HTG+AP 100、150、200 mg/kg槲皮素干预组 vs 未给药组总评分: 均P<0.001; 正常血脂+AP 100、150、200 mg/kg槲皮素干预组 vs 未给药组总评分: P = 0.084, P = 0.003, P<0.001). 其中, 又以腺泡坏死和炎性浸润改善得最为显著(HTG+AP 100、150、200 mg/kg槲皮素干预组 vs 未给药组坏死评分: 均P<0.001; 炎性浸润评分: P = 0.008, P = 0.006, P = 0.001).
结论: 槲皮素可以减轻大鼠HTG相关性AP的胰腺病理损伤, 尤其是腺泡坏死和炎性浸润, 且这一保护作用呈现剂量依赖性.
核心提示: 槲皮素可以呈剂量依赖性地改善胰腺病理, 且槲皮素对高甘油三酯血症(hypertriglyceridemia)相关性急性胰腺炎(acute pancreatitis, AP)的胰腺病理改善作用显著大于正常血脂的AP, 尤其是腺泡坏死和炎性浸润.
引文著录: 郑俊媛, 曾悦, 吴江红, 陈静, 刘杰. 不同剂量槲皮素对高甘油三酯血症相关性急性胰腺炎大鼠胰腺病理的影响. 世界华人消化杂志 2015; 23(20): 3195-3202
Revised: May 20, 2015
Accepted: June 1, 2015
Published online: July 18, 2015
AIM: To investigate the effect of different doses of quercetin on the pancreatic pathology in rats with cerulein-induced acute pancreatitis (AP) associated with hypertriglyceridemia (HTG).
METHODS: Seventy-two male SD rats were randomly divided into 12 groups: HTG group (n = 6, fed a high-fat diet for 2 wk: 77% normal chow + 3% cholesterol + 20% lard), HTG + AP group (n = 6, after 2 wk of a high-fat diet, AP was induced by peritoneal injection of 50 μg/kg cerulein twice at 1-h interval), HTG + AP + quercetin groups [n = 24, divided into 4 groups (6 rats each), quercetin (50, 100, 150, 200 mg/kg) was administered to rats by peritoneal injection after AP induction], normal blood lipid group (n = 6, fed normal chow for 2 wk), normal blood lipid + AP group (n = 6, after 2 wk of normal chow, AP was induced by peritoneal injection of 50 μg/kg cerulein twice at 1-h interval), normal blood lipid + AP + quercetin groups [n = 24, divided into 4 groups (6 rats each), quercetin (50, 100, 150, 200 mg/kg) was administered to rats by peritoneal injection after AP induction]. All rats were sacrificed 9 h after AP induction. Plasma levels of amylase were tested and the pathological changes of pancreatic tissues were observed.
RESULTS: After two weeks of a high-fat diet, serum levels of triglyceride and total cholesterol were much higher than those in rats given normal chow (P < 0.001). Compared with the normal blood lipid + AP group, plasma level of amylase was significantly higher (23670.00 U/L ± 2053.13 U/L vs 13136.00 U/L ± 3536.95 U/L) and pancreatic tissue injury was significantly more serious in the HTG + AP group (9.75 ± 0.94 vs 5.92 ± 1.32) (P = 0.022; P < 0.001). Quercetin intervention groups showed significantly lower levels of amylase and less serious pancreatic tissue injury; the effect was dose-dependent. This protective effect of quercetin was more obvious in the HTG + AP group than in the AP group (HTG + AP + 100, 150, 200 mg/kg quercetin group vs HTG + AP group total histopathological scores: P < 0.001 for all; normal blood lipid + AP + 100, 150, 200 mg/kg quercetin group vs normal blood lipid + AP group total histopathological scores: P = 0.084, P = 0.003, P < 0.001), particularly in acinar necrosis and inflammatory infiltration (HTG + AP + 100, 150, 200 mg/kg quercetin group vs HTG + AP group necrosis score: P < 0.001 for all; inflammatory infiltration: P = 0.008, P = 0.006, P = 0.001).
CONCLUSION: Quercetin could significantly ameliorate the pancreatic pathology in rats with HTG related AP, especially acinar necrosis and inflammatory infiltration. The protective effect is dose-dependent.
- Citation: Zhen JY, Zeng Y, Wu JH, Chen J, Liu J. Effect of different doses of quercetin on pancreatic pathology in rats with hypertriglyceridemia related acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3195-3202
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3195.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3195
随着西式饮食的全球化, 高脂食物的摄入越来越多, 高脂饮食相关性疾病也越来越成为各学科的研究热点, 包括高脂饮食诱发的高脂血症、肥胖、非酒精性脂肪肝、糖尿病、高血压等. 作为急性胰腺炎(acute pancreatitis, AP)发病的危险因素之一, 高脂饮食诱发的高脂血症可直接诱发AP以及加重AP病情[1]. 槲皮素(3,3',4',5,7-五羟基黄酮)(quercetin)是一种广泛存在于水果、蔬菜和谷物等植物中的植源性黄酮类化合物, 具有抗炎、抗氧化、降压、降脂、抗肿瘤等多种药理作用, 对多种疾病可发挥保护效应[2-5]. 本研究拟在大鼠高脂饮食诱发高甘油三酯血症(hypertriglyceridemia, HTG)的基础上再诱发AP模型, 并观察不同剂量槲皮素对其的影响.
健康♂SD大鼠(SPF级, 体质量150-160 g)72只, 与动物饲料, 均购自上海斯莱克实验动物有限公司. 高脂饲料配方(以质量分数表示): 77%正常饲料+20%猪油+3%胆固醇. 雨蛙肽、槲皮素和二甲基亚砜(dimethyl sulfoxide, DMSO)购自Sigma. 雨蛙肽溶于生理盐水(normal saline, NS), 槲皮素溶于50%DMSO.
1.2.1 造模及分组: SD大鼠分为12组: (1)HTG组(n = 6), SD大鼠高脂饮食2 wk建立HTG模型; (2)HTG+AP组(n = 6), SD大鼠高脂饮食2 wk建立HTG模型后, 腹腔内注射雨蛙肽50 μg/kg×2次, 每次间隔1 h; (3)HTG+AP+槲皮素组(n = 24): SD大鼠建立HTG+AP模型后再分为4个不同剂量槲皮素干预组, 每组6只. 50 mg/kg干预组, 诱发AP后30 min予槲皮素50 mg/kg腹腔注射; 100 mg/kg干预组, 诱发AP后30 min和1 h各予50 mg/kg槲皮素腹腔注射; 150 mg/kg干预组, 诱发AP后30 min、1和2 h各予50 mg/kg槲皮素腹腔注射; 200 mg/kg干预组, 诱发AP后30 min、1、2和3 h各予50 mg/kg槲皮素腹腔注射; (4)正常血脂组(n = 6); (5)正常血脂+AP组(n = 6): SD大鼠正常饮食2 wk后, 腹腔内注射雨蛙肽50 μg/kg×2次, 每次间隔1 h; (6)正常血脂+AP+槲皮素组(n = 24): SD大鼠建立正常血脂+AP模型后再分为4组, 每组6只, 分别予50、100、150、200 mg/kg槲皮素腹腔注射. 未予槲皮素干预组均予等量50%DMSO腹腔注射作为对照. 鉴于预实验表明诱发AP 9 h后胰腺病理损伤最严重, 故本试验选择术后9 h解剖取材. 所有大鼠予1%戊巴比妥钠腹腔注射麻醉, 腹主动脉采血处死.
1.2.2 标本取材及处理: 正常饮食或高脂饮食2 wk后, 所有大鼠尾静脉采血, 分离血清送检本院生化室检测甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC). 解剖后, 抽取腹主动脉血分离血浆送检本院生化室检测淀粉酶活性. 取胰腺组织置于中性甲醛溶液中固定48 h, 常规脱水、包埋、切片及HE染色, 胰腺组织病理学评分参照Schmidt法[6].
统计学处理 各组计量资料采用mean±SD表示. 通过SPSS19.0软件进行统计学分析, 采用t检验和方差分析比较各组间差异, P<0.05为差异有统计学意义.
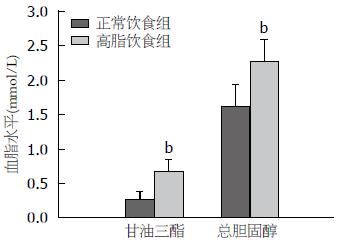
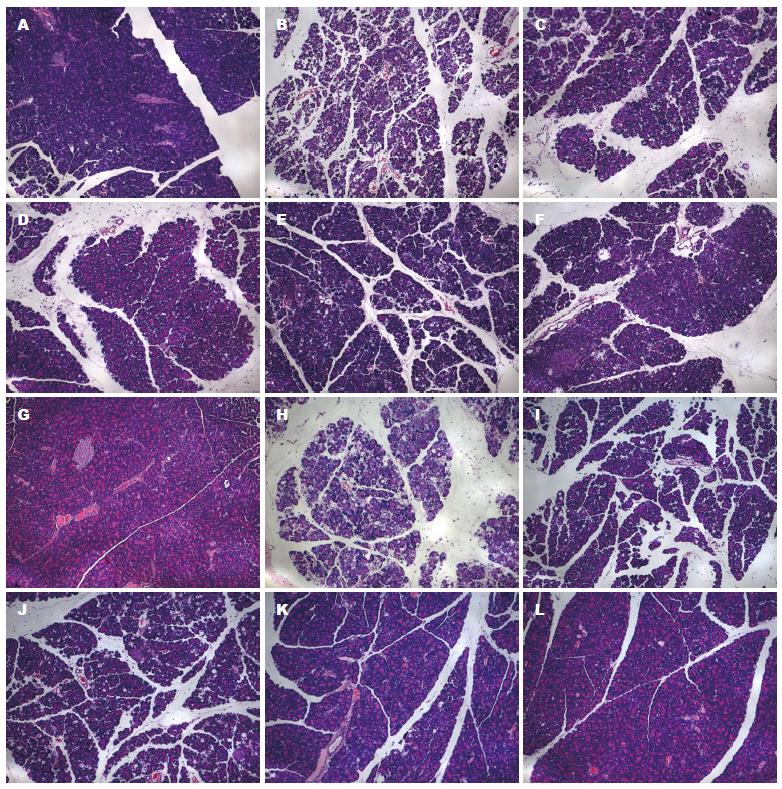
高脂饮食2 wk后, 成功建立HTG模型, 大鼠血清TG、TC水平均显著高于正常饮食组(0.67 mmol/L±0.18 mmol/L vs 0.27 mmol/L±0.11 mmol/L, 2.27 mmol/L±0.32 mmol/L vs 1.62 mmol/L±0.32 mmol/L)(P<0.001)(图1). 诱发AP后, HTG+AP组的淀粉酶活性明显高于正常血脂+AP组(23670.00 U/L±2053.13 U/L vs 13136.00 U/L±3536.95 U/L, P = 0.022)(图2). 光镜下可见HTG+AP组胰腺水肿、坏死、出血和炎性浸润程度较正常血脂+AP组明显加重, 尤其是腺泡坏死(3.42分±0.38分 vs 1.58分±0.74分)和炎性浸润(1.42分±0.49分 vs 0.75分±0.27分)(P<0.001, P = 0.020)(图3, 4).
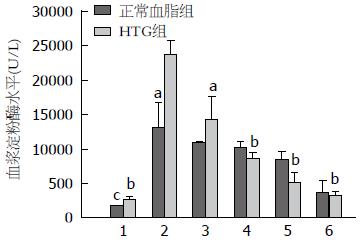
HTG大鼠诱发AP, 槲皮素干预组的血浆淀粉酶活性随着槲皮素剂量的升高而逐渐减低, 50、100、150、200 mg/kg槲皮素干预组的血浆淀粉酶活性分别为14272.33 U/L±3272.79 U/L、8650.00 U/L±822.64 U/L、5140.33 U/L±1461.33 U/L和3283.67 U/L±523.57 U/L, 与未给药组(23670.00 U/L±2053.13 U/L)比较, 差异均有统计学意义(P值分别为0.014, <0.001, <0.001, <0.001). 而正常血脂大鼠诱发AP后, 槲皮素干预组的血浆淀粉酶活性虽然随槲皮素剂量依赖性地降低, 但与未给药组比较, 差异均无统计学意义(图2). 正常血脂+AP和HTG+AP 50、100、150、200 mg/kg槲皮素干预组淀粉酶被抑制的程度分别是16.26% vs 39.70%、22.12% vs 63.46%、35.74% vs 78.28%和71.67% vs 86.13%.
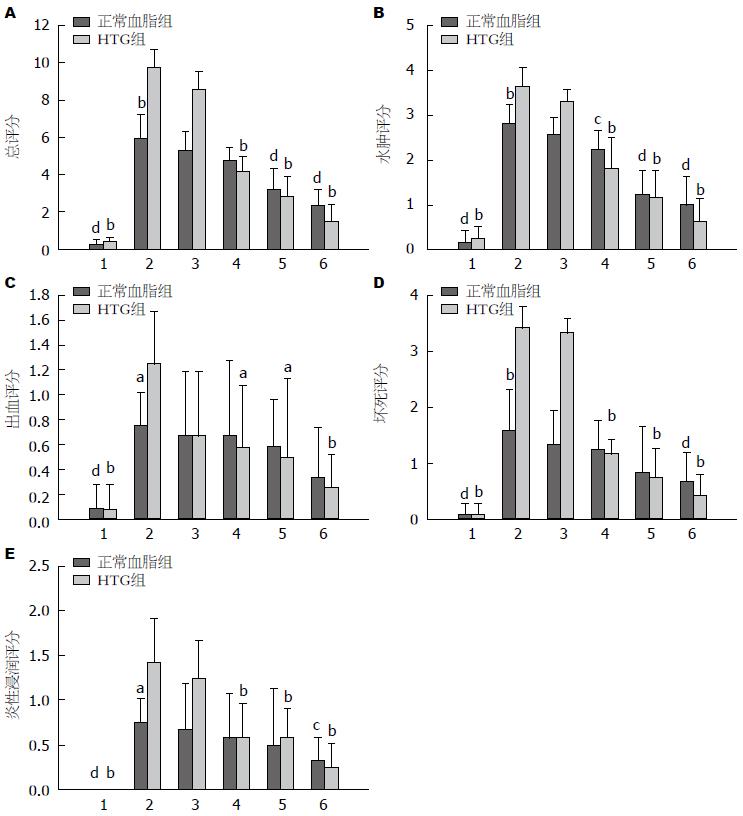
HTG大鼠AP槲皮素干预后, 胰腺病理损伤减轻, 总评分和水肿、出血、坏死、炎性浸润评分均随着槲皮素剂量的升高而逐渐降低, 且100、150、200 mg/kg槲皮素干预组的病理评分与未给药组比较, 差异均有统计学意义(总评分: 均P<0.001; 水肿: 均P<0.001; 出血: P = 0.03, P = 0.036, P = 0.001; 坏死: 均P<0.001; 炎性浸润: P = 0.008, P = 0.006, P = 0.001), 而50 mg/kg槲皮素干预组则没有. 其中, 在胰腺坏死方面, HTG+AP+100、150、200 mg/kg槲皮素干预组的评分分别为1.17分±0.26分、0.75分±0.52分、0.42分±0.38分, 与HTG+AP组(3.42分±0.38分)比较, 均P<0.001; 炎性浸润评分分别为0.58分±0.38分、0.42分±0.49分、0.25分±0.27分, 与HTG相关性AP组(1.42分±0.49分)比较, P值分别为0.008、0.006、0.001.
正常血脂大鼠AP槲皮素干预后, 总评分和水肿、出血、坏死、炎性浸润评分也都呈现槲皮素剂量依赖性地降低. 但其中, 150和200 mg/kg槲皮素干预组的胰腺病理总评分与未给药组比较, 差异有统计学意义(P = 0.003; P<0.001), 而50和100 mg/kg槲皮素干预组则没有; 100、150、200 mg/kg槲皮素干预组的水肿评分与未给药组比较, 差异有统计学意义(P = 0.035; P<0.001; P<0.001), 而50 mg/kg槲皮素干预组则没有; 200 mg/kg槲皮素干预组的坏死和炎性浸润评分与未给药组比较(0.67分±0.52分 vs 1.58分±0.74分; 0.33分±0.26分 vs 0.75分±0.27分), 差异有统计学意义(P = 0.032; P = 0.022), 而50、100、150 mg/kg槲皮素干预组则没有. 具体病理变化及评分如图3, 4.
已有研究[7]表明HTG加重雨蛙肽诱导的AP, 本研究通过在SD大鼠高脂饮食2 wk诱发HTG的基础上诱发AP模型, 进一步证实与正常血脂的AP相比, HTG相关性AP的胰腺损伤更为严重, 血浆淀粉酶活性也更高. 高脂饮食诱发的HTG相关性AP重症化的机制可能包括: (1)过多的TG被胰脂肪酶水解成游离脂肪酸(free fatty acids, FFAs), FFA对胰腺腺泡细胞和血管内皮细胞有直接的细胞毒性; 大量乳糜微粒可增加血液黏稠度, 甚至堵塞血管; 局部缺血缺氧进一步导致pH下降, 酸性环境更加加重FFA的毒性[8]; (2)高脂饮食引起内脏脂肪大量堆积, AP时大量胰周脂肪坏死, 脂解作用及其产生的不饱和脂肪酸(unsaturated fatty acids, UFAs)也可能是AP加重的原因之一[9]; (3)过量的TG沉积在肝脏胰腺等非脂肪组织, 前者发展为非酒精性脂肪性肝病, 后者则可能引起"非酒精性脂肪性胰腺病", 通过扰乱微循环和氧化应激引起胰腺慢性损伤[10], 从而使得胰腺对各种致病因素的敏感性增加, 发生AP时胰腺病理损伤可能也更加严重; (4)慢性低度炎症学说: 高脂饮食增加体内脂质代谢, 产生大量氧自由基, 使机体处于一种慢性低度炎性状态[11], AP时炎性反应进一步加剧扩大; (5)内质网应激学说: 高脂血症可以促进肝脏、脂肪和胰腺等多个组织发生内质网应激反应(endoplasmic reticulum stress, ERS)[12-15]. Zeng等[16]的研究发现在SD大鼠高脂饮食的基础上再用雨蛙肽诱发AP模型, 胰腺损伤比正常饮食AP明显加重, 而且电镜观察到前者内质网出现极度扩张、变形并出现空泡; ERS标记分子葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)、剪切型X盒结合蛋白1(spliced X-box binding protein 1, sXBP1)的基因和蛋白水平均显著增高; (6)脂肪因子学说: 脂肪组织不仅是机体的能量"贮存仓库", 还是一个重要的内分泌器官, 分泌脂联素(adiponectin, APN)、瘦素、抵抗素、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、内脂素等多种因子, 称脂肪因子. 高脂饮食可引起脂肪因子分泌异常, 比如APN分泌水平降低[17]; 而APN对高脂饮食AP具有保护效应, Araki等[18]在Gut上发表了一项研究, APN基因敲除小鼠予高脂饮食喂养后即使给予低剂量雨蛙肽注射也诱导了严重的胰腺损伤, 而利用腺病毒转染的APN过表达小鼠经高脂饮食+雨蛙肽处理, 胰腺损伤却明显减轻.
槲皮素是植物界分布最广的一种黄酮类化合物, 大量研究[19-22]表明槲皮素对非酒精性脂肪性肝病、心血管疾病、Ⅱ型糖尿病等多种疾病都具有一定的保护效应. Carvalho等[23]在注射雨蛙肽(50 μg/kg i.p, qh×5 h)诱发正常饮食小鼠AP 1 h之前预先给予25、50、100 mg/kg槲皮素灌胃, 结果发现这三个剂量槲皮素干预组的胰腺损伤均明显减轻, 白介素(interleukin, IL)-1β、IL-6、TNF-α和过氧化物酶(myeloperoxidase, MPO)、丙二醛(methane dicarboxylic aldehyde, MDA)水平均降低, 且与未给药组比较差异均有统计学意义, 故推测槲皮素可能是通过抗炎抗氧化的机制发挥保护效应, 但该研究并未观察到25、50、100 mg/kg槲皮素明显的剂量依赖效应. 我们查阅文献, 参考了槲皮素动物实验的安全剂量之后, 采用SD大鼠AP建模和槲皮素大剂量, 即150、200 mg/kg治疗性腹腔注射给药进一步证实了槲皮素对AP的保护效应, 而且呈明显的剂量依赖效应; 而常规剂量50 mg/kg槲皮素干预对AP的病理改善不明显, 病理学评分虽有下降却差异均无统计学意义. 更有趣的是, 我们发现槲皮素干预后, HTG的AP比正常血脂的AP改善的更为显著, 且血浆淀粉酶和胰腺的病理改变随着槲皮素的剂量改变依赖效应更明显. 与正常血脂诱发AP相比, 槲皮素更明显地改善了HTG诱发AP的动物胰腺病理变化, 推测他可能阻断了HTG相关性AP发病的主要发病环节. 有研究[24]表明槲皮素可以影响高脂饮食肥胖大鼠内脏脂肪因子的分泌和表达, 从而调节肥胖相关炎症反应; 槲皮素也能刺激APN的分泌[25], 发挥抗炎抗氧化的作用. 大量的体内和体外实验研究[26-30]发现槲皮素还可以抑制ERS, 而ERS正是高脂血症HTG相关性AP的重要发病机制之一[16]. 槲皮素极有可能就是通过阻断ERS或者调节脂肪因子的分泌表达来发挥对HTG相关性AP的保护效应. 鉴于本研究中槲皮素给药和解剖取材只相差8个多小时, 而槲皮素发挥降脂作用是慢性的、长期的(至少是在连续8 wk以上)[31], 故槲皮素不可能是通过降脂作用来改善HTG相关性AP的.
本研究成功建立HTG相关性大鼠AP模型, 进一步证实了HTG的AP比正常血脂的AP病情更严重; 并观察到治疗性给予槲皮素干预后, AP的病理损伤明显减轻, 且槲皮素对AP的保护效应呈剂量依赖性. 最有意义的是发现槲皮素对HTG相关性AP的病理改善作用显著大于正常血脂的AP, 尤其是腺泡坏死和炎性浸润, 提示槲皮素较为针对性地抑制了HTG相关性AP的某个主要发病机制, 确切的机制有待进一步研究.
随着饮食结构的改变, 高甘油三酯血症(hypertriglyceridemia, HTG)相关性急性胰腺炎(acute pancreatitis, AP)的发病率逐年升高, 且病情严重, 易反复发作, 并发症较多; 发病机制复杂, 目前尚未无统一、有效的治疗方案. 本文从胰腺组织学改善的角度探讨了槲皮素对HTG相关性AP的治疗作用.
沈薇, 教授, 重庆医科大学附属第二医院消化内科
槲皮素(quercetin)是植物界广泛分布的一种黄酮类化合物, 具有抗炎、抗氧化、降压、降脂、抗肿瘤等多种药理作用. 大量研究表明槲皮素对酒精性脂肪肝、心血管疾病、糖尿病、急性肺损伤等多种疾病都具有一定的保护效应.
Carvalho等研究显示, 在正常饮食小鼠AP模型(雨蛙肽50 μg/kg i.p, qh×5 h)中, 造模前1 h预先给予槲皮素灌胃, 可减轻胰腺损伤, 降低白介素(interleukin, IL)-1β、IL-6、肿瘤坏死因子-α和过氧化物酶(myeloperoxidase)、丙二醛(methane dicarboxylic aldehyde)水平, 推测槲皮素可能通过抗炎抗氧化的机制发挥保护效应, 但该研究并未观察到25、50、100 mg/kg槲皮素明显的剂量依赖效应.
本研究采用SD大鼠AP建模、槲皮素小剂量(50、100 mg/kg)和大剂量(150、200 mg/kg)腹腔注射给药, 发现槲皮素呈剂量依赖性地改善胰腺病理, 且槲皮素对HTG相关性AP的病理改善作用显著大于正常血脂的AP, 尤其是腺泡坏死和炎性浸润.
本研究在大鼠HTG相关性AP模型上首次探讨槲皮素干预对胰腺病理的影响, 发现槲皮素可剂量依赖性地改善HTG相关性AP的胰腺病理, 对HTG相关性AP发病机制的阐明及治疗方案的制定具有一定的价值.
内质网应激(ERS): 任何扰乱ER稳态的因素如氧化应激、Ca2+紊乱、病毒感染等都可导致ERS, 激活多条下游通路, 促进细胞生存; 但应激反应过于强烈或持久时, ERS则引起细胞损伤甚至死亡. ERS激活的三大信号通路包括: IRE1α/sXBP1、PERK/eIF2α和ATF6通路.
本研究选题紧密结合临床, 设计合理, 从胰腺组织学改善的角度探讨了槲皮素对HTG相关性AP的治疗作用, 具有一定创新, 科学性、学术性较好, 具有一定理论及临床意义.
编辑: 韦元涛 电编:闫晋利
| 1. | Baranyai T, Terzin V, Vajda Á, Wittmann T, Czakó L. Hypertriglyceridemia causes more severe course of acute pancreatitis. Clin Lipidol. 2012;7:731-736. [DOI] |
| 2. | Takashima K, Matsushima M, Hashimoto K, Nose H, Sato M, Hashimoto N, Hasegawa Y, Kawabe T. Protective effects of intratracheally administered quercetin on lipopolysaccharide-induced acute lung injury. Respir Res. 2014;15:150. [PubMed] [DOI] |
| 3. | Liu H, Guo X, Chu Y, Lu S. Heart protective effects and mechanism of quercetin preconditioning on anti-myocardial ischemia reperfusion (IR) injuries in rats. Gene. 2014;545:149-155. [PubMed] [DOI] |
| 4. | Mahmoud MF, Hassan NA, El Bassossy HM, Fahmy A. Quercetin protects against diabetes-induced exaggerated vasoconstriction in rats: effect on low grade inflammation. PLoS One. 2013;8:e63784. [PubMed] [DOI] |
| 5. | Liu SH, Lu TH, Su CC, Lay IS, Lin HY, Fang KM, Ho TJ, Chen KL, Su YC, Chiang WC. Lotus leaf (Nelumbo nucifera) and its active constituents prevent inflammatory responses in macrophages via JNK/NF-κB signaling pathway. Am J Chin Med. 2014;42:869-889. [PubMed] [DOI] |
| 6. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] [DOI] |
| 7. | Hu G, Zhao Y, Tang Y, Wang Y, Shen J, Liu L, Li H, Liu Y, Cui X, Yu Y. Development of a novel model of hypertriglyceridemic acute pancreatitis in hamsters: protective effects of probucol. Pancreas. 2012;41:845-848. [PubMed] [DOI] |
| 8. | Valdivielso P, Ramírez-Bueno A, Ewald N. Current knowledge of hypertriglyceridemic pancreatitis. Eur J Intern Med. 2014;25:689-694. [PubMed] [DOI] |
| 9. | Noel P, Patel K, Durgampudi C, Trivedi RN, de Oliveira C, Crowell MD, Pannala R, Lee K, Brand R, Chennat J. Peripancreatic fat necrosis worsens acute pancreatitis independent of pancreatic necrosis via unsaturated fatty acids increased in human pancreatic necrosis collections. Gut. 2014; Dec 10. [Epub ahead of print]. [PubMed] [DOI] |
| 10. | Yan MX, Li YQ, Meng M, Ren HB, Kou Y. Long-term high-fat diet induces pancreatic injuries via pancreatic microcirculatory disturbances and oxidative stress in rats with hyperlipidemia. Biochem Biophys Res Commun. 2006;347:192-199. [PubMed] [DOI] |
| 11. | Das N, Sikder K, Bhattacharjee S, Majumdar SB, Ghosh S, Majumdar S, Dey S. Quercetin alleviates inflammation after short-term treatment in high-fat-fed mice. Food Funct. 2013;4:889-898. [PubMed] [DOI] |
| 12. | Wang Y, Wu Z, Li D, Wang D, Wang X, Feng X, Xia M. Involvement of oxygen-regulated protein 150 in AMP-activated protein kinase-mediated alleviation of lipid-induced endoplasmic reticulum stress. J Biol Chem. 2011;286:11119-11131. [PubMed] [DOI] |
| 13. | Li YX, Han TT, Liu Y, Zheng S, Zhang Y, Liu W, Hu YM. Insulin resistance caused by lipotoxicity is related to oxidative stress and endoplasmic reticulum stress in LPL gene knockout heterozygous mice. Atherosclerosis. 2015;239:276-282. [PubMed] [DOI] |
| 14. | Pierre N, Deldicque L, Barbé C, Naslain D, Cani PD, Francaux M. Toll-like receptor 4 knockout mice are protected against endoplasmic reticulum stress induced by a high-fat diet. PLoS One. 2013;8:e65061. [PubMed] [DOI] |
| 15. | Kim JA, Montagnani M, Chandrasekran S, Quon MJ. Role of lipotoxicity in endothelial dysfunction. Heart Fail Clin. 2012;8:589-607. [PubMed] [DOI] |
| 16. | Zeng Y, Wang X, Zhang W, Wu K, Ma J. Hypertriglyceridemia aggravates ER stress and pathogenesis of acute pancreatitis. Hepatogastroenterology. 2012;59:2318-2326. [PubMed] [DOI] |
| 17. | Chaolu H, Asakawa A, Ushikai M, Li YX, Cheng KC, Li JB, Zoshiki T, Terashi M, Tanaka C, Atsuchi K. Effect of exercise and high-fat diet on plasma adiponectin and nesfatin levels in mice. Exp Ther Med. 2011;2:369-373. [PubMed] |
| 18. | Araki H, Nishihara T, Matsuda M, Fukuhara A, Kihara S, Funahashi T, Kataoka TR, Kamada Y, Kiyohara T, Tamura S. Adiponectin plays a protective role in caerulein-induced acute pancreatitis in mice fed a high-fat diet. Gut. 2008;57:1431-1440. [PubMed] [DOI] |
| 19. | Surapaneni KM, Priya VV, Mallika J. Pioglitazone, quercetin and hydroxy citric acid effect on cytochrome P450 2E1 (CYP2E1) enzyme levels in experimentally induced non alcoholic steatohepatitis (NASH). Eur Rev Med Pharmacol Sci. 2014;18:2736-2741. [PubMed] |
| 20. | Arumugam S, Thandavarayan RA, Arozal W, Sari FR, Giridharan VV, Soetikno V, Palaniyandi SS, Harima M, Suzuki K, Nagata M. Quercetin offers cardioprotection against progression of experimental autoimmune myocarditis by suppression of oxidative and endoplasmic reticulum stress via endothelin-1/MAPK signalling. Free Radic Res. 2012;46:154-163. [PubMed] [DOI] |
| 21. | Eid HM, Nachar A, Thong F, Sweeney G, Haddad PS. The molecular basis of the antidiabetic action of quercetin in cultured skeletal muscle cells and hepatocytes. Pharmacogn Mag. 2015;11:74-81. [PubMed] [DOI] |
| 22. | Alam MM, Meerza D, Naseem I. Protective effect of quercetin on hyperglycemia, oxidative stress and DNA damage in alloxan induced type 2 diabetic mice. Life Sci. 2014;109:8-14. [PubMed] [DOI] |
| 23. | Carvalho KM, Morais TC, de Melo TS, de Castro Brito GA, de Andrade GM, Rao VS, Santos FA. The natural flavonoid quercetin ameliorates cerulein-induced acute pancreatitis in mice. Biol Pharm Bull. 2010;33:1534-1539. [PubMed] [DOI] |
| 24. | Kim OY, Lee SM, Do H, Moon J, Lee KH, Cha YJ, Shin MJ. Influence of quercetin-rich onion peel extracts on adipokine expression in the visceral adipose tissue of rats. Phytother Res. 2012;26:432-437. [PubMed] [DOI] |
| 25. | Wein S, Behm N, Petersen RK, Kristiansen K, Wolffram S. Quercetin enhances adiponectin secretion by a PPAR-gamma independent mechanism. Eur J Pharm Sci. 2010;41:16-22. [PubMed] [DOI] |
| 26. | Liu CM, Zheng GH, Ming QL, Sun JM, Cheng C. Protective effect of quercetin on lead-induced oxidative stress and endoplasmic reticulum stress in rat liver via the IRE1/JNK and PI3K/Akt pathway. Free Radic Res. 2013;47:192-201. [PubMed] [DOI] |
| 27. | Suganya N, Bhakkiyalakshmi E, Suriyanarayanan S, Paulmurugan R, Ramkumar KM. Quercetin ameliorates tunicamycin-induced endoplasmic reticulum stress in endothelial cells. Cell Prolif. 2014;47:231-240. [PubMed] [DOI] |
| 28. | Wu Z, Zhao J, Xu H, Lyv Y, Feng X, Fang Y, Xu Y. Maternal quercetin administration during gestation and lactation decrease endoplasmic reticulum stress and related inflammation in the adult offspring of obese female rats. Eur J Nutr. 2014;53:1669-1683. [PubMed] [DOI] |
| 29. | Guo W, Ding J, Zhang A, Dai W, Liu S, Diao Z, Wang L, Han X, Liu W. The inhibitory effect of quercetin on asymmetric dimethylarginine-induced apoptosis is mediated by the endoplasmic reticulum stress pathway in glomerular endothelial cells. Int J Mol Sci. 2014;15:484-503. [PubMed] [DOI] |
| 30. | Yao S, Sang H, Song G, Yang N, Liu Q, Zhang Y, Jiao P, Zong C, Qin S. Quercetin protects macrophages from oxidized low-density lipoprotein-induced apoptosis by inhibiting the endoplasmic reticulum stress-C/EBP homologous protein pathway. Exp Biol Med (Maywood). 2012;237:822-831. [PubMed] [DOI] |
| 31. | Kobori M, Masumoto S, Akimoto Y, Oike H. Chronic dietary intake of quercetin alleviates hepatic fat accumulation associated with consumption of a Western-style diet in C57/BL6J mice. Mol Nutr Food Res. 2011;55:530-540. [PubMed] [DOI] |