修回日期: 2014-11-09
接受日期: 2014-11-18
在线出版日期: 2015-01-18
目的: 研究RNA干扰技术的重组慢病毒载体沉默人肝癌HepG2细胞中表皮脂肪酸结合蛋白-5(fatty acid binding protein-5, FABP-5)基因对其增殖、凋亡和侵袭力的影响及作用机制.
方法: 构建3个靶向FABP-5基因shRNA载体, 并筛选出最有效的靶点. 将HepG2细胞分为3组: 实验组用FABP-5基因沉默重组慢病毒颗粒(LV-shRNA-FABP-5)感染HepG2细胞; 阴性对照组用空载慢病毒颗粒(LV-shRNA-NC组)感染HepG2; 空白对照组正常培养. 应用RT-PCR、实时荧光定量PCR检测FABP-5基因mRNA的表达; Western blot技术检测各组细胞FABP-5蛋白的相对表达; MTT法测定细胞体外增殖能力; Giemsa染色法检测细胞的克隆形成; 细胞侵袭小室法检测各组细胞的体外侵袭力; 流式细胞技术(flow cytometry, FCM)检测各组细胞增殖和凋亡的变化情况.
结果: 通过测序验证构建的FABP-5-shRNA表达载体, 感染人肝癌HepG2细胞, 荧光显微镜观察到细胞感染率>90%. Real-time PCR和Western blot结果得出: 相比空白对照组和阴性对照组, 实验组的3种靶点FABP-5-shRNA干扰序列中, LV-shRNA-FABP-5(1)靶点中FABP-5表达的敲减率最高(P<0.05), 筛选出此组为最佳靶点; MTT法结果提示: 实验组细胞490 nm处的吸光度(A)值在转染后第1-5天时均低于阴性对照组、空白对照组, 差别有统计学意义(P<0.05). Giemsa染色法结果显示: 稳定转染HepG2细胞后细胞的增殖能力明显下降(P<0.05); 细胞侵袭小室实验显示: 与空白对照和阴性对照组相比, 实验组细胞的侵袭力明显受到抑制(P<0.05); 流式细胞技术检测发现实验组的细胞相对于阴性对照组出现了明显的凋亡(P<0.05). 实验组较阴性对照组、空白对照组G2/M期延长, G1期缩短, 差别具有统计学意义(P<0.05).
结论: 人肝癌HepG2细胞中沉默FABP-5基因可以有效抑制其表达, 能够降低肝癌细胞的侵袭力, 抑制肝癌细胞的增殖, 将细胞周期阻滞于G2/M期, 使其凋亡显著增加.
核心提示: 本研究采用慢病毒为载体, 将表皮型脂肪酸结合蛋白(fatty acid binding protein-5)-shRNA质粒转入人肝癌HepG2细胞后, 有效阻滞了肝癌细胞周期进程, 凋亡大幅增加, 可明显降低肝癌生长增殖功能, 抑制肿瘤细胞的侵袭力.
引文著录: 周玲丽, 曹骥, 李薇, 罗旺, 杨香娣, 杨春, 骆成飘, 唐艳萍, 李瑗. 沉默FABP-5基因对人肝癌HepG2细胞的影响. 世界华人消化杂志 2015; 23(2): 179-188
Revised: November 9, 2014
Accepted: November 18, 2014
Published online: January 18, 2015
AIM: To investigate the effect of recombinant lentiviral mediated RNA interference (RNAi) targeting the fatty acid binding protein-5 (FABP-5) gene on cell proliferation, apoptosis and invasiveness in human hepatocellular carcinoma cell line HepG2, and to explore the possible underlying mechanisms.
METHODS: Three vectors carrying short hairpin RNAs (shRNAs) targeting the FABP-5 gene (FABP-5-shRNA expression vectors) were constructed and selected for the most effective one. HepG2 cells were divided into three groups: an experimental group, a normal control group and a negative control group. For the experimental group, HepG2 cells were transfected with the recombinant lentiviral vector (LV-shRNA-FABP-5), the negative control group was transfected with a control lentiviral vector (LV-shRNA-NC), and the normal control group did not undergo any treatment. The mRNA level of FABP-5 was analyzed by reverse transcription-polymerase chain reaction (RT-PCR) and quantitative real-time polymerase chain reaction (qPCR). The relative expression of FABP-5 protein was analyzed by Western blot. Cell proliferation was detected by MTT assay, cell colony formation was detected by Giemsa staining, cell invasion ability was assessed using the cell invasion chamber method, and cell cycle and apoptosis were observed by flow cytometry (FCM).
RESULTS: FABP-5-shRNA expression vectors were transfected into HepG2 cells, and fluorescence analysis indicated that > 90% of cells showed fluorescence signal. Compared with the normal control group and negative control group, FABP-5 mRNA and protein expression was significantly down-regulated in cells transfected with the three shRNA carrying vectors, with the LV-shRNA-FABP-5 having the highest efficiency ( P < 0.05). HepG2 cell transfected with the FABP-5-shRNA had significantly reduced proliferation and invasion compared with the other two groups ( P < 0.05). Flow cytometry analysis showed that the experimental group showed obvious apoptosis ( P < 0.05). The percentage of cells in G2/M phase significantly increased in cells transfected with the FABP-5-shRNA ( P < 0.05).
CONCLUSION: The high expression of the FABP-5 gene could be silenced by RNAi, and RNAi-induced FABP-5 knockdown could effectively inhibit the proliferation and invasion of HepG2 cells, block the cell cycle in G2/M phase, and significantly increase cell apoptosis.
- Citation: Zhou LL, Cao J, Li W, Luo W, Yang XD, Yang C, Luo CP, Tang YP, Li Y. Effect of RNA interference targeting FABP-5 on cell proliferation, apoptosis and invasion in human hepatocellular carcinoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 179-188
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/179.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.179
据研究统计, 肝细胞癌(hepatocellular carcinoma, HCC)是一种多见且预后较差的恶性肿瘤, 在人类癌症中排名前十, 死亡率在全球排名前五. 其中在男性和女性患恶性肿瘤死因排名中分别位于第2位和第6位. 全球每年肝癌的新发病例高达5000000例, 严重威胁着人类的健康[1-5]. 表皮型脂肪酸结合蛋白-5(fatty acid binding protein-5, FABP-5)基因是在表皮细胞中发现的脂肪酸结合蛋白, 分子量为15 kDa, 是肿瘤发生发展的关键作用分子. 在多种肿瘤中, 肿瘤相关的上皮细胞黏附分子可以上调FABP-5基因的表达, 高表达FABP-5基因的肿瘤细胞通过脂肪酸代谢产物影响细胞的信号转导功能[6]. 本课题组前期应用跨种属研究人、树鼩和大鼠肝癌及其相应的癌旁和正常肝组织, 发现在肝癌中FABP-5基因的mRNA和蛋白表达水平均显著上调[7-12]. 随后进一步用免疫组织化学方法验证了FABP-5在上述3个种属的肝癌组织中表达均明显上调, 并且发现FABP-5与肝癌的转移有重要关系. 提示该基因可能有早期诊断肝癌、预测肝癌转移的应用前景[13,14].
目前对FABP-5基因的功能尚不太清楚, 在肝癌中所起的作用也不了解. 为了进一步研究FABP-5基因在肝癌中的作用机制, 本研究采用RNA干扰技术, 沉默人肝癌HepG2细胞中FABP-5基因, 观察其对肿瘤细胞的增殖、凋亡和对其侵袭力的影响.
人肝癌HepG2细胞株购自上海凯基因技术有限公司; shRNA靶点设计和3种同时带有绿色荧光蛋白(green fluorescent protein, GFP)和嘌呤霉素抗性筛选标记的FABP-5基因沉默重组慢病毒颗粒LV-shRNA-FABP-5(1,2,3)及对照空载体慢病毒颗粒(LV-shRNA-NC)均由上海吉凯基因技术有限公司提供; DMEM、磷酸盐缓冲液(phosphatic buffered saline, PBS)、胎牛血清均购自Hyclone公司; TRIzol购自Invitrogen公司; 逆转录试剂盒购自美国Fermentas公司; 荧光定量PCR试剂盒购自TaKaRa宝生物工程(大连)有限公司、DNA Marker购自广州东盛生物科技有限公司; Western blot及IP细胞裂解液、苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)、SDS-PAGE蛋白上样缓冲液(5×)、BCA蛋白浓度测试试剂盒(增强型)、20×TBS缓冲液等均购自江苏碧云天生物技术研究所; PVDF膜购自美国Millipore公司; 碘化丙锭PI和RNase酶购自Fermentas公司; 流式细胞仪购自美国BD公司; 荧光显微镜购自奥林帕斯公司; 凋亡试剂盒购自eBioscience公司; 噻唑蓝(MTT)、二甲基亚砜(DMSO)均购自北京Solarbio科技有限公司; Giemsa染液(ECM550)购自美国Chemicon公司; 细胞侵袭实验采用Cell Invasion Assay Kit(Chemicon International Cat. No. ECM550); FABP-5和GAPDH基因的引物由上海生工生物工程公司合成; 兔抗人FABP-5单克隆抗体购自美国Abcam公司; 鼠抗人GAPDH单克隆抗体购自北京中杉金桥生物技术有限公司.
1.2.1 细胞培养和转染: 在37 ℃、50 mL/L CO2条件下, 将人肝癌细胞株HepG2用含10%胎牛血清、100 U/mL左氧氟沙星的DMEM的培养基进行培养. 随机选取处于对数生长期的细胞: 3个实验组分别加入Lv-shRNA-FABP-5(1,2,3), 阴性对照组加入(LV-shRNA-NC), 空白对照组常规培养. 转染前12 h将对数生长期的人肝癌细胞系HepG2进行胰酶消化, 制成细胞悬液接种于6孔板(细胞数约为5×104), 37 ℃、50 mL/L CO2培养箱培养待细胞融合度达到约20%-30%进行转染, 每孔均加入Polybrene及感染增强液, 转染的感染复数(multiplicity of infection, MOI)为10. 每组均设3个重复孔. 最后在荧光倒置显微镜下观察结果. 转染96 h后荧光最强, 转染后4-5 d收获细胞.
1.2.2 嘌呤霉素(puromycin)处理细胞: 通过预实验得到嘌呤霉素的最终工作浓度, 即HepG2细胞经过药物处理48 h后全部死亡的最低药物浓度. 转染72 h后每孔加入3 µg/mL的嘌呤霉素, 筛选出稳定的细胞株, 之后使用含0.1 µg/mL嘌呤霉素的培养基继续培养细胞.
1.2.3 实时荧光定量PCR、RT-PCR检测FABP-5基因的mRNA表达量: 首先Primer Primer 5.0软件设计引物, FABP-5上游引物: 5'-TGAAGGAGCTAGGAGTGGGAA-3', 下游引物: 5'-TGCACCATCTGTAAAGTTGCAG-3', 扩增片段212 bp; 内参GAPDH上游引物: 5'-TGACTTCAACAGCGACACCCA-3', 下游引物: 5'-CACCCTGTTGCTGTAGCCAAA-3', 扩增片段121 bp. TRIzol法分别提取5组细胞总RNA, 并逆转录为cDNA, 每组细胞设计3个重复孔. 采用2-ΔΔCt分析法, GAPDH基因作为内参, 2-ΔΔCt即反映FABP-5 mRNA相对表达水平. 检测目的基因FABP-5 mRNA的表达情况, 从而判断各个靶点的干扰效果, 确定有效的靶点.
1.2.4 Western blot检测FABP-5蛋白表达: 首先提取每组细胞蛋白, 用BCA法测定各组细胞总蛋白的浓度, 置于-80 ℃保存备用. 蛋白变性后上样, 经12%SDS-PAGE胶上电泳, 然后转至PVDF膜, TBST配制5%脱脂奶粉封闭液, 室温封闭1 h. 用FABP-5、GAPDH两张膜一抗4 ℃下孵育过夜, 第2天TBST洗膜3次, 5 min/次. 常温下孵育相应二抗1 h, TBST洗膜5 min/次×3次. 用ECL化学发光法检测蛋白质印记. 获取图像并进行条带灰度值分析; 目的蛋白相对表达量 = 目的蛋白条带灰度值/内参蛋白条带灰度值.
1.2.5 MTT法检测细胞增殖: 将对数生长期的各实验组细胞用胰酶消化后, 完全培养基重悬成细胞悬液, 接种于96孔板, 每组5复孔, 每孔100 µL(细胞数大约为2000个/孔), 共5张96孔板, 用于连续检测5 d, 置37 ℃、50 mL/L CO2培养箱培养. 从铺板后第2天开始, 培养终止前4 h, 每孔加入10 µL 5 mg/mL的MTT, 4 h后吸弃培养液, 每孔加入100 µL DMSO终止反应. 振荡器振荡5-10 min, 酶标仪490 nm检测吸光度(A)值, 取5个复孔的平均数, 绘制生长曲线.
1.2.6 各组细胞的克隆形成(Giemsa染色): 将对数生长期的各组细胞经胰酶消化, 完全培养基重悬, 细胞计数后将3组细胞于6孔板接种, 每组设3个复孔, 置接种好的细胞在培养箱中培养14 d或绝大多数单克隆中细胞数>50个终止. 实验终止时用PBS洗涤细胞1次, 多聚甲醛固定细胞30 min. PBS洗涤细胞1次, Giemsa染细胞20 min. 最后克隆计数.
1.2.7 细胞侵袭实验: 在无菌条件下, 将侵袭室放到培养箱中使其达到室温, 加温无血清培养基到嵌入物内, 之后从嵌入物小心移去培养基, 加含比侵袭室FBS高的培养基到下室中, 然后加处于对数生长期的各组细胞到每个嵌入物中. 在培养箱中培养24-72 h, 倒扣嵌入物于吸水纸上以去除培养基, 用棉拭子轻轻移去非侵袭细胞, 加染色液到板的空孔中. 将嵌入物浸泡在Giemsa染色液中20 min, 在膜的下表面染色侵入细胞, 浸泡嵌入物在一个大的水杯中, 冲洗数次. 空气中晾干嵌入物, 显微镜拍照膜. 然后用200 µL 10 mL/L的醋酸溶解, 检测A570值.
1.2.8 细胞周期检测: 将各组细胞接种于6孔板中. 待细胞生长至覆盖率约为80%时吸弃细胞培养上清, 胰酶消化细胞, 每组设3个复孔, 离心并弃去上清. 用4 ℃预冷PBS洗涤细胞沉淀1次, 再离心并收集细胞. 然后4 ℃预冷的700 mL/L的乙醇固定细胞至少1 h, 离心后去固定液. 每管加入100 µL RNase, 37 ℃水浴30 min, 然后每管再加入500 µL PI染液, 室温避光孵育30 min, 上机进行检测.
1.2.9 流式细胞仪检测细胞凋亡: 各组细胞经胰酶消化后, 收集细胞, 离心并弃去上清, 每组设3个复孔. PBS洗涤细胞沉淀1次, 然后用1×Staining buffer重悬细胞沉淀. 取细胞悬液100 µL, 加入5 µL Annexin V-APC染色, 室温避光10-15 min. 转移至流式上机管中, 上机检测, 实验重复3次.
统计学处理 应用SPSS16.0统计软件进行分析, 细胞凋亡计量资料两组间比较采用t检验; 其余计量资料多组间比较采用单因素方差分析(One-way ANOVA). 实验数据以mean±SD表示, P<0.05为差异具有统计学意义.
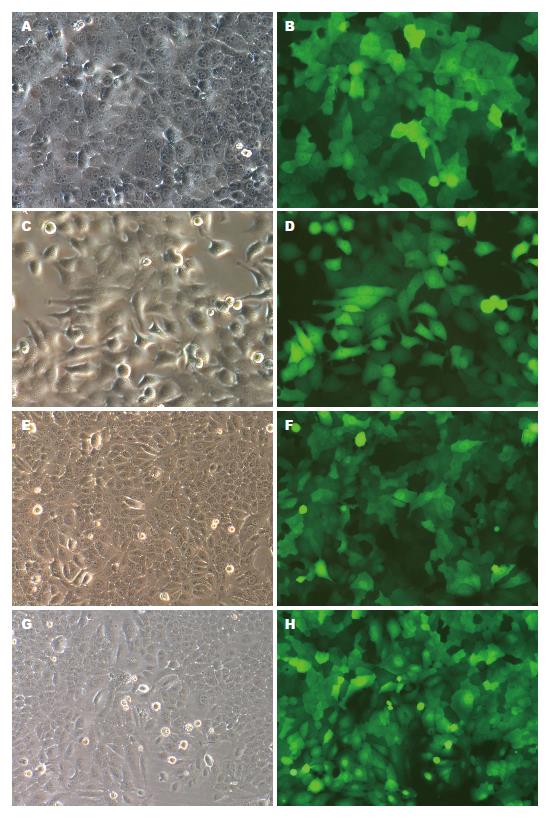
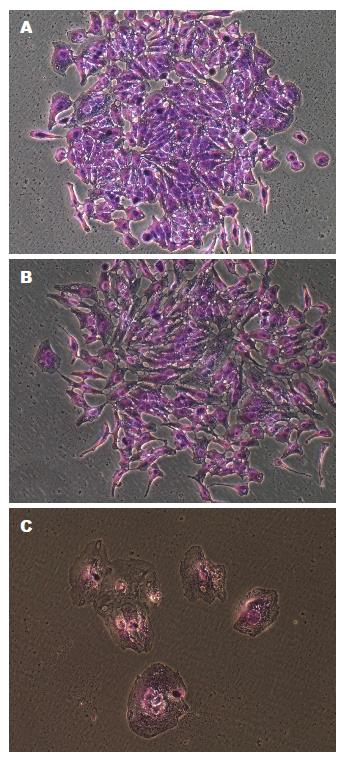
在感染复数MOI = 10的条件下, 将3种慢病毒LV-shRNA-FABP-5(1, 2, 3)和阴性对照组慢病毒LV-shRNA-NC感染HepG2细胞, 72 h后加3 µg/mL的嘌呤霉素处理, 96 h后GFP(绿色荧光蛋白)表达率稳定增强, 慢病毒感染效率>90%(如果转染率>50%, 即可验证内源性靶点). 3组实验组转染不同靶点的慢病毒后, 各组细胞GFP荧光显色均匀一致, GFP荧光蛋白表达强度无明显差别(图1).
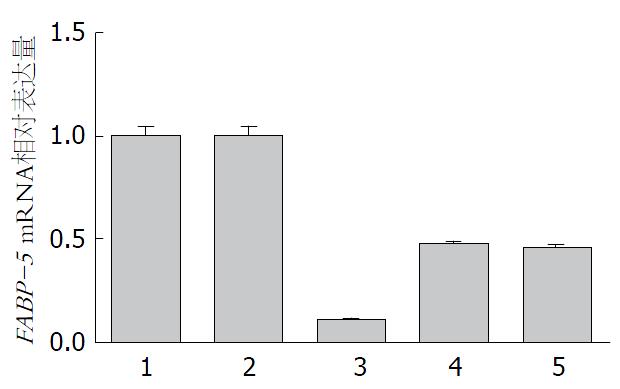
采用RT-PCR、实时荧光定量PCR的方法检测目的基因FABP-5 mRNA的表达情况, 从而判断各个靶点的干扰效果. 3个实验组相对于空白对照组和阴性对照组, FABP-5 mRNA的表达量减少均>50%以上, 差异具有统计学意义(均P<0.05). 其中LV-shRNA-FABP-5(1)组(即1号靶点)FABP-5表达的敲减率最高, 达85%以上. 认为该靶点为最佳的有效靶点(表1, 表2, 图2).
| 各靶点序号 | 靶点序列 |
| LV-shRNA-FABP-5(1) | 5'-TGGGAAGGAAAGCACAATA-3' |
| LV-shRNA-FABP-5(2) | 5'-ATCATCACTTGTGATGGTA-3' |
| LV-shRNA-FABP-5(3) | 5'-TGAATACATGAAGGAGCTA-3' |
| NC(Negative Control) | 5'-TTCTCCGAACGTGTCACGT-3' |
| 分组 | FABP-5 mRNA相对表达量(2-ΔΔCt) |
| Control | 0.998±0.049 |
| LV-shRNA-NC | 1.001±0.048 |
| LV-shRNA-FABP-5(1) | 0.108±0.002 |
| LV-shRNA-FABP-5(2) | 0.479±0.004 |
| LV-shRNA-FABP-5(3) | 0.457±0.016 |
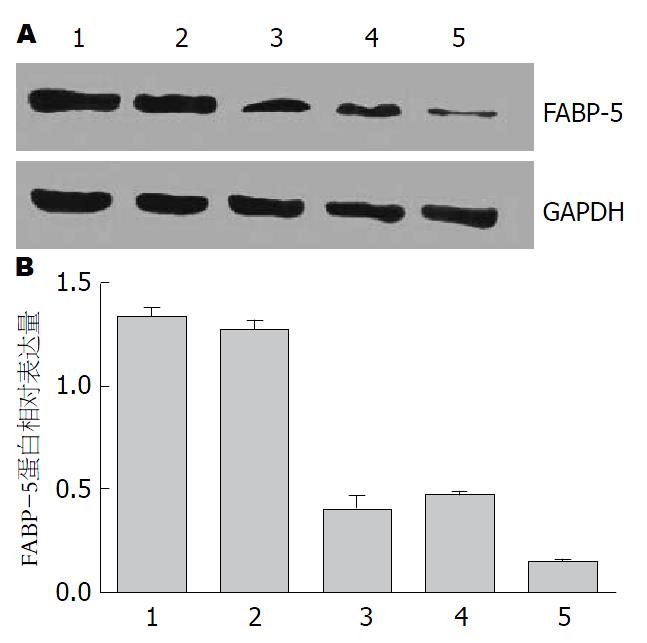
用GAPDH作为内参, 实验组3个靶点KD1、KD2、KD3的蛋白相对表达量分别比阴性对照组减少了88.28%、63.28%和67.97%, 差异均有统计学意义(P<0.05). 可得出LV-shRNA-FABP-5(1)组是最有效的靶点. 该靶点相比于阴性对照组和空白对照组, FABP-5蛋白表达减少明显分别达88.28%和88.81%, 差异具有统计学意义(P<0.05). 阴性对照组和空白对照组相比较差异无统计学意义(P>0.05)(图3).
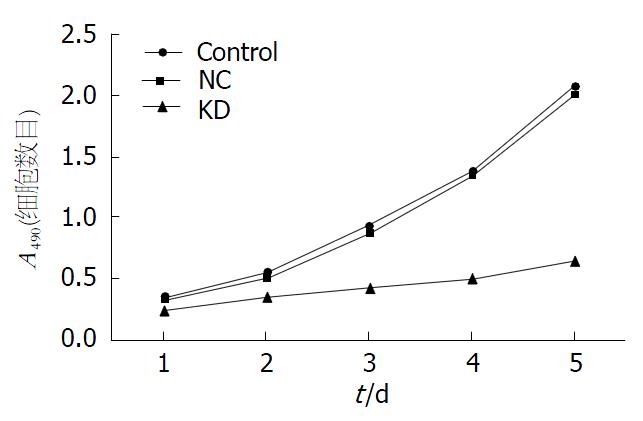
MTT检测结果表明, 实验组中细胞增殖抑制率明显受到抑制. A490值分别在第1、2、3、4和5天时, 实验组相比空白对照组和阴性对照组(0.25±0.01 vs 0.35±0.02, 0.34±0.02, F = 55.56; 0.35±0.01 vs 0.54±0.02, 0.52±0.01, F = 270.56; 0.43±0.01 vs 0.92±0.02, 0.90±0.04, F = 573.23; 0.50±0.02 vs 1.38±0.07, 1.36±0.05, F = 511.69; 0.65±0.07 vs 2.07±0.06, 2.02±0.03, F = 2183.38, 均P<0.05), 差异均有统计学意义. 阴性对照组和空白对照组比较, 差异无统计学意义(P>0.05). 由此可见, 实验组细胞生长明显受到抑制(表3, 图4).
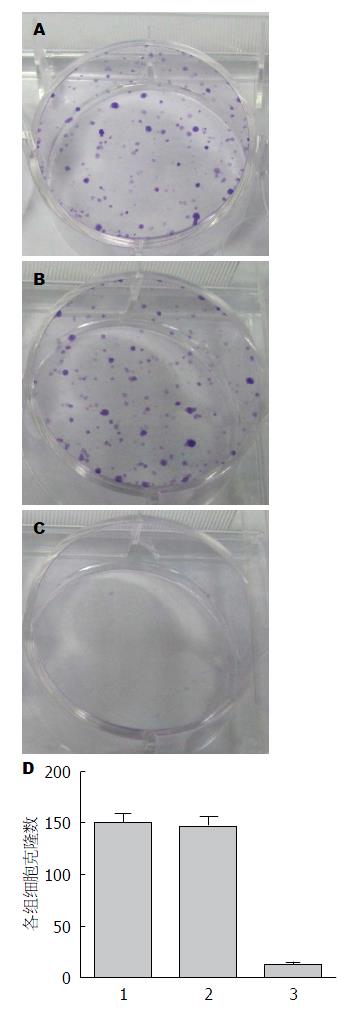
Giemsa染色法检测结果表明, 各组细胞克隆形成数不相等, 实验组较空白对照组、阴性对照的均明显减少. 实验组的克隆形成数与空白对照组和阴性对照组比较(12±2 vs 149±10, 146±11, F = 158.33, P<0.05), 差异具有统计学意义. 可以得出实验组细胞体外增生能力明显下降. 空白对照组和阴性对照组无统计学差异(P>0.05)(图5, 图6).
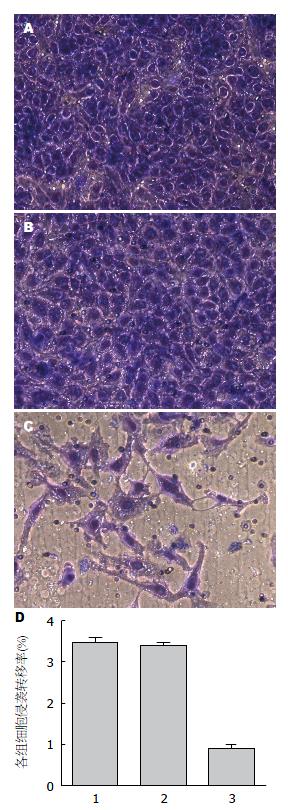
该实验检测结果得出, 实验组相比空白对照组和阴性对照组而言, 细胞的体外侵袭力明显受到抑制(0.87%±0.11% vs 3.45%±0.12%, 3.37%±0.06%, F = 602.29, P<0.05), 差异具有统计学意义. 而阴性对照组和空白对照组差异无统计学意义(P>0.05). 说明沉默FABP-5基因后能有效降低肿瘤细胞的侵袭能力(图7).
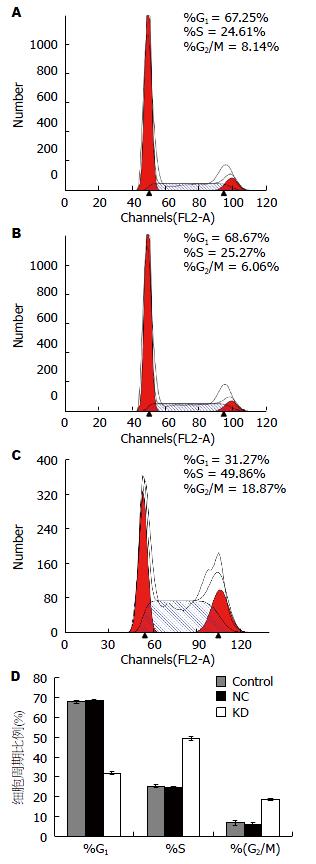
与阴性对照组和空白对照组相比, 实验组G1期细胞相比空白对照组和阴性对照组比例减少(31.91%±0.59% vs 67.95%±0.71%, 68.52%±0.48%, F = 3666.428, P<0.05). 实验组S期细胞比例较阴性对照组和空白对照组比例增高(49.41%±0.86% vs 25.32%±0.74%, 24.45%±0.44%, F = 1214.32, P<0.05). 实验组G2/M期细胞相比阴性对照组与空白对照组比例增高(18.69%±0.59% vs 6.73%±1.22%, 6.12%±0.63%, F = 202.06, P<0.05). 实验组G1期比例降低, S期和G2/M期比例增高. 阴性对照组和空白对照组比较, 差异无统计学意义(P>0.05)(表4, 图8).
| 分组 | G1期 | S期 | G2/M期 |
| 实验组 | 31.91±0.59 | 49.41±0.86 | 18.69±0.59 |
| 阴性对照组 | 68.52±0.48 | 24.45±0.44 | 6.12±0.63 |
| 空白对照组 | 67.95±0.71 | 25.32±0.74 | 6.73±1.22 |
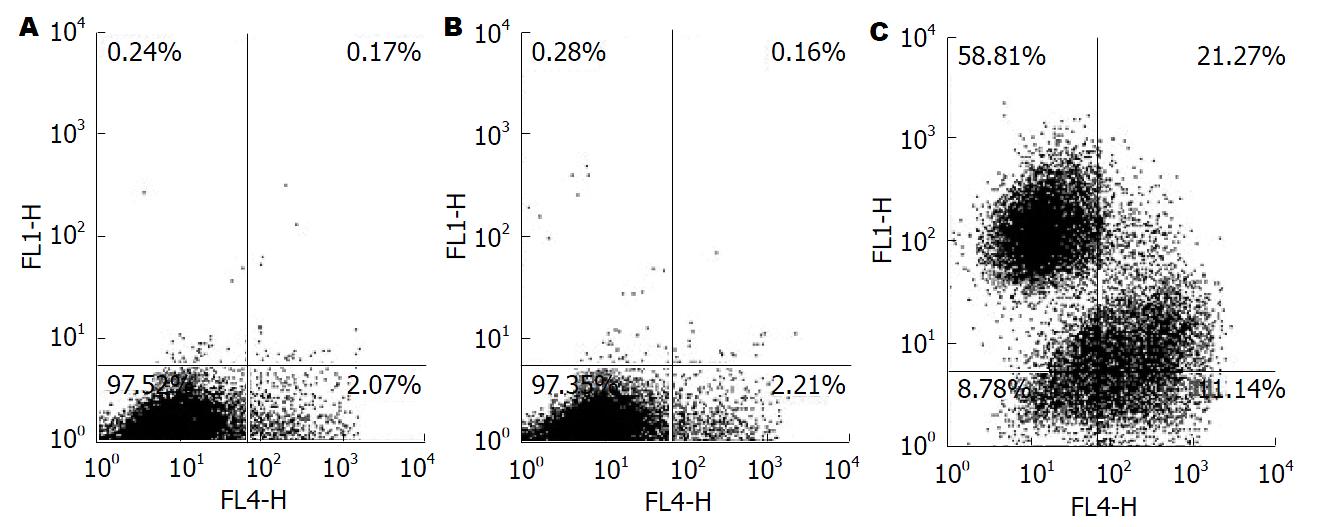
实验检测结果表明, 实验组中HepG2细胞凋亡率(26.88%±0.11%)明显高于阴性对照组(2.13%±0.36%), 差异有统计学意义(P<0.05). 由于此处凋亡百分比, 为GFP细胞中凋亡细胞所占比例. 空白对照组因细胞不带荧光, 故不做统计分析. RNA干扰技术沉默FABP-5基因可以明显促进HepG2细胞的凋亡(图9).
FABPs为一组小的、高度保守的胞质蛋白, 广泛表达于哺乳动物的多种细胞内, 其中表皮型或牛皮癣相关型即为FABP-5. 目前研究发现, 细胞表达的FABP-5可以结合长链脂肪酸, 为细胞的生长提供能量及原材料, 并且能结合和转运各种疏水性配体, 参与肿瘤生长相关的信号转导. 脂肪酸结合蛋白与包括肿瘤在内的多种疾病密切相关[15-17]. FABP-5作为维甲酸(retinoic acid, RA)的转运蛋白, 将RA从细胞质转运至细胞核, 活化过氧化物酶体增殖物激活受体β/δ (peroxisome proliferator-activated receptor β/δ, PPARβ/δ), 通过信号传导通路来调节细胞分化、抑制细胞凋亡、促进细胞增殖[18,19]. FABP-5基因与多种肿瘤性疾病相关. 在乳腺癌[20]、肺鳞状细胞癌[21]中, FABP-5基因显著上调, 促进肿瘤的发生. 非小细胞肺癌原发癌组织中, FABP-5的表达与肿瘤的病理分级、有无转移有关. 瘤体体积愈大、病理分级愈高且有转移的患者, 则FABP-5的表达愈占优势[22]. Uma等[23]报道在舌鳞状细胞癌原发组织中FABP-5 mRNA的表达量是其转移癌组织中的4倍. 肝内胆管细胞癌和口腔鳞状细胞癌中FABP-5能促进肿瘤细胞的增殖, 增强细胞的侵袭能力[24,25]. Celis等[26]发现FABP-5在膀胱癌的表达水平与分化程度呈正相关, FABP-5的表达水平随着膀胱癌分化程度的降低而降低. 前列腺癌中, 通过体内外实验证实FABP-5下调能降低肿瘤细胞转移和抑制肿瘤生长[27,28]. 此外, 黑色素瘤[29]、头颈部癌[30]、子宫内膜癌[31]均与FABP-5的表达有密切的关系. 本课题组前期通过跨种属研究还发现了人、树鼩和大鼠肝癌组织中FABP-5基因表达明显增多, 这种不同种属的肝癌组织中共同高表达的现象, 提示FABP-5基因表达的上调可能促进肝癌发生发展.
本研究中我们将FABP-5-shRNA表达载体转染进入人肝癌HepG2细胞中后, 实验组的3种靶点干扰序列中, FABP-5 mRNA和蛋白的表达水均下调, 其中以LV-shRNA-FABP-5(1)靶点敲减效率最高, 筛选出了最佳靶点. 实验结果表明我们所构建的FABP-5-shRNA表达载体是成功的, 明显降低了FABP-5基因的表达水平. MTT检测得出相比空白对照组和阴性对照组, 实验组细胞增殖活力明显受到抑制. Giemsa染色法发现实验组细胞克隆形成数明显少于空白对照组和阴性对照组. 细胞侵袭小室实验中, 实验组的细胞侵袭力明显低于空白对照组和阴性对照组. 流式细胞术检测发现, FABP-5基因沉默后可以明显促进肿瘤细胞的凋亡, 使细胞分裂阻滞在G2/M期附近, 抑制肝癌细胞的增殖, 并且降低肝癌细胞的侵袭力.
总之, 慢病毒RNA干扰技术敲除FABP-5基因后可影响肝癌细胞的增殖和促进其凋亡, 而且能明显抑制肿瘤细胞的侵袭力. 提示FABP-5基因可能直接或间接的参与到肝癌细胞周期的调控, 其基因的表达水平改变与肿瘤细胞侵袭力有密切的关系. 因此, FABP-5基因有可能成为肝癌和其他肿瘤治疗的一个靶点, 其是否有临床应用价值需要做更进一步的研究.
肝细胞肝癌(hepatocellular carcinoma, HCC)在人类癌症中排明前十, 死亡率极高, 绝大部分患者就诊时已属晚期, 具有发病率高、预后较差、目前尚无有效治疗手段等特点. 及早研究促进肝癌发生发展的关键分子, 并进行有效干预对于改善肝癌患者的预后具有重要作用.
姚登福, 教授, 南通大学附属医院
脂肪酸结合蛋白为一族小的、高度保守的结合长链脂肪酸等疏水性配体的胞质蛋白, 其中表皮型即为表皮脂肪酸结合蛋白-5(fatty acid binding protein-5, FABP-5), 能结合和转运各种疏水性配体, 参与肿瘤生长相关的信号转导. 近年来, 越来越多的研究发现FABP-5与肿瘤的发生发展、恶性转化密切相关.
本课题组前期实验结果表明, FABP-5不仅在人肝癌组织中高表达, 在大鼠和树鼩肝癌模型中也明显上调, 并且发现FABP-5表达水平与恶性肿瘤的分化、转移有密切关系, 提示FABP-5可能成为肝癌发生发展中的关键作用分子, 有望成为一个早期诊断或预测肿瘤转移的新指标.
目前尚无FABP-5基因沉默对肝癌细胞侵袭力、生长和增殖的影响的报道, 本实验利用慢病毒为载体, 采用RNA干扰技术将重组慢病毒载体FABP-5-shRNA转入人肝癌HepG2细胞中, 研究沉默FABP-5表达对HepG2细胞增殖、凋亡和其侵袭能力的影响.
本研究结果表明, FABP-5 RNA干扰后肝癌细胞周期进程得到有效阻滞, 凋亡大幅增加, 可明显降低肝癌生长增殖功能, 肿瘤细胞的侵袭力明显受到抑制. FABP-5基因有望成为肝癌基因治疗的一个有效靶点.
RNA干扰(RNAi): 指在进化过程中高度保守的、由双链RNA(double-stranded RNA, dsRNA)诱发的、同源mRNA高效特异性降解的现象. RNAi技术可以特异性剔除或关闭特定基因的表达. 该技术已被广泛用于多方面的研究领域, 如探索基因功能、传染性疾病和恶性肿瘤的基因治疗等.
本文将最佳FABP-5-shRNA表达载体转染肝癌HepG2细胞, 沉默FABP-5基因后促进癌细胞凋亡, 细胞分裂阻滞在G2/M期, 抑制细胞增殖, 降低癌细胞侵袭力, FABP-5基因有可能成为肝癌治疗新靶点.
编辑: 郭鹏 电编:闫晋利
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | Thun MJ, DeLancey JO, Center MM, Jemal A, Ward EM. The global burden of cancer: priorities for prevention. Carcinogenesis. 2010;31:100-110. [PubMed] [DOI] |
| 3. | El-Serag HB. Hepatocellular carcinoma. N Engl J Med. 2011;365:1118-1127. [PubMed] [DOI] |
| 4. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 5. | Vivarelli M, Risaliti A. Liver transplantation for hepatocellular carcinoma on cirrhosis: strategies to avoid tumor recurrence. World J Gastroenterol. 2011;17:4741-4746. [PubMed] [DOI] |
| 6. | Münz M, Zeidler R, Gires O. The tumour-associated antigen EpCAM upregulates the fatty acid binding protein E-FABP. Cancer Lett. 2005;225:151-157. [PubMed] |
| 7. | 李 瑗, 苏 建家, 曹 骥, 欧 超, 仇 效坤, 杨 春, 班 克臣, 岳 惠芬, 张 丽生, 万 大方. 不同因素诱发的树鼩肝癌组织的基因表达差异. 癌症. 2003;22:1018-1022. |
| 8. | Li Y, Wan DF, Su JJ, Cao J, Ou C, Qiu XK, Ban KC, Yang C, Qin LL, Luo D. Differential expression of genes during aflatoxin B(1)-induced hepatocarcinogenesis in tree shrews. World J Gastroenterol. 2004;10:497-504. [PubMed] |
| 9. | 秦 雪, 代 智, 崔 杰峰, 苏 建家, 曹 骥, 欧 超, 李 山, 陈 晓燕, 谢 丽, 王 健. 黄曲霉毒素B1诱发树鼩肝癌过程中的差异表达蛋白质分析及意义. 中华检验医学杂志. 2006;29:538-542. |
| 10. | Li Y, Qin X, Cui J, Dai Z, Kang X, Yue H, Zhang Y, Su J, Cao J, Ou C. Proteome analysis of aflatoxin B1-induced hepatocarcinogenesis in tree shrew (Tupaia belangeri chinensis) and functional identification of candidate protein peroxiredoxin II. Proteomics. 2008;8:1490-1501. [PubMed] [DOI] |
| 11. | Li Y, Wan D, Wei W, Su J, Cao J, Qiu X, Ou C, Ban K, Yang C, Yue H. Candidate genes responsible for human hepatocellular carcinoma identified from differentially expressed genes in hepatocarcinogenesis of the tree shrew (Tupaia belangeri chinesis). Hepatol Res. 2008;38:85-95. [PubMed] [DOI] |
| 12. | 梁 宏洁, 韦 薇, 康 晓楠, 郭 坤, 曹 骥, 苏 建家, 杨 春, 欧 超, 李 瑗, 刘 银坤. 二乙基亚硝胺诱发大鼠肝癌过程中癌前病变阶段差异表达蛋白质的筛选. 中华肝脏病杂志. 2009;17:669-674. |
| 14. | 史 俊林, 曹 骥, 苏 建家, 杨 春, 欧 超, 汪 多平, 李 瑗. 表皮型脂肪酸结合蛋白在不同种属肝癌组织中的高表达及其临床意义. 世界华人消化杂志. 2013;21:963-969. |
| 15. | Storch J, Thumser AE. Tissue-specific functions in the fatty acid-binding protein family. J Biol Chem. 2010;285:32679-32683. [PubMed] [DOI] |
| 16. | Thumser AE, Moore JB, Plant NJ. Fatty acid binding proteins: tissue-specific functions in health and disease. Curr Opin Clin Nutr Metab Care. 2014;17:124-129. [PubMed] [DOI] |
| 17. | Kitanaka N, Owada Y, Abdelwahab SA, Iwasa H, Sakagami H, Watanabe M, Spener F, Kondo H. Specific localization of epidermal-type fatty acid binding protein in dendritic cells of splenic white pulp. Histochem Cell Biol. 2003;120:465-473. [PubMed] |
| 18. | Schug TT, Berry DC, Shaw NS, Travis SN, Noy N. Opposing effects of retinoic acid on cell growth result from alternate activation of two different nuclear receptors. Cell. 2007;129:723-733. [PubMed] |
| 19. | Armstrong EH, Goswami D, Griffin PR, Noy N, Ortlund EA. Structural basis for ligand regulation of the fatty acid-binding protein 5, peroxisome proliferator-activated receptor β/δ (FABP5-PPARβ/δ) signaling pathway. J Biol Chem. 2014;289:14941-14954. [PubMed] [DOI] |
| 20. | Levi L, Lobo G, Doud MK, von Lintig J, Seachrist D, Tochtrop GP, Noy N. Genetic ablation of the fatty acid-binding protein FABP5 suppresses HER2-induced mammary tumorigenesis. Cancer Res. 2013;73:4770-4780. [PubMed] [DOI] |
| 23. | Uma RS, Naresh KN, D'Cruz AK, Mulherkar R, Borges AM. Metastasis of squamous cell carcinoma of the oral tongue is associated with down-regulation of epidermal fatty acid binding protein (E-FABP). Oral Oncol. 2007;43:27-32. [PubMed] |
| 24. | Jeong CY, Hah YS, Cho BI, Lee SM, Joo YT, Jung EJ, Jeong SH, Lee YJ, Choi SK, Ha WS. Fatty acid-binding protein 5 promotes cell proliferation and invasion in human intrahepatic cholangiocarcinoma. Oncol Rep. 2012;28:1283-1292. [PubMed] [DOI] |
| 25. | Fang LY, Wong TY, Chiang WF, Chen YL. Fatty-acid-binding protein 5 promotes cell proliferation and invasion in oral squamous cell carcinoma. J Oral Pathol Med. 2010;39:342-348. [PubMed] [DOI] |
| 26. | Celis JE, Rasmussen HH, Vorum H, Madsen P, Honoré B, Wolf H, Orntoft TF. Bladder squamous cell carcinomas express psoriasin and externalize it to the urine. J Urol. 1996;155:2105-2112. [PubMed] [DOI] |
| 27. | Morgan EA, Forootan SS, Adamson J, Foster CS, Fujii H, Igarashi M, Beesley C, Smith PH, Ke Y. Expression of cutaneous fatty acid-binding protein (C-FABP) in prostate cancer: potential prognostic marker and target for tumourigenicity-suppression. Int J Oncol. 2008;32:767-775. [PubMed] |
| 28. | Adamson J, Morgan EA, Beesley C, Mei Y, Foster CS, Fujii H, Rudland PS, Smith PH, Ke Y. High-level expression of cutaneous fatty acid-binding protein in prostatic carcinomas and its effect on tumorigenicity. Oncogene. 2003;22:2739-2749. [PubMed] |
| 29. | Brouard MC, Saurat JH, Ghanem G, Siegenthaler G. Urinary excretion of epidermal-type fatty acid-binding protein and S100A7 protein in patients with cutaneous melanoma. Melanoma Res. 2002;12:627-631. [PubMed] [DOI] |
| 30. | Rauch J, Ahlemann M, Schaffrik M, Mack B, Ertongur S, Andratschke M, Zeidler R, Lang S, Gires O. Allogenic antibody-mediated identification of head and neck cancer antigens. Biochem Biophys Res Commun. 2004;323:156-162. [PubMed] [DOI] |
| 31. | Li Z, Huang C, Bai S, Pan X, Zhou R, Wei Y, Zhao X. Prognostic evaluation of epidermal fatty acid-binding protein and calcyphosine, two proteins implicated in endometrial cancer using a proteomic approach. Int J Cancer. 2008;123:2377-2383. [PubMed] [DOI] |