修回日期: 2015-05-12
接受日期: 2015-05-28
在线出版日期: 2015-07-08
目的: 探讨影像学方法对硬化性胆管炎的诊断价值.
方法: 回顾性分析经内镜逆行胰胆管造影(endoscopic retrograde cholangiography, ERCP)和手术探查证实的34例硬化性胆管炎患者的影像学资料. 患者术前均行计算机断层扫描(computed tomography, CT)、磁共振胰胆管造影(magnetic resonance cholangiopanceatography, MRCP)以及磁共振成像(magnetic resonance imaging, MRI)三者中的一种或两种以上检查. 由两名从事影像诊断的高年资医生在对患者临床资料和诊断结果不知情的情况下对图像进行诊断和测量. 包括分析每例患者胆道系统、肝脏及其他相关脏器的影像学特征.
结果: 34例硬化性胆管炎患者中原发性硬化性胆管炎有6例, 男性5例, 女性1例, 继发性硬化性胆管炎患者28例, 男性15例, 女性13例. 继发性硬化性胆管炎患者中胆管阻塞、微生物感染和IgG4相关的硬化性胆管炎分别为20、1、7例. 原发性硬化性胆管炎主要影像表现为肝内外胆管增厚, 呈局灶性、节段性狭窄, 胆管树呈剪树征. 继发性硬化性胆管炎主要表现为肝外胆管增厚, 呈局灶性、节段性、弥漫性狭窄, 胆管树呈穿珠征和剪树征, 部分硬化性胆管炎患者可出现胆管壁强化和肝脏动脉期局灶性异常灌注, 患者到了疾病中晚期均会伴有不同程度肝硬化表现. IgG4相关性继发性硬化性胆管炎患者以肝外胆管病变为主, 常伴有自身免疫性胰腺炎表现.
结论: 影像学对于硬化性胆管炎的诊断具有一定的特征性, 结合临床资料, 大部分患者可作出正确诊断.
核心提示: 经内镜逆行胰胆管造影(endoscopic retrograde cholangiography)可以无创地显示胰胆管树的全貌, 结合常规断层影像还可对胆管壁和壁外表现、胆囊、肝脏、胰腺、淋巴结等其他脏器的受累情况进行全面评价, 可以更好地为临床评价病变程度、检测病情进展.
引文著录: 边云, 杨学东, 王莉, 陆建平. 硬化性胆管炎的影像学特征. 世界华人消化杂志 2015; 23(19): 3157-3162
Revised: May 12, 2015
Accepted: May 28, 2015
Published online: July 8, 2015
AIM: To explore the diagnostic value of imaging in sclerosing cholangitis (SC).
METHODS: A total of 34 SC patients after endoscopic retrograde cholangiography (ERCP) and common bile duct exploration were included. The clinical data and imaging findings were retrospectively reviewed. The images were independently recorded by two radiologists in a blinded, randomized manner for the imaging features of the biliary system, the liver and other-related signs.
RESULTS: Six patients had primary sclerosing cholangitis (PSC), and 28 patients had secondary sclerosing cholangitis (SSC). Bile duct obstruction, microbial infection and IgG4-related SC were seen in 20, 1 and 7 patients, respectively. PSC showed thickening of the intrahepatic and extrahepatic bile duct walls, and focal and segmental strictures. Pruned-tree and diverticulum-like appearances were more frequent in PSC. SSC showed thickening of the extrahepatic bile duct wall, and focal, segmental and long strictures. Beaded and pruned-tree appearances were more frequent in SSC. The bile duct wall enhancement was found in SC. The hepatic perfusion disorder was found in the arterial phase in SC. There was liver cirrhosis in patients with advanced stage disease. IgG4-related SC mainly showed extrahepatic bile duct stenosis with autoimmune pancreatitis.
CONCLUSION: SC has some radiological characteristics. A correct diagnosis can be made by imaging combined with clinical data in the majority of patients.
- Citation: Bian Y, Yang XD, Wang L, Lu JP. Imaging diagnosis of sclerosing cholangitis. Shijie Huaren Xiaohua Zazhi 2015; 23(19): 3157-3162
- URL: https://www.wjgnet.com/1009-3079/full/v23/i19/3157.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i19.3157
硬化性胆管炎(sclerosing cholangitis, SC)是一类罕见的慢性阻塞性胆管疾病, 以胆管炎性反应和闭塞性纤维化为主要病变特征, 常呈进行性、反复性和可逆性, 预后不一, 若不及时治疗最终可演变为终末期肝病[1-4]. 此病常表现为乏力、皮肤瘙痒、间歇性或进行性黄疸, 可伴有右上腹痛、恶性、呕吐、肝脾肿大, 晚期出现胆汁性肝硬化、门脉高压和肝功能衰竭. 目前治疗该病最有效的方法为肝移植, 其他方法只能减轻症状, 却不可改变病程[2,3,5]. 经内镜逆行胰胆管造影(endoscopic retrograde cholangiography, ERCP)是诊断该病的金标准, 但其为有创检查、术中易致肝损伤、急性胰腺等并发症. 磁共振胰胆管造影(magnetic resonance cholangiopanceatography, MRCP)可以完整地显示胰胆管树的全貌, 结合断层影像可以观察胆管壁内外变化和其他脏器受累情况, 为临床诊断和监测病程提供了一种全新、无创的检查方法.
回顾性分析2012-06/2015-04经ERCP或手术胆管探查确诊为SC患者的临床资料和影像学资料. 计算机断层扫描(computed tomography, CT)扫描设备为德国Siemens 64层螺旋CT, 核磁共振成像(nuclear magnetic resonance imaging, MRI)扫描设备为美国GE Signa Excite 3.0 T超导型MR仪.
1.2.1 CT检查: 采用德国Siemens 64层螺旋CT. 扫描条件: 120 kV, 180 mA. 扫描参数: 准直0.6 mm, 层厚0.6 mm, 重建间隔3.0 mm, 螺距为1.0, 矩阵512×512, 视野348 mm×348 mm. 对比剂为碘海醇, 300 mgI/mL, 总量90-95 mL左右, 注射流率3.0 mL/s. 分别于注射对比剂后20-25、60-70、110-130 s行动脉期、门脉期和延迟期3期扫描.
1.2.2 MRI检查: 采用美国GE Signa Excite 3.0 T超导型MR仪, 使用体线圈(body coil). 扫描序列包括: (1)横断面T1WI平扫和增强采用基于肝脏容积加速采集(liver aquisition with volume acceleration, LAVA)序列: TR 4.25 ms, TE 1.94 ms, 层厚5 mm, 无层间距. 对比剂Gd-DTPA, 0.1 mL/kg, 注射流率2 mL/s. 增强采用于注射对比剂后15、20、40 s行3期扫描; (2)横断面抑脂呼吸触发T2WI序列: TR 2833 ms, TE 86.74 ms, 层厚6 mm, 层间距6 mm; (3)厚层块二维MRCP序列: TR 7000 ms, TE 1271.81 ms, 层厚64 mm, 层间距6 mm.
1.2.3 图像分析: 由两名从事影像诊断的高年资医生在对患者临床资料、ERCP或手术结果不知情的情况下对图像进行诊断和测量. 胆道系统影像学表现: (1)狭窄与扩张的有无: 各部位胆管直径的正常值分别为肝内胆管≤3 mm, 左、右肝管≤6 mm, 胆总管≤10 mm; (2)狭窄的位置: 肝内胆管(左、右肝内胆管)、肝外胆管(左、右肝管和胆总管); (3)狭窄的长度: 局灶性狭窄(<3 mm), 节段性狭窄(3-10 mm), 广泛狭窄(>10 mm); (4)胆道系统的形态: 串珠征, 剪树征, 憩室征; (5)胆管壁的厚度: 测量病变胆管壁厚度并判断其有无增厚(>2 mm); (6)胆管壁强化程度: 低、等、高信号或密度(与同平面肝实质相比较). 肝脏影像学表现: 肝脏的大小、形态, 在平扫密度或T1WI、T2WI上的信号特征, 增强后动脉期肝实质是否有异常强化. 其他: 肝门部有无淋巴结增大, 是否并发胆囊炎症、结石, 胆囊是否切除, 是否并发胰腺炎, 脾脏有无增大. 所有患者的影像学检查资料与手术病理或ERCP结果间隔1 wk-1 mo.
统计学处理 所有资料运用SPSS20.0统计软件对试验数据进行统计学分析和处理. 所有数据进行正态检验和方差齐性检验. 计量资料连续性变量若符合正态分布则用mean±SD表示, 不符合正态分布则用中位数和四分位间距表示. P<0.05为差异有统计学意义.
原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)患者6例, 继发性硬化性胆管炎(second sclerosing cholangitis, SSC)患者28例, 包括胆道阻塞4例, 微生物感染1例, IgG4相关性5例, 患者基本临床资料如表1.
| 分类 | 性别 | 年龄(mean±SD, 岁) | 确诊方法 | 影像学检查 | |||||
| 男 | 女 | ERCP | 手术 | CT增强 | MRI增强 | MRCP | 多项 | ||
| PSC | 5 | 1 | 47±12 | 6 | 0 | 0 | 1 | 2 | 3 |
| SSC胆道阻塞 | 12 | 8 | 60±18 | 15 | 5 | 4 | 3 | 6 | 7 |
| SSC微生物感染 | 0 | 1 | 74 | 1 | 0 | 1 | 0 | 0 | 0 |
| SSC-IgG4 | 3 | 4 | 57±16 | 7 | 0 | 0 | 0 | 1 | 6 |
| 合计 | 20 | 14 | 57±16 | 29 | 5 | 5 | 4 | 9 | 16 |
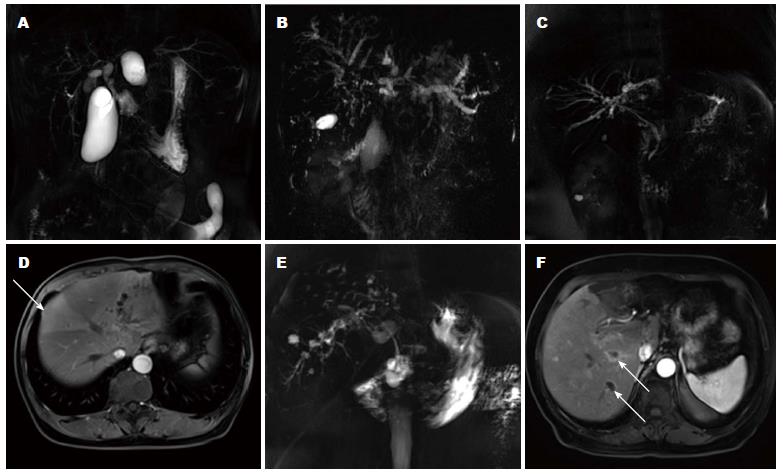
PSC表现为肝内和/或肝外胆管多发狭窄、扩张, T1WI呈树状号, T2WI呈高信号, 以局灶和节段性狭窄为主, MRCP胆管树呈"剪树征"为主, 胆管壁较厚, 可伴有胆管壁的强化. SSC以肝外胆管狭窄为主, 狭窄呈局灶性、节段性或弥漫性, MRCP胆管树呈"串珠征"或"剪树征", 肝内胆管显著扩张者可呈憩室样改变, 胆管壁增厚, 可伴有胆管壁强化. CT平扫对胆管病变显示不显著, 增强后可见扩张和狭窄的胆管, 胆管壁可出现环形强化(表2, 图1A-C、E、F).
| 分类 | 狭窄位置 | 狭窄长度 | 胆系形态 | 胆管壁厚度 | 胆管壁强化 | ||||||||
| 肝内 | 肝外 | 肝内外 | 局灶 | 节段 | 弥漫 | 串珠 | 剪树 | 憩室 | (mean±SD, mm) | 未做 | 无 | 有 | |
| PSC | 1 | 3 | 2 | 3 | 3 | 0 | 0 | 5 | 1 | 3.55±1.03 | 2 | 2 | 2 |
| SSC胆道阻塞 | 1 | 17 | 2 | 6 | 7 | 7 | 8 | 10 | 2 | 3.30±0.72 | 6 | 10 | 4 |
| SSC微生物感染 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 3.8 | 0 | 0 | 1 |
| SSC-IgG4 | 0 | 5 | 2 | 1 | 3 | 3 | 2 | 5 | 0 | 3.07±1.13 | 1 | 3 | 3 |
SC部分患者出现不同程度的肝硬化, 影像表现为肝裂增宽, 轮廓呈波浪状, 肝叶萎缩、尾叶肥大. 动脉增强后部分SC患者出现肝脏局灶性灌注异常, 表现为肝脏外缘斑片状和三角形强化, 门脉期恢复正常. 另外, 部分病例可见到胆囊炎症、结石、肝门淋巴结肿大、脾脏增大. 5例IgG4相关性SSC中, 均不明确诊断为自身免疫性胰腺炎, 胰腺表现为胰腺弥漫性肿大, 呈腊肠样改变, 平扫CT密度减低, MRI T1WI信号减低, 增强胰腺实质延迟强化(表3, 图1D).
| 分类 | n | 肝脏 | 胆囊 | 肝门淋巴结增大 | 胰腺异常 | 脾脏增大 | |||
| 硬化 | 异常强化 | 炎症 | 结石 | 切除 | |||||
| PSC | 8 | 2 | 2 | 3 | 5 | 0 | 1 | 0 | 4 |
| SSC胆道阻塞 | 20 | 9 | 3 | 3 | 3 | 9 | 2 | 1 | 8 |
| SSC微生物感染 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| SSC-IgG4 | 5 | 4 | 2 | 1 | 4 | 0 | 0 | 7 | 4 |
SC是消化系统比较罕见的疾病之一, 由Delbet等于1924年以胆道纤维化致胆系梗阻首次报道[1,4]. SC可分为PSC和SSC两型, PSC均不明原因, 常伴有炎症性肠病, 而SSC多由胆道手术、缺血、结石、损伤或免疫性疾病等继发性病变所致. PSC和SSC在影像学上均表现为胆道系统的不同程度的狭窄和扩张, 又无特征性临床症状, 因此与其他胆道疾病较难鉴别. 一直以来, 认为ERCP为诊断该病的金标准, 但他因其有创、患者痛苦、操作者要求高、有碘过敏的危险, 术中易致肝损伤和急性胰腺炎等并发症, 所以并未及时运用于该病的诊断, 导致较多患者误诊、漏诊, 甚至就诊时已进入疾病晚期, 不得不进行肝移植治疗. 随着影像学技术的飞跃发展, 对该病的诊断优势逐步体现出来.
文献研究[6]认为与ERCP相比, MRCP在诊断SC时, 不仅可以显示胰胆管的全貌, 对观察胆管地狭窄, 尤其是周围肝内胆管地显示更具优势. 我们研究表明PSC主要影像学表现为以肝内外胆管为主的增厚、扩张、狭窄, T1WI呈树状号, T2WI呈高信号, 以局灶性和节段性狭窄为主, MRCP胆管树呈剪树征、憩室征, 部分患者会出现胆管壁的环形强化. 这与文献报道的基本相符, 但文献报道中PSC中串珠征显示较多[7,8]. 而SSC患者中以肝外胆管狭窄并肝内胆管扩张为主, MRCP胆管树呈串珠征、剪树征. SC部分患者增强后有胆管壁的强化, 这与胆管壁炎细胞浸润, 管壁充血有关. 本研究中逆行感染所致的SSC较多, MRCP和薄层CT可以清晰地显示胆囊或肝外胆管梗阻的部位和原因, 为诊断提供依据. 本研究中7例IgG4相关SSC均为肝外胆管胰腺段内狭窄, 其中2例伴有肝内胆管狭窄, 与文献[9,10]报道的基本吻合. 这与大量IgG4阳性浆细胞浸润致胆管纤维化有关[2,6]. 本研究中只有1例寄生虫感染所致的SC, 此类型病例不足. 但根据Lalwani等[1]研究表明, 各种细菌或虫卵释放的囊液刺激胆管上皮细胞, 可致胆管纤维化, 影像学此类患者常无结石和胆囊炎, 而表现为胆总管、乳突部狭窄. 文献还报道了由于肝动脉化疗栓塞、肝移植、各种胆系手术、创伤以及危重病致肝动脉缺血, 胆管上皮细胞血管受到影响, 从而引起缺血性SC, 表现为近端肝内胆管狭窄、坏疽、化脓、胆脂瘤形成[11-14].
影像学不仅可以全面评估胰胆管系统, 还可对相关脏器进行评估. SC患者常伴有不同程度肝硬化, 我们研究发现16例患者出现不同程度的肝硬化表现, 表现为肝裂增宽, 肝脏轮廓呈波浪状, 肝叶体积缩小, 尾叶肥大, 晚期会出血局灶性结节, 部分患者伴有脾脏增大、门脉高压表现. Bader等[15]研究发现SC患者出现不同程度肝硬化, 但与肝功能分级却无相关性. 增强后有7例患者动脉期出现肝脏局灶性灌注异常, 表现为肝外缘片状或三角状强化, 静脉期异常灌注区域恢复正常. 肝脏具有门静脉和肝动脉双重供血, 两者之间有许多交通吻合支, 当肝脏发生血供障碍时, 可通过神经体液调节开发吻合支, 从而使肝脏供血发生流量变化, 甚至方向改变[16]. 由于胆管炎可致区域性门静脉、肝静脉血流瘀滞、血栓形成、闭塞, 肝动脉代偿性充血, 从而导致肝脏局部异常灌注[17]. 在胆道系统的逆行感染的SSC中, 我们可以观察胆道系统内是否有结石, 是否合并胆囊炎. 在我们的研究中共计有19例出现胆囊炎或并发胆囊结石, 这在PSC中出现的几率也很高, 与Said等[18]研究的结果相符. 在IgG4相关性SSC中, 患者往往伴有血IgG4水平增高, 影像学上不仅胆道系统有特征性表现, 胰腺也具备特征表现, 常表现为胰腺弥漫性肿大, 呈腊肠样改变, 平扫CT密度减低, MRI T1WI信号减低, 部分患者胰周出现界限清晰、平整的低密度胶囊样边缘, 增强胰腺实质延迟强化等自身免疫性胰腺炎的影像学特征.
我们的研究还存在着一定不足. (1)本研究为回顾性研究, 因此部分患者影像资料不够完整, 本研究34例患者中, 具有两项或以上影像学资料的患者仅有16例; (2)本研究病例数较少, 病例结构不全, 34例患者中PSC有6例, SSC患者28例, 还缺乏缺血、获得性免疫缺乏综合征(acquired immune deficiency syndrome, AIDS)、危重病患者所致的SSC; (3)本研究在MRCP扫描中仅仅采用二维厚层序列, 如能才有三维薄层序列扫描, 胰胆管树的图像会更加美观、清晰.
总之, 影像学对于SC的诊断具有一定的特征性, 结合临床资料, 大部分患者可作出正确诊断.
硬化性胆管炎是以胆管进行性炎症和纤维化为特征的疾病, 后期常发展为肝硬化、门脉高压、肝衰竭. 经内镜逆行胰胆管造影(endoscopic retrograde cholangiography, ERCP)为诊断金标准, 其他影像学特征文献报道较少. 肝移植目前认为是最为有效的治疗手段.
陈海龙, 教授, 大连医科大学附属第一医院院办
如何对硬化性胆管炎做出早期诊断仍是研究的热点和重点. 到目前为止, 除了肝移植, 其他治疗方式均为缓解症状, 不能改变其病程, 但是肝移植又是导致继发性胆管炎的一重要病因, 因此探索新的治疗方式也是今后面临的挑战.
近年来继发性硬化性胆管炎中关于获得性免疫缺乏综合征(acquired immune deficiency syndrome, AIDS)相关性、IgG4相关性、肝移植和危重病所致导致胆道缺血相关报道越来越多, 虽均表现为肝内外胆管地狭窄和扩张, 但因病因不同在影像学上有其特征性表现.
本研究将继发性胆管炎按病因明确分类, 对狭窄位置、狭窄长度、胆系形态、胆壁厚度、胆壁强化程度做出量化评估, 并对肝脏、胆囊、肝门淋巴结、胰腺、脾脏全面评价, 对硬化性胆管炎做了较全面的影像学评估.
硬化性胆管炎诊断的金标准为ERCP, 但是该检查有创.欧洲肝病学会建议对疑诊病例首先行磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)检查. 本文总结长海医院确诊病例影像学特征, 为临床诊断该类疾病提供无创检查方式, 值得推广.
硬化性胆管炎: 是一种以胆管进行性炎症和纤维化为特征的疾病, 后期可发展为肝硬化、门脉高压及肝衰竭. 该病可分为原发性和继发性两类. 原发性为不明原因, 常伴有炎症性肠病, 继发性常继发于胆道手术、缺血、结石和损伤.
硬化性胆管炎进展缓慢, 但他最终导致大部分患者肝衰竭而死亡. 本文系统阐述了硬化性胆管炎的影像学特征, 提高大家对本病的认识, 可以更好地为临床评价病变程度、检测病情进展, 并且对于发现门脉高压、胆管癌等并发症有重要的作用.
编辑: 郭鹏 电编:都珍珍
| 1. | Lalwani N, Bhargava P, Chintapalli KN, Shanbhogue A, Nagar AM, Prasad SR. Current update on primary and secondary sclerosing cholangitis. Curr Probl Diagn Radiol. 2011;40:248-261. [PubMed] [DOI] |
| 2. | Imam MH, Talwalkar JA, Lindor KD. Secondary sclerosing cholangitis: pathogenesis, diagnosis, and management. Clin Liver Dis. 2013;17:269-277. [PubMed] [DOI] |
| 3. | Hirschfield GM, Karlsen TH, Lindor KD, Adams DH. Primary sclerosing cholangitis. Lancet. 2013;382:1587-1599. [PubMed] [DOI] |
| 6. | Kim JH, Byun JH, Kim SY, Lee SS, Kim HJ, Kim MH, Lee MG. Sclerosing cholangitis with autoimmune pancreatitis versus primary sclerosing cholangitis: comparison on endoscopic retrograde cholangiography, MR cholangiography, CT, and MRI. Acta Radiol. 2013;54:601-607. [PubMed] [DOI] |
| 7. | Ruiz A, Lemoinne S, Carrat F, Corpechot C, Chazouillères O, Arrivé L. Radiologic course of primary sclerosing cholangitis: assessment by three-dimensional magnetic resonance cholangiography and predictive features of progression. Hepatology. 2014;59:242-250. [PubMed] [DOI] |
| 8. | Dave M, Elmunzer BJ, Dwamena BA, Higgins PD. Primary sclerosing cholangitis: meta-analysis of diagnostic performance of MR cholangiopancreatography. Radiology. 2010;256:387-396. [PubMed] [DOI] |
| 9. | Katabathina VS, Dasyam AK, Dasyam N, Hosseinzadeh K. Adult bile duct strictures: role of MR imaging and MR cholangiopancreatography in characterization. Radiographics. 2014;34:565-586. [PubMed] [DOI] |
| 10. | Maillette de Buy Wenniger L, Rauws EA, Beuers U. What an endoscopist should know about immunoglobulin-G4-associated disease of the pancreas and biliary tree. Endoscopy. 2012;44:66-73. [PubMed] [DOI] |
| 11. | Azizi L, Raynal M, Cazejust J, Ruiz A, Menu Y, Arrivé L. MR Imaging of sclerosing cholangitis. Clin Res Hepatol Gastroenterol. 2012;36:130-138. [PubMed] [DOI] |
| 12. | Voigtländer T, Alten T, Lehner F, Strassburg CP, Manns MP, Lankisch TO. [Secondary sclerosing cholangitis following liver transplantation: a rare cause for graft failure]. Z Gastroenterol. 2013;51:296-298. [PubMed] [DOI] |
| 13. | Voigtländer T, Negm AA, Schneider AS, Strassburg CP, Manns MP, Wedemeyer J, Lankisch TO. Secondary sclerosing cholangitis in critically ill patients: model of end-stage liver disease score and renal function predict outcome. Endoscopy. 2012;44:1055-1058. [PubMed] [DOI] |
| 14. | Gudnason HO, Björnsson HK, Gardarsdottir M, Thorisson HM, Olafsson S, Bergmann OM, Björnsson ES. Secondary sclerosing cholangitis in patients with drug-induced liver injury. Dig Liver Dis. 2015; Mar 11. [Epub ahead of print]. [PubMed] [DOI] |
| 15. | Bader TR, Beavers KL, Semelka RC. MR imaging features of primary sclerosing cholangitis: patterns of cirrhosis in relationship to clinical severity of disease. Radiology. 2003;226:675-685. [PubMed] [DOI] |
| 16. | 赵 晓军, 李 健丁, 武 志锋, 乔 英. 肝脏一过性灌注异常对肿瘤和感染性病变的鉴别诊断价值. 中国中西药结合影像学杂志. 2009;7:111-113. |
| 18. | Said K, Edsborg N, Albiin N, Bergquist A. Gallbladder emptying in patients with primary sclerosing cholangitis. World J Gastroenterol. 2009;15:3498-3503. [PubMed] [DOI] |