修回日期: 2015-05-26
接受日期: 2015-06-10
在线出版日期: 2015-07-08
目的: 探讨内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)在上消化道黏膜下肿瘤(submucosal tumor, SMT)中的治疗价值及并发症危险因素.
方法: 回顾性分析2009-05/2014-03于成都军区总医院实施ESD治疗的73患者临床资料, 主要分析其整块切除率、治愈性切除率、复发率、并发症发生率, 利用Logistic回归分析并发症的危险因素.
结果: 73例患者中, 成功实施ESD 69例, 其中整块切除率为98.6%, 治愈性切除率为100%, 复发率为0, 中位手术时间为100.9 min(30.0-275.0 min), 出血发生15例, 穿孔发生7例, 没有死亡病例.
结论: ESD可以有效的治疗SMT, 但位于贲门-胃底的病变, 应注意防治并发症的发生.
核心提示: 本文回顾性分析了内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)在上消化道黏膜下肿瘤(submucosal tumor, SMT)中的治疗情况, 并且对并发症影响因素进行Logistic回归分析. 结果提示, ESD可以有效的治疗SMT, 但应注意位于贲门-胃底的病变有并发症的危险.
引文著录: 陈虹彬, 倪阵, 吕勇, 刘阳, 刘炼炼, 徐辉. 内镜黏膜下剥离术治疗上消化道黏膜下病变的价值及并发症危险因素. 世界华人消化杂志 2015; 23(19): 3141-3146
Revised: May 26, 2015
Accepted: June 10, 2015
Published online: July 8, 2015
AIM: To explore the therapeutic efficiency of endoscopic submucosal dissection (ESD) in the treatment of upper gastrointestinal submucosal tumors and the risk factors for complications.
METHODS: Seventy-three patients with upper gastrointestinal submucosal tumors were collected from Chengdu Military Medical Hospital from May 2009 to March 2014. All the patients underwent ESD and were followed by endoscopy. The complete resection rate, the frequency of complications and the risk factors for complications were analyzed.
RESULTS: The overall rate of R0 resection was 98.6% (68/69), with six endoscopic failures. Complete resection was achieved in all submucosal tumor (SMT) cases. The median procedure time was 100.9 min (range, 30.0-275.0 min). Perforation occurred in 7 patients. Bleeding occurred in 15 patients. No death occurred. No recurrence cases were noted.
CONCLUSION: ESD is an effective treatment in SMT patients with a high success rate and a low incidence of complications.
- Citation: Chen HB, Ni Z, Lv Y, Liu Y, Liu LL, Xu H. Clinical effects of endoscopic submucosal dissection in treatment of upper gastrointestinal submucosal tumors. Shijie Huaren Xiaohua Zazhi 2015; 23(19): 3141-3146
- URL: https://www.wjgnet.com/1009-3079/full/v23/i19/3141.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i19.3141
上消化道肿瘤是我国常见疾病之一, 其早期发现与早期治疗对提高患者预后至关重要. 内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是在内镜下黏膜切除术(endoscopic mucosal resection, EMR)基础上发展而来的微创技术, 具有创伤小、整块切除率高、并发症少等优点, 多项研究[1,2]显示其在消化系肿瘤中的治疗价值. 中国人民解放军成都军区总医院消化内镜中心自2009年开展ESD以来, 共治疗上消化道黏膜下病变73例, 本文回顾性分析其疗效及安全性, 并分析ESD相关并发症的危险因素.
回顾性分析2009-05/2014-03在成都军区总医院消化内镜中心接受ESD治疗的患者共73例, 其中男性22例, 女性51例, 年龄30-75岁, 平均53.8岁. 所有患者均符合ESD适应症: 经临床表现、胃镜或超声内镜(endoscopic ultrasound, EUS)检查确诊黏膜下层起源的黏膜下肿瘤(submucosal tumor, SMT), 无消化道外侵犯及胸腹腔转移表现, 患者无严重心肺功能损害和严重凝血障碍. 于全麻下行ESD手术, 器械包括Olympus公司GIF-Q260J型胃镜, LUCERA CV-260主机, EU-ME1超声主机, GIF-UZ260超声胃镜, UM-S20-20R和UM-DP12-25R超声小探头, ERBE VIOS-200D海博刀系统, KD-10Q-1针形刀, KD-610LIT刀, FD-410R止血钳, DuaKnife刀, 透明帽, 23G注射针等. 所有患者术前均进行上消化道EUS检查, 了解病变大小、形态、浸润深度及起源、有无淋巴结转移等; 患者及家属术前同意并签署知情同意书.
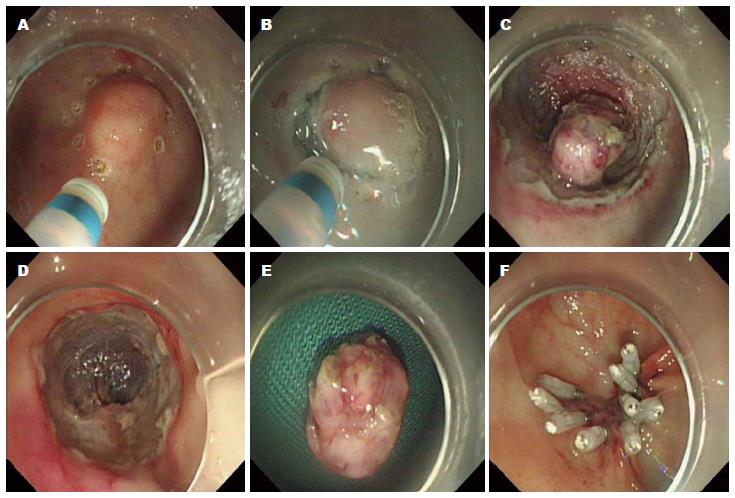
1.2.1 治疗: ESD手术步骤参考我们的前期研究[3]进行, 简而言之, 应用DuaKnife刀在病变外缘0.5 cm处进行环形标记, 采用靛胭脂、玻璃酸钠、0.9%氯化钠混合溶液进行黏膜下注射, 利用DuaKnife刀或IT刀沿标记点外缘进行环形切开, 术中根据情况追加黏膜下注射以利于剥离. 对于活动性渗血或裸露血管利用止血钳进行止血. 切除标本利用大头针固定于泡沫平板上, 分别标记口侧与肛侧, 40 g/L甲醛固定后送病理活检(如图1).
术后放置胃管, 禁食水24 h, 常规抗感染、止血、抑酸、保护胃黏膜等; 密切观察患者生命体征, 重点观察有无皮下气肿和迟发性出血. 术后2 d进流质饮食.
1.2.2 疗效评价标准及定义: 疗效包括完全治愈性切除(R0切除), 即整块一次性切除标本切缘及基底均无异型细胞; 非治愈性切除(R1切除), 为整块一次性切除标本切缘或基底有异型细胞或分块切除标本. 复发包括局部复发, 指术后6 mo以上肿瘤在切除部位及周围1 cm内生长; 残留指术后6 mo内经病理证实肿瘤在原部位或周围1 cm内生长; 异时病灶指病灶出现在原部位及周围1 cm以外.
1.2.3 并发症: 并发症主要包括出血和穿孔. 出血包括术中出血和术后出血, 术中出血为手术过程中出现的搏动性出血, 需要采用电凝或止血夹治疗; 术后出血为术后患者出现血红蛋白下降、便血或大便潜血阳性; 穿孔为术中出现内镜下可见的穿孔或术后计算机断层扫描(computed tomography, CT)发现腹腔游离气体.
1.2.4 随访: 术后1、3、6、12 mo复查胃镜, 以后1-2年复查胃镜, 必要时行影像学检查了解有无复发或转移.
统计学处理 采用SPSS13.0软件, 所有定量资料表示为mean±SD, 定性资料表示为率或中位数. 定性资料比较采用χ2检验或Fisher确切检验. 危险因素分析采用Logistic回归分析模型, 并计算OR值和95%CI. P<0.05认为差异有统计学意义.
患者年龄、性别、病变位置、病灶大小等资料如表1. 所有患者术前均接受EUS检查, 结果显示: 53例病变位于固有肌层, 9例位于黏膜下层, 9例位于黏膜肌层, 2例显示不清.
术前超声诊断正确率为67.1%, 一次性整块切除率为98.6%, 治愈性切除率为100%, 出血率为20.5%(15例), 穿孔率为9.5%(7例)(表2).
| 术后资料 | 数值 |
| 手术时间(min) | 30.0-275.0(100.9) |
| 并发症 | |
| 出血 | 15 |
| 穿孔 | 7 |
| 术前后EUS[%(n1/n)] | 67.1(49.0/73.0) |
| 起源层次 | |
| 固有肌层 | 53 |
| 黏膜下层 | 9 |
| 黏膜肌层 | 9 |
| 显示不清 | 2 |
| 整块切除[%(n1/n)] | 98.6(68.0/69.0) |
| 治愈性切除[%(n1/n)] | 100.0(69.0/69.0) |
| 转手术 | 2 |
| 腹腔镜辅助切除 | 2 |
| 病理结果 | |
| 间质瘤 | 58 |
| 脂肪瘤 | 4 |
| 异位胰腺 | 7 |
| 纤维瘤 | 1 |
| 神经鞘瘤 | 1 |
| 平滑肌瘤 | 1 |
| 血管瘤 | 1 |
纳入年龄、性别、部位、大小、病理、是否合并症、操作时间等因素, 结果显示病变位于贲门-胃底为出现并发症的唯一危险因素(OR值为7.349, 95%CI为1.478-36.554)(表3).
| 因素 | Wald | P值 | OR | 95%CI | |
| Lower | Upper | ||||
| 时间 | 2.186 | 0.139 | 0.991 | 0.979 | 1.003 |
| 病变位置 | 5.939 | 0.015 | 7.349 | 1.478 | 36.554 |
| 大小 | 3.653 | 0.056 | 0.552 | 0.301 | 1.015 |
| 年龄 | 0.000 | 0.986 | 1.001 | 0.936 | 1.069 |
| 性别 | 1.998 | 0.157 | 2.794 | 0.672 | 11.616 |
| 是否固有肌层 | 3.004 | 0.083 | 5.097 | 0.808 | 32.153 |
| 是否合并症 | 3.094 | 0.079 | 3.250 | 0.874 | 12.090 |
住院时间为3-7 d, 平均5.4 d, 随访12-56 mo, 平均随访时间为33.4 mo, 复发率为0.
ESD是一种治疗消化系早癌、癌前病变及隆起型病变的内镜微创技术. 较传统的EMR, ESD不仅可以控制切除病变的大小和形态, 还可以实现较大病变的整块切除, 因此能够进行精确的病理学诊断分期, 并显著降低局部肿瘤复发的风险[1]. 国内外研究[2,4,5]显示, 胃部和食管早癌的整块切除率和完整切除率可以分别达到97%和94.7%与100%和97.4%.
SMT患者大多数没有特异性的临床症状, 少数患者以消化系出血为首发表现, 本组研究中, 仅有4例患者以消化系出血就诊, 比例仅仅为4/73, 其余患者症状均无特异性, 与其他研究结果一致. 对于SMT的诊断, 目前还缺乏特异性的检查方法. EUS技术的开展, 为此类疾病的诊断提供了一定的优势, 其可以显示病变的大小、起源、边界和回声特点, 对于部分患者还可以考虑EUS引导下穿刺活检. 然而目前的研究[6]结果显示, EUS的诊断优势并不突出, 其最大优势体现在病变起源层次的分析, 为下一步的治疗方法的选择提供一定的帮助. EUS无法准确判断病变的性质, 其最终还需要依靠病理的诊断. 有中心利用细针穿刺抽吸活检术(fine needle aspiration, FNA), 结果其阳性率也仅仅为33.3%, 因此, EUS并不能对SMT做出明确的诊断, 且对疾病的良恶性无法进行鉴别[7]. 我们在术前对患者均进行了EUS检查, 其主要目的为评判病变的大小、来源和与周围脏器组织的关系, 根据病变回声和镜下特点, 最终与病理的诊断符合率仅为67.1%.
目前针对SMT的治疗, 传统以手术为主, 而随着内镜技术的发展, ESD成为此类疾病的首选治疗方法, 且较手术创伤小、住院费用低、患者恢复快、短期疗效确切, 但是部分病例存在残留、复发和出现并发症的风险[8]. 在本研究中, 其整块切除率为98.6%, R0切除率为100%, 术后平均随访33.4 mo均无复发, 最终病理诊断结果如表2. 其中1例患者病变位于食管25 cm, 手术过程中发现其与主动脉毗邻, 随终止操作. 2例患者由于病变较大或与基底部黏连较重, 无法整块切除, 最终选择圈套器分块切除. 因此, ESD在SMT的诊断和治疗上存在很大的优势, 对于多数患者可以避免传统手术, 但是术前评估至关重要, 包括对于病变大小的判断、来源层次的评估和与周围脏器组织的毗邻关系, 都会影响手术的结果.
然而, 对于一些特殊部位的SMT, 单纯ESD可能不是最佳选择, 主要是由于病变面积较大、位置较深及黏连较重. 本组研究中, 共有4例患者ESD失败, 选择外科手术2例, 其中1例由于术中发现浸润较深, 穿孔几率较大或无法剥离而转外科手术; 1例为5 cm病变, 瘤体较大无法剥离而转外科手术; 术中选择在腹腔镜辅助下切除2例, 其中1例为7 cm病变, 且浸润较深, 遂采取腹腔镜-内镜联合切除; 1例为术中发现病变成葫芦状, 基底范围较广, 随在腹腔镜辅助下完成ESD. 此类腹腔镜-内镜联合手术在国内外均有报道, 患者选择主要根据病变的位置和大小[9,10]. 研究[11]显示, 对于位于靠近贲门和胃后壁, 且病变>5 cm的病变, 腹腔镜辅助下的ESD可能更具安全性. 当然, 还需要进一步的研究来证实.
ESD作为一种近年来发展的微创手术, 尽管由于其本身所具备的优势, 逐步成为治疗SMT治疗的首选, 然而其也存在一定的并发症风险, 主要包括出血和穿孔, 对于早癌患者, ESD术后还存在食管狭窄. 在本研究中, 出现并发症22例(30.1%), 其中术中出血15例(20.5%), 术中穿孔7例(9.6%), 无术后出血, 其中1例穿孔内镜下闭合失败而选择开腹修补术. 我们的并发症发生率稍高于国内外其他研究, 主要原因为本研究中对于出血的定义较宽[12-14].
ESD出现并发症的危险因素较多, 目前其确切因素仍不完全清楚, 一定程度上限制了ESD技术的发展. 研究提示, ESD术后出血的危险因素主要涉及3个方面[15,16], (1)患者相关因素, 包括年龄、体质量、合并疾病、用药史等; (2)病变相关因素: 包括病变位置、大小、肉眼形态、病理类型、侵犯深度等; (3)操作相关因素, 包括操作时间、操作者等. 但是目前多数因素均存在较大争议. 本研究中, 纳入年龄、性别、病变位置、病变大小、操作时间、合并症等因素, 结果显示, 病变位于贲门-胃底是ESD术后出现并发症的唯一独立危险因素. 由于本研究为回顾性研究, 术前对于病变的选择会对术后并发症产生较大影响, 如没有纳入存在严重并发症的患者、对于病变侵犯较深或较大的患者直接选择手术或腹腔镜联合治疗等, 因此对于ESD并发症危险因素的研究, 还有待于进一步的深入.
总之, 该项回顾性研究结果显示ESD在治疗SMT中有重要治疗价值, 但是部分患者会出现并发症, 主要与病变位置有关.
内镜黏膜下剥离术(endoscopic submucosal dissection,
ESD)是在内镜下黏膜切除术(endoscopic mucosal
resection, EMR)基础上发展而来的微创技术, 具有创伤小, 整块切除率高, 并发症少等优点, ESD不仅可以控制切除病变的大小和形态, 还可以实现较大病变的整块切除, 因此能够进行精确的病理学诊断分期, 并显著降低局部肿瘤复发的风险.
万军, 教授, 中国人民解放军总医院南楼老年消化科
国内外研究显示, 胃部和食管早癌的整块切除率和完整切除率可以分别达到97%和94.7%与100%和97.4%.
病变位于贲门-胃底是ESD术后出现并发症的惟一独立危险因素, 对于此类病变的治疗要慎重对待.
本文资料较详实, 分析正确, 结果较可靠, 对临床开展黏膜下肿瘤的ESD治疗具有一定的参考价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Toyonaga T, Man-i M, East JE, Nishino E, Ono W, Hirooka T, Ueda C, Iwata Y, Sugiyama T, Dozaiku T. 1,635 Endoscopic submucosal dissection cases in the esophagus, stomach, and colorectum: complication rates and long-term outcomes. Surg Endosc. 2013;27:1000-1008. [PubMed] [DOI] |
| 2. | Kim YJ, Park DK. Management of complications following endoscopic submucosal dissection for gastric cancer. World J Gastrointest Endosc. 2011;3:67-70. [PubMed] [DOI] |
| 4. | Tsuji Y, Ohata K, Ito T, Chiba H, Ohya T, Gunji T, Matsuhashi N. Risk factors for bleeding after endoscopic submucosal dissection for gastric lesions. World J Gastroenterol. 2010;16:2913-2917. [PubMed] [DOI] |
| 6. | Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut. 2000;46:88-92. [PubMed] [DOI] |
| 7. | Ha CY, Shah R, Chen J, Azar RR, Edmundowicz SA, Early DS. Diagnosis and management of GI stromal tumors by EUS-FNA: a survey of opinions and practices of endosonographers. Gastrointest Endosc. 2009;69:1039-1044.e1. [PubMed] [DOI] |
| 8. | Catalano F, Rodella L, Lombardo F, Silano M, Tomezzoli A, Fuini A, Di Cosmo MA, de Manzoni G, Trecca A. Endoscopic submucosal dissection in the treatment of gastric submucosal tumors: results from a retrospective cohort study. Gastric Cancer. 2013;16:563-570. [PubMed] [DOI] |
| 9. | Sakamoto Y, Sakaguchi Y, Akimoto H, Chinen Y, Kojo M, Sugiyama M, Morita K, Saeki H, Minami K, Soejima Y. Safe laparoscopic resection of a gastric gastrointestinal stromal tumor close to the esophagogastric junction. Surg Today. 2012;42:708-711. [PubMed] [DOI] |
| 10. | Marano L, Torelli F, Schettino M, Porfidia R, Reda G, Grassia M, Braccio B, Petrillo M, Di Martino N. Combined laparoscopic-endoscopic "Rendez-vous" procedure for minimally invasive resection of gastrointestinal stromal tumors of the stomach. Am Surg. 2011;77:1100-1102. [PubMed] |
| 11. | Privette A, McCahill L, Borrazzo E, Single RM, Zubarik R. Laparoscopic approaches to resection of suspected gastric gastrointestinal stromal tumors based on tumor location. Surg Endosc. 2008;22:487-494. [PubMed] |
| 13. | Higashiyama M, Oka S, Tanaka S, Sanomura Y, Imagawa H, Shishido T, Yoshida S, Chayama K. Risk factors for bleeding after endoscopic submucosal dissection of gastric epithelial neoplasm. Dig Endosc. 2011;23:290-295. [PubMed] [DOI] |
| 15. | Toyokawa T, Inaba T, Omote S, Okamoto A, Miyasaka R, Watanabe K, Izumikawa K, Horii J, Fujita I, Ishikawa S. Risk factors for perforation and delayed bleeding associated with endoscopic submucosal dissection for early gastric neoplasms: analysis of 1123 lesions. J Gastroenterol Hepatol. 2012;27:907-912. [PubMed] [DOI] |
| 16. | Jang JS, Choi SR, Graham DY, Kwon HC, Kim MC, Jeong JS, Won JJ, Han SY, Noh MH, Lee JH. Risk factors for immediate and delayed bleeding associated with endoscopic submucosal dissection of gastric neoplastic lesions. Scand J Gastroenterol. 2009;44:1370-1376. [PubMed] [DOI] |