修回日期: 2015-05-14
接受日期: 2015-05-15
在线出版日期: 2015-07-08
目的: 探讨晚期糖基化终产物受体(receptor for advanced glycation end products, RAGE)特异性小干扰RNA(small interfering RNA, siRNA)对原代大鼠肝星状细胞(hepatic stellate cells, HSCs)和肝纤维化(hepatic fibrosis, HF)大鼠肝脏基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)及金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1, TIMP-1)表达的影响.
方法: 分离培养原代大鼠HSCs, 将RAGE特异性siRNA表达载体pAKD-GR126转染入原代大鼠HSCs, 以空白组和转染非特异性siRNA表达载体pAKD-NC组为对照, 分别应用实时荧光定量PCR和Western blot检测各组原代大鼠HSCs中RAGE、MMP-1和TIMP-1的mRNA及蛋白的表达; 制备CCl4诱导的HF大鼠模型, 将不同治疗剂量的pAKD-GR126经尾静脉导入成模后大鼠, 以正常对照组(NC组)、模型组(FM组)和非特异性siRNA表达载体pAKD-NC组(NS组)为对照, 分别应用PCR和Western blot检测各组大鼠肝组织中RAGE、MMP-1和TIMP-1的mRNA及蛋白的表达. 常规HE及Masson胶原染色, 光镜下观察, 比较各组肝组织形态学改变.
结果: 转染pAKD-GR126的原代HSCs中, RAGE和TIMP-1的mRNA和蛋白的表达显著低于空白对照组和pAKD-NC组(均P<0.05), MMP-1的mRNA和蛋白的表达显著高于空白对照组和pAKD-NC组(均P<0.05). 动物试验中, 与FM组相比, pAKD-GR126小剂量治疗组(LT组)、中剂量治疗组(MT组)、高剂量治疗组(HT组)的RAGE和TIMP-1的mRNA和蛋白表达均有不同程度的降低(均P<0.05), MMP-1的mRNA和蛋白表达均有不同程度的增加(均P<0.05), 且与pAKD-GR126呈剂量依赖关系. 光镜下观察, LT组、MT组和HT组纤维化程度较FM组和NS组相比, 均有不同程度的减轻, 且以HT组减轻最明显.
结论: RAGE特异性siRNA在原代大鼠HSCs和HF大鼠体内均能抑制RAGE和TIMP-1的表达, 并促进MMP-1的表达, 使大鼠肝脏HF的程度减轻.
核心提示: 近年来, 随着对肝纤维化(hepatic fibrosis, HF)发生的分子机制有了进一步的认识, 基因治疗HF已成为可能. 我们的研究从细胞和组织水平初探晚期糖基化终产物受体(receptor for advanced glycation end products, RAGE)、基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)、金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1, TIMP-1)三者之间的相互作用, 通过封闭RAGE基因的表达可影响TIMP-1和MMP-1的表达, 显著改善大鼠肝脏的HF程度, 为临床治疗HF提供了新的思路.
引文著录: 刘阳, 夏金荣, 蔡晓刚. 晚期糖基化终产物受体特异性小干扰RNA对MMP-1和TIMP-1表达的影响. 世界华人消化杂志 2015; 23(19): 3012-3021
Revised: May 14, 2015
Accepted: May 15, 2015
Published online: July 8, 2015
AIM: To investigate the effect of small interfering RNA (siRNA)-mediated down-regulation of receptor for advanced glycation end products (RAGE) on the expression of matrix metalloproteinase-1 (MMP-1) and tissue inhibitor of metalloproteinase-1 (TIMP-1) in primary rat hepatic stellate cells (HSCs) and hepatic fibrosis (HF).
METHODS: In in vitro experiment, primary rat HSCs were cultured and isolated. The pAKD-GR126 vector carrying siRNA targeting RAGE was constructed and transfected to primary rat HSCs. Blank cells and cells transfected with unspecific siRNA vector pAKD-NC were used as controls. In in vivo experiment, liver fibrosis was induced in SD rats with CCl4. pAKD-GR126 was transfected to liver fibrosis rats at different doses via the tail vein. A blank group, a liver fibrosis model group and an unspecific siRNA vector pAKD-NC-transfected group were used as controls. Real-time PCR and Western blot were used to detect the expression of RAGE, MMP-1 and TIMP-1. The histological changes of the liver were observed by HE and Masson staining methods.
RESULTS: The mRNA and protein expression of RAGE and TIMP-1 in pAKD-GR126-transfected primary HSCs was significantly lower than that in the blank group and unspecific siRNA vector pAKD-NC-transfected group (P < 0.05 for all). However, the level of MMP-1 in pAKD-GR126-transfected primary HSCs was significantly higher than that in the blank group and pAKD-NC-transfected group (P < 0.05 for all). In vivo, the mRNA and protein expression of RAGE and TIMP-1 was significantly lower and that of MMP-1 was significantly higher in the low-, medium-, and high-dose RAGE siRNA groups than in the liver fibrosis model group (P < 0.05 for all). Compared with the liver fibrosis model group, liver fibrosis was significantly milder in the low-, medium-, and high-dose RAGE siRNA groups, especially the high-dose group.
CONCLUSION: RAGE specific siRNA could decrease the expression of RAGE and TIMP-1, increase the expression of MMP-1 in primary rat HSCs and HF rats, and reduce the degree of rat hepatic fibrosis.
- Citation: Liu Y, Xia JR, Cai XG. Effect of siRNA-mediated down-regulation of receptor for advanced glycation end products on expression of matrix metalloproteinase-1 and tissue inhibitor of metalloproteinase-1 in rat hepatic stellate cells and hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2015; 23(19): 3012-3021
- URL: https://www.wjgnet.com/1009-3079/full/v23/i19/3012.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i19.3012
晚期糖基化终产物(advanced glycation end products, AGEs)是蛋白质、脂质或核酸等大分子经复杂的多步骤反应所生成的一组稳定共价加合物. 晚期糖基化终产物受体(receptor for advanced glycation end products, RAGE)作为受体与其结合在细胞表面, 可引起一系列复杂的病理改变, 如糖尿病、肾间质纤维化、动脉粥样硬化等[1]. 已有研究[2-5]证实, AGEs/RAGE在肺脏、肾脏、心脏等器官的纤维化过程中起重要作用. 夏金荣等[6,7]、Cai等[8]证实在活化的肝星状细胞(hepatic stellate cells, HSCs)和大鼠肝纤维化(hepatic fibrosis, HF)肝脏有RAGE的高表达, RAGE特异性小干扰RNA表达载体可使原代大鼠HSCs细胞以及纤维化大鼠肝脏RAGE蛋白的表达显著下降, 同时能抑制层黏连蛋白(laminin, LN)、Ⅲ型前胶原(procollagen type Ⅲ, PⅢNP)、透明质酸(hyaluronic acid, HA)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、核因子κB(nuclear factor κB, NF-κB)及Ⅰ型胶原mRNA和蛋白质的表达, 从而使Sprague-Dawley(SD)大鼠肝脏HF程度明显减轻. 陈婷婷[9]研究证实, 应用RAGE特异性小干扰RNA亦可抑制原代大鼠HSCs中致纤维化因子β1转化生长因子(transforming growth factor β1, TGF-β1)和结缔组织生长因子(connective tissue growth factor, CTGF)的表达. 但迄今为止, RAGE在原代大鼠HSCs和SD大鼠体内对HF形成影响的研究仍较少, 本研究通过RAGE特异性siRNA在原代大鼠HSCs和HF大鼠肝脏内对RAGE、基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)及金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1, TIMP-1)基因和蛋白表达活性的影响及其三者的相关性作一探讨, 以期为HF的预防和治疗提供新靶点.
选用8周龄健康♂SD大鼠108只, 体质量250-300 g, 清洁级, 购自南京医科大学实验动物中心; Ⅳ型胶原酶、链霉蛋白酶(Pronase E)、Nycodenz购自美国Sigma公司; RAGE特异性siRNA腺相关病毒重组表达载体pAKD-GR126和非特异性siRNA腺相关病毒重组表达载体pAKD-NC由华东理工大学药学院制药工程和化学研究中心提供. RAGE、MMP-1、TIMP-1基因引物由上海生物工程有限公司合成, 具体序列如表1; TRIzol试剂购自Invitrogen美国公司; cDNA第一链合成试剂盒、Taq酶购自立陶宛Fermentas公司; Agarose购自西班牙Biowes公司; MMP-1、TIMP-1、RAGE蛋白抗体均购自Abcam公司; CCl4为上海长江化工厂产品.
| 引物 | 引物序列 | 扩增长度(bp) |
| RAGE | F: 5'-CCTCTGATTCCTGATGGCAA-3' | 158 |
| R: 5'-CTCCTACTCATGCCCTACCT-3' | ||
| MMP-1 | F: 5'-TTCAGCCAGGCCCAGGTA-3' | 100 |
| R: 5'-TGAGCAGCCACACGATACAAGT-3' | ||
| TIMP-1 | F: 5'-GAGAAGGGCTACCAGAGCGA-3' | 82 |
| R: 5'-TCGAGACCCCAAGGTATTGC-3' | ||
| GAPDH | F: 5'-GATGCTGGTGCTGAGTATGRCG-3' | 200 |
| R: 5'-GTGGTGCAGGATGCATTGCTCTGA-3' |
1.2.1 细胞实验分组和干预: 将培养5 d的原代HSCs随机分为空白组、pAKD-GR126组和pAKD-NC组, 3组均给予AGE-BSA 200 mg/L刺激后, pAKD-GR126组和pAKD-NC组再分给予RAGE特异性siRNA表达载体pAKD-GR126和非特异性siRNA表达载体pAKD-NC感染48 h.
1.2.2 动物模型分组及干预处理: 8周龄♂SD大鼠108只, 随机分成正常对照组(NC组)18只、HF模型组90只. 正常对照组以2 mL/kg体质量精制橄榄油腹腔注射, 2次/wk, 共6 wk; HF模型组用2 mL/kg体质量50%的CCl4(CCl4与橄榄油按1:1比例混合)腹腔注射, 2次/wk, 共6 wk. 将成模后大鼠随机分为模型组(FM组)、pAKD-GR126小剂量治疗组(LT组)、中剂量治疗组(MT组)、高剂量治疗组(HT组)和pAKD-NC组(NS组), 每组各18只, 将NC组做空白对照. LT组、MT组、HT组及NS组分别经尾静脉单次注射6×1010、3×1011、1×1012particle的重组病毒pAKD-GR126和1×1012particle的重组病毒pAKD-NC, 2次/wk, 共6 wk, FM组不予特殊干预. 各组分别于末次尾静脉注射3 d后处死, 留取肝组织标本待测.
1.2.3 实时荧光定量PCR检测各组原代HSCs及肝组织标本中RAGE、MMP-1及TIMP-1的表达: 按TRIzol说明书分别提取各组细胞总RNA, 检测各组RNA的浓度、纯度, 重复操作3次取平均值. 逆转录合成用于PCR的cDNA. 扩增反应条件: 94 ℃预变性2 min, 然后94 ℃变性45 s、54 ℃或58 ℃退火45 s、72 ℃延伸45 s进行35个循环扩增, 再以72 ℃延伸7 min. 采用比较Ct法相对定量计算.
1.2.4 Western blot检测各组原代HSCs及肝组织标本中RAGE和MMP-1及TIMP-1蛋白的表达: 分别提取大鼠原代HSCs和肝脏组织中的蛋白, 用BCA法测定样品蛋白浓度. 制备10%分离胶和5%浓缩胶后上样, 采用SDS-PAGE凝胶电泳分析, 待溴酚蓝到达底部时停止电泳, 转膜(75 V 120 min)5%脱脂牛奶封闭1 h, 加入RAGE、MMP-1、TIMP-1一抗孵育, 4 ℃过夜. 第2天用TBST清洗膜6次×10 min, 加入相应的二抗, 室温孵育1 h, 用TBST清洗6次×10 min, 加上millipore显影液后用电子发光仪采集信号.
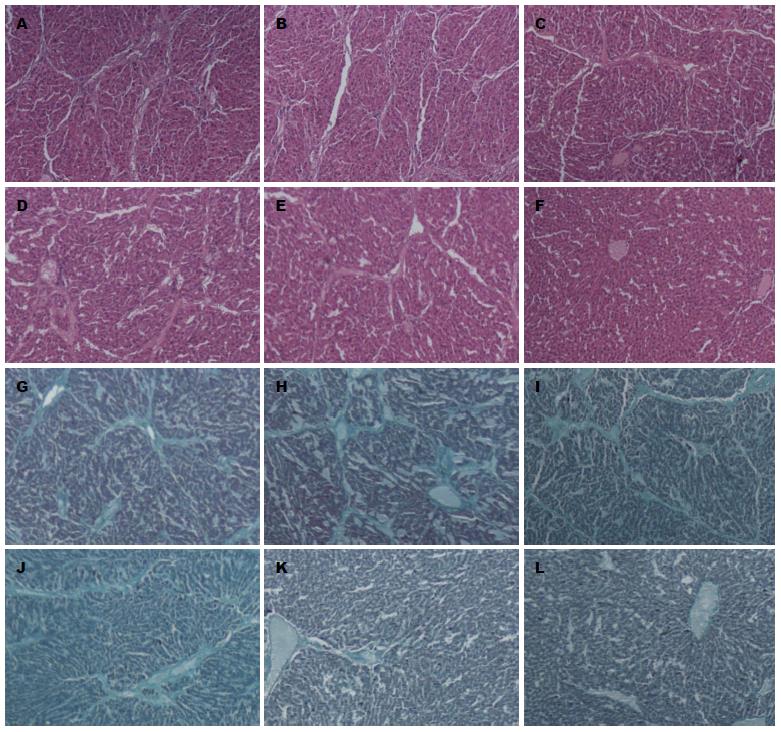
1.2.5 肝脏炎症活动度分级及纤维化程度分期: 取各组第12周处死大鼠新鲜肝脏组织, 由东南大学附属中大医院病理科医生协助制作快速冰冻切片, 标本以4%多聚甲醛固定, 石蜡包埋和切片, 常规HE及Masson胶原染色, 由两名病理科医生在双盲情况下阅片, 观察各组肝脏炎形态学改变.
统计学处理 使用SPSS18.0统计分析软件进行统计学分析, 实验数据均用mean±SD表示, 多组间比较采用单因素方差分析, 两两比较采用SNK-q法, 按等级分组的资料采用秩和检验, 以P<0.05表示差异具有统计学意义.
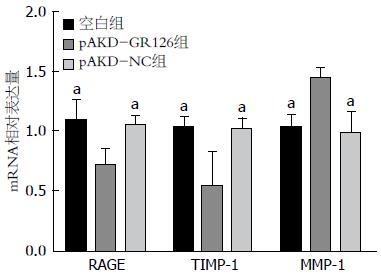
在转染RAGE特异性siRNA表达载体pAKD-GR126的原代HSCs中, 其RAGE、TIMP-1的mRNA表达显著低于空白组和pAKD-NC组(均P<0.05); MMP-1 mRNA的表达显著高于空白组和pAKD-NC组(均P<0.05), 差异均有统计学意义. 而空白组与pAKD-NC组间RAGE、MMP-1和TIMP-1的表达差异均无统计学意义(均P>0.05). 结果表明pAKD-GR126表达的RAGE特异性siRNA在原代HCSs中能有效抑制RAGE、TIMP-1的mRNA表达, 而促进MMP-1的mRNA表达(表2, 图1).
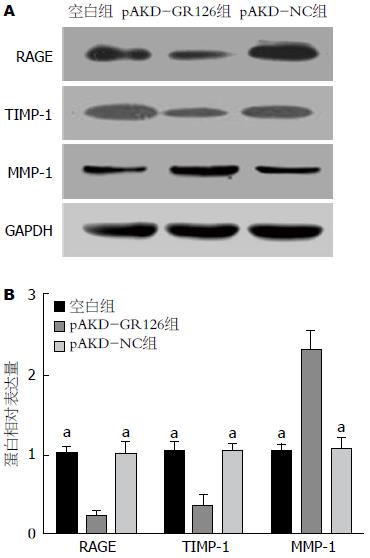
Western blot结果显示, pAKD-GR126组RAGE、TIMP-1和MMP-1蛋白的表达水平显著低于空白组和pAKD-NC组(均P<0.05), 差异均有统计学意义. 而空白组与pAKD-NC组间RAGE、MMP-1和TIMP-1蛋白的表达(均P>0.05), 差异均无统计学意义, 结果表明pAKD-GR126表达的RAGE特异性siRNA在原代HCSs中能有效地抑制RAGE、TIMP-1蛋白的表达, 从而促进MMP-1蛋白的表达(表3, 图2).
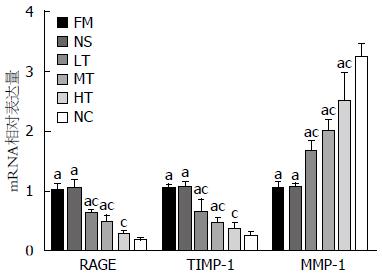
与NC组比较, FM组的RAGE、TIMP-1的mRNA表达显著增多(均P<0.05), MMP-1的mRNA表达显著减少(均P<0.05), 提示HF大鼠肝脏中RAGE、TIMP-1合成增多, 而MMP-1的合成受到抑制而减少; 应用RAGE特异性siRNA治疗6 wk后, LT组、MT组、HT组大鼠肝组织RAGE和TIMP-1 mRNA表达较FM组均有不同程度的降低, 以HT组降低最明显; 而MMP-1 mRNA的表达均不同程度的增高, 其中HT组升高最明显. LT组、MT组、HT组之间, 比较应用RAGE特异性siRNA治疗后的MMP-1和TIMP-1 mRNA水平的差异, 结果LT组与MT组的TIMP-1和MMP-1(P = 0.094、0.123), MT组与HT组的MMP-1(P = 0.203)的治疗后水平差异无统计学意义; LT组与HT组的MMP-1和TIMP-1的治疗后水平差异有统计学意义(P<0.01); NS组与FM组比较, RAGE、MMP-1、TIMP-1 mRNA表达水平差异无统计学意义(均P>0.05). 结果表明, RAGE特异性siRNA能剂量依赖性地有效抑制HF大鼠体内RAGE和TIMP-1基因的表达, 促进MMP-1基因的表达(表4, 图3).
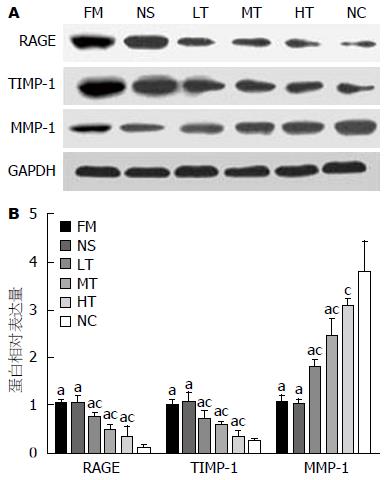
Western blot结果显示, FM组的RAGE、TIMP-1蛋白表达较NC组明显增多(均P<0.05), 而MMP-1的蛋白表达较NC组明显减少(均P<0.05), 与PCR结果一致, 均提示大鼠肝脏发生纤维化后中RAGE、TIMP-1合成增多, MMP-1的合成受TIMP-1的抑制而减少; 应用RAGE特异性siRNA治疗6 wk后, LT组、MT组、HT组大鼠肝组织RAGE和TIMP-1蛋白的表达较FM组均有不同程度的降低(均P<0.05), 而MMP-1蛋白的表达均不同程度的增高(均P<0.05), 提示应用RAGE特异性siRNA封闭RAGE的表达后, 可以抑制TIMP-1的合成, 从而提高HF大鼠肝脏MMP-1的水平. LT组、MT组、HT组之间比较应用RAGE特异性siRNA治疗后的MMP-1和TIMP-1蛋白水平的差异, 结果除LT组与MT组的MMP-1以外(P = 0.227), 其余各组MMP-1和TIMP-1的治疗后水平均有差异(P<0.05), 其中LT组与HT组间差异有统计学意义(P<0.01). 结果同样说明RAGE特异性siRNA能剂量依赖性地有效抑制HF大鼠体内TIMP-1基因的表达, 促进MMP-1基因的表达. NS组与FM组比较, RAGE、MMP-1、TIMP-1蛋白的表达水平差异无统计学意义(均P>0.05)(表5, 图4).
肝组织切片经HE和Masson染色, 光镜下观察FM组及NS组大鼠肝脏标本可见正常肝小叶结构消失伴假小叶形成, 肝内结缔组织增生明显, 汇管区、包浆内可见大量炎症细胞浸润. 经Scheuer改良评分系统对各组大鼠肝脏炎症活动度分级和纤维化程度分期结果显示, 与FM组和NS组相比, 各治疗组肝脏炎症活动度及纤维化程度均有明显减轻(χ2 = 29.642, 30.710, 均P<0.01), 且以HT组减轻最明显. NC组肝脏组织中未见纤维增生及炎性细胞(表6, 图5).
肝硬化(cirrhosis of liver, LC)目前已成为危害人类健康的常见病、多发病, HF是各种慢性肝病向LC进展的必经阶段. 由于LC一旦发生则无法逆转, 而HF可逆转[10-12], 因此寻找新的治疗手段和途径来阻断HF, 防治LC已成为临床上的热门话题. 目前公认HF发生的中心环节是HSCs的激活, 从而合成和分泌大量细胞外基质(extracellular matrix, ECM), 同时多种炎症因子及TIMP-1表达增加维持其增殖状态, 导致ECM在肝脏内过度沉积, 这是HF的主要病理改变[13-15]. ECM的降解依赖多种酶参与, 基质金属蛋白酶(matrix metalloproteinases, MMPs)和其特异性抑制剂金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase, TIMPs)是一组重要酶系, 其中MMP-1主要参与对Ⅰ、Ⅲ型胶原的降解, 而TIMP-1的过度表达可抑制包括MMP-1在内的多种MMPs对ECM的降解[16,17], 最终造成ECM在肝内合成分泌过多, 降解减少而形成HF[18,19]. Zhang等[20]应用ELISA法对60例慢性乙型病毒性肝炎患者和20例健康献血者的MMP-1和TIMP-1的检测结果发现, 慢性乙型病毒肝炎患者血清中TIMP-1的浓度及TIMP-1的mRNA水平显著高于正常献血者, 且TIMP-1/MMP-1及TIMP-1 mRNA/MMP-1 mRNA的比例亦显著高于正常献血者; Nie等[21]研究发现, 正常大鼠仅有极少量TIMP-1和TIMP-2表达, 而HF程度越严重, TIMP-1和TIMP-2表达越活跃. 故TIMP-1的表达过多而MMP-1表达相对不足是HF进展的重要"助推剂". 因此越来越多的学者认为TIMP-1及TIMP-1 mRNA/MMP-1 mRNA的比例可作为HF诊断的较好指标[22,23].
RAGE作为信号转导受体介导AGEs结合在细胞表面, 可引起众多复杂的病理作用, 已有研究证实AGEs/RAGE在HF发生过程中具有促进HSCs的增殖和活化作用[24-26]. 我们认为AGEs/RAGE激活HSCs后, 通过上调多种炎症因子及TIMP-1的表达, 抑制MMP-1的表达, 使ECM产生增多, 降解受阻, 造成其在肝内过多积聚, 最终由HF发展为LC. 本研究从细胞及动物实验获得的结果均显示, 通过应用RAGE特异性小干扰siRNA在原代HSCs及纤维化大鼠肝脏沉默RAGE基因, 可明显抑制HSCs的激活和TIMP-1的分泌, 增加MMP-1的表达, 促进ECM的降解, 最终使得大鼠肝脏纤维化程度减轻. 通过用不同治疗剂量的RAGE特异性小干扰siRNA pAKD-GR126对HF大鼠进行干预, 结果显示随着pAKD-GR126治疗量的增加, 对RAGE表达的抑制作用越明显, 大鼠肝脏的炎症程度和HF分期减轻越明显. 结果表明, RAGE特异性小干扰siRNA pAKD-GR126可通过介导RAGE基因的沉默有效地抑制HSCs的激活和致纤维化细胞因子TIMP-1的表达, 增加抗纤维化细胞因子MMP-1的表达, 显著改善纤维化大鼠的炎症程度和纤维化分期, 可为抗HF治疗提供新的靶点.
近年来, 随着对HF发生的分子机制有了进一步的认识, 基因治疗HF已成为可能[27-29]. RNA干扰是一项新近发展的技术, 可通过靶向性阻断目的基因的复制和表达以达到治疗的目的, 具有高效、快速、针对性强等优点[30,31]. 我们的研究从细胞和组织水平对RAGE、MMP-1、TIMP-1三者之间的相互作用做了初步的探索, 通过封闭RAGE基因的表达可影响TIMP-1和MMP-1的表达, 显著改善大鼠肝脏的HF程度. 在临床防治HF的实践中, 能否通过合成一种RAGE拮抗剂, 抑制RAGE表达而减少对HSCs的激活, 降低TIMP-1的表达, 促进MMP-1的表达来治疗或延缓HF的进展, 尚需做进一步研究.
肝硬化(cirrhosis of liver, LC)现已成为危害人类健康的常见病、多发病. 目前晚期LC除肝移植外仍无十分有效的治疗方法, 由于供肝短缺、手术费用高昂、并发症多, 肝移植治疗LC尚无法普及. 因此探寻新的、有效的防治LC的方法在临床上变得越发迫切.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
近年来随着人们对肝纤维化(hepatic fibrosis, HF)发生发展机制研究的进展, 基因治疗及逆转HF以达到防治LC成为目前研究HF的热点话题, 寻找高效、特异的靶向基因与载体系统是目前基因治疗HF需要解决的首要问题.
已有研究证实晚期糖基化终产物(advanced glycation end products, AGEs)/晚期糖基化终产物受体(receptor for advanced glycation end products, RAGE)在肺脏、肾脏、心脏等器官的纤维化过程中起重要作用; Fehrenbach等研究发现, RAGE mRNA只有在大鼠肝脏中的肝星状细胞(hepatic stellate cells, HSCs)和MFs中特异性表达. 夏金荣等前期的研究也证实在活化的HSCs和大鼠HF肝脏有RAGE的高表达.
本文以AGEs/RAGE为切入点, 从体外到体内实验沉默RAGE基因的表达, 通过检测相关致纤维化因子金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1, TIMP-1)与抑制纤维化因子基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)的水平, 观察组织形态学的改变, 来探寻沉默RAGE基因对HF的治疗作用, 以期为临床防治LC提供新的手段.
本文从体外到体内研究结果均表明, 通过介导RAGE基因的沉默能有效地抑制致纤维化细胞因子TIMP-1的表达, 增加抗纤维化细胞因子MMP-1的表达, 显著改善纤维化大鼠的炎症程度和纤维化分期, 有望为抗HF治疗提供新的靶点.
RAGE: 是细胞膜分子免疫球蛋白超家族的新成员, RAGE作为信号转导受体介导AGEs结合在细胞表面, 可引起广泛的病理作用和各种疾病, 如糖尿病、肾小球硬化、肾间质纤维化、炎症、神经性变性或多发性神经病变、动脉粥样硬化和老化等;
MMP-1: 在肝内主要由活化的HSCs以酶原形式分泌, 主要降解ECM中的Ⅰ、Ⅲ型胶原, 其活性可被相应TIMPs所抑制;
TIMP-1: 主要由活化的HSCs分泌, 能抑制几乎所有MMPs的活性, 尤其是MMP-1、2、9, 同时TIMP-1可抑制HSCs的凋亡, 与肝脏炎症和纤维化密切相关.
本研究通过RAGE特异性小干扰siRNA在原代HSCs和HF大鼠肝脏中沉默RAGE基因, 结果表明在体外细胞和体内肝组织中RAGE和TIMP-1基因和蛋白表达均明显降低, MMP-1基因和蛋白的表达明显增加, 使大鼠肝脏HF的程度明显减轻, 且存在剂量依赖, 为HF临床治疗提供了新的思路.
编辑: 韦元涛 电编:都珍珍
| 1. | Ramasamy R, Vannucci SJ, Yan SS, Herold K, Yan SF, Schmidt AM. Advanced glycation end products and RAGE: a common thread in aging, diabetes, neurodegeneration, and inflammation. Glycobiology. 2005;15:16R-28R. [PubMed] [DOI] |
| 2. | Englert JM, Kliment CR, Ramsgaard L, Milutinovic PS, Crum L, Tobolewski JM, Oury TD. Paradoxical function for the receptor for advanced glycation end products in mouse models of pulmonary fibrosis. Int J Clin Exp Pathol. 2011;4:241-254. [PubMed] |
| 3. | Ciulla MM, Paliotti R, Carini M, Aldini G. Fibrosis, enzymatic and non-enzymatic cross-links in hypertensive heart disease. Cardiovasc Hematol Disord Drug Targets. 2011; Oct 26. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Busch M, Franke S, Rüster C, Wolf G. Advanced glycation end-products and the kidney. Eur J Clin Invest. 2010;40:742-755. [PubMed] [DOI] |
| 5. | Yamagishi S. Role of advanced glycation end products (AGEs) and receptor for AGEs (RAGE) in vascular damage in diabetes. Exp Gerontol. 2011;46:217-224. [PubMed] [DOI] |
| 7. | Xia JR, Liu NF, Zhu NX. Specific siRNA targeting the receptor for advanced glycation end products inhibits experimental hepatic fibrosis in rats. Int J Mol Sci. 2008;9:638-661. [PubMed] [DOI] |
| 8. | Cai XG, Xia JR, Li WD, Lu FL, Liu J, Lu Q, Zhi H. Anti-fibrotic effects of specific-siRNA targeting of the receptor for advanced glycation end products in a rat model of experimental hepatic fibrosis. Mol Med Rep. 2014;10:306-314. [PubMed] [DOI] |
| 11. | Ismail MH, Pinzani M. Reversal of liver fibrosis. Saudi J Gastroenterol. 2009;15:72-79. [PubMed] [DOI] |
| 12. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 13. | Kisseleva T, Brenner DA. Anti-fibrogenic strategies and the regression of fibrosis. Best Pract Res Clin Gastroenterol. 2011;25:305-317. [PubMed] [DOI] |
| 14. | Watanabe T, Niioka M, Hozawa S, Kameyama K, Hayashi T, Arai M, Ishikawa A, Maruyama K, Okazaki I. Gene expression of interstitial collagenase in both progressive and recovery phase of rat liver fibrosis induced by carbon tetrachloride. J Hepatol. 2000;33:224-235. [PubMed] [DOI] |
| 15. | Iredale JP. Tissue inhibitors of metalloproteinases in liver fibrosis. Int J Biochem Cell Biol. 1997;29:43-54. [PubMed] [DOI] |
| 16. | Murphy G, Docherty AJ. The matrix metalloproteinases and their inhibitors. Am J Respir Cell Mol Biol. 1992;7:120-125. [PubMed] [DOI] |
| 17. | Murphy FR, Issa R, Zhou X, Ratnarajah S, Nagase H, Arthur MJ, Benyon C, Iredale JP. Inhibition of apoptosis of activated hepatic stellate cells by tissue inhibitor of metalloproteinase-1 is mediated via effects on matrix metalloproteinase inhibition: implications for reversibility of liver fibrosis. J Biol Chem. 2002;277:11069-11076. [PubMed] [DOI] |
| 18. | Henderson NC, Iredale JP. Liver fibrosis: cellular mechanisms of progression and resolution. Clin Sci (Lond). 2007;112:265-280. [PubMed] [DOI] |
| 19. | Roderfeld M, Geier A, Dietrich CG, Siewert E, Jansen B, Gartung C, Roeb E. Cytokine blockade inhibits hepatic tissue inhibitor of metalloproteinase-1 expression and up-regulates matrix metalloproteinase-9 in toxic liver injury. Liver Int. 2006;26:579-586. [PubMed] [DOI] |
| 20. | Zhang BB, Cai WM, Weng HL, Hu ZR, Lu J, Zheng M, Liu RH. Diagnostic value of platelet derived growth factor-BB, transforming growth factor-beta1, matrix metalloproteinase-1, and tissue inhibitor of matrix metalloproteinase-1 in serum and peripheral blood mononuclear cells for hepatic fibrosis. World J Gastroenterol. 2003;9:2490-2496. [PubMed] |
| 21. | Nie QH, Duan GR, Luo XD, Xie YM, Luo H, Zhou YX, Pan BR. Expression of TIMP-1 and TIMP-2 in rats with hepatic fibrosis. World J Gastroenterol. 2004;10:86-90. [PubMed] |
| 22. | El-Gindy I, El Rahman AT, El-Alim MA, Zaki SS. Diagnostic potential of serum matrix metalloproteinase-2 and tissue inhibitor of metalloproteinase-1 as non-invasive markers of hepatic fibrosis in patients with HCV related chronic liver disease. Egypt J Immunol. 2003;10:27-35. [PubMed] |
| 23. | Murawaki Y, Ikuta Y, Idobe Y, Kitamura Y, Kawasaki H. Tissue inhibitor of metalloproteinase-1 in the liver of patients with chronic liver disease. J Hepatol. 1997;26:1213-1219. [PubMed] [DOI] |
| 24. | Iwamoto K, Kanno K, Hyogo H, Yamagishi S, Takeuchi M, Tazuma S, Chayama K. Advanced glycation end products enhance the proliferation and activation of hepatic stellate cells. J Gastroenterol. 2008;43:298-304. [PubMed] [DOI] |
| 25. | Guimarães EL, Empsen C, Geerts A, van Grunsven LA. Advanced glycation end products induce production of reactive oxygen species via the activation of NADPH oxidase in murine hepatic stellate cells. J Hepatol. 2010;52:389-397. [PubMed] [DOI] |
| 26. | Lohwasser C, Neureiter D, Popov Y, Bauer M, Schuppan D. Role of the receptor for advanced glycation end products in hepatic fibrosis. World J Gastroenterol. 2009;15:5789-5798. [PubMed] [DOI] |
| 27. | Abe H, Uto H, Takami Y, Takahama Y, Hasuike S, Kodama M, Nagata K, Moriuchi A, Numata M, Ido A. Transgenic expression of osteoactivin in the liver attenuates hepatic fibrosis in rats. Biochem Biophys Res Commun. 2007;356:610-615. [PubMed] [DOI] |
| 28. | Roderfeld M, Weiskirchen R, Wagner S, Berres ML, Henkel C, Grötzinger J, Gressner AM, Matern S, Roeb E. Inhibition of hepatic fibrogenesis by matrix metalloproteinase-9 mutants in mice. FASEB J. 2006;20:444-454. [PubMed] [DOI] |
| 29. | Chen M, Wang GJ, Diao Y, Xu RA, Xie HT, Li XY, Sun JG. Adeno-associated virus mediated interferon-gamma inhibits the progression of hepatic fibrosis in vitro and in vivo. World J Gastroenterol. 2005;11:4045-4051. [PubMed] |
| 30. | Takahashi Y, Nishikawa M, Takakura Y. [In vivo siRNA delivery to tumor cells and its application to cancer gene therapy]. Yakugaku Zasshi. 2007;127:1525-1531. [PubMed] [DOI] |
| 31. | Volarevic M, Smolic R, Wu CH, Wu GY. Potential role of RNAi in the treatment of HCV infection. Expert Rev Anti Infect Ther. 2007;5:823-831. [PubMed] [DOI] |