修回日期: 2015-05-11
接受日期: 2015-05-15
在线出版日期: 2015-06-18
目的: 建立慢性胰腺炎(chronic pancreatitis, CP)模型, 检测模型大鼠背根神经节(dorsal root ganglion, DRG)的胰腺节段, 并通过物理及化学检测方法论证模型可行性, 为进一步探讨慢性内脏疼痛的发生机制奠定基础.
方法: 选取成年SD大鼠为实验对象, 分为实验组和对照组, 实验组一次性经尾静脉注射二丁基二氯化锡溶液, 对照组注射等剂量的乙醇溶液, 注药前后不同时间点测定机械缩足反射阈值, 8 wk后处死两组大鼠, 通过HE染色对比两组大鼠胰腺组织病理变化, 选取正常大鼠行1,1'-双十八烷基-3,3,3',3'-4甲基吲哚羰花青-高氯酸盐(1,1'-dioctadecyl-3,3,3',3'-tetramethindo-carbocyanine perchlorate, Dil)逆行示踪明确支配胰腺的DRG段, 通过RT-PCR法测两组大鼠DRG的c-fos指标的mRNA的表达变化.
结果: 注药8 wk后, 与对照组相比, 实验组大鼠胰腺组织显示明显的慢性炎症表现; 痛阈值明显降低; Dil逆行示踪证实支配胰腺组织的脊髓神经表达节段在T8-12, DRG的c-fos表达较对照组增多(P<0.05).
结论: CP疼痛模型成功, 支配胰腺的DRG段在T8-12, c-fos的表达在慢性疼痛刺激条件下明显增多, 提示模型成功.
核心提示: 本实验目的即为建立慢性胰腺炎模型, 检测模型大鼠背根神经节的胰腺节段, 并通过物理及化学检测方法论证模型可行性, 为进一步探讨慢性内脏疼痛的发生机制奠定实验基础.
引文著录: 胡先平, 程立, 马锐, 郑伟, 李凡, 陈欣. 慢性胰腺炎疼痛模型大鼠背根神经节胰腺节段的确定. 世界华人消化杂志 2015; 23(17): 2774-2779
Revised: May 11, 2015
Accepted: May 15, 2015
Published online: June 18, 2015
AIM: To establish a rat model of chronic pancreatitis and determine dorsal root ganglion (DRG) segments projecting to the pancreas, in order to lay a foundation for further study of the pathogenesis of chronic visceral pain
METHODS: Adult male Sprague Dawley rats were randomly divided into an experimental group and a control group. The experimental group was intravenously given 8 mg/kg body weight dibutyltin dichloride to induce chronic pancreatitis, and the control group was injected with ethanol solution. Mechanical withdraw threshold at different time points was detected. Rats of the two groups were sacrificed after 8 wk. HE staining was used to detect the histological changes of pancreatic tissue, and RT-PCR was used to measure c-fos mRNA expression in DRG.
RESULTS: Compared with the control group, the rats in the experimental group showed chronic inflammation in pancreatic tissue at 8 wk and had significantly decreased mechanical withdraw threshold. 1,1'-dioctadecyl-3,3,3',3'-tetramethindo-carbocyanine perchlorate (Dil) retrograde tracing confirmed that the dorsal root ganglion (DRG) segments projecting to the pancreas were T8-12, and c-fos expression in DRG significantly increased (P < 0.05).
CONCLUSION: The dorsal root ganglion (DRG) segments projecting to the pancreas are T8-12. c-fos expression in chronic DRG significantly increases in rats with chronic pancreatitis pain.
- Citation: Hu XP, Cheng L, Ma R, Zheng W, Li F, Chen X. Determination of dorsal root ganglion segments projecting to the pancreas in a rat model of chronic pancreatitis pain. Shijie Huaren Xiaohua Zazhi 2015; 23(17): 2774-2779
- URL: https://www.wjgnet.com/1009-3079/full/v23/i17/2774.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i17.2774
慢性胰腺炎(chronic pancreatitis, CP)的主要症状常为频繁的、难控制的内脏痛. 80%-90%的CP患者出现顽固性疼痛[1], 常常是CP患者就诊的主要原因, 有其重要的社会、经济影响, 后果包括因残疾引起的待岗失业、多次住院治疗、患者生活质量的降低、超额药物控制以及各种对疾病的检查干预手段.
以CP为代表性的内脏痛信息在神经系统内的转导是一个相当复杂的过程, 关于产生机制, 有两个主要理论出现: 其一, 疼痛的产生是由于管内压狭窄引起的管内压增高, 胰腺纤维化, 胰腺间质高压, 胰腺缺血[2]; 其二, 生物活性物质和炎症细胞的浸润致周围神经损伤[3], 使多种神经生长因子、神经活性递质的数量及表达增加, 初级传入神经传导通路的致敏等因素对内脏痛的产生和维持发挥了重要作用[3-6]. 内脏痛的机制探讨已经取得了一定进展, 但各种研究都无法完全解释内脏痛复杂的产生机制及有效的治疗手段, 仍有待细致、深入的探讨.
背根神经节(dorsal root ganglion, DRG)的神经元是周围神经系统主要的传入神经元, 是伤害性信号向中枢系统传递的中转站. 本实验为建立可靠的CP模型, 并在大鼠DRG找到胰腺相关节段, 通过相关节段DRG的c-fos表达变化, 从而进一步论证慢性疼痛模型成功, 为下一步探讨内脏痛的发生机制以及减轻疼痛的治疗方法奠定实验基础.
成年♂SD大鼠45只, 质量200-250 g, 由湖北医药学院实验动物中心提供. 在湖北医药学院实验动物中心饲养1 wk后造模, 造模过程中死亡20只, 其余分为2组, 实验组、对照组各10只. 造模后在湖北医药学院实验动物中心喂养.
1.2.1 模型建立: 实验组大鼠一次性经尾静脉注入药物二丁基二氯化锡(dibutyltin dichloride, DBTC)的800 mL/L乙醇溶液(配制方法: 在400 mL无水乙醇加入400 mg DBTC, 再慢慢加入生理盐水定容至500 mL, 摇匀)DBTC按8 mg/kg体质量计算注药量[7], 对照组一次性经尾静脉注射等剂量的800 mL/L乙醇溶液(配制方法: 在400 mL无水乙醇加入生理盐水定容至500 mL, 摇匀). 两组大鼠均在湖北医药学院实验室动物中心喂养, 常规饲料和饮水不限8 wk.
1.2.2 疼痛行为学指标机械缩足反射阈值(mechanical withdraw threshold, MWT): 各组大鼠于注药前1 d、注药后1 d、注药后4 wk和注药后8 wk分别测定MWT值. 将大鼠放在测试笼内, 用测试探针直接刺激大鼠左足底, 每隔10 s应用1次, 共测3次, 取平均值. 用药后4、8 wk分别测定MWT值, 每次测量均在上午8:00-10:00进行.
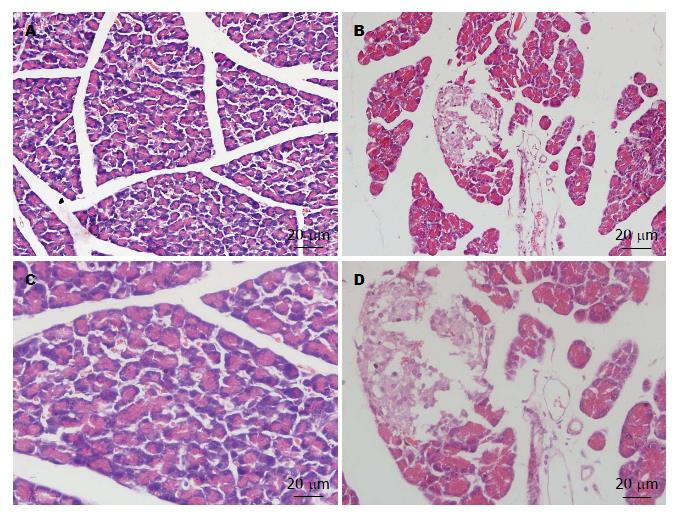
1.2.3 胰腺组织HE染色: 8 wk后处死两组大鼠, 10%水合氯醛(300 mg/kg)腹腔注射麻醉成功后, 仰卧位固定, 开腹取胰腺组织, 蜡块包埋, 脱蜡, 染色、脱水、自然晾干, 中性树胶封片, 显微镜下观察结果.
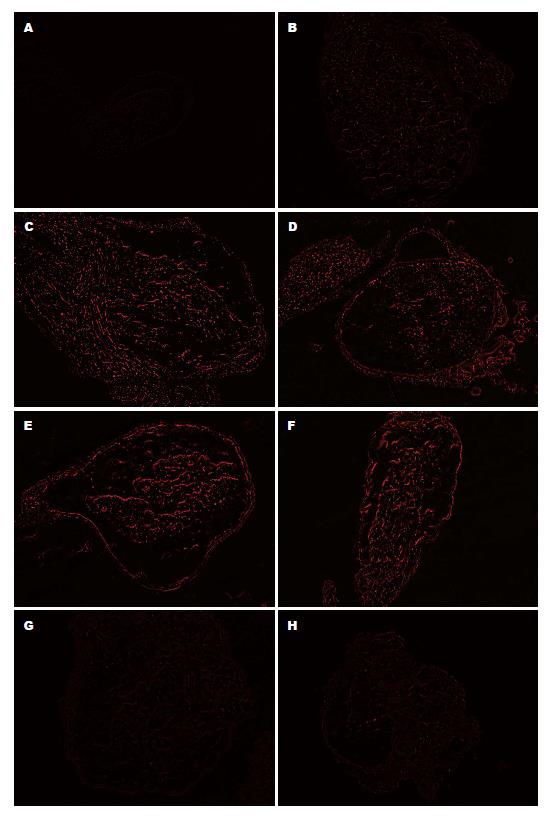
1.2.4 背根节段的示踪: 取正常大鼠10%水合氯醛(300 mg/kg)行腹腔注射麻醉成功后仰卧位固定, 于上腹部行直径5 cm常规备皮, 消毒, 做1.5 cm纵形切口, 暴露胰腺, 找到胰管, 在胰管及胰腺组织中注入荧光染料1,1'-双十八烷基-3,3,3',3'-4甲基吲哚羰花青-高氯酸盐(1,1'-dioctadecyl-3,3,3',3'-tetramethindo-carbocyanine perchlorate, Dil)(以甲醇溶解, 浓度1%), 注射15-20个点, 每点注射1-2 μL, 术后常规使用青霉素160万单位于腹腔, 层次关闭缝合, 恢复1 wk. 再以10%水合氯醛麻醉成功后, 仰卧位固定去除腹腔脏器, 去头, 背部正中切口剪开皮肤, 分离筋膜及肌肉, 充分暴露背根, 0 ℃取DRG(T6-S1), 冰盒保存, 立即行冰冻切片, 2张/节段, 在正置显微镜下照相并保存.
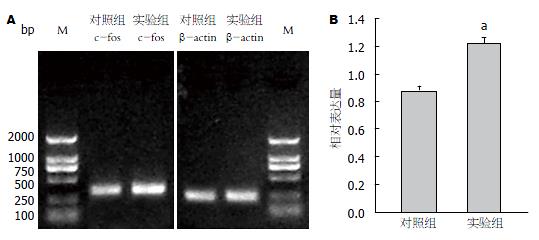
1.2.5 RT-PCR法检测DRG的c-fos mRNA: 取两组大鼠在10%水合氯醛注射麻醉下, 仰卧位固定, 开腹除去腹腔脏器, 冲洗, 断头, 冰中快速分离脊髓T8-12节段DRG, 进行总RNA抽提, 逆转录, PCR扩增, 电泳, BandScan凝胶成像分析系统分析电泳图像光密度值, 经β-actin校正得到相对c-fos mRNA的RD值.
统计学处理 用SPSS17.0对结果进行软件处理, 计量资料以mean±SD表示, 采用两样本均数t检验比较各组表达差异, P<0.05为差异有统计学意义.
对照组实质结构完整, 有少量炎细胞浸润, 小叶间有轻度水肿和增宽; 实验组可见间质内炎性细胞浸润广泛, 多为淋巴细胞和浆细胞, 血管充血, 小叶明显水肿, 结构破坏, 实质组织片状坏死, 腺泡萎缩消失, 腺泡周围存在纤维化, 显示慢性炎症表现(图1).
与对照组对比, 实验组在注药前、注药后1 d及注药后4 wk差异均无统计学意义(P>0.05), 但注药后8 wk两者差异有统计学意义(P<0.01). 与注药前对比, 实验组注药后1 d、注药后4 wk及注药后8 wk差异有统计学意义(P<0.01); 对照组注药后1 d及注药后4 wk差异均有统计学意义(P<0.01), 注药后8 wk与注药前相比无差异无统计学意义(P>0.05). 提示注药后8 wk实验组痛阈值明显降低(表1).
荧光显微镜下, Dil的红色荧光在神经节细胞内有明显聚集, 成簇成群, 节细胞多呈卵圆形, 大小不一, 其颜色的深浅与Dil的聚集含量相关, T6、T7及T13、S1荧光表达不明显, T8-12均有表达, 以T9-12显著, 提示支配胰腺组织的背根神经的表达节段在T8-12(图2).
实验组大鼠的RD值为1.217±0.401, 对照组为0.879±0.053, 两组表达差异有统计学意义(P<0.05), 提示实验组DRG的c-fos表达较对照组增多(图3).
慢性致残性疼痛是大多数CP患者最常见的症状, 他们描述这种疼痛为深部的、持久的、难以忍受的疼痛, 可放射到腰背部, 呈现餐后痛和自发痛, 与饮酒相关, 腹痛部位和疼痛程度存在明显的个体差异. 传统观念认为, 疼痛的感知及调节主要是由神经元所介导的, 因此认为疼痛在脊髓水平的出现和传导与脊髓神经元及其递质相关. 本实验目的就是在大鼠脊髓神经水平研究疼痛的发生机制, 从而引申慢性疼痛的治疗办法.
本实验通过尾静脉注射DBTC建立大鼠胰腺炎模型, 具有操作简单、建模时间短、CP发病率高及费用低等优点. 研究[8]表明, 注药后28 d内, 大鼠的各项生化指标(淀粉酶、脂肪酶、碱性磷酸酶、血清胆红素、胆汁酸浓度等)都明显升高[8-10]. 研究[8]结果表明DBTC诱导胰腺炎有着双重的发病机制: (1)作用在胰胆管上皮细胞导致上皮坏死并阻塞胆管, 然后出现胆汁淤积和间质性胰腺炎; (2)在血管的DBTC对胰腺细胞的直接损害作用(线粒体损伤, 细胞自噬, 细胞坏死), 随后出现间质的水肿和炎症浸润. 这两个过程都导致胆汁淤积、胆管阻塞从而发生这类DBTC诱导的胰腺炎的慢性进程倾向. 本实验通过DBTC诱导大鼠CP模型是有效的. 研究[8]报道注药4 wk后1/3的大鼠出现了CP表现, 在预实验中, 我们发现注药8 wk后所有的大鼠均有明显的CP表现, 本实验造模时间选取8 wk.
羰花青荧光染料Dil在细胞生物学的应用有着久远的历史, 近些年主要作为神经元的示踪剂. 早在1985年, 科学家就发现[11]这些染料分子在神经系统可作为优秀的逆行与顺行的示踪剂, 紧接着发现这些染料在培养的神经元细胞上能够被保留, 他们标记在神经元细胞胞体上, 无毒, 高度亲脂, Dil标记的主要机制一向被认为是迁移进细胞膜及侧向扩散, 而不会越过轴突, 可使整个细胞膜染成橙红色, 这些特点使Dil成为优秀的示踪剂. 国外研究[12]表明, DRG的T8-12是胰腺疼痛在背根上表达的节段. 本实验中, 我们取了T6-S1节段的DRG, 通过Dil的逆行性示踪, 发现背根节段T6、T7及T13、S1的荧光表达不明显, 而以T8-12明显, 提示支配胰腺组织的背根表达节段在T8-12, 与Vardanyan等[12]的研究结果一致. 亦有Fasanella等[13]研究表明胰腺逆行示踪后的DRG段在T9-12, 与本实验结果无明显相左, 下一步研究可考虑用多种示踪剂逆行示踪, 明确相关节段.
本实验中大鼠注药8 wk后机械痛阈明显降低、DRG的c-fos mRNA表达增强, 提示大鼠存在疼痛感觉和痛敏改变. c-fos在脊髓水平的表达通常被视为伤害信息的传输路径在神经元激活的一种象征, 与疼痛超敏感和疼痛持续有着密切的关系. 研究[14]表明, 最开始急性伤害性刺激主要激活脊髓浅角的c-fos表达, 经过反复的刺激, 才会诱发脊髓疼痛控制中心c-fos的表达, 才能产生疼痛过敏, 异常疼痛的慢性疼痛症状[15]. c-fos在神经元的表达增强提示了DRG兴奋性增高, 提示慢性疼痛模型成功.
但也有研究[16,17]表明, DBTC模型的不足之处是对胰腺外器官有一定的非致死性毒性作用, 例如动脉粥样硬化和肝、肺、肾的纤维化. 如何尽量避免胰腺外主要器官损伤有待更深入的研究, 我们猜想可能的解决途径之一是给予少量而多次的注射, 但药物对血管壁和尾部软组织的刺激性很强, 可出现血管硬化、阻塞, 药物外渗, 沿静脉黑色斑、组织水肿、缺血、坏死, 甚至断尾的并发症, 增加动物的痛苦和不配合, 故其浓度、注射技术和次数有待更进一步的摸索和统一.
本实验通过尾静脉注射DBTC建立CP模型, 注药8 wk后, 实验组机械痛阈明显降低、利用Dil逆行示踪证实了支配胰腺组织的脊髓神经表达节段在T8-12, 且此节段的DRG的c-fos mRNA表达增强, 提示CP慢性疼痛模型成功, 为下一步探讨CP疼痛机制及缓解疼痛方法提供了实验基础.
胰腺的慢性炎症引起的胰源性疼痛经常是顽固性的, 临床上通过当前可选的治疗方法难以管理. 这种疼痛产生的根本机制研究很多, 却知之甚少. 探讨疼痛发生机制以便于更好管理慢性胰腺炎(chronic pancreatitis, CP)患者的疼痛是至关重要的.
梁国刚, 教授, 大连医科大学附属第一医院
研究表明, CP的疼痛通常被认为是由综合因素导致的, 包括导管和实质内的压力增加, 胰腺神经的改变, 胰腺的局部缺血和胰腺神经疤痕的形成. 并发症包括假性囊肿, 胆总管阻塞, 发展为胰腺癌, 考虑也可能与胰腺的疼痛相关.
胰腺是一个有着非常良好的神经支配的器官. 胰腺神经敏感的物质有: 化学物质(炎症介质)、物理变化(热, pH值)及机械刺激(张力)这几类刺激. 生物活性物质和炎症介质对胰腺神经的损害是最近提出的另一个胰腺炎疼痛机制的推动因素.
本实验为建立可靠的CP模型, 并在大鼠背根神经节找到胰腺相关节段, 为下一步探讨内脏痛的发生机制以及减轻疼痛的治疗方法奠定实验基础.
背根神经节: 是指来源于神经嵴的脊神经节内的感觉神经母细胞发出轴突, 呈束状, 左右对称地从神经管的背部进入, 此时的脊神经节即改称为背根神经节. 他的神经元是周围神经系统主要的传入神经元, 是伤害性信号向中枢系统传递的中转站.
本文立题新颖, 有一定的临床应用价值, 思路清晰, 文章科学性强, 设计合理.
编辑: 韦元涛 电编:都珍珍
| 1. | Andrén-Sandberg A, Hoem D, Gislason H. Pain management in chronic pancreatitis. Eur J Gastroenterol Hepatol. 2002;14:957-970. [PubMed] [DOI] |
| 2. | Di Sebastiano P, di Mola FF, Buchler MW, Friess H. Pathogenesis of pain in chronic pancreatitis. Dig Dis. 2004;22:267-272. [PubMed] [DOI] |
| 3. | Friess H, Shrikhande S, Shrikhande M, Martignoni M, Kulli C, Zimmermann A, Kappeler A, Ramesh H, Büchler M. Neural alterations in surgical stage chronic pancreatitis are independent of the underlying aetiology. Gut. 2002;50:682-686. [PubMed] [DOI] |
| 4. | Bockman DE, Buchler M, Malfertheiner P, Beger HG. Analysis of nerves in chronic pancreatitis. Gastroenterology. 1988;94:1459-1469. [PubMed] |
| 5. | Vardanyan M, Rilo HL. Pathogenesis of chronic pancreatitis-induced pain. Discov Med. 2010;9:304-310. [PubMed] |
| 6. | Basbaum AI, Bautista DM, Scherrer G, Julius D. Cellular and molecular mechanisms of pain. Cell. 2009;139:267-284. [PubMed] [DOI] |
| 7. | Sparmann G, Merkord J, Jäschke A, Nizze H, Jonas L, Löhr M, Liebe S, Emmrich J. Pancreatic fibrosis in experimental pancreatitis induced by dibutyltin dichloride. Gastroenterology. 1997;112:1664-1672. [PubMed] |
| 8. | Merkord J, Jonas L, Weber H, Kröning G, Nizze H, Hennighausen G. Acute interstitial pancreatitis in rats induced by dibutyltin dichloride (DBTC): pathogenesis and natural course of lesions. Pancreas. 1997;15:392-401. [PubMed] [DOI] |
| 9. | Tsukamoto H, Towner SJ, Yu GS, French SW. Potentiation of ethanol-induced pancreatic injury by dietary fat. Induction of chronic pancreatitis by alcohol in rats. Am J Pathol. 1988;131:246-257. [PubMed] |
| 10. | Vera-Portocarrero LP, Lu Y, Westlund KN. Nociception in persistent pancreatitis in rats: effects of morphine and neuropeptide alterations. Anesthesiology. 2003;98:474-484. [PubMed] [DOI] |
| 11. | Honig MG, Hume RI. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends Neurosci. 1989;12:333-335, 340-341. [PubMed] [DOI] |
| 12. | Vardanyan M, Melemedjian OK, Price TJ, Ossipov MH, Lai J, Roberts E, Boos TL, Deschamps JR, Jacobson AE, Rice KC. Reversal of pancreatitis-induced pain by an orally available, small molecule interleukin-6 receptor antagonist. Pain. 2010;151:257-265. [PubMed] [DOI] |
| 13. | Fasanella KE, Christianson JA, Chanthaphavong RS, Davis BM. Distribution and neurochemical identification of pancreatic afferents in the mouse. J Comp Neurol. 2008;509:42-52. [PubMed] [DOI] |
| 14. | Morgan JI, Cohen DR, Hempstead JL, Curran T. Mapping patterns of c-fos expression in the central nervous system after seizure. Science. 1987;237:192-197. [PubMed] [DOI] |
| 15. | Pinto M, Lima D, Tavares I. Neuronal activation at the spinal cord and medullary pain control centers after joint stimulation: a c-fos study in acute and chronic articular inflammation. Neuroscience. 2007;147:1076-1089. [PubMed] [DOI] |
| 16. | Zhao HF, Ito T, Gibo J, Kawabe K, Oono T, Kaku T, Arita Y, Zhao QW, Usui M, Egashira K. Anti-monocyte chemoattractant protein 1 gene therapy attenuates experimental chronic pancreatitis induced by dibutyltin dichloride in rats. Gut. 2005;54:1759-1767. [PubMed] [DOI] |
| 17. | Glawe C, Emmrich J, Sparmann G, Vollmar B. In vivo characterization of developing chronic pancreatitis in rats. Lab Invest. 2005;85:193-204. [PubMed] [DOI] |