修回日期: 2015-05-05
接受日期: 2015-05-08
在线出版日期: 2015-06-18
目的: 通过观察转化生长因子-β1(transforming growth factor-β1, TGF-β1)、β-连环蛋白(β-catenin)mRNA和蛋白质的表达, 探讨清热祛湿活血法干预大鼠肝纤维化的分子机制.
方法: 成年♂Wistar大鼠60只随机分组为给药组(中药和秋水仙碱)、造模组和正常组. 造模组给予四氯化碳皮下注射, 辅以高脂饮食和30 mL/L乙醇为唯一饮用水, 共16 wk. 第5周起给予中药和秋水仙碱组每天灌胃干预, 12 wk后处死, 检测各组大鼠血清透明质酸酶(hyaluronidase, HA)、Ⅳ胶原蛋白、Ⅲ型前胶原(procollagen type Ⅲ, PCⅢ)、层黏连蛋白(laminin, LN)血清水平, HE染色和Masson染色观察各组大鼠肝组织病理变化情况, RT-PCR和Western blot检测TGF-β1和β-catenin mRNA和蛋白质表达水平.
结果: 中药组大鼠HE染色及Masson染色均见中药组大鼠肝纤维化程度较造模组和秋水仙碱组减轻, 血清Ⅳ型胶原蛋白、HA、Ⅲ型前胶原氨基末端肽(N-terminal procollagen Ⅲ propeptide, PⅢNP)值均明显下降. 中药组大鼠肝脏组织内TGF-β1、β-catenin在mRNA和蛋白质表达水平上均低于造模组大鼠和秋水仙碱组大鼠.
结论: 基于清热祛湿活血立法的加味茵芍散对大鼠肝纤维化有一定的逆转作用, 其抗肝纤维化分子机制可能与抑制或下调TGF-β1、β-catenin mRNA和蛋白质的表达, 从而阻断TGF-β1、Wnt/β-catenin细胞通路的激活有关.
核心提示: 基于清热祛湿活血立法的加味茵芍散可缓解大鼠模型的肝纤维化. 其抗肝纤维化分子机制可能与抑制或下调转化生长因子-β1(transforming growth factor-β1, TGF-β1)、β-连环蛋白(β-catenin)mRNA和蛋白质的表达, 从而阻断TGF-β1、Wnt/β-catenin细胞通路的激活有关.
引文著录: 王心蕊, 鲁玉辉, 郑旭, 徐文洋, 陈燕花. 基于转化生长因子-β1、β-catenin的表达水平初步探讨清热祛湿活血法干预大鼠肝纤维化的机制. 世界华人消化杂志 2015; 23(17): 2697-2706
Revised: May 5, 2015
Accepted: May 8, 2015
Published online: June 18, 2015
AIM: To investigate the effect of traditional Chinese medicine Yinshao powder on the expression of transforming growth factor-β1 (TGF-β1) and β-catenin in hepatic fibrosis in rats to clarify the molecular mechanism of clearing heat, expelling damp and promoting blood circulation.
METHODS: Sixty adult male Wistar rats were divided randomly into six groups: a normal control group, a model group, low-, medium- and high-dose Yinshao powder groups and a colchicine group. Hepatic fibrosis was induced by giving subcutaneous injection of carbon tetrachloride, a high-fat diet and 30 mL/L alcohol for 16 wk. At the fifth week, Yinshao powder or colchicine was intragastrically administered. After 12 wk of treatment, the rats were sacrificed to measure serum levels of hyaluronidase (HA), type Ⅳ collagen, procollagen type Ⅲ (PCⅢ), and laminin (LN), observe hepatic pathological changes by HE staining and Masson staining, and determine the mRNA and protein expression levels of TGF-β1 and β-catenin by RT-PCR and Western blot.
RESULTS: Compared with the colchicine group and model group, serum levels of HA, type Ⅳ collagen, PCⅢ, and LN declined significantly in the other groups. The degree of hepatic fibrosis in the Yinshao powder groups was less than that in the colchicine group and model group. The mRNA and protein expression levels of TGF-β1 and β-catenin were significantly lower in the Yinshao powder groups than in the model group and colchicine group.
CONCLUSION: Clearing heat, expelling damp and promoting blood circulation with Yinshao powder for intervention of hepatic fibrosis may be via molecular mechanisms associated with inhibiting or down-regulating the expression of TGF-β1 and β-catenin and blocking the activation of TGF-β1 signaling pathway and Wnt/β-catenin signaling pathway.
- Citation: Wang XR, Lu YH, Zheng X, Xu WY, Chen YH. Effect of Yinshao powder on expression of transforming growth factor-β1 and β-catenin in hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(17): 2697-2706
- URL: https://www.wjgnet.com/1009-3079/full/v23/i17/2697.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i17.2697
肝纤维化为慢性肝损伤的伤口愈合性反应, 各种致病因子导致肝细胞炎症、坏死, 细胞外基质(extracellular matrix, ECM)出现降解与沉积失衡, 进而导致结缔组织异常增生, 其终末阶段为肝硬化. 我国人群肝纤维化的主要病因是病毒性肝炎, 尤其是慢性乙型病毒性肝炎. 在肝纤维化发展过程中, 肝星状细胞为主要效应细胞. 目前已证实多条细胞通路参与到肝星状细胞的激活、ECM分泌的过程中, 其中最主要的细胞通路为转化生长因子-β1(transforming growth factor-β1, TGF-β1)/Smads通路. 新近发现Wnt/β-连环蛋白(β-catenin)通路亦参与到肝星状细胞的激活、肝纤维化形成的过程中. 我们既往的临床研究[1]发现: 基于清热祛湿活血立法的加味茵芍散治疗慢性肝炎和肝纤维化有一定疗效, 可缓解和/或逆转肝纤维化患者肝纤维化进展. 本实验旨在通过观察中药干预对大鼠TGF-β1、β-catenin mRNA和蛋白质的表达情况的影响, 进一步探讨清热祛湿活血法抗肝纤维化的分子机制, 为中医药防治肝纤维化寻找新的作用靶点和途径.
由福建中医药大学实验动物中心提供SPF级成年♂Wistar大鼠60只, 购自上海斯莱克实验动物有限责任公司, 许可证: SCXK(沪)2012-0002, 体质量均在200-300 g之间. 四氯化碳(分析纯)购自天津市福晨化学试剂厂; 橄榄油(化学纯)购自国药集团化学试剂有限公司; 中药(茵陈20 g、桃仁10 g、丹参20 g、黄芩10 g、姜厚朴12 g、白花蛇舌草30 g、炒栀子10 g、党参25 g、黄芪30 g、白芍15 g、醋鳖甲15 g、甘草6 g)购自福建中医药大学附属福建省第二人民医院; 秋水仙碱购自北京索莱宝科技有限公司; 透明质酸酶(hyaluronidase, HA)试剂盒、Ⅳ型胶原蛋白试剂盒、Ⅲ型前胶原(procollagen type Ⅲ, PCⅢ)试剂盒、层黏连蛋白(laminin, LN)试剂盒购自北京热景生物技术有限公司; TGF-β1(Ⅴ) Antibody(sc-146)、β-catenin Antibody(H-102)(sc-7199)均购自美国Santa cruz公司; Biozol Reagent、BioRT cDNA First Strand Synthesis Kit、RNase free ddH2O、BioEasy SYBR Green Ⅰ荧光PCR试剂盒均购自杭州博日科技有限公司. 上转发光免疫分析仪UPF-3A, 北京热景生物技术有限公司产品; PCR仪(ABI 7500Fast)购自美国应用生物系统公司; 转移脱色摇床购自海门其林贝尔仪器制造公司; 去离子水仪, 型号Purelab Plus, 购自美国PALL公司; PVDF膜购自美国Millipore公司; 医用X射线胶片购自柯达公司; 美国通用显影粉、酸性定影粉购自天津天陆海感光材料厂; 电泳仪, 北京六一仪器厂生产.
1.2.1 造模和给药: 将大鼠随机分成6组: 中药高剂量组10只、中药中剂量组10只、中药低剂量组10只、秋水仙碱组10只、模型对照组10只、正常空白组10只. 四氯化碳与橄榄油以2:3的比例, 以0.3 mL/100 g皮下注射, 2次/wk, 并给予高脂饮食(79.5%玉米面、20%猪油、0.5%胆固醇), 饮料为30 mL/L酒精, 造模16 wk. 中药浸泡30 min后, 煎煮30 min, 水煎2次, 经过过滤、浓缩后, 每1 mg约含生药1 g. 放在4 ℃环境中冷藏备用, 使用时用蒸馏水稀释灌胃. 第5周起以4、2、1 mL/kg的比例给予中药灌胃, 1次/d; 秋水仙碱组以0.02 mg/100 g灌胃, 1次/d. 12 wk后处死取材.
1.2.2 血清学肝纤维化四项测定: 麻醉成功后, 打开腹腔, 小心拨开并分离组织器官暴露腹主动脉, 抽取动脉血约10 mL, 静置1 h后, 以4000 r/min、10 min离心, 取上层血清. 使用上转发光免疫分析仪UPF-3A及其配套试剂盒检测HA、Ⅳ胶原蛋白、PCⅢ、LN.
1.2.3 肝组织病理学检测: 取血后立即摘取大鼠肝脏, 取约1 cm×1 cm大小肝组织, 生理盐水冲洗后放入40 g/L甲醛液中固定, 固定后乙醇梯度脱水, 二甲苯透明后浸蜡及包埋, 制作病理切片. HE染色和Masson染色后, 光镜观察各组大鼠肝组织病理变化情况.
1.2.4 实时荧光定量PCR检测TGF-β1、β-catenin mRNA表达水平: 取1.0 μL样品, 以双蒸水为对照, 用NanoDrop ND-1000对提取的RNA样品进行定量分析并保存于-80 ℃, 备用. 参照BioRT cDNA First Strand Synthesis Kit(BIOER)说明书的步骤合成cDNA: 42 ℃ 45 min, 95 ℃ 5 min, 4 ℃保存. RT反应体系为: RT Buffer 2.0 μL, dNTP 1.0 μL, Oligo-dT 0.5 μL, Random Primer 0.5 μL, Rnase inhibitor 0.5 μL, AMV Reverse Transcriptase 0.5 μL, RNA 1.5 μL, RNAse free H2O 3.5 μL, Total: 10.0 μL. 在Applied Biosystems 7500 Fast荧光定量PCR仪上进行PCR反应. PCR体系为: 1.6 μL cDNA, 1.0 μL上游引物, 1.0 μL下游引物, 0.2 μL ROX, 0.3 μL Taq酶, 21.3 μL H2O和25.0 μL of 2×SYBR Green PCR Master mix(BIOER). 反应条件为: 92 ℃ 10 min, (92 ℃ 15 s, 60 ℃ 1 min)40个循环, 4 ℃保存. 将GAPDH作为内参基因, 以正常组为对照组, 采用2-△△Ct法对目的基因进行相对定量, 实验组和对照组的基因表达的相对定量用2-△△Ct表示, 即2-△△Ct值表示实验组和对照组目的基因表达的倍数关系, 其中△△Ct = (实验组目的基因平均Ct值-实验组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值). TGF-β1和β-catenin扩增用的引物列表如表1.
| 基因 | 引物序列 | 产物大小(bp) | 退火温度(℃) |
| TGF-β1 | Sense: 5'-CAACAATTCCTGGCGTTACCT-3' | 125 | 58 |
| Antisense: 5'-AGCCCTGTATTCCGTCTCCTT-3' | |||
| β-catenin | Sense: 5'-TGACAGGGAGGACATTACCGA-3' | 175 | 58 |
| Antisense: 5'-CAATCCAACAGTTGCCTTTATC-3' | |||
| GAPDH | Sense: 5'-TGGAGTCTACTGGCGTCTT-3' | 138 | 58 |
| Antisense: 5'-TGTCATATTTCTCGTGGTTCA-3' |
1.2.5 Western blot分析TGF-β1、β-catenin蛋白质表达情况: 从各组中随机选取3份大鼠肝组织. Western blot检测大鼠肝组织内TGF-β1、β-catenin蛋白表达情况, 内参蛋白为Actin. 将组织充分裂解后, 取上清. 根据蛋白定量结果, 加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液, 95 ℃变性10 min; 80 V电压使样品通过浓缩胶[ddH2O 1.200 mL、30% Acrylamide(4 ℃避光) 0.270 mL、0.5 mol Tris-HCl(pH 6.8) 0.500 mL、10%SDS 20 μL、10%APS(后加) 20 μL、TEMED(后加) 2 μL]与分离胶[ddH2O 1.576 mL、30%Acrylamide(4 ℃避光) 1.360 mL、1.5 mol Tris-HCl(pH 8.8) 1.000 mL、10%SDS 40 μL、10%APS(后加)40 μL、TEMED(后加) 2.0 μL)](电压约8 V/cm). 将蛋白条带通过转移电泳方式转印至固相支持物上, 然后分别用非标记一抗及辣根过氧化物酶标记的二抗对其进行孵育、检测. 本实验采用PVDF膜作为固相支持物以及半干转的转膜方式. 取出转移膜置于封闭液中, 封闭1 h; 一抗反应: 将一抗用封闭液稀释[胰岛素样生长因子(insulin-like growth factor, IGF)-1抗体稀释度均为1:300, 内参抗体稀释度为1:1000], 4 ℃反应过夜; 二抗反应: 将用1×TBST洗涤3次后的一抗反应膜放入二抗工作液(1:3000)中, 室温、避光缓慢摇动作用60 min; 洗去游离二抗; 曝光及洗片; 用Image J软件分析灰度值.
统计学处理 实验数据均以mean±SD表示. 组间比较用单因素方差分析. 满足方差齐性, 用LSD法进行组间两两比较; 若方差不齐, 用Tamhane's T2法进行各组间的多重比较. 所有数据均通过SPSS18.0软件分析, 取α = 0.05为显著性检验水准, P<0.05为差异有统计学意义.
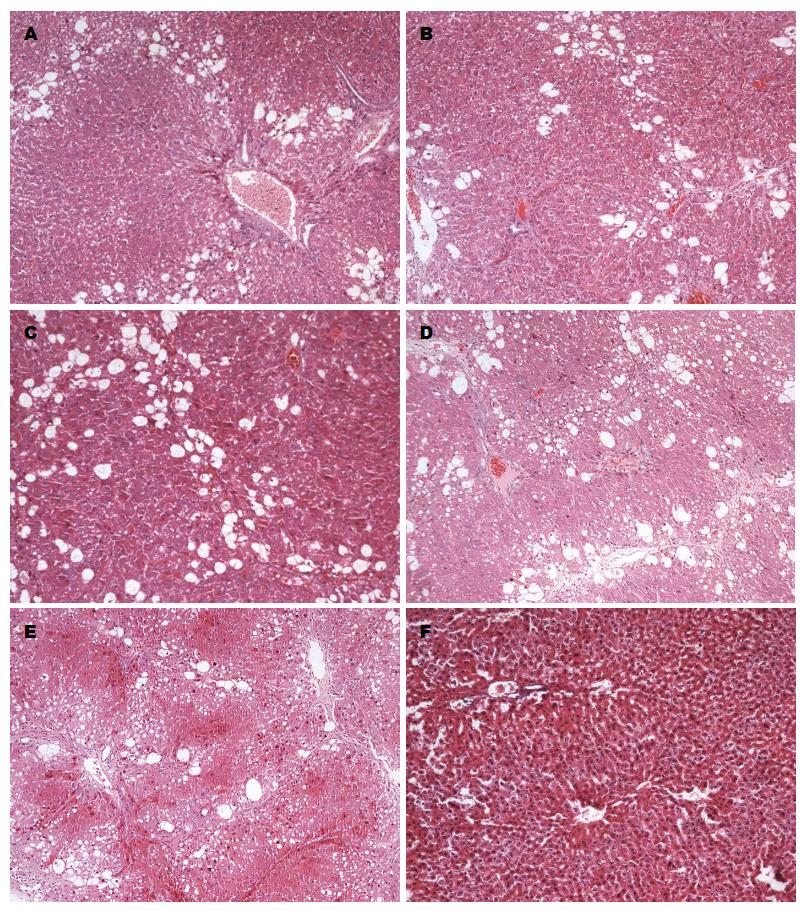
在造模期间正常组大鼠一般状态良好, 毛发有光泽, 饮食、大小便正常, 有活力. 随着造模的进行, 造模组大鼠精神萎靡, 毛发枯黄无光泽, 尿黄, 时有腹泻、气味臭秽, 或大便干结, 饮食量减少, 活动量逐渐减少. 中药组一般情况明显好于模型组, 秋水仙碱组大鼠状况较中药组大鼠状况稍差.
血清Ⅳ型胶原蛋白值结果可见: 与正常组相比, 秋水仙碱组、造模组血清值明显上升(P<0.01); 与造模组相比, 给药各组血清值显著降低(P<0.01); 中药各组血清值较秋水仙碱组血清值显著降低(P<0.01). 血清LN值结果可见: 与正常组相比, 造模组血清值明显上升(P<0.01); 与造模组相比, 给药组血清值降低(P<0.05), 但中药各组血清值与秋水仙碱组血清值相比, 其差异无统计学意义. 血清HA值结果可见: 与正常组比较, 中药低剂量、秋水仙碱组、造模组血清值明显上升(P<0.01); 与造模组相比, 中药高剂量组、中药中剂量组血清值显著降低(P<0.01); 与秋水仙碱组相比, 中药高、中剂量组降低(P<0.05). 血清PⅢNP值结果可见: 与正常组相比, 秋水仙碱组、造模组大鼠血清值显著升高(P<0.01); 与造模组相比, 中药各组血清值显著降低(P<0.01), 秋水仙碱组血清值降低(P<0.05); 与秋水仙碱组相比, 中药各组血清值降低(P<0.05)(表2).
| 分组 | Ⅳ胶原蛋白 | LN | HA | PⅢNP |
| 中药高剂量组 | 22.22±2.28df | 35.67±3.87d | 272.67±6.38df | 7.67±1.23df |
| 中药中剂量组 | 22.57±1.51df | 35.57±3.05d | 278.00±33.47de | 8.29±1.60df |
| 中药低剂量组 | 28.14±3.13bdf | 38.00±5.89d | 360.00±25.68b | 8.57±1.71ade |
| 秋水仙碱组 | 35.71±1.38bd | 46.14±7.27c | 354.71±32.57b | 11.00±2.16bc |
| 造模组 | 41.17±3.66b | 60.33±2.07b | 391.00±19.68b | 13.17±1.47b |
| 正常组 | 21.80±2.93 | 38.30±2.31 | 233.20±17.31 | 6.70±2.21 |
2.3.1 大鼠肝组织HE染色结果: HE染色见正常组大鼠肝组织结构完整、细胞形态正常; 造模组大鼠肝组织正常结构破坏严重、细胞肿胀且排列紊乱、伴明显的炎细胞浸润及空泡样变性; 秋水仙碱组大鼠肝组织结构破坏稍严重、细胞稍肿胀且排列较紊乱、伴随部分细胞空泡样变性及脂滴形成, 可见炎细胞浸润; 中药低剂量组肝组织结构破坏稍严重、细胞稍肿胀且排列较紊乱、伴随部分细胞空泡样变性; 中药高剂量组、中药中剂量组肝组织正常结构破坏程度较轻, 伴随少量细胞空泡样变性及脂滴形成(图1).
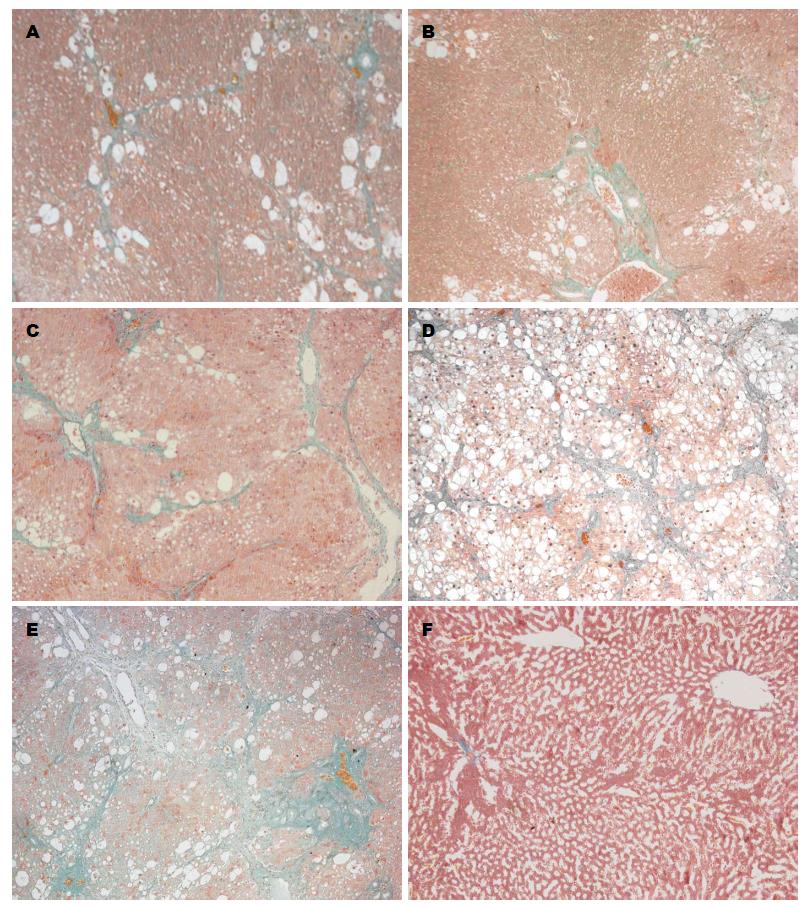
2.3.2 大鼠肝组织Masson染色结果: Masson染色用于显示组织中纤维, 纤维染色结果为绿色. 染色结果可见: 正常组大鼠肝小叶结构正常, 肝细胞绕中央静脉成放射状, 细胞结构正常, 可见细胞周围有少量胶原纤维排列整齐; 造模组肝小叶结构破坏、纤维组织增生明显, 大量胶原包绕细胞形成纤维间隔, 部分细胞呈空泡样变性; 秋水仙碱组大鼠肝组织空泡样变性明显, 亦可见大量胶原包绕组织形成纤维间隔; 中药低剂量组大鼠肝小叶亦可见大量胶原包绕细胞形成纤维间隔, 部分细胞空泡样变性; 中药高剂量组、中药中剂量组肝组织正常结构破坏程度较轻, 部分细胞脂滴形成, 可见部分胶原纤维形成, 纤维间隔形成程度较造模组、秋水仙碱组轻(图2).
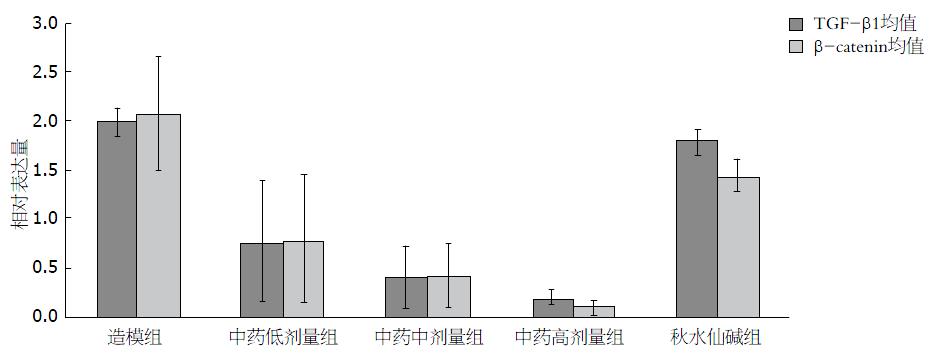
中药高剂量组、中剂量组TGF-β1 mRNA表达低于造模组(P<0.01,P<0.05)及秋水仙碱组(P<0.01, P<0.05). 中药3组β-catenin mRNA表达水平明显低于造模组(P<0.01); 中药高剂量组、中剂量组低于秋水仙碱组(P<0.01, P<0.05)(表3, 图3).
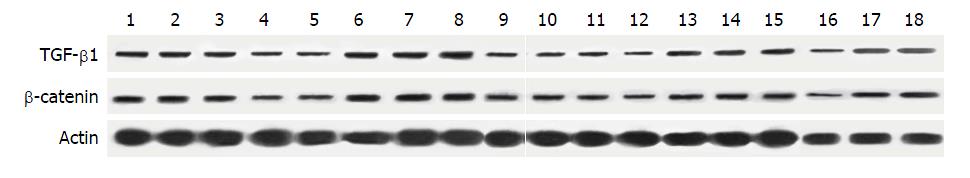
TGF-β1蛋白质表达检测结果如下: 造模组的蛋白质表达情况明显高于正常组(P<0.01)、秋水仙碱组蛋白质表达高于正常组(P<0.05)、中药高剂量组的蛋白质表达情况明显低于正常组(P<0.01); 造模组TGF-β1的蛋白质表达情况明显高于其他5组(P<0.01); 中药高剂量组、中药中剂量组的蛋白质表达情况明显低于秋水仙碱组(P<0.01); 中药高剂量组蛋白质表达明显少于中药中剂量、中药低剂量组(P<0.01). β-catenin蛋白质表达结果如下: 造模组的蛋白质表达情况明显高于正常组(P<0.01)、中药高剂量组的蛋白质表达情况明显低于正常组(P<0.01); 造模组蛋白质表达情况明显高于其他5组(P<0.01); 中药高剂量组、中药中剂量组的蛋白质表达情况明显低于秋水仙碱组(P<0.01); 中药高剂量组蛋白质表达情况低于中药中剂量组(P<0.05)(表4, 图4).
肝纤维化是现代医学病理形态学概念, 中医学并无此病名, 但从中医辨证的角度看, 肝纤维化过程中具有胁肋部胀痛, 黄疸、胁下积块等临床表现, 有中医瘀血或积聚痞块的特征, 可归属于"胁痛"、"痞满"、"黄疸"、"积聚"、"癥瘕"等病范畴. 其病机关键是湿热疫毒留恋, 肝脾肾俱损, 以致湿浊瘀热互结, 肝络受损. 肝纤维化发病机制虽然复杂, 但大多认为湿热毒蕴是其始动因素并持续存在, 正气虚弱是内因和转归, 肝络瘀阻是其病理基础[2,3]. 针对其湿、毒、热、瘀互结病机, 我们采用清热祛湿活血立方的加味茵芍散在临床上治疗肝纤维化取得一定疗效. 该方中黄芩、茵陈、炒栀子清热祛湿, 厚朴行气燥湿, 桃仁、丹参活血祛瘀, 白花蛇舌草清热解毒, 甘草、党参补脾益气, 黄芪健脾补中, 醋鳖甲滋阴潜阳, 白芍养血敛阴, 全方共奏清热祛湿活血之功效.
TGF-β1与细胞膜受体结合后, 依赖或不依赖细胞核内Smad蛋白与DNA的结合, 传递细胞信号. 该通路不仅参与调控生物体免疫调节、血管形成、创伤愈合等生理过程, 也与组织纤维化、癌症等疾病的发生发展相关联. TGF-β1在慢性炎症性疾病纤维化形成的过程中起到非常重要的作用, 其特征性功能为增加ECM组分的合成, 参与间质细胞的增殖、迁移和积累[4]. 肝脏在慢性炎性损伤后, 由免疫细胞、星状细胞和上皮细胞分泌的TGF-β1, 通过TGF-β1/Smad通路激活了肝星状细胞, 并促进肝星状细胞向肌成纤维细胞的分化, 诱导α1(Ⅰ)和α2(Ⅰ)胶原的基因转录, 刺激ECM组分的合成和沉积, 这些是肝纤维化的形成过程中不可缺少的重要步骤, 因此可以认为TGF-β1是肝星状细胞中有效的促进纤维发生的细胞因子[5-7], 结合Ⅰ型和Ⅱ型细胞膜表面受体后激活了形成纤维化的TGF-β1/Smad细胞通路[8], 促进肝纤维化的形成. TGF-β1在肝纤维化患者的肝脏组织中的表达与正常肝组织相比有所增加, 并且TGF-β1的mRNA的表达水平与炎症的程度相关[9]. 抑制TGF-β1的表达后, 可见Ⅰ型和Ⅲ型胶原蛋白表达减少[10]. 因TGF-β在肝纤维化形成过程中起到了重要的作用, 持续激活的TGF-β通路可诱导ECM组分的产生, 故调节TGF-β的表达的水平能成为肝纤维化的治疗的靶目标[11]. 因此具有抗纤维化作用的药物均可通过减少肝纤维化大鼠肝组织内TGF-β1、Smad3、α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)、Ⅰ-Ⅲ型胶原蛋白的表达, 达到抗肝纤维化的目的[12,13].
Wnt蛋白与细胞膜表面卷曲样蛋白(Frizzled proteins)和低密度脂蛋白受体相关蛋白家族(low-density lipoprotein receptor related protein, LRP)相结合, 将信号传给Dishevelled(Dsh), 活化的Dsh抑制由轴蛋白Axin、APC蛋白、糖原合成酶激酶3β(glycogen synthase kinase-3β, GSK-3β)组成的复合物的活性, 使胞浆内β-catenin蛋白不能被磷酸化而积累并且与转录因子T细胞因子/淋巴增强因子(T cell factor/lymphoid enhancer factor, TCF/LEF)结合, 最终调节靶基因的表达. Wnt/β-catenin通路参与胚胎发育过程以及组织干细胞的更新和分化, 激活的Wnt/β-catenin通路与肿瘤、阿尔兹海默病等疾病相关, 也参与到器官纤维化的形成过程中[14-17]. 已有研究证实在肝纤维化的过程中可观察到Wnt/β-catenin通路的异常活性. 激活的Wnt通路除了可明显激活肝星状细胞并促进肝星状细胞向肌成纤维细胞的分化外, 也可减少肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL)诱导的肝星状细胞的凋亡[18,19]. 作为Wnt/β-catenin通路的核心组分β-catenin, 调节β-catenin在胞浆内的稳定以及胞核内的累积是激活该通路的最重要环节. 在活化的肝星状细胞(hepatic stellate cell, HSC)中, 不仅观察到细胞内存在着Wnt和Fz的基因的表达和细胞核内β-catenin累积的增加, 亦能观察到β-catenin、TCF与DNA结合增加, 上调促进纤维化的基因的表达[20-22]. 细胞核内β-catenin的蛋白质水平增加后, 可诱导体外培养的肝星状细胞的增殖以及α-SMA、Ⅰ型胶原蛋白的表达; 反之则使激活状态的肝星状细胞恢复成静止状态, 并诱导了肝星状细胞的凋亡[23-25], 以及减少胶原蛋白的合成[26]、改善肝纤维化的发展[27]. 而不少具有抗纤维化作用的化合物, 均可通过减少组织中β-catenin和α-SMA的蛋白质表达水平, 来减轻肝纤维化的发生发展[28,29]. 另外有研究[30]证实, Wnt/β-catenin通路和TGF-β通路之间存在着信号相互作用, β-catenin和TGF-β可协同调节相同基因的表达.
本次实验以成年♂Wistar大鼠为研究对象, 结果显示, 经过造模及中药、秋水仙碱灌胃干预后, 中药中、高剂量组大鼠肝纤维化四项血清指标情况较造模组、秋水仙碱组好转; 通过HE染色和Masson染色观察到给予中药干预后, 大鼠肝细胞空泡样变性减轻, 胶原纤维的沉积和纤维组织增生减少. 以上结果证实基于清热祛湿活血立法的加味茵芍散在减轻肝纤维化的程度上效果优于秋水仙碱. 另外在给予加味茵芍散灌胃的大鼠肝脏组织内TGF-β1、β-catenin在mRNA和蛋白质表达水平上均低于造模组和秋水仙碱组(P<0.01). 因此, 本研究表明, 基于清热祛湿活血立法的加味茵芍散对大鼠肝纤维化有一定的逆转作用, 其作用机制可能与下调和抑制TGF-β1和β-catenin的表达, 从而阻断TGF-β1、Wnt/β-catenin细胞通路的激活有关.
目前已证实多条细胞通路参与到肝星状细胞的激活、细胞外基质(extracellular matrix)分泌的过程中, 其中最主要的细胞通路为转化生长因子-β1(transforming growth factor-β1, TGF-β1)/Smads通路. 新近发现Wnt/β-连环蛋白(β-catenin)通路亦参与到肝星状细胞的激活、肝纤维化形成过程中.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所
既往的临床研究发现基于清热祛湿活血立法的加味茵芍散治疗慢性肝炎和肝纤维化有一定疗效, 可缓解和/或逆转肝纤维化患者肝纤维化进展. 本实验旨在通过观察中药干预对大鼠TGF-β1、β-catenin mRNA和蛋白质的表达情况的影响, 进一步探讨清热祛湿活血法抗肝纤维化的分子机制.
国内李文庭等在研究肝纤维化分子机制中发现, 在肝纤维化的大鼠肝组织中, 明显可见β-catenin的表达; 活化的肝星状细胞(hepatic stellate cell, HSC)-T6细胞株亦可见β-catenin蛋白的表达; β-catenin也参与到TGF-β1/Smad3通路致肝纤维化的过程中, 通过1 ng/mL TGF-β1刺激2 h后, HSC表达β-catenin mRNA、Smad3 mRNA和α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)mRNA量最大, β-catenin mRNA表达与两者均具有明显的相关关系.
针对近年来对肝纤维化的中医病因病机的认识, 制定清热祛湿活血的治法并探讨该治法抗肝纤维化机制可更好地为临床用药提供理论依据, 为中医药防治肝纤维化寻找新的作用靶点和途径.
近年来中医药在抗肝纤维化治疗中已显示出较大优势和潜力, 探讨基于清热祛湿活血立法的加味茵芍散缓解和/或逆转肝纤维化患者肝纤维化进展的分子机制, 可更好地为中医药防治肝纤维化寻找新的作用靶点和途径.
典型Wnt/β-catenin信号通路: 通路激活核内靶基因的表达; Wnt家族分泌蛋白、Frizzled家族跨膜受体蛋白Dishevelled、糖原合成激酶3、APC、Axin、β-catenin及T细胞因子/淋巴增强因子家族转录调节因子等构成了经典通路.
该研究内容丰富, 具有一定的创新性, 方法先进, 实验数据支持研究结论.
编辑: 韦元涛 电编:都珍珍
| 4. | Pohlers D, Brenmoehl J, Löffler I, Müller CK, Leipner C, Schultze-Mosgau S, Stallmach A, Kinne RW, Wolf G. TGF-beta and fibrosis in different organs - molecular pathway imprints. Biochim Biophys Acta. 2009;1792:746-756. [PubMed] [DOI] |
| 5. | Zhang S, Sun WY, Wu JJ, Wei W. TGF-β signaling pathway as a pharmacological target in liver diseases. Pharmacol Res. 2014;85:15-22. [PubMed] [DOI] |
| 6. | Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. Best Pract Res Clin Gastroenterol. 2011;25:195-206. [PubMed] [DOI] |
| 7. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] [DOI] |
| 8. | Mann J, Mann DA. Transcriptional regulation of hepatic stellate cells. Adv Drug Deliv Rev. 2009;61:497-512. [PubMed] [DOI] |
| 9. | Li L, Wu T, Huang J, Ma K, Xu L, Wang H, Fan X, Tao R, Ai G, Ning Q. Expression of heat shock protein 47, transforming growth factor-beta 1, and connective tissue growth factor in liver tissue of patients with Schistosoma japonicum-induced hepatic fibrosis. Parasitology. 2015;142:341-351. [PubMed] [DOI] |
| 10. | Lang Q, Liu Q, Xu N, Qian KL, Qi JH, Sun YC, Xiao L, Shi XF. The antifibrotic effects of TGF-β1 siRNA on hepatic fibrosis in rats. Biochem Biophys Res Commun. 2011;409:448-453. [PubMed] [DOI] |
| 11. | Hayashi H, Sakai T. Biological Significance of Local TGF-β Activation in Liver Diseases. Front Physiol. 2012;3:12. [PubMed] [DOI] |
| 12. | Pérez-Vargas JE, Zarco N, Shibayama M, Segovia J, Tsutsumi V, Muriel P. Hesperidin prevents liver fibrosis in rats by decreasing the expression of nuclear factor-κB, transforming growth factor-β and connective tissue growth factor. Pharmacology. 2014;94:80-89. [PubMed] [DOI] |
| 13. | Sferra R, Vetuschi A, Catitti V, Ammanniti S, Pompili S, Melideo D, Frieri G, Gaudio E, Latella G. Boswellia serrata and Salvia miltiorrhiza extracts reduce DMN-induced hepatic fibrosis in mice by TGF-beta1 downregulation. Eur Rev Med Pharmacol Sci. 2012;16:1484-1498. [PubMed] |
| 14. | Ye B, Ge Y, Perens G, Hong L, Xu H, Fishbein MC, Li F. Canonical Wnt/β-catenin signaling in epicardial fibrosis of failed pediatric heart allografts with diastolic dysfunction. Cardiovasc Pathol. 2013;22:54-57. [PubMed] [DOI] |
| 15. | Huang C, Ogawa R. Fibroproliferative disorders and their mechanobiology. Connect Tissue Res. 2012;53:187-196. [PubMed] [DOI] |
| 16. | Beyer C, Reichert H, Akan H, Mallano T, Schramm A, Dees C, Palumbo-Zerr K, Lin NY, Distler A, Gelse K. Blockade of canonical Wnt signalling ameliorates experimental dermal fibrosis. Ann Rheum Dis. 2013;72:1255-1258. [PubMed] [DOI] |
| 17. | Dees C, Distler JH. Canonical Wnt signalling as a key regulator of fibrogenesis - implications for targeted therapies? Exp Dermatol. 2013;22:710-713. [PubMed] [DOI] |
| 18. | Myung SJ, Yoon JH, Gwak GY, Kim W, Lee JH, Kim KM, Shin CS, Jang JJ, Lee SH, Lee SM. Wnt signaling enhances the activation and survival of human hepatic stellate cells. FEBS Lett. 2007;581:2954-2958. [PubMed] [DOI] |
| 19. | Tsukamoto H, She H, Hazra S, Cheng J, Miyahara T. Anti-adipogenic regulation underlies hepatic stellate cell transdifferentiation. J Gastroenterol Hepatol. 2006;21 Suppl 3:S102-S105. [PubMed] [DOI] |
| 20. | Tsukamoto H, Zhu NL, Wang J, Asahina K, Machida K. Morphogens and hepatic stellate cell fate regulation in chronic liver disease. J Gastroenterol Hepatol. 2012;27 Suppl 2:94-98. [PubMed] [DOI] |
| 21. | Cheng JH, She H, Han YP, Wang J, Xiong S, Asahina K, Tsukamoto H. Wnt antagonism inhibits hepatic stellate cell activation and liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2008;294:G39-G49. [PubMed] [DOI] |
| 22. | Arellanes-Robledo J, Reyes-Gordillo K, Shah R, Domínguez-Rosales JA, Hernández-Nazara ZH, Ramirez F, Rojkind M, Lakshman MR. Fibrogenic actions of acetaldehyde are β-catenin dependent but Wingless independent: a critical role of nucleoredoxin and reactive oxygen species in human hepatic stellate cells. Free Radic Biol Med. 2013;65:1487-1496. [PubMed] [DOI] |
| 23. | Behari J. The Wnt/β-catenin signaling pathway in liver biology and disease. Expert Rev Gastroenterol Hepatol. 2010;4:745-756. [PubMed] [DOI] |
| 24. | Yin X, Yi H, Wu W, Shu J, Wu X, Yu L. R-spondin2 activates hepatic stellate cells and promotes liver fibrosis. Dig Dis Sci. 2014;59:2452-2461. [PubMed] [DOI] |
| 25. | Xinguang Y, Huixing Y, Xiaowei W, Xiaojun W, Linghua Y. R-spondin1 arguments hepatic fibrogenesis in vivo and in vitro. J Surg Res. 2015;193:598-605. [PubMed] [DOI] |
| 26. | Ge WS, Wang YJ, Wu JX, Fan JG, Chen YW, Zhu L. β-catenin is overexpressed in hepatic fibrosis and blockage of Wnt/β-catenin signaling inhibits hepatic stellate cell activation. Mol Med Rep. 2014;9:2145-2151. [PubMed] [DOI] |
| 27. | MadanKumar P, NaveenKumar P, Manikandan S, Devaraj H, NiranjaliDevaraj S. Morin ameliorates chemically induced liver fibrosis in vivo and inhibits stellate cell proliferation in vitro by suppressing Wnt/β-catenin signaling. Toxicol Appl Pharmacol. 2014;277:210-220. [PubMed] [DOI] |
| 28. | Li W, Zhu C, Chen X, Li Y, Gao R, Wu Q. Pokeweed antiviral protein down-regulates Wnt/β-catenin signalling to attenuate liver fibrogenesis in vitro and in vivo. Dig Liver Dis. 2011;43:559-566. [PubMed] [DOI] |
| 29. | Cui L, Jia X, Zhou Q, Zhai X, Zhou Y, Zhu H. Curcumin affects β-catenin pathway in hepatic stellate cell in vitro and in vivo. J Pharm Pharmacol. 2014;66:1615-1622. [PubMed] [DOI] |
| 30. | Lam AP, Gottardi CJ. β-catenin signaling: a novel mediator of fibrosis and potential therapeutic target. Curr Opin Rheumatol. 2011;23:562-567. [PubMed] [DOI] |