修回日期: 2015-04-15
接受日期: 2015-04-24
在线出版日期: 2015-06-08
目的: 探讨八聚体结合转录因子4蛋白(octamerbinding transcription factor-4, Oct4)与Smad1(drosophila mothers against decapentaplegic protein-1)和Smad2在胃癌和胃正常组织(距癌组织边缘10 cm以上)中的表达及其相互作用.
方法: 收集60例胃癌(腺癌)组织和25例胃正常组织(距癌组织边缘10 cm以上), 应用qRT-PCR技术检测Oct4、smad1和smad2基因在组织中的表达情况, 应用Western blot蛋白印迹技术检测Oct4、Smad1和Smad2蛋白的表达情况.
结果: 在胃癌组织中Oct4的表达明显高于胃正常组织(P<0.05), 在高、中分化胃癌的表达低于低分化胃癌的表达(P<0.05), Oct4的表达随肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期的升高而增高(P<0.05), 伴有淋巴结转移的胃癌组织中Oct4较无转移病例表达高(P<0.05); Smad1、Smad2在正常胃组织表达明显高于胃癌组织(P<0.05), 高、中分化胃癌的表达高于低分化胃癌的表达(P<0.05), 胃癌组织中Smad1、Smad2的表达随TNM分期的升级而降低(P<0.05), 伴有淋巴结转移的胃癌组织Smad1、Smad2较无转移病例表达低(P<0.05); 上述3个指标与患者年龄及性别均无统计学意义(P>0.05); Oct4与Smad1呈负相关(r = -0.882, P<0.05); Oct4与Smad2呈负相关(r = -0.859, P<0.05); Smad1与Smad2呈正相关(r = 0.905, P<0.05).
结论: Oct4、Smad1与Smad2的改变与胃癌的发生、发展密切相关. 因此, Oct4可能为胃癌的靶向治疗提供新药物作用靶点.
核心提示: 八聚体结合转录因子4蛋白(octamer-binding transcription factor-4, Oct4)的分子机制可能调控胃癌细胞的增殖分化及侵袭转移, 并且可能参与骨形态发生蛋白(bone morphogenetic protein)和转化生长因子-β(transforming growth factor-β)信号通路对于肿瘤的作用. 所以Oct4和Smad(drosophila mothers against decapentaplegic protein)1、Smad2的交互作用及对话与胃癌的发生发展有密切的关系.
引文著录: 郝美玲, 李春辉. Oct4、Smad1和Smad2在胃癌中的表达及相关性. 世界华人消化杂志 2015; 23(16): 2539-2548
Revised: April 15, 2015
Accepted: April 24, 2015
Published online: June 8, 2015
AIM: To detect the expression of octamer-binding transcription factor-4 (Oct4) and drosophila mothers against decapentaplegic protein (Smad) 1 and 2 in gastric cancer, and to discuss their interactions.
METHODS: We collected 60 cases of gastric cancer (adenocarcinoma) and 25 cases of normal gastric tissue (above 10 cm from the tumor edge) to detect Oct4, Smad1 and Smad2 gene expression by quantitative real-time PCR technique and protein expression by Western blot.
RESULTS: Oct4 expression was significantly higher in gastric cancer than in normal gastric tissue (P < 0.05). Oct4 expression was significantly lower in well and moderately differentiated gastric cancer than in poorly differentiated gastric cancer (P < 0.05). Oct4 expression increased along with the increase of TNM stage (P < 0.05). Oct4 expression was significantly higher in gastric cancer with lymph node metastasis than in without (P < 0.05). Smad1 and Smad2 expression was significantly higher in normal gastric tissue than in gastric cancer (P < 0.05). Smad1 and Smad2 expression was significantly higher in well and moderately differentiated gastric cancer than in poorly differentiated gastric cancer (P < 0.05). Smad1 and Smad2 expression decreased along with the increase of TNM stage (P < 0.05). Smad1 and Smad2 expression was significantly lower in gastric cancer with lymph node metastasis than in without (P < 0.05). All the above three indicators had no significant correlation with age or gender (P > 0.05); Oct4 expression was correlated negatively with Smad1 (r = -0.882, P < 0.05) and Smad2 expression (r = -0.859, P < 0.05); Smad1 expression was correlated positively with Smad2 expression (r = 0.905, P < 0.05).
CONCLUSION: Oct4, Smad1 and Smad2 expression may be closely related to the occurrence and development of gastric cancer, and therefore, they may be used as new drug targets for targeted therapy of gastric cancer.
- Citation: Hao ML, Li CH. Expression of Oct4, Smad1 and Smad2 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(16): 2539-2548
- URL: https://www.wjgnet.com/1009-3079/full/v23/i16/2539.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i16.2539
八聚体结合转录因子4蛋白(octamer-binding transcription factor-4, Oct4)早期发现于胚胎干细胞[1-3]中, 但是随着研究的深入, 在乳腺癌细胞、胃癌细胞等中也有表达. Oct4作为重要的转录因子, 调控细胞的自我更新, 提示Oct4可能通过某些信号通路发挥调控细胞增殖更新的能力[1,2,4]. 骨形态发生蛋白(bone morphogenetic protein, BMP)信号通路通过经典的Smad(drosophila mothers against decapentaplegic protein)信号通路传递信号, 维持肠上皮细胞的增殖与分化的平衡, 如这种抑制作用被破坏, 则细胞可以进行无限制的增殖分化甚至癌变[5,6]. 转化生长因子-β(transforming growth factor-β, TGF-β)信号通路参与胚胎的发育、胞外基质形成和抑制机体免疫反应等过程, 这些都为癌细胞提供有利的微环境, 促进癌细胞的生长浸润及转移[7,8]. 目前, 对于Oct4在胃癌的发生发展[9,10]中可能介导BMP和TGF-β信号通路的研究尚未见报道, 本实验通过研究Oct4、Smad1和Smad2在正常胃组织及胃癌中的表达来分析三者与胃癌分化程度、淋巴结转移及肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期的关系及三者之间的相互关系, 来研究胃癌组织中Oct4介导BMP和TGF-β信号传导通路交互对话对胃癌的发生、发展及预后, 同时也为临床治疗胃癌提供潜在的作用靶点.
本实验标本取自2013-01/2014-01承德医学院附属医院手术切除的新鲜胃癌组织60例及其相对应癌旁正常组织25例, 术后经病理检查确诊. 男23例、女37例, 年龄39-80岁(58.07岁±7.82岁), 高-中分化腺癌27例、低分化腺癌33例; 有淋巴结转移者31例、无淋巴结转移者29例; TNM分期Ⅰ+Ⅱ期17例、Ⅲ+Ⅳ期43例; 癌组织穿透浆膜者37例、未穿透者23例, 所有患者术前均未进行放疗、化疗和免疫治疗, 患者知情同意, 通过伦理委员会批准. 组织获得后立即置于-80 ℃超低温冰箱中冻存. 异丙醇、氯仿、乙醇、DEPC、10%SDS、Tris-HCL、过硫酸铵、PVDF膜、TBST、脱脂奶粉、1×电泳缓冲液及转膜缓冲液、显影粉和定影粉等均由承德医学院基础研究所分子生物实验室提供; TRIzol试剂购自宝生物工程(大连)有限公司; Oct4、Smad1和Smad2 Primer(表1), PrimeScript RT regent kit with gDNA Eraser(反转录试剂盒)和SYBR Primix ExTaqⅡ(实时荧光定量试剂盒)均购自宝生物工程(大连)有限公司; GAPDH引物(表1)购自武汉博士德生物工程有限公司; Oct4抗体、Smad1抗体和Smad2抗体均采用兔抗人单克隆抗体, 二抗为羊抗兔抗体; Oct4抗体购自Bioworld公司; Smad1和Smad2抗体和二抗均购自武汉博士德生物工程有限公司; β-actin抗体购自北京中杉金桥生物技术公司; BCA蛋白浓度测定试剂盒、裂解液及PMSF均购自Solarbio公司.
| 基因名称 | 引物序列 |
| Oct4 | 上游引物: 5'-GTGCCGTGAAGCTGGAGAA-3' |
| 下游引物: 5'-TGGTCGTTTGGCTGAATACCTT-3' | |
| Smad1 | 上游引物: 5'-ACAGTCTGTGAACCATGGATTTGA-3' |
| 下游引物: 5'-TGAGGTGAACCCATTTGAGTAAGAA-3' | |
| Smad2 | 上游引物: 5'-CATCAGCCAATGGCAAGTGAA-3' |
| 下游引物: 5'-AGAACAGGGTCTGCATCCATCATA-3' | |
| GAPDH | 上游引物: 5'-CCTCTGACTTCAACAGCGACA-3' |
| 下游引物: 5'-TGGTCCAGGGGTCTTACTCC-3' |
1.2.1 RNA的提取、反转录以及荧光实时定量PCR: 取出-80 ℃冰箱中冻存的新鲜组织称量后, 置于匀浆器内, 加入1 mL TRIzol充分匀浆, 冰上静置5 min, 加入氯仿, 摇匀后冰上静置5 min, 然后置于离心机中, 12000 r/min 4 ℃离心15 min, 取上清, 置于标注后的离心管内, 然后加入TRIzol的1/5体积的异丙醇, 摇匀后冰上静置3 min, 放入离心机中12000 r/min 4 ℃离心10 min, 弃上清, 用750 mL/L乙醇清洗2次, 分别离心10 min, 溶解于DEPC水中置于冰上待测. 测其RNA浓度. 计算后, 配成20 μL的反转录体系, 使得mRNA反转录成cDNA, 放于-20 ℃冰箱中备用. 取出cDNA, 加入PCR引物(PCR引物设计如表1), 按照实时荧光定量PCR说明书配成一定的PCR体系, 置于qRT-PCR仪进行PCR反应, 得出溶解曲线和扩增曲线及Ct值, 采用相对定量法2-△△Ct进行计算.
1.2.2 Western blot蛋白印迹: 取出-80 ℃超低温冰箱中冻存的新鲜组织, 称质量后置于匀浆器内, 于冰上加入裂解液和PMSF充分匀浆, 导入1.5 mL EP管中静置30 min, 置于离心机中5500 r/min 4 ℃离心20 min, 取上清移至新标注的EP管中. 应用BCA法测蛋白浓度, 分装冻存. 取出分装的蛋白加入上样缓冲液95 ℃水浴5 min后, 进行SDS-PAGE电泳(12%分离胶+5%浓缩胶), 当蛋白跑至浓缩胶与分离胶的交界时, 将电压由80 mV换至120 mV, 当蛋白电泳到分离胶的底部时, 停止电泳, 进行转膜, 恒流130 mA转2 h, 取出PVDF膜, 标记好, 再用5%封闭液进行封闭2 h, 然后加入一抗孵育1 h→过夜→1 h, 洗膜4次, 每次10 min, 加入二抗孵育1 h, 洗膜3次, 每次5 min, 后用ECL发光液进行显影. 采用Quantity one V462图像分析软件对蛋白电泳条带灰度值进行定量分析, 按照下列公式计算: 蛋白相对定量 = 目的蛋白灰度值/同标本β-actin内参灰度值.
统计学处理 实验数据为计量资料, 以mean±SD示, 采用SPSS17.0统计分析软件, 两个独立样本间比较用t检验, 多个样本间均数比较用方差分析, P<0.05为差异有统计学意义.
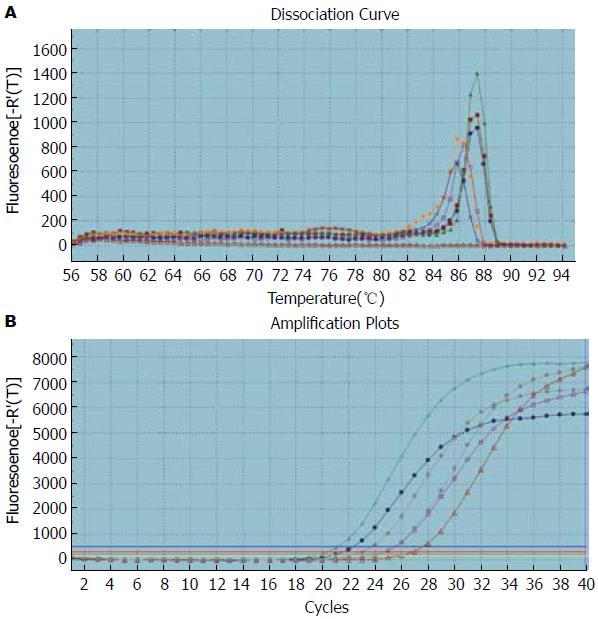
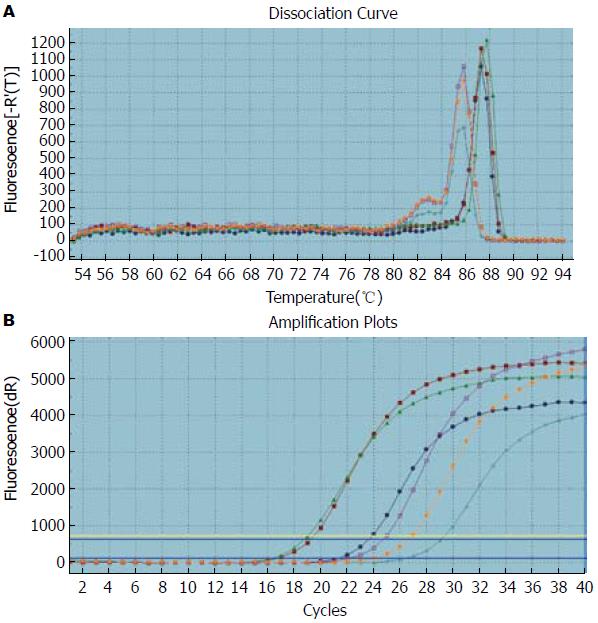
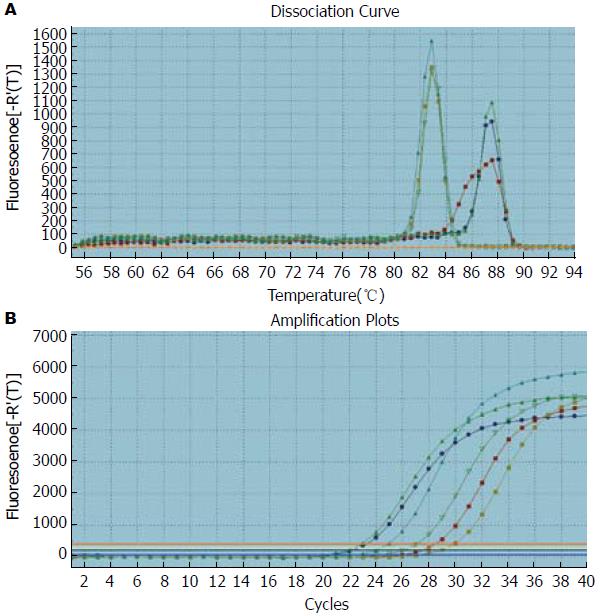
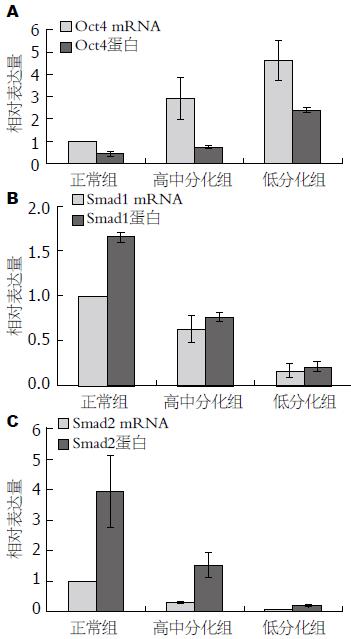
如图1-3所示, Oct4、Smad1和Smad2的扩增曲线和溶解曲线显示良好, 表明引物的特异性良好, 并且实时荧光定量PCR的结果可靠可取. 如图4, 5所示, Oct4在胃癌组织中的表达高于正常胃组织, 其中在低分化组中的表达明显高于高中分化组, 3组中两两比较差异有统计学意义(P<0.05); Smad1和Smad2在胃癌组织中的表达低于正常胃组织, 其中在低分化组中的表达明显低于高中分化组, 3组中两两比较差异有统计学意义(P<0.05).
如表2所示, Oct4与Smad1呈负相关; Oct4与Smad2呈负相关; Smad1与Smad2呈正相关.
| 指标 | Oct4 | Smad1 | Smad2 | |
| Oct4 | Person相关性 | 1.000 | -0.882 | -0.859 |
| 显著性 | 0.000 | 0.000 | ||
| Smad1 | Person相关性 | -0.882 | 1.000 | 0.905 |
| 显著性 | 0.000 | 0.000 | ||
| Smad2 | Person相关性 | -0.859 | 0.905 | 1.000 |
| 显著性 | 0.000 | 0.000 |
如表3, 4所示, Oct4、Smad1和Smad2三者的表达与年龄和性别无关(均P>0.05); 就分化程度而言, Oct4在高中分化组中的表达明显低于低分化组, 差异有统计学意义(P<0.05), 而Smad1和Smad2在高中分化组中的表达高于低分化组, 差异有统计学意义(P<0.05); 在胃癌组中Oct4的表达随着TNM分期的提高而升高, Ⅰ+Ⅱ期与Ⅲ+Ⅳ期两组比较差异有统计学意义(P<0.05), 而Smad1和Smad2的表达在胃癌组中随着TNM分期的提高而降低, Ⅰ+Ⅱ期与Ⅲ+Ⅳ期两组比较差异有统计学意义(P<0.05); 就淋巴结有无转移而言, Oct4在高中分化组中的表达明显低于低分化组, 差异有统计学意义(P<0.05), 而Smad1和Smad2在高中分化组中的表达高于低分化组, 差异有统计学意义(P<0.05); 就癌组织有无侵及浆膜层而言, Oct4在高中分化组中的表达明显低于低分化组, 差异有统计学意义(P<0.05), 而Smad1和Smad2在高中分化组中的表达高于低分化组, 差异有统计学意义(P<0.05).
| 临床特征 | n | Oct4 mRNA | t值 | P值 | Smad1 mRNA | t值 | P值 | Smad2 mRNA | t值 | P值 |
| 年龄(岁) | 0.42 | 0.67 | 0.46 | 0.64 | 0.46 | 0.89 | ||||
| >56 | 35 | 3.78±1.31 | 0.39±0.09 | 0.17±0.03 | ||||||
| ≤56 | 25 | 3.92±1.21 | 0.36±0.11 | 0.16±0.07 | ||||||
| 性别 | 2.40 | 0.18 | 0.73 | 0.47 | 0.73 | 0.21 | ||||
| 男 | 37 | 3.54±1.18 | 0.40±0.14 | 0.18±0.07 | ||||||
| 女 | 23 | 4.32±1.26 | 0.35±0.13 | 0.13±0.04 | ||||||
| 组织学分型 | 7.14 | 0.00 | 15.64 | 0.00 | 15.64 | 0.00 | ||||
| 高中分化 | 27 | 2.89±0.93 | 0.63±0.15 | 0.30±0.05 | ||||||
| 低分化 | 33 | 4.61±0.92 | 0.17±0.08 | 0.06±0.01 | ||||||
| 临床分期 | 4.24 | 0.00 | 2.30 | 0.00 | 2.30 | 0.02 | ||||
| Ⅰ+Ⅱ期 | 17 | 3.13±1.16 | 0.47±0.16 | 0.21±0.03 | ||||||
| Ⅲ+Ⅳ期 | 43 | 4.37±1.06 | 0.32±0.14 | 0.13±0.03 | ||||||
| 浆膜浸润 | 3.69 | 0.00 | 5.06 | 0.00 | 5.06 | 0.00 | ||||
| 有 | 37 | 3.13±1.22 | 0.56±0.22 | 0.27±0.09 | ||||||
| 无 | 23 | 4.28±1.06 | 0.27±0.11 | 0.09±0.01 | ||||||
| 淋巴结转移 | 1.73 | 0.04 | 3.68 | 0.00 | 3.68 | 0.00 | ||||
| 有 | 31 | 3.57±1.36 | 0.49±0.20 | 0.21±0.07 | ||||||
| 无 | 29 | 4.12±1.10 | 0.27±0.10 | 0.11±0.04 |
| 临床特征 | n | Oct4蛋白 | t值 | P值 | Smad1蛋白 | t值 | P值 | Smad2蛋白 | t值 | P值 |
| 年龄(岁) | 0.29 | 0.77 | 0.37 | 0.71 | 0.37 | 0.98 | ||||
| >56 | 35 | 1.63±0.63 | 0.47±0.21 | 0.78±0.25 | ||||||
| ≤56 | 25 | 1.70±0.57 | 0.44±0.18 | 0.79±0.20 | ||||||
| 性别 | 1.50 | 0.14 | 1.20 | 0.24 | 1.20 | 0.24 | ||||
| 男 | 37 | 1.53±0.64 | 0.49±0.27 | 0.85±0.40 | ||||||
| 女 | 23 | 1.86±0.82 | 0.40±0.29 | 0.69±0.19 | ||||||
| 组织学分型 | 74.49 | 0.00 | 43.05 | 0.00 | 43.05 | 0.00 | ||||
| 高中分化 | 27 | 0.74±0.07 | 0.76±0.05 | 1.51±0.41 | ||||||
| 低分化 | 33 | 2.41±0.10 | 0.21±0.05 | 0.19±0.04 | ||||||
| 临床分期 | 2.46 | 0.02 | 2.20 | 0.03 | 2.20 | 0.03 | ||||
| Ⅰ+Ⅱ期 | 17 | 1.37±0.80 | 0.54±0.27 | 0.94±0.33 | ||||||
| Ⅲ+Ⅳ期 | 43 | 1.88±0.81 | 0.39±0.07 | 0.67±0.27 | ||||||
| 浆膜浸润 | 6.68 | 0.00 | 7.02 | 0.00 | 7.02 | 0.00 | ||||
| 有 | 37 | 0.97±0.30 | 0.69±0.19 | 1.36±0.57 | ||||||
| 无 | 23 | 2.09±0.67 | 0.31±0.16 | 0.43±0.21 | ||||||
| 淋巴结转移 | 4.22 | 0.00 | 3.94 | 0.00 | 3.94 | 0.00 | ||||
| 有 | 31 | 1.27±0.79 | 0.58±0.27 | 1.07±0.52 | ||||||
| 无 | 29 | 2.08±0.69 | 0.32±0.09 | 0.58±0.20 |
Oct4作为胚胎干细胞的特异性基因, 参与维持胚胎细胞多潜能性和自我更新能力[3,4], 不仅仅表达于胚胎和生殖细胞癌中, 有研究者在非生殖细胞肿瘤和组织中也发现了Oct4的表达, 如肝癌Mahlava细胞系、宫颈癌Hela细胞株、乳腺癌MCF7细胞系等[11-14]. 本研究中, 正常组、高中分化组和低分化组中均有Oct4的表达, 证实了以上的结论, 说明Oct4在胃癌组织中确实有表达, 并且, 随着临床分期的进展, 表达越来越高, 差异具有统计学意义.
TGF-β超家族是一个包含众多成员的多功能大家族, 其中也存在大量的协同效应分子, 这也就决定了TGF-β信号通路调节的生物学效应的多样性[6]. Smads蛋白中的Smad1、5、8形成的多元复合物为BMP通路中的信号使者, 通过实验证实Smad1相较于Smad5和Smad8, 是BMP信号传导过程中不可或缺的响应元件[15-17]. Smad1通过介导BMP信号通路调节软骨与骨的形成、生殖与胚胎发育等过程, 并且激活的BMP信号Smad或是PTEN/PI3K/Akt通路等途径抑制Wnt信号的传递[18-23], 使成熟的肠上皮细胞走向凋亡, 维持肠道上皮细胞的增殖与分化的平衡. 所以BMP信号的过低或是失活可导致幼年性息肉病(juvenile polyposis syndrome, JPS)的病发, 并可能在遗传性的结肠癌的发生发展两方面起到重要的作用[5,6]. 值得一提的是, 本实验中Smad1在胃癌组织中低表达, 随着临床分期的进展和淋巴结的转移, 表达越来越低, 故我们推测BMP信号通路在胃癌的发生发展中可能也起到重要的作用. 在胃癌细胞中, BMP信号通路可能通过Smad途径激活某种信号通路或是直接激活某个靶基因调控细胞的分化与增殖, BMP信号受到抑制, 使得这种抑制作用减轻或是消失, 造成细胞无限制增殖分化. 我们还检测到, Smad1的表达与受检者的年龄和性别无关, 与临床分期、淋巴结有无转移和是否侵及浆膜层有关. 这一结果显示, BMP通路极有可能促进胃癌细胞的侵袭转移, 与胃癌的发展可能存在着重要的联系, 这需要进一步的实验证实.
Smad2与Smad1同属于TGF-β超家族, 在TGF-β信号通路中同样扮演着重要的角色. Smads蛋白是TβR-Ⅰ(type Ⅰ TGF-β receptor)的直接作用底物, 磷酸化后将信号从胞浆传递至核内, 然后与不同的转录因子结合作用于不同的靶基因, 调节其转录[24,25]. Smad2作为TGF-β信号通路中的响应元件, 如果其被降解或是缺失, 中断正常的信号传导, 细胞就能逃避TGF-β调节的生长抑制而发生癌变[25]. 本实验数据显示, 正常胃组织中Smad2的表达高于胃癌组, 其中高分化组高于低分化组, 随着临床分期的进展及淋巴结转移的出现, Smad2表达降低. 根据实验数据推测Smad2的表达降低, TGF-β信号传导中断, 抑制正常胃组织细胞生长增殖的作用降低或消失, 导致细胞无限增殖分化发生癌变. 有研究[24,26]显示, TGF-β信号通路也参与在免疫细胞的发育、分化和参与免疫应答等过程, TGF-β部分通过诱导转录因子Id3的表达介导对B细胞增殖的抑制效应, TGF-β信号通路的障碍也可能使肿瘤细胞产生免疫逃逸, 并且, TGF/Smad通路通过与多条通路间进行"对话", 其中与Wnt通路的"交谈", 可以共同协调完成肿瘤上皮间充质转化(epithelial to mesenchymal transition, EMT)的调节[27,28], 在肿瘤的EMT发生后, N-黏连蛋白表达增加, 促进肿瘤细胞的运动和转移作用[12,13], 本实验数据也证实, Smad2的表达与胃癌有无淋巴结转移、临床分期和是否侵及浆膜层有极其密切的联系, 据此, 我们推测在胃癌的发生发展中, 癌细胞转移浸润的过程有TGF-β信号的参与, 并且发挥着不可或缺的作用.
生物信息学研究发现Oct4可能是某个或是某些TGF-β基因的调控基因. 有研究[29-31]用TetOP-Oct4转基因小鼠证明了Oct4的持续表达可导致多种上皮组织肿瘤样异型性改变, Oct4作为一种调控基因使某些信号通路发生障碍, 失去正常功能, 引起细胞生物学作用的改变. 通过我们对本实验数据进行整理, 也发现三者在胃癌组织和正常组织中的表达均有相关性, 如表2所示: Smad1和Smad2在胃癌组织和癌旁正常组织中二者的表达与Oct4彼此之间均存在相互关系或是调控作用. Oct4调控Smad1介导的BMP通路和Smad2介导的TGF-β信号通路, 对细胞增殖的抑制作用减小或消失, 过量增殖或癌变的细胞也可能发生免疫逃逸. 根据Oct4对于胃癌细胞的增殖分化及侵袭转移作用的分子机制, Oct4为再生医学和胃癌的治疗提供了新的依据, 而Oct4和Smad1、Smad2有望成为治疗胃癌新的作用靶点. 目前对于Oct4、Smad1和Smad2这三种元件的表达, 所导致的各个通路的障碍以及与其余通路的交互对话所引起的细胞内微环境的变化及细胞的增殖分化凋亡的影响并不是十分的明确, 故进一步的实验证实是有必要的, 例如对这三个指标的基因分别进行沉默或是突变, 观察另两个指标所受的影响, 本实验也为进一步的研究和临床研究提供了一定的理论基础. 根据肿瘤干细胞理论, Oct4在正常成体干细胞和肿瘤干细胞中仍有表达, 若Oct4为胃癌干细胞的表面标志, 推测Oct4发挥作用的机制也可能会调控BMP信号通路和TGF-β信号通路在细胞的增殖分化侵袭转移方面发挥作用.
中国胃癌发病率和死亡率总体呈上升趋势, 死亡率在世界范围内居首位, 因此胃癌发生发展机制的研究成为了热点问题. 八聚体结合转录因子4蛋白(octamer-binding transcription factor-4, Oct4)作为肿瘤干细胞的重要的调控分子, 调控Smad(drosophila mothers against decapentaplegic protein)1、Smad2这两种分子所在不同的信号通路的研究仍少见. 故此实验有一定的可行性的.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
Oct4作为存在于胚胎干细胞和肿瘤细胞中的重要调控信号, 他的分子机制研究是胃癌研究中的热点及重点, 其趋向于调控某个或多个分子通路的信号转导, 从而使得此信号通路的信号传导发生障碍, 不能下传或中断, 抑或是增强信号的传导.
Mamuya等研究表明转化生长因子-β(transforming growth factor-β, TGF-β)作为上皮间充质转化(epithelial to mesenchymal transition)中重要的启动信号, 所诱发形成肿瘤上皮间充质转化过程与整合素αV之间的交互调控, 并且不仅仅是简单的调控, 而是形成调控网络对其他信号通路进行干扰.
(1)本文研究了Oct4与骨形态发生蛋白(bone morphogenetic protein, BMP)和TGF-β两条信号传导通路的相互关系, 国内外尚未见报道; (2)通过研究Oct4与这两条信号通路的关系, 进而推断出Oct4有可能是胃癌发生发展中重要的作用靶点; (3)研究BMP和TGF-β两条信号传导通路在胃癌中的相互关系.
推测Oct4发挥作用的机制也可能会调控BMP信号通路和TGF-β信号通路在细胞的增殖分化侵袭转移方面发挥作用. Oct4调控胃癌细胞的增殖分化及侵袭转移作用的分子机制, 有望为再生医学和胃癌的治疗提供新的依据, 而Oct4和Smad1、Smad2有望成为治疗胃癌新的作用靶点.
通过收集病例组织, 采用qRT-PCR技术和Western blot蛋白印迹技术进行检测Oct4、Smad1与Smad2的基因和蛋白. 三者的改变与胃癌的发生、发展密切相关, Oct4可能通过上调BMP信号通路中的Smad1和TGF-β信号通路中Smad2参与胃癌发生发展.
编辑: 韦元涛 电编:闫晋利
| 1. | Boo K, Bhin J, Jeon Y, Kim J, Shin HJ, Park JE, Kim K, Kim CR, Jang H, Kim IH. Pontin functions as an essential coactivator for Oct4-dependent lincRNA expression in mouse embryonic stem cells. Nat Commun. 2015;6:6810. [PubMed] [DOI] |
| 2. | Guseva D, Rizvanov AA, Salafutdinov II, Kudryashova NV, Palotás A, Islamov RR. Over-expression of Oct4 and Sox2 transcription factors enhances differentiation of human umbilical cord blood cells in vivo. Biochem Biophys Res Commun. 2014;451:503-509. [PubMed] [DOI] |
| 3. | Palmieri SL, Peter W, Hess H, Schöler HR. Oct-4 transcription factor is differentially expressed in the mouse embryo during establishment of the first two extraembryonic cell lineages involved in implantation. Dev Biol. 1994;166:259-267. [PubMed] [DOI] |
| 4. | Pesce M, Schöler HR. Oct-4: gatekeeper in the beginnings of mammalian development. Stem Cells. 2001;19:271-278. [PubMed] [DOI] |
| 5. | Feng Y, Wu H, Xu Y, Zhang Z, Liu T, Lin X, Feng XH. Zinc finger protein 451 is a novel Smad corepressor in transforming growth factor-β signaling. J Biol Chem. 2014;289:2072-2083. [PubMed] [DOI] |
| 6. | Mallano T, Palumbo-Zerr K, Zerr P, Ramming A, Zeller B, Beyer C, Dees C, Huang J, Hai T, Distler O. Activating transcription factor 3 regulates canonical TGFβ signalling in systemic sclerosis. Ann Rheum Dis. 2015; Jan 14. [Epub ahead of print]. [PubMed] [DOI] |
| 7. | Guo H, Bao Z, Li J, Lian S, Wang S, He Y, Fu X, Zhang L, Hu X. Molecular characterization of TGF-β type I receptor gene (Tgfbr1) in Chlamys farreri, and the association of allelic variants with growth traits. PLoS One. 2012;7:e51005. [PubMed] [DOI] |
| 8. | Fuyuhiro Y, Yashiro M, Noda S, Kashiwagi S, Matsuoka J, Doi Y, Kato Y, Hasegawa T, Sawada T, Hirakawa K. Upregulation of cancer-associated myofibroblasts by TGF-β from scirrhous gastric carcinoma cells. Br J Cancer. 2011;105:996-1001. [PubMed] [DOI] |
| 9. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 11. | Hu J, Qin K, Zhang Y, Gong J, Li N, Lv D, Xiang R, Tan X. Downregulation of transcription factor Oct4 induces an epithelial-to-mesenchymal transition via enhancement of Ca2+ influx in breast cancer cells. Biochem Biophys Res Commun. 2011;411:786-791. [PubMed] [DOI] |
| 12. | Schwede M, Spentzos D, Bentink S, Hofmann O, Haibe-Kains B, Harrington D, Quackenbush J, Culhane AC. Stem cell-like gene expression in ovarian cancer predicts type II subtype and prognosis. PLoS One. 2013;8:e57799. [PubMed] [DOI] |
| 13. | Elsir T, Edqvist PH, Carlson J, Ribom D, Bergqvist M, Ekman S, Popova SN, Alafuzoff I, Ponten F, Nistér M. A study of embryonic stem cell-related proteins in human astrocytomas: identification of Nanog as a predictor of survival. Int J Cancer. 2014;134:1123-1131. [PubMed] [DOI] |
| 14. | Darini CY, Pisani DF, Hofman P, Pedeutour F, Sudaka I, Chomienne C, Dani C, Ladoux A. Self-renewal gene tracking to identify tumour-initiating cells associated with metastatic potential. Oncogene. 2012;31:2438-2449. [PubMed] [DOI] |
| 15. | Sartori R, Sandri M. Bone and morphogenetic protein signalling and muscle mass. Curr Opin Clin Nutr Metab Care. 2015;18:215-220. [PubMed] [DOI] |
| 16. | Haramis AP, Begthel H, van den Born M, van Es J, Jonkheer S, Offerhaus GJ, Clevers H. De novo crypt formation and juvenile polyposis on BMP inhibition in mouse intestine. Science. 2004;303:1684-1686. [PubMed] [DOI] |
| 17. | Tasca A, Stemig M, Broege A, Huang B, Davydova J, Zwijsen A, Umans L, Jensen ED, Gopalakrishnan R, Mansky KC. Smad 1/5 and Smad 4 Expression Are Important for Osteoclast Differentiation. J Cell Biochem. 2015; Feb 24. [Epub ahead of print]. [PubMed] [DOI] |
| 18. | Peng J, Yoshioka Y, Mandai M, Matsumura N, Baba T, Yamaguchi K, Hamanishi J, Kharma B, Murakami R, Abiko K. The BMP signaling pathway leads to enhanced proliferation in serous ovarian cancer-a potential therapeutic target. Mol Carcinog. 2015; Feb 7. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Jee MJ, Yoon SM, Kim EJ, Choi HJ, Kim JW, Sung RH, Han JH, Chae HB, Park SM, Youn SJ. A novel germline mutation in exon 10 of the SMAD4 gene in a familial juvenile polyposis. Gut Liver. 2013;7:747-751. [PubMed] [DOI] |
| 20. | Yamaguchi J, Nagayama S, Chino A, Sakata A, Yamamoto N, Sato Y, Ashihara Y, Kita M, Nomura S, Ishikawa Y. Identification of coding exon 3 duplication in the BMPR1A gene in a patient with juvenile polyposis syndrome. Jpn J Clin Oncol. 2014;44:1004-1008. [PubMed] [DOI] |
| 21. | Fausett SR, Brunet LJ, Klingensmith J. BMP antagonism by Noggin is required in presumptive notochord cells for mammalian foregut morphogenesis. Dev Biol. 2014;391:111-124. [PubMed] [DOI] |
| 22. | Chen Y, Roohani-Esfahani SI, Lu Z, Zreiqat H, Dunstan CR. Zirconium ions up-regulate the BMP/SMAD signaling pathway and promote the proliferation and differentiation of human osteoblasts. PLoS One. 2015;10:e0113426. [PubMed] [DOI] |
| 23. | Liou SF, Hsu JH, Chu HC, Lin HH, Chen IJ, Yeh JL. KMUP-1 promotes osteoblast differentiation through cAMP and cGMP pathways and signaling of BMP-2/Smad1/5/8 and Wnt/β-catenin. J Cell Physiol. 2014; Dec 23. [Epub ahead of print]. [PubMed] [DOI] |
| 24. | Zhang T, Wen F, Wu Y, Goh GS, Ge Z, Tan LP, Hui JH, Yang Z. Cross-talk between TGF-beta/SMAD and integrin signaling pathways in regulating hypertrophy of mesenchymal stem cell chondrogenesis under deferral dynamic compression. Biomaterials. 2015;38:72-85. [PubMed] [DOI] |
| 25. | Kel JM, Girard-Madoux MJ, Reizis B, Clausen BE. TGF-beta is required to maintain the pool of immature Langerhans cells in the epidermis. J Immunol. 2010;185:3248-3255. [PubMed] [DOI] |
| 26. | Fleming NI, Jorissen RN, Mouradov D, Christie M, Sakthianandeswaren A, Palmieri M, Day F, Li S, Tsui C, Lipton L. SMAD2, SMAD3 and SMAD4 mutations in colorectal cancer. Cancer Res. 2013;73:725-735. [PubMed] [DOI] |
| 27. | Farrall AL, Riemer P, Leushacke M, Sreekumar A, Grimm C, Herrmann BG, Morkel M. Wnt and BMP signals control intestinal adenoma cell fates. Int J Cancer. 2012;131:2242-2252. [PubMed] [DOI] |
| 28. | Mamuya FA, Duncan MK. aV integrins and TGF-β-induced EMT: a circle of regulation. J Cell Mol Med. 2012;16:445-455. [PubMed] [DOI] |
| 29. | Morrison CD, Parvani JG, Schiemann WP. The relevance of the TGF-β Paradox to EMT-MET programs. Cancer Lett. 2013;341:30-40. [PubMed] [DOI] |
| 30. | Sabe H. Cancer early dissemination: cancerous epithelial-mesenchymal transdifferentiation and transforming growth factor β signalling. J Biochem. 2011;149:633-639. [PubMed] [DOI] |
| 31. | Kern U, Wischnewski V, Biniossek ML, Schilling O, Reinheckel T. Lysosomal protein turnover contributes to the acquisition of TGFβ-1 induced invasive properties of mammary cancer cells. Mol Cancer. 2015;14:39. [PubMed] [DOI] |