修回日期: 2015-04-19
接受日期: 2015-04-24
在线出版日期: 2015-06-08
目的: 探讨MST1(mammalian sterile 20-like kinase 1)在同型半胱氨酸(homocysteine, Hcy)促肝细胞凋亡中的作用.
方法: 动物水平: 实验分为4组, 每组12只小鼠. 正常对照组: 5周龄♂鼠(SPF级C57BL/6J)饲以普通饮食; ApoE-/-对照组: 5周龄♂纯合子ApoE-/-鼠饲以普通饮食; ApoE-/-高蛋氨酸组: 5周龄♂纯合子ApoE-/-鼠饲以高蛋氨酸饮食(普通饮食中加入1.7%蛋氨酸); ApoE-/-叶酸和维生素B12干预组: 5周龄♂纯合子ApoE-/-鼠饲以高蛋氨酸饮食加0.006%叶酸和0.0004%维生素B12. 喂养14 wk后, 全自动生化分析仪测定血清Hcy水平; 透射电镜、DAPI染色观察肝组织凋亡情况; 实时定量聚合酶链反应(qRT-PCR)及Western blot分别检测MST1 mRNA和蛋白表达水平. 细胞水平: 分为3组: 正常对照组(0 μmol/L Hcy); 高同型半胱氨酸(hyperhomocysteinemia, HHcy)组(100 μmol/L Hcy); 干预组(100 μmol/L Hcy+叶酸+维生素B12); 干预肝细胞48 h. AnnexinV-FITC/PI双标记流式细胞术检测肝细胞凋亡水平的变化; 实时定量聚合酶链反应(qRT-PCR)及Western blot分别检测MST1 mRNA和蛋白表达水平.
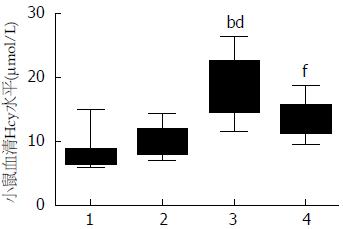
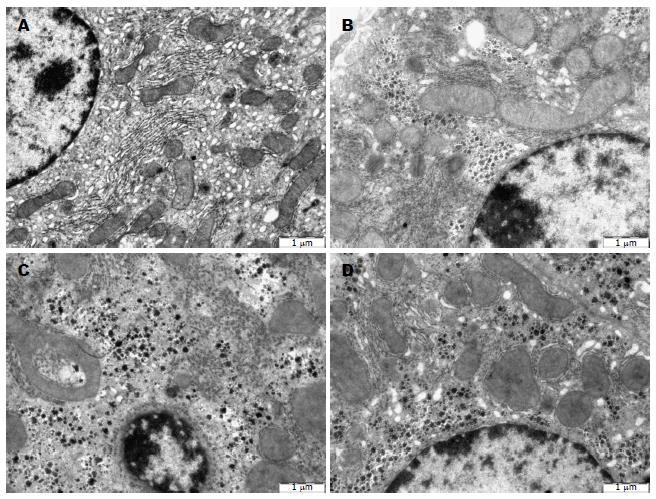
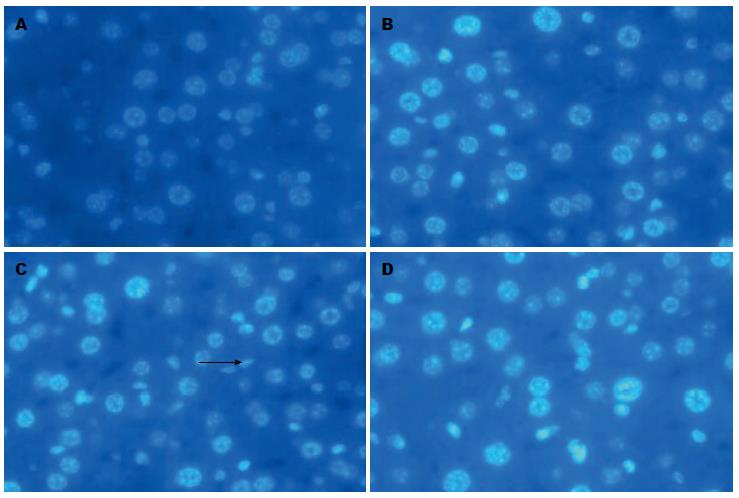
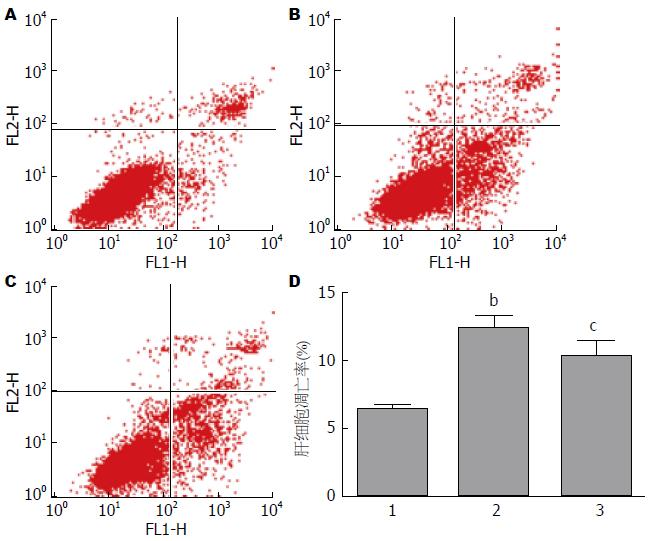
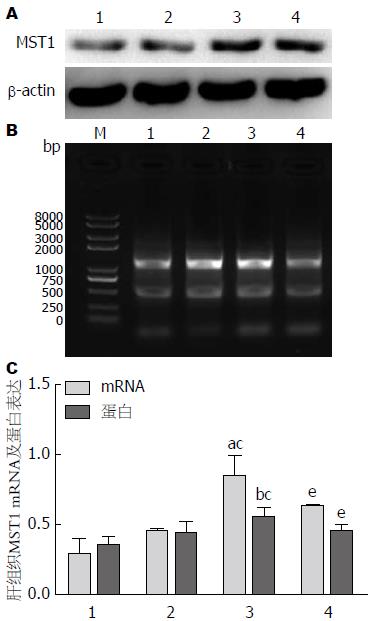
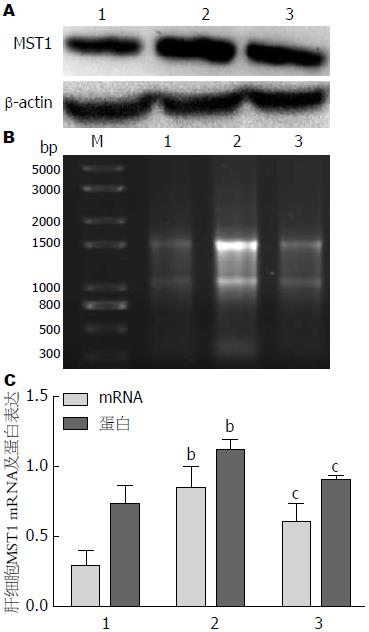
结果: 动物水平: (1)各组小鼠喂养20 wk后, 测定血清Hcy水平, ApoE-/-高蛋氨酸组血清Hcy水平分别是正常对照组和ApoE-/-对照组的2.3倍和1.9倍(P<0.01). 干预组血清Hcy水平较ApoE-/-高蛋氨酸组降低28%(P<0.01), 提示造HHcy模型成功; (2)电镜结果显示, ApoE-/-高蛋氨酸组小鼠肝细胞出现凋亡的倾向, 染色质凝聚浓缩或边缘化, 线粒体肿胀或浓缩、嵴断裂或变短, 粗面内质网和滑面内质网明显肿胀、断裂、连贯性破坏、核糖体脱落, 糖原溶解; (3)DAPI染色后观察, 正常对照组和ApoE-/-对照组中细胞核大小均一、核圆, 核膜光滑; ApoE-/-高蛋氨酸饮食组一些细胞出现核膜皱缩、细胞核呈现出各种不规则形状, 提示可能存在凋亡; ApoE-/-干预组较ApoE-/-高蛋氨酸组细胞核损伤有所减轻; (4)与正常对照组和ApoE-/-对照组相比, ApoE-/-高蛋氨酸组肝组织MST1 mRNA及蛋白表达水平增高(P<0.05或P<0.01), ApoE-/-干预组肝细胞MST1 mRNA及蛋白表达水平较ApoE-/-高蛋氨酸组有所降低(P<0.05). 细胞水平: (1)与正常对照组相比, HHcy组肝细胞凋亡水平增高(P<0.01), 干预组较HHcy组有所减轻(P<0.05); (2)与正常对照组相比, HHcy组肝细胞MST1 mRNA及蛋白表达水平增高(P<0.01), 干预组肝细胞MST1 mRNA及蛋白表达水平较HHcy组有所降低(P<0.05).
结论: 在HHcy促肝细胞凋亡过程中MST1表达上调, 且叶酸和维生素B12可以抑制其表达上调.
核心提示: 同型半胱氨酸(homocysteine)可促进肝细胞凋亡, 且MST1(mammalian sterile 20-like kinase1)在此过程中可能发挥作用.
引文著录: 孔繁琪, 马胜超, 赵丽, 和杨杨, 刘现梅, 周龙霞, 张辉, 张鸣号, 金少举, 姜怡邓. MST1在同型半胱氨酸促肝细胞凋亡过程中的表达及意义. 世界华人消化杂志 2015; 23(16): 2523-2531
Revised: April 19, 2015
Accepted: April 24, 2015
Published online: June 8, 2015
AIM: To study the role of the mammalian sterile 20-like kinase 1 (MST1) gene in homocysteine-induced hepatocyte apoptosis.
METHODS: Five-week-old C57BL/6J mice of SPF grade were divided into four groups: a normal control group, an ApoE-/- group, a high methionine diet group, and an intervention group (n = 12 each). In the normal control group, normal mice were fed a normal diet. In the ApoE-/- group, male ApoE-/- mice were fed a normal diet. In the high methionine diet group, male ApoE-/- mice were fed a high methionine diet. In the intervention group, male ApoE-/- mice were fed a high methionine diet plus folic acid and vitamin B12. Transmission electron microscopy and DAPI staining were used to determine the level of apoptosis in hepatic tissue. qRT-PCR and Western blot were used to determine the expression of MST1. Hepatocytes were then cultured in the presence or absence of homocysteine (100 μmol/L) alone or 100 μmol/L homocysteine plus folic acid and vitamin B12; flow cytometry was used to determine the level of hepatocytes apoptosis, and the expression of MST1 was detected by qRT-PCR and Western blot.
RESULTS: After the mice were fed for 14 wk, serum homocysteine level in the high methionine diet group was 2.3 and 1.9 times as high as that in the normal control group and the ApoE-/- group (P < 0.01), respectively. Serum homocysteine level in the intervention group was 28% lower than that in the high methionine diet group (P < 0.01). These findings suggest that the model was successfully established. Electron microscopy showed that in the high methionine diet group, there were chromosome swelling or condensation, mitochondrial swelling, marked endoplasmic reticulum swelling and break, which suggested the trend of cell apoptosis in hepatic tissue. Compared with the normal control group and ApoE-/- group, hepatic apoptosis level in the high methionine diet group was higher. However, hepatic apoptosis level in the intervention group was lower than that in the high methionine diet group. Compared with the normal control group and ApoE-/- group, the expression of MST1 mRNA and protein in heapatic tissue in the high methionine diet group was upregulated (P < 0.05 or P < 0.01); however, MST1 expression in the intervention group was significantly lower than that in the high methionine diet group (P < 0.05). In vitro, compared with the normal control group, hepatocytes apoptosis level in the homocysteine alone group was significantly higher (P < 0.01); however, hepatocytes apoptosis level in the intervention group was significantly lower than that in the homocysteine alone group (P < 0.05). Compared with the normal control group, the expression of MST1 mRNA and protein in the homocysteine alone group was upregulated (P < 0.01); however, MST1 expression in the intervention group was significantly lower than that in the homocysteine alone group (P < 0.05).
CONCLUSION: MST1 expression is upregulated in homocysteine-induced hepatocyte apoptosis, and folic acid and vitamin B12 can suppress the up-regulation of MST1.
- Citation: Kong FQ, Ma SC, Zhao L, He YY, Liu XM, Zhou LX, Zhang H, Zhang MH, Jin SJ, Jiang YD. Significance of expression of MST1 in homocysteine-induced hepatocyte apoptosis. Shijie Huaren Xiaohua Zazhi 2015; 23(16): 2523-2531
- URL: https://www.wjgnet.com/1009-3079/full/v23/i16/2523.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i16.2523
同型半胱氨酸(homocysteine, Hcy)是甲硫氨酸代谢的中间产物, 是多种疾病的危险因子[1], 同型半胱氨酸代谢紊乱可引起高同型半胱氨酸血症(hyperhomocysteinemia, HHcy)的发生, 研究[2]表明, 慢性肝病、肝硬化和原发性肝癌患者的血浆Hcy浓度明显升高. HHcy与病毒性肝炎、自身免疫性肝炎、酒精性肝硬化等多种肝脏疾病相关. 在这些疾病中, Hcy可促进肝细胞损伤和凋亡[3,4]. 同时, 肝脏又是Hcy代谢的主要器官, 肝脏损伤又会进一步使Hcy水平升高, 产生恶性循环. 蛋白激酶(mammalian sterile 20-like kinase, MST)是各种组织都有表达的丝氨酸/苏氨酸蛋白激酶[5]. MST1基因是一种新的抑癌基因, 他的发现源于其在果蝇中的同源基因Hippo. 在果蝇的发育研究[6]中, Hippo基因被证明可以同时调控细胞周期与细胞凋亡. MST1基因能被多种促凋亡刺激和细胞应激如紫外线照射、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及抗肿瘤药物激活, 继而诱发细胞凋亡[7]. Hcy可导致肝细胞内许多基因表达的改变[8], 但在HHcy致肝细胞凋亡过程中是否能引起MST1表达的改变尚未见报道. 本研究主要探讨MST1基因在HHcy致肝细胞凋亡过程中的表达变化情况, 为研究HHcy致肝脏损伤机制和临床预防提供新的理论基础及思路.
实验动物(北京大学实验动物中心); 透射电子显微镜和荧光显微镜(日本奥林巴斯公司); Annexin V-FITC/PI细胞凋亡检测试剂盒(贝博公司); HL7220肝细胞株(四川大学华西医学中心); 超净工作台(苏州安泰空气技术有限公司); 5415D型微量台式离心机(Eppendorf, 德国); 荧光显微镜(日本奥林巴斯公司); 荧光定量PCR仪(上海枫岭生物技术有限公司); 垂直电泳仪和全自动酶标仪(美国Bio-Rad公司); 1640培养基、胎牛血清(美国Gibco); 总RNA提取试剂盒(北京天根生物技术有限公司); 逆转录和qRT-PCR试剂盒(美国Thermo公司); 蛋白提取试剂盒、蛋白定量试剂盒(南京凯基有限公司); MST1兔抗人、鼠一抗(Abcam公司), 辣根过氧化物酶(HRP)标记的羊抗兔二抗(北京博奥森生物技术有限公司); 引物由上海生工生物工程有限公司合成.
1.2.1 动物模型建立及分组: 36只5周龄♂纯合子ApoE-/-鼠(SPF级近交系C57BL/6J), 随机分为3组, 每组12只小鼠: ApoE-/-对照组(ApoE-/- group): 普通饮食饲养; ApoE-/-高蛋氨酸饮食组(ApoE-/- high methionine diet group): 普通饮食+1.7%蛋氨酸饲养; ApoE-/-干预组(ApoE-/- intervention group): 普通饮食+1.7%蛋氨酸+ 0.006%叶酸及0.0004%维生素B12饲养[9]. 正常对照组(normal control group): 12只性别、年龄与ApoE-/-鼠匹配的♂鼠(SPF级C57BL/6J)作为对照, 普通饮食饲养; 各组小鼠均在SPF环境分笼饲养, 使用高压灭菌垫料, 饲养笼及饮水瓶每周消毒, 室内温度20 ℃-25 ℃, 相对湿度为55%-65%, 所有小鼠饲养20 wk后, 眼球取血并快速剖取肝脏组织, 进行后续实验.
1.2.2 细胞培养: 用含10%胎牛血清的RPMI 1640培养基培养人肝细胞, 置于37 ℃、50 mL/L CO2培养箱中培养. 当细胞密度达到85%左右时, 用终浓度为0、100 μmol/L Hcy和100 μmol/L Hcy+叶酸+维生素B12干预, 其中0 μmol/L Hcy为对照组, 100 μmol/L Hcy为HHcy组, 100 μmol/L Hcy+叶酸+维生素B12为干预组. 48 h后收集细胞, 用于后续实验.
1.2.3 血清Hcy浓度测定: 小鼠全血室温凝固, 3000 r/min离心10 min后取上清. ELISA法检测血清中Hcy浓度. 分别设置空白孔、标准品孔及样本孔. 标准品孔各加不同浓度的标准品50 μL; 样本孔先加样本稀释液40 μL, 再加待测样本10 μL; 空白孔不加. 标准品孔和样本孔中每孔各加入酶标抗体100 μL, 空白孔不加, 37 ℃温育1 h. 弃去液体、拍干, 每孔加适量洗涤液, 静置1 min后甩干, 重复洗板5次. 每孔均加入底物A和B各50 μL, 37 ℃避光孵育15 min. 各孔加入终止液50 μL, 测定各孔的A值(450 nm波长), 即可根据标准曲线计算小鼠血清Hcy浓度.
1.2.4 透射电镜观察肝脏组织亚细胞结构改变: 取1 mm×1 mm×1 mm新鲜肝组织, 分别用戊二醛、锇酸固定, 乙醇、丙酮脱水, 包埋剂浸透, 树脂与硬化剂等包埋, 超薄切片机切片, 枸橼酸铅双染色后电镜下观察.
1.2.5 DAPI染色观察肝脏组织损伤情况: DAPI染色: 将制备好的石蜡切片60 ℃恒温箱中烘烤30 min后置于二甲苯中浸泡2次, 每次10 min. 分别在无水乙醇、950 mL/L乙醇、750 mL/L 乙醇中浸泡各5 min, PBS洗3次, 每次5 min. 加入DAPI染色液(100 mg/L), 室温避光作用10 min后吸除DAPI染色液. 用PBS洗涤3次, 每次5 min. 盖玻片封片后荧光显微镜下观察并照相.
1.2.6 流式细胞仪检测: 肝细胞用不含EDTA的胰酶消化后离心, 收集细胞. 用冷PBS洗涤细胞2次, 300 g, 4 ℃离心5 min收集细胞. 用400 μL 1×AnnexinV结合液悬浮细胞, 浓度大约为1×106 cells/mL. 加入5 μL Annexin V- FITC染色液, 轻轻混匀后于4 ℃避光孵育15 min. 加入10 μL PI染色液后轻轻混匀于4 ℃避光孵育5 min. 立即用流式细胞仪检测. 以FITC和PI荧光作双参数点图, 细胞分为4个象限: 左下象限为活细胞, 右下象限为早期凋亡细胞, 右上象限为晚期凋亡和死亡细胞, 左上象限为机械损伤细胞.
1.2.7 实时定量PCR检测MST1 mRNA水平: 按照总RNA提取说明书提取组织及细胞RNA. 按逆转录说明书逆转录合成cDNA; 采用Primer5.0软件设计引物引, MST1: 5'-GGGTCCCAGTAGCCAAGAT-3'(上游)和5'-GAGGCACCACATACCATTCA-3'(下游); β-actin: 5'-TGACGTGGACATCCGCAAAG-3'(上游)和5'-CTGGAAGGTGGACAGCGACG-3'(下游). PCR条件: 94 ℃预变性10 min, 94 ℃变性30 s、59 ℃退火20 s、72 ℃延长30 s, 扩增45个循环. 反应结束后, 根据扩增曲线及溶解曲线, 选择符合要求的qRT-PCR数据, 结果用2-△△Ct法分析.
1.2.8 Western blot检测MST1的蛋白表达改变: 细胞裂解法提取组织及细胞总蛋白, 取各组总蛋白各10 μL, 80 V 40 min, 120 V 70 min进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳, MST1 20 V恒压转膜30 min, 以β-actin为内参, 15 V恒压转膜10 min, 经5%脱脂奶粉封闭2 h, 与MST1特异性一抗4 ℃孵育过夜, 与二抗室温孵育2 h, 加入显色液, 凝胶成像分析仪上分析MST1与β-actin的灰度值, 并根据二者的比值, 进行分析.
统计学处理 采用Prism 5.0统计软件对实验数据进行分析整理, 计量资料以mean±SD表示, 两组间比较采用t检验, 多组间两两比较采用单因素方差分析, P<0.05表示差异有统计学意义.
与正常对照组和ApoE-/-对照组相比, ApoE-/-高蛋氨酸组血清Hcy浓度明显升高, 分别为上述两组的2.3倍和1.9倍(P<0.01); 给予叶酸和维生素B12干预后, 血清Hcy水平较ApoE-/-高蛋氨酸组降低了28%(P<0.01)(图1).
正常对照组小鼠肝脏组织细胞核膜光滑、染色质清晰均匀, 线粒体内外膜完整光滑、嵴结构清楚, 粗面内质网呈轨道样排列致密、连贯, 核糖体附着在内质网表面. ApoE-/-对照组可见细胞核核膜较完整、线粒体稍有肿胀, 但形态基本正常, 粗面和滑面内质网有部分断裂、核糖体脱落, 未见凋亡小体及凋亡前体; ApoE-/-高蛋氨酸组染色质凝聚、浓缩, 细胞核严重固缩, 线粒体明显肿胀、嵴断裂, 粗面和滑面内质网明显肿胀、断裂、连贯性破坏、核糖体脱落, 糖原溶解, 细胞有凋亡趋势. ApoE-/-干预组细胞核膜完整, 染色质略微凝聚, 线粒体有轻微肿胀, 内质网稍有破坏(图2).
正常对照组和ApoE-/-对照组中细胞核大小均一、核圆且规整, 核膜光滑无皱缩; ApoE-/-高蛋氨酸饮食组可见部分细胞核与细胞质边界模糊, 细胞核皱缩且部分细胞核膜皱缩严重、呈现不规则形状改变; ApoE-/-干预组较ApoE-/-高蛋氨酸饮食组细胞核损伤有所减轻(图3).
不同药物刺激肝细胞48 h后, 通过流式细胞仪检测肝细胞凋亡水平的改变. 结果显示: 与正常对照组相比, HHcy组肝细胞凋亡水平明显升高(P<0.01), 而干预组凋亡水平较HHcy组有所减轻(P<0.05)(图4).
ApoE-/-高蛋氨酸组较正常对照组和ApoE-/-对照组, MST1表达明显升高(P<0.05或P<0.01). 给予叶酸和维生素B12干预后, MST1表达较ApoE-/-高蛋氨酸组降低(P<0.05). MST1 mRNA表达水平变化与蛋白表达变化基本一致(P<0.05)(图5).
不同药物刺激肝细胞48 h后, 检测MST1 mRNA和蛋白表达水平改变. 与正常对照组相比, HHcy组肝细胞MST1 mRNA及蛋白表达水平较正常对照组增高(P<0.01), 干预组肝细胞MST1表达较HHcy组有所降低(P<0.05)(图6).
Hcy是一种含硫氨基酸, 是体内蛋氨酸代谢的中间产物, 正常机体中含量很低[10]. 当Hcy代谢受阻, 就会在体内积聚, 使其在血中的水平持续升高发生HHcy[11,12]. HHcy作为动脉粥样硬化(atherosclerosis, AS)发生的危险因素备受关注[13,14]. 肝脏是Hcy代谢的主要器官之一[15], 若肝脏功能受损, 可进一步加重HHcy, 形成恶性循环. ApoE-/-鼠是目前研究AS常用的动物模型[16], 有研究[17]表明, HHcy可对ApoE-/-鼠肝脏造成损伤. 本研究通过高蛋氨酸饮食复制了ApoE-/-鼠HHcy模型, 检测血清Hcy水平以验证模型复制成功.
有研究[18,19]表明, HHcy可导致哺乳动物的多种细胞发生细胞凋亡. 故有理由认为肝细胞凋亡的失衡与HHcy乃至发生AS密切相关. 细胞凋亡(apoptosis), 又称为程序性细胞死亡(programmed cell death, pCD), 是受细胞外微环境和细胞内基因调控的一种细胞主动性死亡方式, 他是机体用来去除衰老、有害、无用及异型细胞的一种重要机制, 是确保机体正常发育、维持机体正常生理过程所必需的[20]. 肝细胞凋亡是造成肝脏损伤和肝脏疾病最基本的中心环节[21]. 本研究利用电镜技术验证了HHcy可对ApoE-/-鼠肝脏造成损伤; 且从细胞水平利用目前检测细胞凋亡水平较准确的Annexin V- FITC/PI双染流式细胞术对HHcy的促肝细胞凋亡作用进行了验证.
MST1是体内普遍表达的一种丝/苏氨酸蛋白激酶, 其结构类似于酵母sterile 20蛋白[22].有研究[23,24]表明, 多种细胞应激和促凋亡刺激可激活MST1, 激活的MST1可产生能进入细胞核并与核内一些蛋白相互作用的相对分子质量为36×103(或34×103)的片段, 引起染色质浓缩和DNA断裂[25,26]. MST1介导了一条保守的信号通路, 他可能控制着细胞的增殖与凋亡[27-29]. 本研究数据表明, 在HHcy促肝细胞凋亡的过程中, MST1的表达有所增高, 提示MST1可能参与了HHcy促肝细胞凋亡的过程, 是HHcy引起肝细胞凋亡水平增高的关键基因; 但其具体影响程度及相关机制有待于后续细胞转染实验的验证. 本实验的发现可能为研究HHcy致肝脏损伤机制和临床预防、治疗AS提供新的理论基础及思路.
血清Hcy水平受遗传与环境因素共同影响[30]. 一些研究[31-33]表明, 血清叶酸、维生素B12浓度与血清Hcy水平呈负相关, 增加B族维生素的摄入可降低Hcy水平. 本研究证实, 叶酸和维生素B12的干预可以降低血清Hcy的水平, 且能缓解HHcy引起的肝细胞凋亡及抑制HHcy引起的MST1表达增加. 提示叶酸和维生素B12有可能对于临床上预防和控制HHcy及其所造成的多器官损害有所帮助.
肝细胞凋亡是造成肝脏损伤和肝脏疾病最基本的中心环节. 高同型半胱氨酸(hyperhomocysteinemia, HHcy)可导致哺乳动物的多种细胞发生细胞凋亡. MST1是体内普遍表达的一种丝/苏氨酸蛋白激酶, 可能控制着细胞的增殖与凋亡.故阐明HHcy与MST1间的关系, 可能会对纠正HHcy所致的肝细胞凋亡有关键作用.
张锦生, 教授, 复旦大学上海医学院病理学系
目前对于Hcy介导肝细胞凋亡的研究热点主要集中在凋亡相关蛋白等的变化、分子机制, 研究重点在于Hcy怎样调控凋亡相关蛋白的表达及相关通路, 这也是待进一步研究和揭示的问题.
有研究表明, HHcy可造成 ApoE-/-鼠肝脏损伤. 同时有报道称, MST1主要参与细胞生长、增殖、凋亡以及器官大小等的调控, 具有抑癌作用.
本文在已有研究的基础上, 进一步在体外水平验证了HHcy对肝细胞的促凋亡作用, 同时发现HHcy致肝细胞凋亡过程中可导致凋亡相关蛋白MST1表达改变.
本研究将多种疾病的独立危险因素Hcy与凋亡相关蛋白MST1相联系, 为研究HHcy致肝脏损伤机制和临床预防、治疗HHcy所致疾病提供新的理论基础及思路.
同型半胱氨酸(Hcy): 为一种含硫氨基酸, 是蛋氨酸代谢过程中的中间产物;
细胞凋亡: 又称为程序性细胞死亡(programmed cell death, pCD), 是受细胞外微环境和细胞内基因调控的一种细胞主动性死亡方式; MST1: 体内普遍表达的一种丝/苏氨酸蛋白激酶, 其结构类似于酵母sterile20蛋白, 激活的MST1可与核内一些蛋白相互作用, 引起染色质浓缩和DNA断裂.
本文内容有新意, 实验设计合理, 但方法上有不合理, 但可为进一步深入研究打下基础.
编辑: 郭鹏 电编:闫晋利
| 1. | Akgullu C, Huyut MA, Boyacioglu M, Guleş O, Eryilmaz U, Hekim T, Dogan E, Zencir C, Güngör H. Nebivolol to attenuate the effects of hyper-homocysteinaemia in rats. Atherosclerosis. 2015;240:33-39. [PubMed] [DOI] |
| 3. | Liu WH, Zhao YS, Gao SY, Li SD, Cao J, Zhang KQ, Zou CG. Hepatocyte proliferation during liver regeneration is impaired in mice with methionine diet-induced hyperhomocysteinemia. Am J Pathol. 2010;177:2357-2365. [PubMed] [DOI] |
| 4. | 周 龙霞, 杨 安宁, 陈 久凯, 赵 丽, 王 艳华, 刘 现梅, 蔡 欣, 张 鸣号, 姜 怡邓, 曹 军. ERO1α介导同型半胱氨酸诱导的肝细胞内质网应激. 世界华人消化杂志. 2014;22:5228-5234. |
| 5. | Praskova M, Khoklatchev A, Ortiz-Vega S, Avruch J. Regulation of the MST1 kinase by autophosphorylation, by the growth inhibitory proteins, RASSF1 and NORE1, and by Ras. Biochem J. 2004;381:453-462. [PubMed] |
| 6. | Wu S, Huang J, Dong J, Pan D. hippo encodes a Ste-20 family protein kinase that restricts cell proliferation and promotes apoptosis in conjunction with salvador and warts. Cell. 2003;114:445-456. [PubMed] |
| 7. | Lee KK, Ohyama T, Yajima N, Tsubuki S, Yonehara S. MST, a physiological caspase substrate, highly sensitizes apoptosis both upstream and downstream of caspase activation. J Biol Chem. 2001;276:19276-19285. [PubMed] |
| 8. | Yang X, Xu H, Hao Y, Zhao L, Cai X, Tian J, Zhang M, Han X, Ma S, Cao J. Endoplasmic reticulum oxidoreductin 1α mediates hepatic endoplasmic reticulum stress in homocysteine-induced atherosclerosis. Acta Biochim Biophys Sin (Shanghai). 2014;46:902-910. [PubMed] [DOI] |
| 9. | Ma S, Zhang H, Sun W, Gong H, Wang Y, Ma C, Wang J, Cao C, Yang X, Tian J. Hyperhomocysteinemia induces cardiac injury by up-regulation of p53-dependent Noxa and Bax expression through the p53 DNA methylation in ApoE(-/-) mice. Acta Biochim Biophys Sin (Shanghai). 2013;45:391-400. [PubMed] [DOI] |
| 10. | Ansari R, Mahta A, Mallack E, Luo JJ. Hyperhomocysteinemia and neurologic disorders: a review. J Clin Neurol. 2014;10:281-288. [PubMed] [DOI] |
| 11. | Sun W, Pang Y, Liu Z, Sun L, Liu B, Xu M, Dong Y, Feng J, Jiang C, Kong W. Macrophage inflammasome mediates hyperhomocysteinemia-aggravated abdominal aortic aneurysm. J Mol Cell Cardiol. 2015;81:96-106. [PubMed] [DOI] |
| 12. | Fang P, Zhang D, Cheng Z, Yan C, Jiang X, Kruger WD, Meng S, Arning E, Bottiglieri T, Choi ET. Hyperhomocysteinemia potentiates hyperglycemia-induced inflammatory monocyte differentiation and atherosclerosis. Diabetes. 2014;63:4275-4290. [PubMed] [DOI] |
| 13. | Yang XL, Tian J, Liang Y, Ma CJ, Yang AN, Wang J, Ma SC, Cheng Y, Hua X, Jiang YD. Homocysteine induces blood vessel global hypomethylation mediated by LOX-1. Genet Mol Res. 2014;13:3787-3799. [PubMed] [DOI] |
| 14. | Ables GP, Ouattara A, Hampton TG, Cooke D, Perodin F, Augie I, Orentreich DS. Dietary methionine restriction in mice elicits an adaptive cardiovascular response to hyperhomocysteinemia. Sci Rep. 2015;5:8886. [PubMed] [DOI] |
| 15. | Suszyńska-Zajczyk J, Wróblewski J, Utyro O, Luczak M, Marczak L, Jakubowski H. Bleomycin hydrolase and hyperhomocysteinemia modulate the expression of mouse proteins involved in liver homeostasis. Amino Acids. 2014;46:1471-1480. [PubMed] [DOI] |
| 16. | Kayashima Y, Makhanova NA, Matsuki K, Tomita H, Bennett BJ, Maeda N. Identification of aortic arch-specific quantitative trait loci for atherosclerosis by an intercross of DBA/2J and 129S6 apolipoprotein E-deficient mice. PLoS One. 2015;10:e0117478. [PubMed] [DOI] |
| 17. | 王 磊, 田 珏, 曹 成建, 杨 程, 蔡 欣, 周 龙霞, 杨 晓玲, 姜 怡邓. 高同型半胱氨酸血症经内质网途径影响ApoE-/-鼠肝细胞凋亡. 中国药理学通报. 2014;30:261-265. |
| 18. | Fang K, Chen Z, Liu M, Peng J, Wu P. Apoptosis and calcification of vascular endothelial cell under hyperhomocysteinemia. Med Oncol. 2015;32:403. [PubMed] [DOI] |
| 22. | Rawat SJ, Chernoff J. Regulation of mammalian Ste20 (Mst) kinases. Trends Biochem Sci. 2015;40:149-156. [PubMed] [DOI] |
| 23. | Zhou XH, Yang CQ, Zhang CL, Gao Y, Yuan HB, Wang C. RASSF5 inhibits growth and invasion and induces apoptosis in osteosarcoma cells through activation of MST1/LATS1 signaling. Oncol Rep. 2014;32:1505-1512. [PubMed] [DOI] |
| 24. | Del Re DP, Matsuda T, Zhai P, Maejima Y, Jain MR, Liu T, Li H, Hsu CP, Sadoshima J. Mst1 promotes cardiac myocyte apoptosis through phosphorylation and inhibition of Bcl-xL. Mol Cell. 2014;54:639-650. [PubMed] [DOI] |
| 25. | Ura S, Masuyama N, Graves JD, Gotoh Y. Caspase cleavage of MST1 promotes nuclear translocation and chromatin condensation. Proc Natl Acad Sci U S A. 2001;98:10148-10153. [PubMed] |
| 26. | Watabe M, Kakeya H, Onose R, Osada H. Activation of MST/Krs and c-Jun N-terminal kinases by different signaling pathways during cytotrienin A-induced apoptosis. J Biol Chem. 2000;275:8766-8771. [PubMed] |
| 27. | Chen SH, Li DL, Yang F, Wu Z, Zhao YY, Jiang Y. Gemcitabine-induced pancreatic cancer cell death is associated with MST1/cyclophilin D mitochondrial complexation. Biochimie. 2014;103:71-79. [PubMed] [DOI] |
| 28. | Ardestani A, Paroni F, Azizi Z, Kaur S, Khobragade V, Yuan T, Frogne T, Tao W, Oberholzer J, Pattou F. MST1 is a key regulator of beta cell apoptosis and dysfunction in diabetes. Nat Med. 2014;20:385-397. [PubMed] [DOI] |
| 29. | Tang F, Zhang L, Xue G, Hynx D, Wang Y, Cron PD, Hundsrucker C, Hergovich A, Frank S, Hemmings BA. hMOB3 modulates MST1 apoptotic signaling and supports tumor growth in glioblastoma multiforme. Cancer Res. 2014;74:3779-3789. [PubMed] [DOI] |
| 30. | Moore SE, Mansoor MA, Bates CJ, Prentice AM. Plasma homocysteine, folate and vitamin B(12) compared between rural Gambian and UK adults. Br J Nutr. 2006;96:508-515. [PubMed] |
| 31. | Murakami K, Sasaki S, Uenishi K. Higher intake of vitamin B-6 and dairy products and lower intake of green and oolong tea are independently associated with lower serum homocysteine concentration in young Japanese women. Nutr Res. 2013;33:653-660. [PubMed] [DOI] |
| 32. | Martínez-Vega R, Garrido F, Partearroyo T, Cediel R, Zeisel SH, Martínez-Álvarez C, Varela-Moreiras G, Varela-Nieto I, Pajares MA. Folic acid deficiency induces premature hearing loss through mechanisms involving cochlear oxidative stress and impairment of homocysteine metabolism. FASEB J. 2015;29:418-432. [PubMed] [DOI] |
| 33. | Zhang M, Wen J, Wang X, Xiao C. Highdose folic acid improves endothelial function by increasing tetrahydrobiopterin and decreasing homocysteine levels. Mol Med Rep. 2014;10:1609-1613. [PubMed] [DOI] |