修回日期: 2015-04-07
接受日期: 2015-04-10
在线出版日期: 2015-06-08
胰腺体尾部癌症状隐匿, 恶性程度高, 切除率低, 预后差, 整体治疗有待提高. 外科手术是唯一可能治愈的手段, 手术治疗为核心的多学科协作的个体化治疗策略应该成为标准模式. "可能切除"患者先接受新辅助治疗, 再判断是否手术有助于提高R0切除率, 改善预后. 根治性顺行胰腺体尾部癌整体切除术(radical antegrade modular pancreatosplenectomy, RAMPS)手术符合肿瘤切除原则, 有望成为标准的根治手术方式. 腹腔镜探查术能够发现肝转移和腹腔播散, 避免不必要的开腹手术. 腹腔镜下胰腺体尾部癌根治术与开腹手术相比有诸多优势, 但仅限于肿瘤体积较小的早期患者, 肿瘤学方面的远期效果仍需验证, 建议有选择地开展. 联合腹腔干切除的根治性远端胰腺癌切除术(radical distal or left pancreatectomy with resection of the celiac axis, DP-CAR)适合于肝总动脉或腹腔干受侵犯但仍有条件切除的患者, 需谨慎开展. 胰腺体尾部癌在早期诊断、分子水平个体化治疗方面需要突破, 新辅助治疗和腹腔镜手术的开展需要进一步多中心联合前瞻实验研究提供循证证据支持.
核心提示: 手术治疗为核心的多学科协作的个体化治疗策略应该成为治疗胰腺体尾部癌的标准模式. "可能切除"患者先接受新辅助治疗, 再判断是否手术. 根治性顺行胰腺体尾部癌整体切除术(radical antegrade modular pancreatosplenectomy)应该成为标准的手术方式. 腹腔镜下胰腺体尾部癌根治术仅限于肿瘤体积较小的早期患者, 建议有选择地开展. 联合腹腔干切除的根治性远端胰腺癌切除术(radical distal or left pancreatectomy with resection of the celiac axis)适合于肝总动脉或腹腔干受侵犯但仍有条件切除的患者, 需谨慎开展.
引文著录: 王志东, 崔云甫. 胰腺体尾部癌外科治疗的几个焦点问题. 世界华人消化杂志 2015; 23(16): 2515-2522
Revised: April 7, 2015
Accepted: April 10, 2015
Published online: June 8, 2015
Distal pancreatic cancer is an aggressive malignancy with insidious and subtle presentation, low radical resection rate and poor prognosis. The effectiveness of treatments for this disease remains to be improved. Radical resection is the only curable treatment. Personalized therapeutic strategy with surgical resection as a core should be the standard mode for these patients, and a professional multidisciplinary team is indispensable. Patients with borderline resectable cancers may benefit from a neoadjuvant approach by initiating chemotherapy and/or chemoradiation prior to the resection. Radical antegrade modular pancreatosplenectomy (RAMPS) is designed to establish an operation with oncologic rationales and should be the standard radical resection mode for distal pancreatic cancer. The use of diagnostic laparoscopy can help find hepatic metastases and peritoneal dissemination to avoid an unnecessary open operation. Laparoscopic distal pancreatectomy has many advantages compared with open operation, but is only applicable to early-stage patients with small tumors. In addition, the long-term oncologic effects of this surgical procedure still need to be verified, and it should be carried out selectively. Radical distal (or left) pancreatectomy with resection of the celiac axis (DP-CAR) is proper for some patients with evidence of celiac arterial invasion and should be conducted meticulously. However, new breakthroughs in early diagnosis and genetically personalized therapy are urgently needed. We still need prospective, randomized studies in multicenter institutions to provide more evidence for the neoadjuvant approach and laparoscopic distal pancreatectomy.
- Citation: Wang ZD, Cui YF. Several key issues in surgical treatment of distal pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(16): 2515-2522
- URL: https://www.wjgnet.com/1009-3079/full/v23/i16/2515.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i16.2515
胰腺导管腺癌作为一种症状隐匿、进展快速、恶性程度极高的消化系恶性肿瘤, 其发病率在全球范围内有上升趋势, 根据美国2012年统计, 其发病率位于所有肿瘤第6位, 致死率已经上升至所有肿瘤的第4位, 5年生存率不足5%. 特别是发生于胰腺体尾部的导管腺癌, 因其缺乏特异症状, 难以在早期发现, 外科手术切除率仅10%-20%, 即便是接受手术, 其5年生存率也仅为15%-20%[1-3]. 可喜的是近年来新技术和新理念不断涌现, 更精细的计算机断层扫描(computed tomography, CT)成像技术、内镜超声和针刺活检技术、各种肿瘤标志物的联合检测、腹腔镜探查以及对高危人群的筛查使肿瘤可以更早被发现; 多学科协作(multidisciplinary team, MDT)模式使肿瘤患者的诊断和治疗更趋合理; 根治性顺行胰腺体尾部癌整体切除术(radical antegrade modular pancreatosplenectomy, RAMPS)、联合腹腔干切除的根治性远端胰腺癌切除术(radical distal or left pancreatectomy with resection of the celiac axis, DP-CAR)、腹腔镜下胰腺体尾部癌根治术等一系列新手术方式的出现以及新辅助治疗的开展都在一定程度上给胰腺体尾部癌患者带来新的希望[4].
技术和理念的快速进步带给医生更多选择的同时也带来了一些困惑和疑问, 诸如: 患者是否适合手术? 何时选择手术? 选择何种手术? 如何将手术与其他治疗方法结合起来? 对于这些问题, 无论是学科之间还是外科医生内部仍缺乏统一的认识. 鉴于此, 本文就目前胰腺体尾部癌外科治疗领域的一些焦点问题评述如下.
手术治疗是唯一可能治愈胰腺癌的手段, 只要存在根治性切除的可能, 必然应该考虑手术治疗, 因此所有的诊疗计划必须围绕患者是否适合手术这一核心来进行. 但需要注意的是手术治疗是一把"双刃剑", 因此选择手术必须同时考虑到患者的整体状态、肿瘤进展程度、肿瘤生物学行为的特点、具体手术方式的选择和必要的配合治疗手段等诸多因素. 外科医生要做到"有所为, 有所不为"才是科学的态度.
恶性肿瘤的治疗发展到今天, 没有一种治疗方法适合所有患者, MDT的模式能够提供充分的考量和完善的治疗策略, 避免夸大或者忽略某种治疗对患者的作用, 是发展的必然趋势[5,6]. 经过合理的综合治疗不但可以改善预后, 提高生存质量, 还可以使本来不适合切除的患者实现肿瘤根治性切除. 一个合理的诊疗小组至少应该包括胰腺外科医生、消化内科医生、病理科医生、影像科医生、肿瘤科医生. 至于具体的运作模式, 考虑到我国和西方社会的诸多差异, 完全照搬西方发达国家的协作模式未必适合. 在实践过程中逐渐摸索才能制订出适合我们当前实际情况的模式来.
癌症基因和分子生物学的研究已经证明恶性肿瘤具有高度异质性, 同一种治疗方法对不同的患者而言其效果有很大差异, 即使是同一个患者, 其肿瘤在不同发展阶段对某种治疗方法的反应也有很大不同. 因此有针对性的制定个体化的治疗方案最有可能实现治疗效果的最大化. 大数据时代, 运用癌症生物信息学技术对海量数据的分析, 可根据肿瘤细胞的不同特点将肿瘤划分为不同亚型, 从而选择最佳治疗手段.
胰腺体尾部癌发现一般较晚, 如果确诊时发现同时有远处转移(M1), 就不再适合根治性手术. 但是临床实际情况是有相当数量患者仅是肿瘤局部与血管关系密切, 并未发现同时存在远处转移. 此类型患者被称为"胰腺癌局部进展期"(locally advanced pancreatic cancer, LAPC). 研究[7]认为此种类型的胰腺癌其肿瘤细胞的表型往往属于上皮类型的(the epithelial cell type), 与早期出现转移的间质化表型(the mesenchymal phenotype)的肿瘤预后相比要偏好一些. 此类患者的治疗既不同于出现远处转移的患者, 也不同于无血管侵犯的可切除患者. 鉴于此类型患者所占比例较大(约40%), 同时治疗策略又比较复杂, 因此正确处理显得至关重要[8].
既往曾认为伴有血管侵犯的患者就不适合根治性手术治疗, 但随着技术进步, 越来越多的文献报道[9-13]显示合并血管切除, 特别是合并静脉切除是安全的、可以接受的. 这使得LAPC中部分患者可以达到R0切除的要求, 这部分患者根据术前影像学检查发现有血管侵犯但并不能完全排除手术切除的可能, 被称为"可能切除"类型(borderline resectable). 对于这类患者的确认目前已经有了统一的标准: (1)无远处转移; (2)肠系膜上静脉或门静脉局限受累, 狭窄、扭曲或闭塞, 但其远近端正常, 可切除重建; (3)肿瘤包裹胃十二指肠动脉或肝动脉局限性包裹, 但未浸润至腹腔动脉干; (4)肿瘤紧贴肠系膜上动脉, 但未超过180度. 肿瘤包绕胃十二指肠动脉或局限累及肝总动脉, 如后者可切除重建, 视为可能切除. 肠系膜上动脉受累如>180度, 则视为不可切除. 腹腔干受累如>180度, 亦为不可切除[8].
对于"可能切除"患者的治疗策略目前存在争议, 其焦点在于直接手术治疗还是先新辅助治疗, 再根据治疗后的反应有选择地进行手术治疗. 新辅助治疗的优势[14]在于: (1)减小瘤体或使肿瘤降期, 增加阴性切缘概率; (2)新辅助治疗期间评估肿瘤的生物学行为, 如出现远处转移或肿瘤局部进展, 则不选择手术治疗, 此部分患者即使直接手术, 因生物学行为恶劣, 亦难以获益; (3)术后患者如有手术并发症, 相当长时间内不能实施化疗, 而术前患者多有较好的药物耐受性; (4)手术可使术野内解剖结构改变, 破坏血管供应, 局部氧浓度下降, 影响到术后放化疗的敏感性, 使效力下降, 而术前进行可避免上述不足; (5)及早控制潜在的微转移灶. 由于直接手术治疗, 面临着R0切除率降低的风险, 而且众多文献报道[15-19]认为新辅助治疗能够提高R0切除率和延长生存时间. 因此虽然缺乏高等级循证医学证据, 对于可能切除的胰腺体尾部癌患者仍推荐先进行新辅助治疗为宜[8,20-23].
传统的胰腺体尾部癌切除方式是从胰腺体尾部病变切除术演变而来的, 采用的是从左向右的方式, 先游离脾脏, 再顺势游离胰腺体尾部, 最后切断胰腺, 移除病变. 其目的只是单纯的病变切除, 从手术设计层面来讲并没有遵循肿瘤的根治性切除原则. 因此, 这种手术方式存在如下不足: (1)腹膜后解剖层面过浅, 大多在肾前筋膜之前, 难以保证切缘阴性; (2)自左至右的游离顺序使肿瘤的供血血管和淋巴管网最后才被控制, 存在术中播散可能; (3)淋巴结清扫未包括所有N1淋巴结(多数仅包含N11、N10、N18).
随着肿瘤治疗观念的进步, 20世纪90年代以后胰腺体尾部癌手术出现了一些术式的改进, 其中以美国著名胰腺外科医生Strasberg等[24]在1999年提出的"RAMPS"最具影响力.
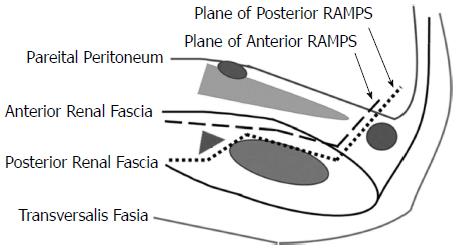
RAMPS手术采用自右至左的方法, 首先切断胰腺颈部, 根部结扎切断脾动静脉, 清除腹腔干(N9)和肠系膜上动脉左侧淋巴结(N14), 然后沿左肾静脉表面向左完整切除包含胰腺体尾部、脾脏和左侧肾前筋膜在内的整块组织. 这种手术方式又根据术前影像学提示肿瘤是否突破胰腺后缘而分成"浅层"(anterior RAMPS)"深层"(posterior RAMPS)两种模式, 如图1所示[25].
浅层模式指腹膜后解剖层面位于肾前筋膜后方, 左肾静脉和左肾上腺静脉前方, 而深层模式指解剖层面位于Grota筋膜后方、膈肌脚和腹后壁肌肉前方, 切除范围包含左侧肾上腺和其周围软组织. 这一术式的主要目的: (1)按照肿瘤根治切除的要求力求切缘阴性; (2)清除所有N1淋巴结, 其理论依据来自于O'Morchoe[26]关于胰腺癌淋巴回流途径的研究. 按照Strasberg本人所言:"RAMPS手术只是按照胰头癌根治手术的标准而施行的胰腺体尾部癌根治术, 而非扩大的根治术"[21].
从1999年开始, Strasberg的团队陆续发表3篇有关RAMPS手术效果的回顾性分析报道[24,25,27]. 最近一篇发表于2012年[21], 总结了1999-2008年单中心共47例RAMPS手术患者的远期疗效. 根据其报道围手术期死亡率(30 d)为0%, R0切除率为81%, 平均淋巴结获取数为15个/例, 中位生存时间(median survival)为26 mo, 5年生存率达到35.5%. 根据他本人在2014年第三届国际肝胆胰和微创外科大会上的报道, 最新病例数达到78例, R0切除率达到93.6%, 平均淋巴结获取数达到20个/例, 上述结果相比传统术式均有较大幅度改善. 其他国家和地区(日本、韩国、欧洲)也陆续有按照RAMPS原则施行开腹或腹腔镜下胰腺体尾部癌根治术的报道, 其结果与Strasberg本人报道数据近似[22,23,28-31]. Shimada等[32]则实行了范围更为扩大的手术方式, 淋巴结清扫范围包括N16, 但其预后与RAMPS相比并无显著差异.
RAMPS手术发展迅速, 因其理论上的合理性和令人鼓舞的实际效果而逐渐被胰腺外科学界主流接受和认可, 有成为标准术式的趋势. 因以往文献皆回顾性研究, 大宗随机对照试验又难以实现, 使这种术式仍缺乏循证证据. 另外, 有关N9、N14淋巴结是否必须清除目前仍存在争议, 如果肿瘤位于胰腺体部仍倾向于清除上述淋巴结为佳.
胰腺体尾部癌症状隐匿, 恶性程度高, 易于出现早期肝转移和腹腔播散, 术前影像学检查难以发现, 导致很多患者术中才发现肿瘤不可切除. 术前应用腹腔镜探查结合术中超声可以发现早期肝脏转移和腹膜播散, 避免不必要的开腹手术. 这方面的报道较多, 如: Catheline等[33]报道55例胰腺癌患者中, 10例腹膜转移的病例全部经腹腔镜探查发现, 而B超只提示1例, CT未发现; 6例肝脏转移灶<1 cm的病例, 腹腔镜探查发现3例, 而B超和CT全部漏诊. Reddy等[34]对109例胰腺癌患者进行了回顾性分析, 其中45例出现转移, 术前CT只提示10例肝脏转移, 而腹腔镜探查发现了另外的29例, 在98例CT考虑可切除的患者中, 腹腔镜探查使29例(29.6%)患者避免了不必要的开腹手术. White等[35]对1045例患者的回顾性分析研究表明, CT判断可切除的胰腺癌患者中有14%经腹腔镜探查证实不可切除. 牟一平等[36]报道19例腹腔镜探查确诊为胰腺恶性肿瘤患者, 4例发现已有远处转移, 避免了不必要的开腹, 另15例腹腔镜探查提示可切除者均接受开腹手术, 其中2例未能切除(术中超声证实肠系膜血管被肿瘤包绕), 余13例均行根治性切除. 腹腔镜探查在评估胰腺癌不可切除性的敏感性为75%, 特异性为100%, 阳性预测值为100%, 阴性预测值为83.3%.
因此, 对于术前认为可能伴有腹腔播散或肝转移的患者, 建议在根治手术之前常规腹腔镜探查, 如: 原发肿瘤>3 cm, 近期明显体质量减轻, 影像学显示肿瘤可切除性存疑, CA19-9水平显著升高等都是适应证[37].
随着腹腔镜技术和机器人手术在全球范围内广泛开展和技术的不断进步, 一方面, 几乎所有传统的胰腺外科手术均已实现腹腔镜下操作, 甚至包括复杂的血管切除重建手术; 另一方面, 随着胃癌、食道癌、结直肠癌、肝癌等一系列恶性肿瘤逐渐实现腹腔镜下切除并获得广泛认可. 胰腺癌, 特别是胰腺体尾部癌的腹腔镜下切除是否也可以达到同样效果甚至比开腹手术更有优势成为一个令人关注的焦点问题.
近几年一系列文献报道[38-42]结果显示: 腹腔镜下按照RAMPS原则施行胰腺体尾部癌根治术已经在多个国家和地区开展, 积累了相当数量的病例并显示出一定优势. 比如: 更短的禁食时间和住院时间、更少的出血量、患者早期离床活动等. 术后的一些重要指标如: 死亡率、并发症发生率、R0切除率、淋巴结清除数等均与开腹手术相当.
虽然技术上可行, 但考虑到操作的复杂性和肿瘤根治的要求, 大部分开展腹腔镜下RAMPS手术的中心目前仍只限于施行anterior RAMPS, 而且对于患者的选择十分严格. 具体的选择标准包括[43]: (1)肿瘤局限于胰腺轮廓内; (2)左肾和肾上腺与胰腺之间的筋膜完整, 未受侵犯; (3)肿瘤与腹腔干或肠系膜上动脉有1-2 cm的距离, 大部分的肿瘤直径都在3 cm以内.
根据现有的文献报道, 符合上述标准的相对早期的胰腺体尾部癌施行腹腔镜下根治性切除和开腹手术相比在肿瘤根治方面未发现有明显差异, 同时又具有微创手术的诸多优势, 受到许多外科医生的推崇. 这方面国内外的病例积累很快, 预计将会很快达到一定规模. 届时大样本随机对照试验结果将会提供更加令人信服的循证证据. 对于不符合上述标准的可切除病例, 仍以开腹RAMPS手术为宜. 预计短期内腹腔镜手术和开腹手术孰优孰劣的争议仍将继续, 根据肿瘤的具体条件来选择手术方式才是最合理的.
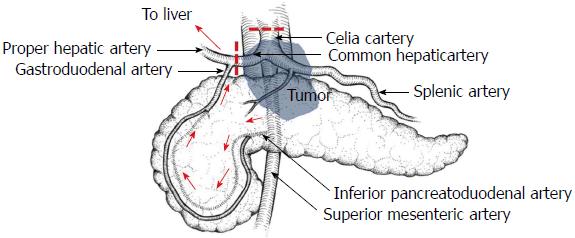
1953年加拿大外科医生Appleby[44]在给1例胃癌患者施行手术过程中, 首次联合切除了腹腔干并且未予重建. 其理论依据是肝脏供血可以通过肠系膜上动脉(superior mesenteric artery, SMA)经胰腺头部血管弓至胃十二指肠动脉(gastroduodenal artery, GDA)来提供. 随后的10年间, 他共积累了19例同样类型的手术并撰文发表[45]. 此后业内将此种为了根治性切除肿瘤而联合切除腹腔干及其周围淋巴组织而不重建动脉的手术命名为"Appleby"手术. 随着医学发展, 此种手术被越来越多应用于胰腺体尾部癌的治疗, 也因此被称为联合腹腔干切除的根治性远端胰腺癌切除术, 简称为DP-CAR, 如图2所示[21].
DP-CAR的手术过程类似于扩大的深层模式的RAMPS, 不同的是自根部切断腹腔干, 同时在GDA分出之前切断肝总动脉, 腹腔干与肝总动脉旁神经和淋巴组织连同远端胰腺组织整块切除. 其切除范围应该包括胰腺体尾部及脾脏、腹腔干、肝总动脉、胃左动脉及腹腔神经丛和神经节、肠系膜上动脉左侧神经丛、上述动脉周围的淋巴组织、左肾上腺、左肾静脉上方腹膜后脂肪组织、Gerota筋膜、肠系膜下静脉. 还可能包括同时切除的部分门静脉、肠系膜上静脉、结肠及其系膜、部分胃或小肠[21].
由于适合病例少见, 现有文献报道DP-CAR均为少量病例的回顾性研究[46-51]. 根据这些文献报道, DP-CAR术后并发症发生率、手术死亡率与未联合切除腹腔干的胰腺体尾部癌根治术相比并无显著上升, 同时中位生存时间较未接受手术者显著延长. 为了减少术后肝脏缺血的风险, 大部分术者采用术前肝总动脉栓塞的方法提前建立侧枝循环, 进一步提高了手术的安全性. DP-CAR术后最常见的问题是胃缺血和胰瘘, 肝脏缺血表现并不常见.
虽然目前报道的文献均证实DP-CAR是一种安全可行的手术方式, 但作为一种扩大范围的根治性手术, 考虑到操作的复杂性和可能的严重后果, DP-CAR的施行必须满足如下条件: (1)术前影像学提示腹腔干被肿瘤包绕侵犯且GDA、SMA能够保全; (2)联合切除腹腔干能够实现肿瘤的R0切除; (3)术中试行阻断肝总动脉后肝固有动脉搏动良好.
文献所积累病例数量有限, 在大规模随机对照试验难以实现的情况下, DP-CAR的开展应该由有丰富胰腺手术经验的外科医生在严格选择病例的前提下谨慎施行.
根治性手术仍是胰体尾癌患者获得长期生存的唯一途径, 以手术为核心的MDT下的个体化治疗策略是胰体尾癌患者的最佳选择. RAMPS手术应该成为根治性手术的标准, 而术前腹腔镜下探查可以避免一些不必要的开腹手术. 随着早期诊断病例的增多, 腹腔镜下根治性手术的开展将会更加普及. 对于可能切除的患者, 新辅助治疗有助于进一步筛选适合手术的病例, 建议有条件的治疗中心积极开展. DP-CAR为少数患者提供根治性切除的机会, 延长生存时间, 可以考虑谨慎开展. 如何早期诊断仍然是提高患者生存率的关键因素; 进一步规范和统一治疗策略, 积极推进MDT有助于改善目前治疗的各自为政的混乱状态; 病理标本处理程序的标准化急需改善和提高, 尤其是切缘的准确标识能够提高R0切除的可信度, 使文献数据具有可比性; 分子生物学和癌症信息学的快速发展则将给我们带来更多的希望.
胰腺体尾部癌的外科治疗近年来有较快发展, 传统的诊疗观念已经不完全适合当前的发展现状. 如何规范根治手术的切除范围、如何合理选择手术时机和适应证、如何正确认识新辅助治疗的价值和作用并将其与外科手术结合起来、如何合理开展腹腔镜下胰腺体尾部切除手术和扩大的根治性胰腺体尾部切除手术等问题成为当前讨论的焦点.
陈光, 教授, 吉林大学第一医院消化器官外科
本文深入讨论了以下几个胰腺体尾部癌外科治疗的焦点问题: (1)根治性顺行胰腺体尾部癌整体切除术(radical antegrade modular pancreatosplenectomy, RAMPS)手术的合理性及其推广和应用; (2)新辅助治疗的重要意义; (3)联合腹腔干切除的根治性远端胰腺癌切除术(radical distal or left pancreatectomy with resection of the celiac axis, DP-CAR)的适用范围和评价; (4)可能切除患者的处理方法和重要意义; (5)腹腔镜手术在胰腺体尾部癌治疗中的地位和作用.
按照Strasberg本人所言: "RAMPS手术不是扩大的根治性手术, 而是按照胰头癌根治标准而设计的胰腺体尾部癌的根治手术".
本文提出以下主要观点: (1)手术治疗为核心的多学科协作的个体化治疗策略应该成为治疗胰腺体尾部癌的标准模式; (2)"可能切除"患者先接受新辅助治疗, 再判断是否手术有助于提高R0切除率, 改善预后; (3)RAMPS手术符合肿瘤切除原则, 应该成为标准的根治手术方式; (4)腹腔镜下胰腺体尾部癌根治术仅限于肿瘤体积较小的早期患者, 建议有选择地开展; (5)DP-CAR适合于肝总动脉或腹腔干受侵犯但仍有条件切除的患者, 需谨慎开展.
本文深入讨论了胰腺体尾部癌外科治疗的焦点问题, 提出了具有指导和借鉴作用的观点和证据, 有助于解决临床胰腺外科医生和相关专业医生对于胰腺体尾部癌的诊疗过程中的诸多疑惑, 也有助于提高年轻医生对于胰腺体尾部癌的认识.
根治性顺行胰腺体尾部癌整体切除术(RAMPS): 是按照肿瘤根治切除要求, 特别是追求胰腺后方切缘阴性而设计的胰腺体尾部癌根治性切除手术; 联合腹腔干切除的根治性远端胰腺癌切除术(DP-CAR): 是针对具备根治切除条件但癌肿侵犯肝总动脉和/或腹腔干的胰腺癌患者而设计的联合切除血管的扩大根治手术.
本文综合了国内外文献, 就胰腺体尾部癌外科治疗的多个关键问题进行了探讨, 对手术的进一步改进有良好的参考价值.
编辑: 韦元涛 电编:闫晋利
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Tuveson DA, Neoptolemos JP. Understanding metastasis in pancreatic cancer: a call for new clinical approaches. Cell. 2012;148:21-23. [PubMed] [DOI] |
| 3. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 4. | Evans DB, Farnell MB, Lillemoe KD, Vollmer C, Strasberg SM, Schulick RD. Surgical treatment of resectable and borderline resectable pancreas cancer: expert consensus statement. Ann Surg Oncol. 2009;16:1736-1744. [PubMed] [DOI] |
| 5. | Hosein PJ, Macintyre J, Kawamura C, Maldonado JC, Ernani V, Loaiza-Bonilla A, Narayanan G, Ribeiro A, Portelance L, Merchan JR. A retrospective study of neoadjuvant FOLFIRINOX in unresectable or borderline-resectable locally advanced pancreatic adenocarcinoma. BMC Cancer. 2012;12:199. [PubMed] [DOI] |
| 6. | Pawlik TM, Laheru D, Hruban RH, Coleman J, Wolfgang CL, Campbell K, Ali S, Fishman EK, Schulick RD, Herman JM. Evaluating the impact of a single-day multidisciplinary clinic on the management of pancreatic cancer. Ann Surg Oncol. 2008;15:2081-2088. [PubMed] [DOI] |
| 7. | Schneider G, Hamacher R, Eser S, Friess H, Schmid RM, Saur D. Molecular biology of pancreatic cancer--new aspects and targets. Anticancer Res. 2008;28:1541-1550. [PubMed] |
| 9. | Tseng JF, Raut CP, Lee JE, Pisters PW, Vauthey JN, Abdalla EK, Gomez HF, Sun CC, Crane CH, Wolff RA. Pancreaticoduodenectomy with vascular resection: margin status and survival duration. J Gastrointest Surg. 2004;8:935-949; discussion 949-950. [PubMed] [DOI] |
| 10. | Fuhrman GM, Leach SD, Staley CA, Cusack JC, Charnsangavej C, Cleary KR, El-Naggar AK, Fenoglio CJ, Lee JE, Evans DB. Rationale for en bloc vein resection in the treatment of pancreatic adenocarcinoma adherent to the superior mesenteric-portal vein confluence. Pancreatic Tumor Study Group. Ann Surg. 1996;223:154-162. [PubMed] [DOI] |
| 11. | Poon RT, Fan ST, Lo CM, Liu CL, Lam CM, Yuen WK, Yeung C, Wong J. Pancreaticoduodenectomy with en bloc portal vein resection for pancreatic carcinoma with suspected portal vein involvement. World J Surg. 2004;28:602-608. [PubMed] [DOI] |
| 12. | Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, Weitz J. Arterial resection during pancreatectomy for pancreatic cancer: a systematic review and meta-analysis. Ann Surg. 2011;254:882-893. [PubMed] [DOI] |
| 13. | Bockhorn M, Burdelski C, Bogoevski D, Sgourakis G, Yekebas EF, Izbicki JR. Arterial en bloc resection for pancreatic carcinoma. Br J Surg. 2011;98:86-92. [PubMed] [DOI] |
| 14. | Goodman KA, Hajj C. Role of radiation therapy in the management of pancreatic cancer. J Surg Oncol. 2013;107:86-96. [PubMed] [DOI] |
| 15. | Katz MH, Pisters PW, Evans DB, Sun CC, Lee JE, Fleming JB, Vauthey JN, Abdalla EK, Crane CH, Wolff RA. Borderline resectable pancreatic cancer: the importance of this emerging stage of disease. J Am Coll Surg. 2008;206:833-846; discussion 846-848. [PubMed] [DOI] |
| 16. | Mehta VK, Fisher G, Ford JA, Poen JC, Vierra MA, Oberhelman H, Niederhuber J, Bastidas JA. Preoperative chemoradiation for marginally resectable adenocarcinoma of the pancreas. J Gastrointest Surg. 2001;5:27-35. [PubMed] [DOI] |
| 17. | Small W, Berlin J, Freedman GM, Lawrence T, Talamonti MS, Mulcahy MF, Chakravarthy AB, Konski AA, Zalupski MM, Philip PA. Full-dose gemcitabine with concurrent radiation therapy in patients with nonmetastatic pancreatic cancer: a multicenter phase II trial. J Clin Oncol. 2008;26:942-947. [PubMed] [DOI] |
| 18. | Stokes JB, Nolan NJ, Stelow EB, Walters DM, Weiss GR, de Lange EE, Rich TA, Adams RB, Bauer TW. Preoperative capecitabine and concurrent radiation for borderline resectable pancreatic cancer. Ann Surg Oncol. 2011;18:619-627. [PubMed] [DOI] |
| 19. | Patel M, Hoffe S, Malafa M, Hodul P, Klapman J, Centeno B, Kim J, Helm J, Valone T, Springett G. Neoadjuvant GTX chemotherapy and IMRT-based chemoradiation for borderline resectable pancreatic cancer. J Surg Oncol. 2011;104:155-161. [PubMed] [DOI] |
| 20. | 张 太平, 肖 剑春, 赵 玉沛. 胰体尾癌的规范化治疗. 中国普外基础与临床杂志. 2011;18:6-10. |
| 21. | Strasberg SM, Fields R. Left-sided pancreatic cancer: distal pancreatectomy and its variants: radical antegrade modular pancreatosplenectomy and distal pancreatectomy with celiac axis resection. Cancer J. 2012;18:562-570. [PubMed] [DOI] |
| 22. | Chang YR, Han SS, Park SJ, Lee SD, Yoo TS, Kim YK, Kim TH, Woo SM, Lee WJ, Hong EK. Surgical outcome of pancreatic cancer using radical antegrade modular pancreatosplenectomy procedure. World J Gastroenterol. 2012;18:5595-5600. [PubMed] [DOI] |
| 23. | Kitagawa H, Tajima H, Nakagawara H, Makino I, Miyashita T, Terakawa H, Nakanuma S, Hayashi H, Takamura H, Ohta T. A modification of radical antegrade modular pancreatosplenectomy for adenocarcinoma of the left pancreas: significance of en bloc resection including the anterior renal fascia. World J Surg. 2014;38:2448-2454. [PubMed] [DOI] |
| 24. | Strasberg SM, Drebin JA, Linehan D. Radical antegrade modular pancreatosplenectomy. Surgery. 2003;133:521-527. [PubMed] [DOI] |
| 25. | O'Morchoe CC. Lymphatic system of the pancreas. Microsc Res Tech. 1997;37:456-477. [PubMed] [DOI] |
| 26. | Strasberg SM, Linehan DC, Hawkins WG. Radical antegrade modular pancreatosplenectomy procedure for adenocarcinoma of the body and tail of the pancreas: ability to obtain negative tangential margins. J Am Coll Surg. 2007;204:244-249. [PubMed] [DOI] |
| 27. | Mitchem JB, Hamilton N, Gao F, Hawkins WG, Linehan DC, Strasberg SM. Long-term results of resection of adenocarcinoma of the body and tail of the pancreas using radical antegrade modular pancreatosplenectomy procedure. J Am Coll Surg. 2012;214:46-52. [PubMed] [DOI] |
| 28. | Rosso E, Langella S, Addeo P, Nobili C, Oussoultzoglou E, Jaeck D, Bachellier P. A safe technique for radical antegrade modular pancreatosplenectomy with venous resection for pancreatic cancer. J Am Coll Surg. 2013;217:e35-e39. [PubMed] [DOI] |
| 29. | Park HJ, You DD, Choi DW, Heo JS, Choi SH. Role of radical antegrade modular pancreatosplenectomy for adenocarcinoma of the body and tail of the pancreas. World J Surg. 2014;38:186-193. [PubMed] [DOI] |
| 30. | Kang CM, Kim DH, Lee WJ. Ten years of experience with resection of left-sided pancreatic ductal adenocarcinoma: evolution and initial experience to a laparoscopic approach. Surg Endosc. 2010;24:1533-1541. [PubMed] [DOI] |
| 31. | Yamamoto J, Saiura A, Koga R, Seki M, Katori M, Kato Y, Sakamoto Y, Kokudo N, Yamaguchi T. Improved survival of left-sided pancreas cancer after surgery. Jpn J Clin Oncol. 2010;40:530-536. [PubMed] [DOI] |
| 32. | Shimada K, Sakamoto Y, Sano T, Kosuge T. Prognostic factors after distal pancreatectomy with extended lymphadenectomy for invasive pancreatic adenocarcinoma of the body and tail. Surgery. 2006;139:288-295. [PubMed] [DOI] |
| 33. | Catheline JM, Turner R, Rizk N, Barrat C, Champault G. The use of diagnostic laparoscopy supported by laparoscopic ultrasonography in the assessment of pancreatic cancer. Surg Endosc. 1999;13:239-245. [PubMed] [DOI] |
| 34. | Reddy KR, Levi J, Livingstone A, Jeffers L, Molina E, Kligerman S, Bernstein D, Kodali VP, Schiff ER. Experience with staging laparoscopy in pancreatic malignancy. Gastrointest Endosc. 1999;49:498-503. [PubMed] [DOI] |
| 35. | White R, Winston C, Gonen M, D'Angelica M, Jarnagin W, Fong Y, Conlon K, Brennan M, Allen P. Current utility of staging laparoscopy for pancreatic and peripancreatic neoplasms. J Am Coll Surg. 2008;206:445-450. [PubMed] [DOI] |
| 36. | 牟 一平, 严 加费. 腹腔镜手术治疗胰体尾癌. 中国普外基础与临床杂志. 2011;18:14-16. |
| 37. | Pisters PW, Lee JE, Vauthey JN, Charnsangavej C, Evans DB. Laparoscopy in the staging of pancreatic cancer. Br J Surg. 2001;88:325-337. [PubMed] [DOI] |
| 38. | Kooby DA, Hawkins WG, Schmidt CM, Weber SM, Bentrem DJ, Gillespie TW, Sellers JB, Merchant NB, Scoggins CR, Martin RC. A multicenter analysis of distal pancreatectomy for adenocarcinoma: is laparoscopic resection appropriate? J Am Coll Surg. 2010;210:779-785, 786-787. [PubMed] |
| 39. | Magge D, Gooding W, Choudry H, Steve J, Steel J, Zureikat A, Krasinskas A, Daouadi M, Lee KK, Hughes SJ. Comparative effectiveness of minimally invasive and open distal pancreatectomy for ductal adenocarcinoma. JAMA Surg. 2013;148:525-531. [PubMed] [DOI] |
| 40. | Marangos IP, Buanes T, Røsok BI, Kazaryan AM, Rosseland AR, Grzyb K, Villanger O, Mathisen Ø, Gladhaug IP, Edwin B. Laparoscopic resection of exocrine carcinoma in central and distal pancreas results in a high rate of radical resections and long postoperative survival. Surgery. 2012;151:717-723. [PubMed] [DOI] |
| 41. | DiNorcia J, Schrope BA, Lee MK, Reavey PL, Rosen SJ, Lee JA, Chabot JA, Allendorf JD. Laparoscopic distal pancreatectomy offers shorter hospital stays with fewer complications. J Gastrointest Surg. 2010;14:1804-1812. [PubMed] [DOI] |
| 42. | Kim J, Han HS, Yoon YS, Cho JY, Ahn KS, Kwon Y. Outcomes of the patients who were postoperatively diagnosed as malignancy after laparoscopic distal pancreatectomy. Surg Laparosc Endosc Percutan Tech. 2012;22:467-470. [PubMed] [DOI] |
| 43. | Kang CM, Lee SH, Lee WJ. Minimally invasive radical pancreatectomy for left-sided pancreatic cancer: current status and future perspectives. World J Gastroenterol. 2014;20:2343-2351. [PubMed] [DOI] |
| 44. | APPLEBY LH. The coeliac axis in the expansion of the operation for gastric carcinoma. Cancer. 1953;6:704-707. [PubMed] [DOI] |
| 45. | APPLEBY LH. Removal of the celiac axis in gastrectomy for carcinoma of the stomach in selected cases: a ten-year assessment. J Int Coll Surg. 1960;34:143-147. [PubMed] |
| 46. | Tanaka E, Hirano S, Tsuchikawa T, Kato K, Matsumoto J, Shichinohe T. Important technical remarks on distal pancreatectomy with en-bloc celiac axis resection for locally advanced pancreatic body cancer (with video). J Hepatobiliary Pancreat Sci. 2012;19:141-147. [PubMed] [DOI] |
| 47. | Mayumi T, Nimura Y, Kamiya J, Kondo S, Nagino M, Kanai M, Miyachi M, Hamaguchi K, Hayakawa N. Distal pancreatectomy with en bloc resection of the celiac artery for carcinoma of the body and tail of the pancreas. Int J Pancreatol. 1997;22:15-21. [PubMed] [DOI] |
| 48. | Kondo S, Katoh H, Hirano S, Ambo Y, Tanaka E, Okushiba S, Morikawa T. Results of radical distal pancreatectomy with en bloc resection of the celiac artery for locally advanced cancer of the pancreatic body. Langenbecks Arch Surg. 2003;388:101-106. [PubMed] [DOI] |
| 49. | Kondo S, Katoh H, Shimizu T, Omi M, Hirano S, Ambo Y, Okushiba S, Morikawa T. Preoperative embolization of the common hepatic artery in preparation for radical pancreatectomy for pancreas body cancer. Hepatogastroenterology. 2000;47:1447-1449. [PubMed] |
| 50. | Hirano S, Kondo S, Hara T, Ambo Y, Tanaka E, Shichinohe T, Suzuki O, Hazama K. Distal pancreatectomy with en bloc celiac axis resection for locally advanced pancreatic body cancer: long-term results. Ann Surg. 2007;246:46-51. [PubMed] [DOI] |
| 51. | Takada M, Kondo S, Hirano S, Miura T. [Indications for and postoperative problems of distal pancreatectomy with en bloc celiac axis resection for locally advanced pancreatic body cancer]. Nihon Geka Gakkai Zasshi. 2011;112:177-181. [PubMed] |