修回日期: 2015-04-10
接受日期: 2015-04-16
在线出版日期: 2015-05-28
目的: 探讨术前应用乌司他丁对小鼠70%肝切除术后肝功能及一磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)信号通路的影响.
方法: ♂ICR小鼠48只, 体质量25-30 g, 随机均分为70%肝切除对照组和乌司他丁组. 检测术后第1、3、5、7天肝功能指标, 残肝组织病理学改变以及AMPK蛋白活化情况.
结果: 与对照组比较, 乌司他丁组术后第1、3天谷草转氨酶水平较低, 差异有统计学意义(P<0.05); 与对照组比较, 乌司他丁组术后第3天乳酸脱氢酶水平有所降低, 差异有统计学意义(P<0.05). 与对照组比较, Western blot结果显示乌司他丁组肝切除术后早期AMPK磷酸化较晚; 与对照组比较, Western blot结果显示乌司他丁组肝切除术后胆盐输出泵蛋白(bile salt export protein, BSEP)水平较高.
结论: 术前应用乌司他丁可以保护术后肝功能, 降低肝损伤, 促进术后肝功能的恢复. 其机制可能与维持肝细胞能量供应以及促进肝细胞极化有关.
核心提示: 该论文重点探讨了肝切除围手术期应用乌司他丁促进术后肝功能恢复的微观机制, 结果提示其机制确实与一磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)信号通路有关; 通过进一步探讨得出, 乌司他丁可以维持肝细胞能量供应和促进肝细胞极化; 最大的亮点是本文首次阐述了乌司他丁对AMPK信号通路的影响, 为以后的基础研究提供较大的参考价值.
引文著录: 訾雪剑, 姚辉, 伏晓, 仇毓东, 贾文俊. 术前应用乌司他丁对小鼠肝大部分切除术后肝功能及一磷酸腺苷活化蛋白激酶信号通路的影响. 世界华人消化杂志 2015; 23(15): 2363-2372
Revised: April 10, 2015
Accepted: April 16, 2015
Published online: May 28, 2015
AIM: To investigate the effect of preoperative ulinastatin on liver function and adenosine monophosphate-activated protein kinase (AMPK) signaling pathway in mice after 70% hepatectomy.
METHODS: A total of 48 male ICR mice weighing 25-30 g were randomly divided into a control group and an ulinastatin group. Blood and liver tissue samples were collected on days 1, 3, 5 and 7 after 70% hepatectomy. Serum alanine aminotransferase (ALT), aspartate transaminase (AST), total bilirubin (TB) and lactate dehydrogenase (LDH) levels were measured, while liver tissues were used for morphology study and AMPK signaling analysis.
RESULTS: Serum AST levels on days 1 and 3 and serum LDH levels on day 3 after hepatectomy were significantly lower in the ulinastatin group than in the control group (P < 0.05). Subsequent mechanism analysis revealed that AMPK signaling pathway was activated significantly later and bile salt export protein (BSEP) was expressed significantly higher in the ulinastatin group than in the control group.
CONCLUSION: Ulinastatin can reduce liver injury by promoting the recovery of liver function after liver resection, via mechanisms associated with AMPK signaling.
- Citation: Zi XJ, Yao H, Fu X, Qiu YD, Jia WJ. Preoperative ulinastatin promotes liver function via adenosine monophosphate-activated protein kinase signaling pathway in mice after partial hepatectomy. Shijie Huaren Xiaohua Zazhi 2015; 23(15): 2363-2372
- URL: https://www.wjgnet.com/1009-3079/full/v23/i15/2363.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i15.2363
随着精准肝脏外科理念的推广和技术的发展, 肝切除的安全性已大大提高[1-3], 而如何有效地减少术后肝损害和促进其早期恢复仍然是外科研究的重点. 近年来, 大量临床研究证实肝切除围手术期应用乌司他丁可以抑制术后炎症反应, 有效地保护术后肝功能. 也有动物实验[4-7]证实, 大鼠大部分肝切除围手术期使用乌司他丁可以有效保护术后肝功能、促进残肝再生, 其机制可能与信号传导与转录活化因子3(signal transducers and activators of transcription 3, STAT3)信号通路有关. 但乌司他丁保护术后肝功能的机制是否与一磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)信号通路有关, 国内尚无报道. 本研究拟通过建立小鼠70%肝切除的基础上, 观察术前使用乌司他丁对术后肝功能以及AMPK信号通路的影响, 进而探讨两者之间的关联.
实验采用♂ICR小鼠48只, 体质量25-30 g(购自南京大学附属鼓楼医院动物实验中心). 饲养室温度为18 ℃-22 ℃, 湿度为60%, 每天光照12 h(6:00-18:00). 动物被随机分为2组(每组24只): 70%肝切除对照组和乌司他丁组, 乌司他丁组于麻醉后和肝切除前给予尾静脉注射乌司他丁(剂量50000 U/kg), 对照组则注射等量的生理盐水. 注射用乌司他丁, 商品名"天普洛安", 5万单位/瓶, 批号: H19990133; β-actin、AMPK、p-AMPK、occludin、胆盐输出泵蛋白(bile salt export protein, BSEP)抗体均购自Santa Cruz; 免疫组织化学试剂盒购自武汉博士德生物工程有限公司(货号: SA1050); PVDF膜购自密理博公司(货号: IPVH00010); ECL发光液购自密理博公司(货号: WBKLS0010).
1.2.1 模型建立: 两组小鼠术前均禁食12 h, 不禁水. 乌司他丁组于麻醉后和开腹前行尾静脉注射乌司他丁(剂量50000 U/kg), 对照组则给予等量的生理盐水. 所有小鼠均采用腹腔注射氯胺酮麻醉(剂量0.3 mL/100 g), 70%肝切除术选用经典的Higgins-Anderson 70%肝切除术, 依次切除小鼠左叶及中叶后关腹[8,9]. 两组小鼠术后均给予常规饮食、饮水.
1.2.2 标本处理: 各组小鼠分别于肝切除术后第1、3、5、7天处死, 处死后取出残肝组织, 生理盐水漂洗后保存. 其中部分组织固定在40 g/L甲醛保存, 部分组织放置液氮和-80 ℃冰箱中保存.
1.2.3 术后血清学指标检测: 各组小鼠分别于肝切除术后第1、3、5、7天处死, 处死前经眼球取血, 并及时用生化分析仪检测血清中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)、总胆红素及乳酸脱氢酶指标.
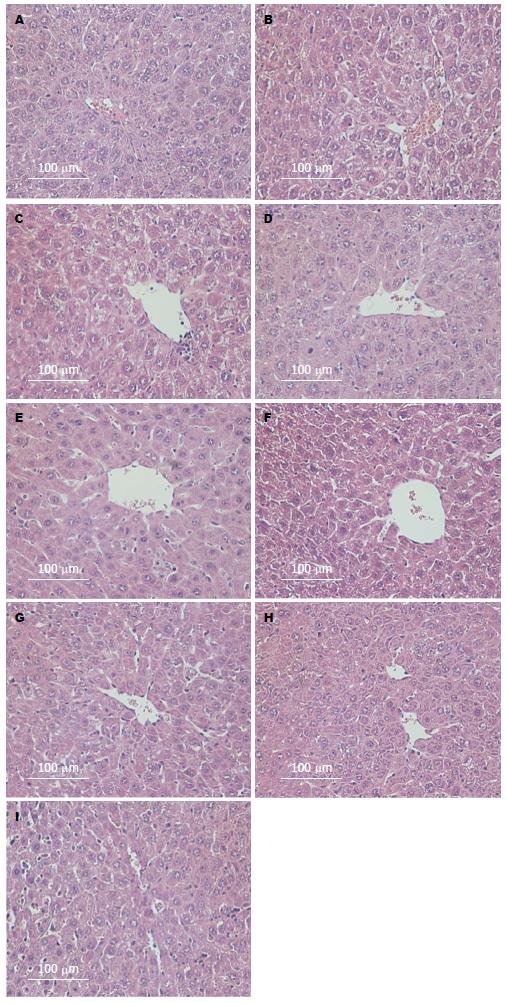
1.2.4 组织病理学检测: 各组小鼠分别于肝切除术后第1、3、5、7天取0.5 cm×0.5 cm×0.5 cm左右小鼠肝组织在40 g/L甲醛中固定后, 包埋切片行HE染色, 并进行厚度为5 μm的连续切片, HE染色后观察肝脏病理结构的改变.
1.2.5 Western blot检测蛋白水平: 用细胞裂解液提取总蛋白, 将提取的总蛋白进行十二烷基硫酸钠一聚丙烯酰胺凝胶电泳. 电泳结束后取下凝胶, 将产物电转移到PVDF膜上, 加入1:1000稀释的一抗, 包括β-actin、AMPK、p-AMPK、occludin、BSEP, 4 ℃孵育过夜. 二抗室温孵育1 h, 将PVDF膜置于增强化学发光试剂(ECL)中显色.
统计学处理 采用SPSS19.0统计软件分析, 实验数据以mean±SD表示, 两组间均数差异采用独立样本t检验, P<0.05为差异具有统计学意义.
所有各组小鼠术后恢复良好, 试验过程中处死前均未出现死亡.
两组小鼠肝切除术后ALT、AST、总胆红素及乳酸脱氢酶水平均于早期达到峰值, 之后逐渐恢复. 与对照组比较, 乌司他丁组术后第1、3、5、7天ALT水平较低, 尤以第1、3天降低较明显, 但差异均无统计学意义(P>0.05); 与对照组比较, 乌司他丁组术后第1、3天AST水平较低, 差异具有统计学意义(P<0.05), 但术后第5、7天差异无统计学意义(P>0.05); 与对照组比较, 乌司他丁组术后第1、3、5、7天总胆红素水平较低, 但差异均无统计学意义(P>0.05); 与对照组比较, 乌司他丁组术后第3天乳酸脱氢酶水平较低, 差异具有统计学意义(P<0.05), 但术后第1、5、7天差异无统计学意义(P>0.05)(表1).
| 观察指标 | 对照组 | 乌司他丁组 | t值或χ2值 | P值 |
| 术后1 d | ||||
| 谷丙转氨酶(U/L) | 329.32±21.51 | 227.35±39.36 | 5.660 | 0.599 |
| 谷草转氨酶(U/L) | 775.57±57.85 | 472.25±17.99 | 5.010 | 0.017 |
| 总胆红素(μmol/L) | 3.25±0.56 | 1.80±0.25 | 2.345 | 0.302 |
| 乳酸脱氢酶(U/L) | 2165.83±113.32 | 1759.67±125.51 | 2.402 | 0.764 |
| 术后3 d | ||||
| 谷丙转氨酶(U/L) | 266.98±17.45 | 134.30±24.84 | 4.370 | 0.603 |
| 谷草转氨酶(U/L) | 421.53±47.83 | 227.48±12.50 | 3.925 | 0.019 |
| 总胆红素(μmol/L) | 2.70±0.26 | 1.70±0.22 | 2.919 | 0.882 |
| 乳酸脱氢酶(U/L) | 1615.83±103.91 | 1400.00±40.85 | 1.933 | 0.031 |
| 术后5 d | ||||
| 谷丙转氨酶(U/L) | 79.40±8.22 | 59.18±11.32 | 1.445 | 0.410 |
| 谷草转氨酶(U/L) | 181.22±10.99 | 167.55±19.06 | 0.621 | 0.507 |
| 总胆红素(μmol/L) | 2.00±0.10 | 1.60±0.17 | 2.052 | 0.383 |
| 乳酸脱氢酶(U/L) | 1498.67±59.00 | 1359.00±66.03 | 1.577 | 0.721 |
| 术后7 d | ||||
| 谷丙转氨酶(U/L) | 55.43±9.21 | 48.38±8.64 | 0.558 | 0.831 |
| 谷草转氨酶(U/L) | 175.93±9.95 | 161.95±11.00 | 0.943 | 0.944 |
| 总胆红素(μmol/L) | 1.43±0.14 | 1.45±0.40 | -0.040 | 0.166 |
| 乳酸脱氢酶(U/L) | 1324.17±30.49 | 1250.17±59.77 | 1.103 | 0.218 |
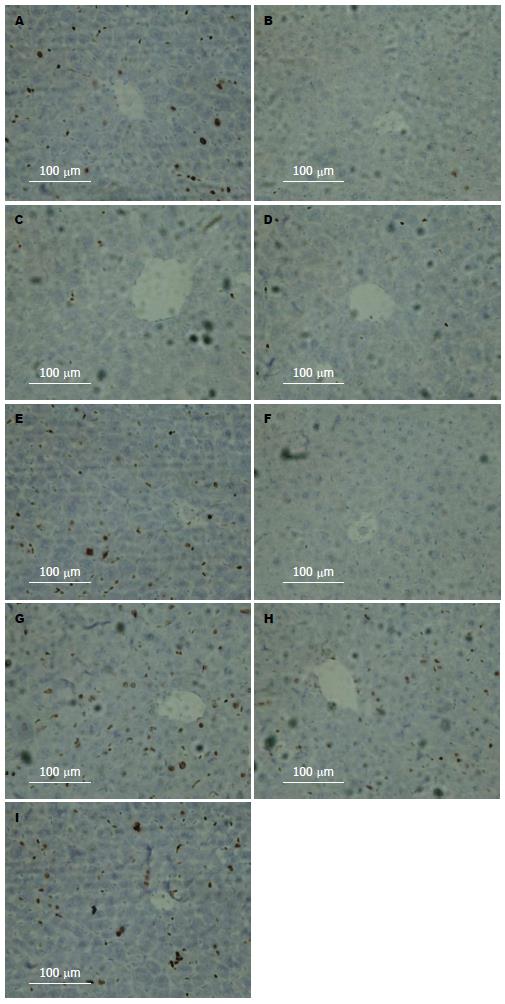
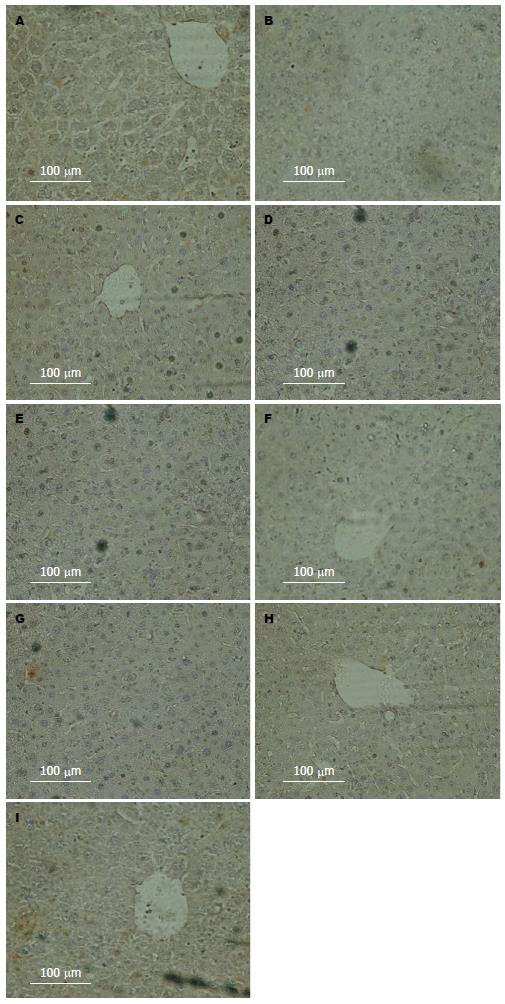
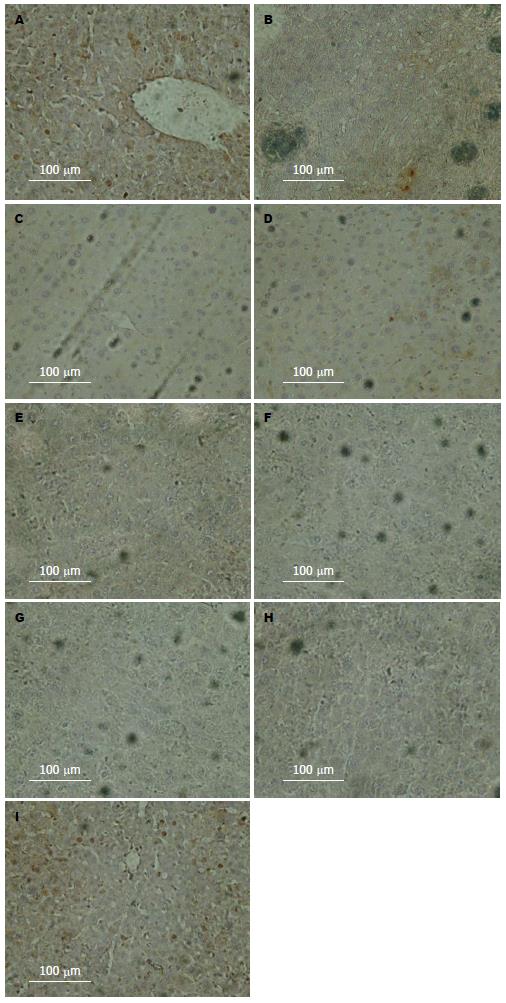
与对照组比较, 乌司他丁组HE染色镜下观察无明显差异、免疫组织化学显示紧密连接蛋白也没有明显差异(图1-4); 与对照组比较, Western blot结果显示肝切除术后早期AMPK的磷酸化明显晚于对照组; 与对照组比较, Western blot结果显示肝切除术后BSEP水平高于对照组(图5).
肝切除术仍然是肝脏外科最主要的治疗手段[10], 但是病灶切除术后肝功能能否顺利恢复将直接影响患者的康复和生存. 乌司他丁是一种尿胰蛋白酶抑制剂, 具有抑制多种酶的活性, 最早应用于胰腺炎的治疗并获得良好的疗效[11-19], 之后被发现其也可以保护肝脏功能, 抑制转氨酶的升高[20-26]. 但具体机制大都报道与抑制炎症有关, 而本文重点探讨应用乌司他丁对AMPK信号通路的影响, 进而阐述其保护肝功能的机制.
研究结果显示, 与对照组比较, 乌司他丁组术后第1、3天ALT、AST、总胆红素以及乳酸脱氢酶水平明显降低, 尤以术后第1、3天AST、术后第3天乳酸脱氢酶降低较明显, 差异具有统计学意义(P<0.05), 说明乌司他丁可以保护肝脏功能, 降低术后肝损害. 与对照组比较, Western blot结果显示肝切除术后早期AMPK的磷酸化明显晚于对照组; 与对照组比较, Western blot结果显示肝切除术后BSEP水平高于对照组.
AMPK是细胞内的一种能量感受器, 当细胞缺乏能量时, AMPK就会被激活(即磷酸化), 从而抑制消耗能量的活动, 激活产生能量的通路. 而AMPK这种能量调节实际上是对细胞的一种保护作用[27,28]. 肝切除后, 肝再生的过程需要大量的能量, 而且术后严重的炎症反应也会增加能量消耗以及加重肝细胞的损伤. 而Western blot结果显示: 在肝切除后肝再生早期, 乌司他丁组AMPK的磷酸化显著推迟, 说明乌司他丁可以显著缓解肝细胞的能量短缺, 从而维持肝细胞的能量供应, 降低了术后肝功能损害. 因此, 乌司他丁组术后第1、3天ALT、AST、总胆红素以及乳酸脱氢酶水平明显降低.
肝细胞的极化涉及肝细胞膜血窦面和胆小管面等不同功能结构域的形成, 以及在不同肝细胞膜结构域上多种功能蛋白的表达[29]. 而BSEP作为肝细胞极化的标志, 已经得到广泛应用. 而且BSEP仅在毛细胆管侧的肝细胞膜上表达. 其作用除了转运牛磺胆酸外, 还介导牛磺鹅脱氧胆酸、牛磺熊脱氧胆酸、甘氨胆酸的ATP依赖的转运[30,31]. 本研究Western blot结果显示: 虽然紧密连接蛋白occludin水平没有明显差异, 但乌司他丁组BSEP水平明显高于对照组, 表明乌司他丁能够显著促进肝细胞极化, 从而加快肝功能的恢复.
总之, 本研究提示肝切除术前使用乌司他丁可以保护术后肝功能, 降低肝损伤, 促进术后肝功能的恢复. 其机制可能与抑制炎症反应、维持肝细胞能量供应以及促进肝细胞极化有关, 具体机制仍需进一步研究.
近年来, 大量文献报道肝切除围手术期应用乌司他丁有益于术后肝功的恢复以及残肝再生, 但具体机制是否与一磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)信号通路有关尚未见报道.
施宝民, 教授, 上海同济医院普外科, 同济大学附属同济医院普外科
本研究采用小鼠70%肝切除模型, 通过术前应用乌司他丁, 旨在探讨乌司他丁对肝切除术后肝功能以及AMPK信号通路的影响, 为肝脏外科应用乌司他丁提供有价值的实验依据.
肝切除围手术期应用乌司他丁可以促进术后肝功能的恢复已经被国内外大量的临床研究证实; 相关动物试验证实其还可以促进残肝再生, 机制可能与抑制炎症反应以及维持能量供应有关.
目前已有大量临床文献证实肝切除围手术期应用乌司他丁可以促进患者早期康复, 而从基础层面探讨其机制的文章少见.
应用转化医学的方法, 通过基础实验探究机制, 取得结果, 为临床肝脏外科应用乌司他丁提供理论依据.
本文立题新颖, 分组科学, 设计合理, 研究方法得当, 研究结论令人信服.
编辑: 韦元涛 电编:都珍珍
| 1. | Makuuchi M, Sano K. The surgical approach to HCC: our progress and results in Japan. Liver Transpl. 2004;10:S46-S52. [PubMed] [DOI] |
| 2. | Fan ST. Precise hepatectomy guided by the middle hepatic vein. Hepatobiliary Pancreat Dis Int. 2007;6:430-434. [PubMed] |
| 3. | Qiu Y, Zhu X, Zhu R, Zhou J, Zhou T, Wang Y, Ding Y. The clinical study of precise hemihepatectomy guided by middle hepatic vein. World J Surg. 2012;36:2428-2435. [PubMed] [DOI] |
| 4. | 朱 宇麟, 周 荣胜, 杨 会, 谭 敬, 张 晓琪, 刘 齐宁. 乌司他丁对肝大部切除合并缺血再灌注损伤后肝再生及TNF-α/IL-6/STAT-3信号通路的影响. 南方医科大学学报. 2012;32:1301-1306. |
| 5. | Zhu Y, Zhou R, Yang H, Tan J, Zhang X, Liu Q. [Effect of ulinastatin pretreatment on liver regeneration and TNF-α/IL-6/STAT-3 signal pathway in rats with major hepatectomy and ischemia-reperfusion injury]. Nan Fang Yi Ke Da Xue Xue Bao. 2012;32:1301-1306. [PubMed] |
| 6. | 谭 敬, 朱 宇麟, 周 荣胜, 张 晓琪, 赵 颌, 张 晓琪, 刘 齐宁. 乌司他丁对肝大部切除合并缺血再灌注损伤后肝再生和能量代谢的影响. 西安交通大学学报(医学版). 2014;35:89-93. |
| 8. | Mezera V, Kučera O, Moravcová A, Peterová E, Červinková Z. Epigallocatechin gallate does not accelerate the early phase of liver regeneration after partial hepatectomy in rats. Dig Dis Sci. 2014;59:976-985. [PubMed] [DOI] |
| 11. | Matsukawa H, Hara A, Ito T, Fukui K, Sato K, Ichikawa M, Yoshioka M, Seki H, Yamataka K, Takizawa K. [Continuous arterial infusion of protease inhibitor with supplementary therapy for the patients with severe acute pancreatitis--clinical effect of arterial injection of ulinastatin]. Nihon Shokakibyo Gakkai Zasshi. 1998;95:1229-1234. [PubMed] |
| 12. | Ohwada M, Watanabe N, Maeda M, Gotoh M, Teramoto J, Moriya H, Nakajima T, Okamoto T, Tsuji N, Kobayashi D. New endoscopic treatment for chronic pancreatitis, using contrast media containing ulinastatin and prednisolone. J Gastroenterol. 1997;32:216-221. [PubMed] [DOI] |
| 13. | Maciejewski R, Burdan F, Burski K, Madej B, Ziemiakowicz R, Dabrowski A, Wallner G. Selected biochemical parameters and ultrastructural picture of pancreas due to Ulinastatin treatment of experimental acute pancreatitis. Exp Toxicol Pathol. 2005;56:305-311. [PubMed] [DOI] |
| 14. | Wang G, Wen J, Wilbur RR, Wen P, Zhou SF, Xiao X. The effect of somatostatin, ulinastatin and Salvia miltiorrhiza on severe acute pancreatitis treatment. Am J Med Sci. 2013;346:371-376. [PubMed] [DOI] |
| 15. | Abraham P, Rodriques J, Moulick N, Dharap S, Chafekar N, Verma PK, Agrawal A, Prabhakar B, Basavaraj A, Shah A. Efficacy and safety of intravenous ulinastatin versus placebo along with standard supportive care in subjects with mild or severe acute pancreatitis. J Assoc Physicians India. 2013;61:535-538. [PubMed] |
| 16. | Feng C, Su X, Zhou X, Wang LL, Li B, Chen LI, Lv FQ, Li TS. Early peritoneal lavage with ulinastatin improves outcome and enhances multi-organ protection in a model of severe acute pancreatitis. Exp Ther Med. 2015;9:1171-1177. [PubMed] |
| 20. | Aihara T, Shiraishi M, Hiroyasu S, Hatsuse K, Mochizuki H, Seki S, Hiraide H, Muto Y. Ulinastatin, a protease inhibitor, attenuates hepatic ischemia/reperfusion injury by downregulating TNF-alpha in the liver. Transplant Proc. 1998;30:3732-3734. [PubMed] [DOI] |
| 25. | Jeong CW, Lee CS, Lee SH, Jeung HJ, Kwak SH. Urinary trypsin inhibitor attenuates liver enzyme elevation after liver resection. Korean J Anesthesiol. 2012;63:120-123. [PubMed] [DOI] |
| 26. | Yang H, Mao Y, Lu X, Sang X, Du S, Zhao H, Xu Y, Xu H, Yang Z, Chi T. The effects of urinary trypsin inhibitor on liver function and inflammatory factors in patients undergoing hepatectomy: a prospective, randomized, controlled clinical study. Am J Surg. 2011;202:151-157. [PubMed] [DOI] |
| 27. | Foretz M, Viollet B. Regulation of hepatic metabolism by AMPK. J Hepatol. 2011;54:827-829. [PubMed] [DOI] |
| 28. | Zhang YL, Guo H, Zhang CS, Lin SY, Yin Z, Peng Y, Luo H, Shi Y, Lian G, Zhang C. AMP as a low-energy charge signal autonomously initiates assembly of AXIN-AMPK-LKB1 complex for AMPK activation. Cell Metab. 2013;18:546-555. [PubMed] [DOI] |
| 29. | Wakabayashi Y, Dutt P, Lippincott-Schwartz J, Arias IM. Rab11a and myosin Vb are required for bile canalicular formation in WIF-B9 cells. Proc Natl Acad Sci U S A. 2005;102:15087-15092. [PubMed] [DOI] |
| 30. | Turncliff RZ, Tian X, Brouwer KL. Effect of culture conditions on the expression and function of Bsep, Mrp2, and Mdr1a/b in sandwich-cultured rat hepatocytes. Biochem Pharmacol. 2006;71:1520-1529. [PubMed] [DOI] |
| 31. | Kidambi S, Yarmush RS, Novik E, Chao P, Yarmush ML, Nahmias Y. Oxygen-mediated enhancement of primary hepatocyte metabolism, functional polarization, gene expression, and drug clearance. Proc Natl Acad Sci U S A. 2009;106:15714-15719. [PubMed] [DOI] |