修回日期: 2015-03-27
接受日期: 2015-04-02
在线出版日期: 2015-05-18
目的: 观察Survivin shRNA、结肠腺瘤息肉易感基因(adenomatous polyposis coli, APC)片段联合对HT-29细胞Survivin表达及细胞增殖的影响.
方法: 构建Survivin shRNA慢病毒载体、APC有效片段慢病毒载体, 对HT-29细胞分别采用单慢病毒载体侵染及联合侵染. 实验分阴性对照组、空载组、shRNA组、APC组、shRNA+APC联合组, 对侵染48 h后的HT-29细胞进行real-time PCR、Western blot及CCK8细胞增殖检测, 检测Survivin mRNA、蛋白表达水平及对细胞增殖的影响.
结果: (1)shRNA+APC联合组与其余各组相比, Survivin mRNA表达量显著下降(P<0.05); (2)shRNA+APC联合组与其余各组相比, 其Survivin蛋白抑制率明显高于其余各组(P<0.05); (3)shRNA+APC联合组与其余各组相比, 细胞增殖速度低于其余各组(P<0.05).
结论: Survivin shRNA与APC片段联合能抑制HT-29细胞内Survivin mRNA及蛋白的表达, 同时能够抑制细胞增殖能力, 并且优于单个基因侵染.
核心提示: 双基因联合治疗对结肠癌HT-29细胞的增殖的抑制及对Survivin基因表达的抑制效果均优于单个基因治疗, 为进一步研究动物体内实验提供了一定的实验基础. 同时双基因及多基因联合也有望成为一种新的肿瘤治疗手段.
引文著录: 袁禧先, 隋子奇, 孙理婷, 张爽, 杨延涛, 薛鸿鹏, 葛文松, 王凤荣. 慢病毒介导Survivin shRNA与结肠腺瘤息肉易感基因片段联合对HT-29细胞的影响. 世界华人消化杂志 2015; 23(14): 2250-2255
Revised: March 27, 2015
Accepted: April 2, 2015
Published online: May 18, 2015
AIM: To observe the effect of Survivin shRNA combined with adenomatous polyposis coli (APC) fragment on the expression of Survivin and cell proliferation in HT-29 cells.
METHODS: Lentiviral vectors for Survivin shRNA and APC fragment were constructed and transfected into HT-29 cells, alone or in combination. Cells were divided into a negative control group, an empty vector group, an shRNA group, an APC group, and an shRNA + APC group. After 48 h of infection, the Survivin mRNA and protein expression was detected by real-time PCR and Western blot, respectively. The proliferation of cells was assayed by CCK8.
RESULTS: ShRNA + APC significantly decreased the expression of Survivin mRNA and protein and cell proliferation compared with the other groups (P < 0.05 for all).
CONCLUSION: Survivin shRNA combined with APC fragment can inhibit the expression of Survivin mRNA and protein and down-regulate cell proliferation in HT-29 cells.
- Citation: Yuan XX, Sui ZQ, Sun LT, Zhang S, Yang YT, Xue HP, Ge WS, Wang FR. Effect of lentiviral-mediated delivery of Survivin shRNA with adenomatous polyposis coli fragment in HT-29 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(14): 2250-2255
- URL: https://www.wjgnet.com/1009-3079/full/v23/i14/2250.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i14.2250
结肠癌发病机制涉及到多个异常失活、异常表达基因的共同作用. 针对于这些功能异常的基因作为靶基因对其进行纠正治疗, 可能会对结肠癌的进展产生一定影响. 结肠腺瘤易感基因(adenomatous polyposis coli, APC)突变导致其表达"短截型"APC蛋白, 从而激活下游Survivin基因的转录过程, 导致癌症并引起癌症的进一步进展[1]. Survivin基因是目前发现最强的凋亡抑制因子, 通过抑制细胞凋亡并参与细胞的有丝分裂过程而发挥其功能[2]. 目前已经有学者将APC、Survivin shRNA基因利用载体分别转染结肠癌细胞后发现能够对结肠癌细胞的增殖起到抑制作用, 但将两者联合应用尚未见报道. 故本研究选取了在结肠癌发生进展过程中密切相关的基因APC、Survivin, 采用干扰异常表达基因和补偿异常失活基因相结合来达到对结肠癌联合治疗, 以探求对结肠癌更加有效治疗方式. 采用Survivin shRNA、APC有效片段(aa1020-1698)慢病毒载体联合侵染HT-29细胞, 来观察细胞增殖及Survivin基因在HT-29细胞内的表达水平, 从而为结肠癌双基因联合治疗提供实验依据.
结肠癌HT-29细胞株、293T细胞株(中科院上海细胞所); PDS019-pL质粒(上海诺百生物公司); APC有效片段质粒(上海捷锐生物公司); McCoy's 5a培养基、DMEM培养基(美国Gibco公司); 胎牛血清(美国Gibco公司); 青霉素-链霉素(上海碧云天生物公司); 感受态细胞DH-5α、real-time PCR试剂盒(日本TaKaRa公司); Survivin抗体、GAPDH抗体(美国Santa Cruz公司); 质粒小量抽提试剂盒(康宁生命科学公司); 引物均由上海捷瑞生物公司合成.
1.2.1 shRNA质粒构建: 本课题组之前相关实验筛选出Survivin干扰效率最佳的siRNA片段为5'-ACTGGACAGAGAAAGAGCC-3'[3], 对siRNA两端加上酶切位点, 中间加上loop序列, 设计出1对互补的shRNA oligo, 1对oligo交由上海捷瑞生物公司合成. 将上述oligo退火形成双链, 用限制性内切酶BsmBⅠ对PDS019-pL质粒单酶切, 酶切后胶回收大片段. 将退火oligo与酶切后的载体用T4连接酶连接, 连接液转化感受态, 涂布于含有抗生素的LB固体培养基上, 37 ℃倒置培养过夜筛选出阳性克隆. 挑单菌落, 质粒小抽, 送于上海捷瑞生物公司测序. Snapgene软件对测序结果进行比对, shRNA序列与设计完全一致.
1.2.2 慢病毒包装: 对shRNA慢病毒质粒、APC慢病毒质粒、空载质粒分别采用三质粒包装系统共同转染293T细胞进行慢病毒包装, 包装后进行过滤及滴度测定.
1.2.3 细胞培养及实验分组: HT-29细胞采用含10%FBS的McCoy's 5a完全培养液进行培养, 常规操作培养HT-29细胞. 实验分阴性对照组、空载组、shRNA组、APC组、shRNA+APC联合组, 各组分别用对应的慢病毒载体对细胞进行侵染, 阴性对照组不做任何处理. 将HT-29细胞以每孔5×105密度铺于12孔板上, 当细胞密度达70%时, 采用空载慢病毒分别以MOI值 = 0、2、5、10、30、60、120侵染HT-29细胞, 侵染过夜, 换新鲜培养液继续培养, 观察72 h阳性细胞比率及细胞生长状态, 确定最适MOI值, 以最适MOI值侵染HT-29细胞.
1.2.4 Real-time PCR测定Survivin mRNA水平: 慢病毒侵染细胞48 h后, 采用TRIzol法提取HT-29细胞总RNA, 取800 ng总RNA, 用RT-PCR试剂盒采用二步法进行反转录. 反转录后, 取1 μL产物进行实时定量测定. 用于扩增Survivin的引物为Sense primer: 5'-CAGATTTGAATCGCGGGACCC-3'; antisense primer: 5'-CCAAGTCTGGCTCGTTC
TCAG-3'. 以β-actin作内参基因, 通过Ct值进行数据分析其mRNA表达相对水平. 运用Ct值计算出各组Survivin mRNA的相对含量, 相对含量用2-△△Ct来表示, △△Ct = (实验组Surivivin平均Ct值-实验组β-actin平均Ct值)-(空载组Surivivin平均Ct值-空载组β-actin平均Ct值). β-actin引物为上游引物: 5'-GTGGACATCCGCAAAGAC-3'; 下游引物: 5'-AAAGGGTGTAACGCAACTAA-3'.
1.2.5 Western blot测定Survivin蛋白表达水平: 慢病毒侵染HT-29细胞48 h后, 用预冷的PBS液漂洗细胞, 吸取残留培养基, 向其中加入蛋白裂解液, 提取细胞总蛋白. 将提取的总蛋白用BCA法测定蛋白浓度. 将样品经SDS-PAGE凝胶电泳分离后条带转移至PVDF膜上, 经过洗膜、封闭缓冲液中封闭1 h、加入一抗4 ℃过夜、TBS洗膜3次、加二抗孵育1 h、洗膜3次过程后, 行ECL显色, 曝光胶片, 并进行光密度分析. 以GAPDH作内参照, Survivin蛋白相对表达水平 = 各组条带吸光度值/GAPDH条带吸光度值. Survivin蛋白抑制率 = 1-实验组相对表达水平/阴性对照组相对表达水平.
1.2.6 CCK8法测定细胞增殖的变化: 提前对HT-29细胞进行CCK8预实验, 以确定加入CCK8溶液后最佳孵育时间和实验最适细胞数. 待慢病毒侵染细胞48 h后, 将细胞从培养皿上消化下来, 每孔按照细胞数15000个铺于96孔板上, 待细胞贴壁后向其中分别滴加10 μL CCK8试剂, 37 ℃孵育, 孵育后用酶标仪测定A值, 即为0 h. 按照同样的方式测定24、48、72、96 h A值. 每组实验设3个复孔, 每次测定时重复3次. 实验除上述5组外, 额外再设一个不含细胞的空白调零组, 以对转染病毒后的细胞增殖情况进行分析, 计算各组病毒对于细胞增殖的抑制率. 根据测定A值作出细胞增殖曲线.
统计学处理 实验数据采用SPSS17.0软件进行统计, 数据以mean±SD表示, 组间数据比较采用ANOVA方差分析, 各组数据间两两比较采用SNK-q检验. 以α = 0.05作为检验水准, P<0.05为差异有统计学意义.
经过慢病毒侵染72 h后, 观察细胞状态及荧光率, 确定慢病毒侵染HT-29的最适MOI为30.
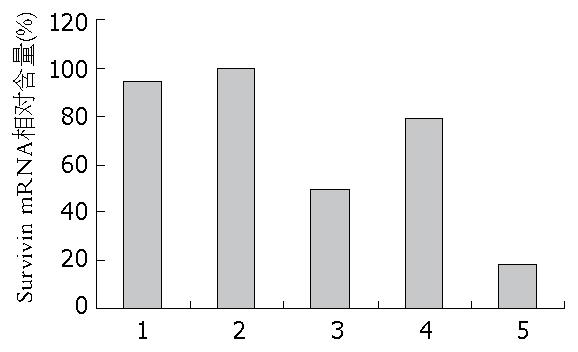
经过real-time PCR进行实时定量检测Survivin基因mRNA表达水平, 将各组Survivin mRNA的Ct值进行计算2-△△Ct, 结果如图1. 结果显示, 与空载体组相比较, 阴性对照组、shRNA组、APC组、shRNA+APC联合组中Survivin mRNA表达相对含量分别为(94.17%±3.12%、49.15%±2.41%、79.05%±2.81%、18.66%±0.86%), 各组间差异具有统计学意义(P<0.05). shRNA+APC联合组中Survivin mRNA表达量与shRNA组、APC组相比较组间差异有统计学意义(P<0.05). shRNA+APC联合侵染HT-29后, Survivin mRNA的表达显著降低.
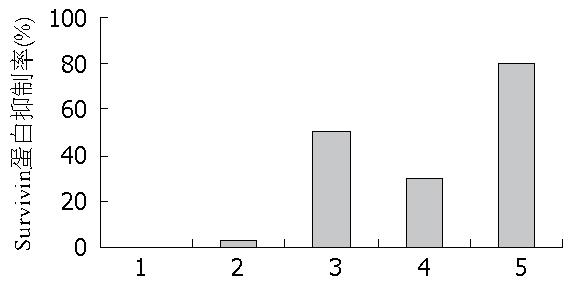
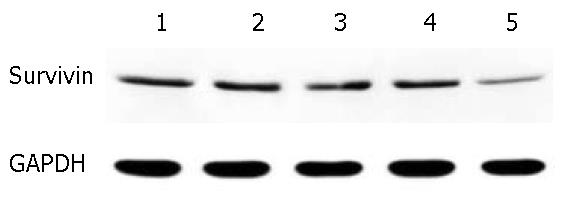
蛋白印迹检测结果显示(图2, 图3), 与阴性对照组相比较, 空载组、shRNA组、APC组、shRNA+APC联合组中Survivin蛋白抑制率较高(3.22%±0.46%、50.53%±1.26%、29.93%±1.41%、80.64%±1.32%), 各组间差异具有统计学意义(P<0.05). shRNA+APC联合组中Survivin蛋白表达量与shRNA组、APC组相比较组间差异有统计学意义(P<0.05). shRNA+APC联合侵染对于HT-29细胞Survivin蛋白的抑制最明显.
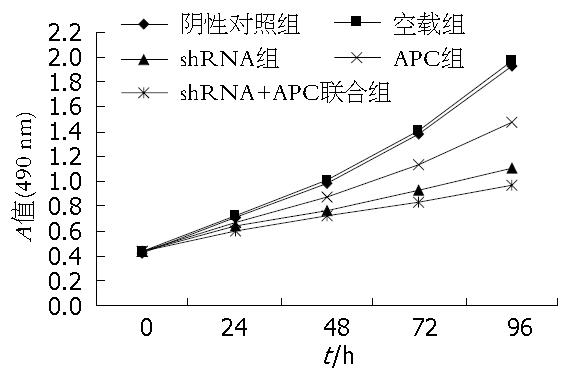
细胞增殖曲线(图4)显示, 慢病毒侵染HT-29细胞后, 细胞的增殖能力明显受到抑制, 并表现出时间依从性. 与阴性对照组比较, shRNA+APC联合组的24、48、72、96 h细胞增殖抑制率分别为29.7%、40.8%、53.5%、60.6%, 与shRNA组、APC组相比较, 其细胞增殖之间的差异有统计学意义(P<0.05). shRNA+APC联合组其细胞增殖速度显著低于其余各组.
Wnt/β-catenin/Tcf-4信号通路在结肠癌发生发展过程中起到重要作用[4], APC基因作为该通路重要的调节基因, APC基因如发生突变从而引起APC基因表达一种无活性的APC蛋白, 导致Axin/GSK-3/APC复合体的形成受到抑制. Axin/GSK-3/APC复合体则失去了对于信号通路中β-catenin降解的促进作用, 从而胞浆内β-catenin大量进入细胞核后与LEF、Tcf-4结合而进一步激活下游Survivin基因的表达[5]. Näthke等[6]利用载体将野生APC蛋白导入结肠癌细胞后, β-catenin大量进入细胞核的现象可被消除.
Survivin是目前发现的具有最强凋亡作用的因子, 其在正常大肠组织内不表达, 而在大肠癌组织中表达水平较高[7]. Pavlidou等[8]的研究表明, Survivin高表达与肿瘤的进展和转移率增高、复发率增加相关. 针对Survivin机制的研究表明, 一方面Survivin通过BIR的氨基酸残基同Caspase3、Caspase7相结合从而达到对Caspases蛋白酶活性的抑制, Caspases活性受到抑制, 则进一步引起肿瘤细胞的凋亡受到抑制[9]. β-catenin作为Wnt/β-catenin信号通路的核心因子, β-catenin水平含量决定了其下游Survivin基因的表达. 刘锋等[10]的研究结果表明, 直肠癌组织中β-catenin的表达与Survivin表达具有相关性, 两者表达呈正相关. 而Zhang等[11]学者研究发现APC基因通过抑制β-catenin来达到对Survivin表达的抑制, 这样可以使肠道干细胞向肠腔迁移的进程中产生凋亡从而丧失其干细胞表型. Kim等[12]的研究结果也同样表明, APC可以通过Wnt/β-catenin/Tcf-4信号通路来达到对Survivin表达的调节. 如Survivin持续表达, 细胞凋亡会受到抑制, 进而细胞大量增殖. 癌组织细胞的生长转移的基础为组织血管形成, 在血管形成的过程中血管内皮生长因子(vascular endothelial growth factor, VEGF)等因子起到重要作用. Li等[13]研究表明, Survivin表达上调可以引起VEGF等血管形成因子表达进而促进肿瘤组织血管形成. 国内孔令建等[14]的结果也表明, Survivin可以通过环氧合酶-2(cyclooxygenase-2, COX-2)、VEGF而促进结直肠癌组织血管的形成. 因此能够在有效减少Survivin的表达的同时使APC过表达可能会对结肠癌的治疗起到一定的作用.
肿瘤基因治疗方法有基因增强、基因失活等. Cai等[15]、王平等[16]的研究表明, 将Survivin shRNA基因利用载体导入结肠癌细胞能够对其增殖起到抑制作用并促进结肠癌细胞的凋亡. Heinen等[17]将APC基因导入结肠癌细胞后发现, 细胞周期阻滞于G2/S期, 进而影响细胞增殖. 但通过载体将两者联合导入细胞中能否取得更强的抑制效果还未见报导. 故本研究选取了在结肠癌发生进展过程中密切相关的基因APC、Survivin, 采用干扰异常表达基因和补偿异常失活基因相结合来达到对结肠癌联合治疗, 以期待能够达到比单基因更佳的效果, 同时探求对结肠癌更加有效治疗方式. 但由于APC蛋白分子量较大, 通过载体转染比较困难. 我们在查阅资料后选取其中能发挥作用的最强功能片段(aa1020-1698)进行实验[18]. 一方面通过干扰Survivin mRNA的表达; 另外一方面通过外源补偿APC基因以避免β-catenin解聚从而达到避免Survivin基因的激活, 间接减少Survivin的表达.
载体的选择对于基因治疗非常重要, 由于质粒载体转染效率低, 腺病毒载体所携带的目的基因不能整合到细胞的染色体上, 不能实现长期稳定的表达. 因此, 我们选择侵染效率高并且能够整合到染色体上的慢病毒来实现稳定表达. 本实验在之前实验筛选出的最佳siRNA片段及查阅资料的基础上, 分别构建Survivin shRNA、APC慢病毒载体, 利用慢病毒载体对HT-29细胞进行单独侵染及联合侵染. 对侵染48 h瞬时表达的HT-29结肠癌细胞进行real-time PCR及Western blot后结果显示, 单独侵染组及联合侵染其Survivin基因在mRNA及蛋白水平均有一定的降低, 但联合侵染对于Survivin基因mRNA、蛋白水平的表达的抑制明显优于其余各组(P<0.05). Survivin基因表达水平降低, 则使结肠癌细胞的有丝分裂过程受到抑制, 进而影响细胞的增殖速度. 实验的结果也证明, Survivin shRNA+APC联合组对于HT-29细胞的增殖抑制效果最佳(P<0.05).
通过本实验的研究发现, 与APC慢病毒载体、Survivin shRNA慢病毒载体单独侵染相比, 联合转染对结肠癌HT-29细胞的增殖的抑制及对Survivin基因表达的抑制效果均优于他们. 双基因及多基因联合有望成为一种新的肿瘤治疗手段, 为进一步研究动物体内实验提供了一定的实验基础, 同时也为临床治疗结肠癌提供理论基础.
在结肠癌发生过程中结肠腺瘤易感基因(adenomatous polyposis coli, APC)突变失活是早期分子事情, APC基因突变导致其表达"短截型"APC蛋白, 最终导致下游Survivin基因的转录过程激活, Survivin作为一种凋亡抑制基因, 能够抑制结肠癌细胞的凋亡, 导致癌症并引起癌症的进一步进展.
朱建伟, 教授, 江苏南通大学附属医院普外科四病区
将Survivin shRNA及APC利用载体分别导入结肠癌细胞中, 已经证明能够对结肠癌细胞增殖起到一定的抑制作用. 将APC有效片段导入细胞后能够使β-catenin表达下调. 双基因联合进行基因治疗是否能够起到比单基因治疗更好的效果尚需要进一步研究.
将Survivin shRNA基因利用载体导入结肠癌细胞能够对其增殖起到抑制作用并促进结肠癌细胞的凋亡, 而将APC基因利用载体导入结肠癌细胞后也能够使细胞周期阻滞于G2/M期, 从而抑制细胞增殖.
我们使用RNA干扰Survivin和外源补偿APC基因联合的方法进行基因治疗, 同时利用慢病毒载体实现两个基因在HT-29结肠癌细胞的长期稳定表达, 为进一步构建稳转细胞株及体内动物实验提供基础.
RNA干扰技术已经广泛应用于恶性肿瘤的治疗领域, 基因增强能够使表达有缺陷的基因在细胞中得以表达从而发挥相应功能. 两者联合应用能够找到一条对结肠癌有效的治疗方式.
RNA干扰: 是指在进化过程中高度保守的、由双链RNA诱发的同源mRNA高效特异性降解的现象; 基因增强: 将正常功能的基因转移到有基因缺陷或基因丢失的细胞中以表达正常产物, 从而弥补缺陷基因的功能的一种基因治疗方式.
本研究采用基因干扰和基因补偿相结合对结肠癌联合治疗, 发现能够对结肠癌细胞的增殖起到抑制作用. 本实验联合针对APC和Survivin的基因治疗, 是一个好的尝试.
编辑: 郭鹏 电编: 闫晋利
| 1. | Liu J, Stevens J, Rote CA, Yost HJ, Hu Y, Neufeld KL, White RL, Matsunami N. Siah-1 mediates a novel beta-catenin degradation pathway linking p53 to the adenomatous polyposis coli protein. Mol Cell. 2001;7:927-936. [PubMed] [DOI] |
| 2. | Li F, Ackermann EJ, Bennett CF, Rothermel AL, Plescia J, Tognin S, Villa A, Marchisio PC, Altieri DC. Pleiotropic cell-division defects and apoptosis induced by interference with survivin function. Nat Cell Biol. 1999;1:461-466. [PubMed] [DOI] |
| 4. | Krausova M, Korinek V. Wnt signaling in adult intestinal stem cells and cancer. Cell Signal. 2014;26:570-579. [PubMed] [DOI] |
| 5. | Lepri SR, Zanelatto LC, da Silva PB, Sartori D, Ribeiro LR, Mantovani MS. Effects of genistein and daidzein on cell proliferation kinetics in HT29 colon cancer cells: the expression of CTNNBIP1 (β-catenin), APC (adenomatous polyposis coli) and BIRC5 (survivin). Hum Cell. 2014;27:78-84. [PubMed] [DOI] |
| 6. | Näthke IS, Adams CL, Polakis P, Sellin JH, Nelson WJ. The adenomatous polyposis coli tumor suppressor protein localizes to plasma membrane sites involved in active cell migration. J Cell Biol. 1996;134:165-179. [PubMed] [DOI] |
| 7. | 毛 银玲, 徐 刚, 孟 凡玲, 娄 长杰, 李 志伟, 燕 飞虎, 张 艳桥. P-STAT5和Survivin在结肠腺癌组织中的表达及临床意义. 中国肿瘤临床. 2011;12:716-719. |
| 8. | Pavlidou A, Dalamaga M, Kroupis C, Konstantoudakis G, Belimezi M, Athanasas G, Dimas K. Survivin isoforms and clinicopathological characteristics in colorectal adenocarcinomas using real-time qPCR. World J Gastroenterol. 2011;17:1614-1621. [PubMed] [DOI] |
| 9. | Verdecia MA, Huang H, Dutil E, Kaiser DA, Hunter T, Noel JP. Structure of the human anti-apoptotic protein survivin reveals a dimeric arrangement. Nat Struct Biol. 2000;7:602-608. [PubMed] [DOI] |
| 11. | Zhang T, Otevrel T, Gao Z, Gao Z, Ehrlich SM, Fields JZ, Boman BM. Evidence that APC regulates survivin expression: a possible mechanism contributing to the stem cell origin of colon cancer. Cancer Res. 2001;61:8664-8667. [PubMed] |
| 12. | Kim PJ, Plescia J, Clevers H, Fearon ER, Altieri DC. Survivin and molecular pathogenesis of colorectal cancer. Lancet. 2003;362:205-209. [PubMed] [DOI] |
| 13. | Li YH, Hu CF, Shao Q, Huang MY, Hou JH, Xie D, Zeng YX, Shao JY. Elevated expressions of survivin and VEGF protein are strong independent predictors of survival in advanced nasopharyngeal carcinoma. J Transl Med. 2008;6:1. [PubMed] [DOI] |
| 14. | 孔 令建, 赵 晶, 曲 波, 樊 微微, 高 善玲. Survivin、COX-2及VEGF在大肠癌中的表达及与肿瘤微血管密度的关系. 世界华人消化杂志. 2009;17:2048-2053. |
| 15. | Cai M, Wang G, Tao K, Cai C. Induction of apoptosis of human colon cancer cells by siRNA recombinant expression vector targeting survivin gene. J Huazhong Univ Sci Technolog Med Sci. 2009;29:45-49. [PubMed] [DOI] |
| 16. | 王 平, 肖 琳, 董 俊红, 李 桂枝, 赵 春玲, 王 守训. 在SW480细胞中沉默survivin基因抑制细胞增殖及hTERT表达. 基础医学与临床. 2013;12:1528-1532. |
| 17. | Heinen CD, Goss KH, Cornelius JR, Babcock GF, Knudsen ES, Kowalik T, Groden J. The APC tumor suppressor controls entry into S-phase through its ability to regulate the cyclin D/RB pathway. Gastroenterology. 2002;123:751-763. [PubMed] [DOI] |
| 18. | 吕 梁, 霍 继荣, 刘 佳, 武 捷, 王 捷. APC不同功能区域对结肠癌细胞株HT-29中β-连环蛋白表达的影响. 中南大学学报(医学版). 2010;35:140-145. |