修回日期: 2015-03-23
接受日期: 2015-03-25
在线出版日期: 2015-05-18
目的: 检测胃癌组织及相应的癌旁组织中上皮细胞转化序列2癌基因(epithelial cell transforming sequence 2 oncogene, ECT2)的蛋白及mRNA表达情况, 并探讨其与胃癌临床病理因素的相关性及临床意义.
方法: 采用免疫组织化学S-P法及逆转录聚合酶链反应(RT-PCR)法检测50例胃癌患者的癌组织及相应的癌旁组织(距癌组织边缘>5 cm)中ECT2蛋白及mRNA表达情况.
结果: 免疫组织化学结果显示, 胃癌组织中ECT2蛋白阳性表达率(76.0%)显著高于癌旁组织(36.0%)(P<0.01); RT-PCR结果显示, 癌组织中ECT2 mRNA表达水平显著高于癌旁组织(P<0.05). ECT2蛋白及mRNA表达均与胃癌的分化程度、TNM分期及淋巴结转移密切相关(P<0.05), 与患者的性别、年龄、肿瘤直径无明显相关(P>0.05); 胃癌组织中ECT2蛋白表达与mRNA表达之间呈显著正相关(P<0.01).
结论: ECT2蛋白及mRNA在胃癌组织中均呈高表达, 且与胃癌分化程度、TNM分期及淋巴结转移密切相关; ECT2在胃癌的发生发展中起重要作用, 可以作为反映胃癌生物学行为的有效指标.
核心提示: 靶向治疗对提高胃癌患者5年生存率具有十分重要的影响, 不断探索新的分子靶向药物已成为当前的研究热点之一. 本研究发现上皮细胞转化序列2癌基因(epithelial cell transforming sequence 2 oncogene)在胃癌组织中的高表达具有提示预后的作用, 该发现可能将为预测胃癌预后及临床靶向药物的使用提供更好的选择依据.
引文著录: 严海翠, 王红兵. ECT2基因在胃癌组织中的表达及意义. 世界华人消化杂志 2015; 23(14): 2215-2220
Revised: March 23, 2015
Accepted: March 25, 2015
Published online: May 18, 2015
AIM: To investigate the expression of epithelial cell transforming sequence 2 (ECT2) in gastric cancer (GC) and to analyze its correlation with clinicopathological characteristics.
METHODS: Immunohistochemistry (IHC) and RT-PCR were used to examine the expression of ECT2 protein and mRNA in GC tissues and paired adjacent normal tissues. The correlation between ECT2 expression and clinicopathological characteristics was then analyzed.
RESULTS: In comparison with adjacent normal tissues (36.0%), the expression of ECT2 protein in GC tissues (76.0%) was significantly higher (P < 0.01), and the expression of ECT2 mRNA in GC tissues was also significantly higher in GC tissues than in adjacent normal tissues. The expression of ECT2 protein and mRNA was related to histologic differentiation, TNM stage and lymph node metastasis in GC (P < 0.05), but not to gender, age or tumor size (P > 0.05).
CONCLUSION: Both ECT2 protein and mRNA are overexpressed in GC, and ECT2 expression correlates with the histologic differentiation, TNM stage and lymph node metastasis in GC. ECT2 may play an important role during GC progression, and may serve as a good factor to indicate biologic behavior of GC.
- Citation: Yan HC, Wang HB. Significance of expression of ECT2 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(14): 2215-2220
- URL: https://www.wjgnet.com/1009-3079/full/v23/i14/2215.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i14.2215
胃癌是全球癌症死亡的第二大常见原因[1,2]. 早期胃癌及癌前病变多无症状, 或者仅有一些非特异性的消化系症状, 多数患者确诊时已为进展期, 进展期胃癌患者术后易复发和转移, 预后仍旧较差[3,4]. 遗传和环境因素在胃癌发生和发展过程中起到了重要的作用, 包括胃癌细胞的基因背景[5]. 随着对胃癌发病机制的深入研究, 人们意识到癌基因的激活是肿瘤发生发展过程中的重要原因之一. 最近有研究[6-10]表明, 上皮细胞转化序列2癌基因(epithelial cell transforming sequence 2 oncogene, ECT2)是一个与细胞增生和凋亡相关的癌基因, 他在人类某些肿瘤中高表达, 且与肿瘤的发生、浸润、转移及预后密切相关. 目前国内外尚未见ECT2在胃癌组织中表达的相关性报道. 本研究采用免疫组织化学S-P法及逆转录聚合酶链反应(reverse transcript-polymerase chain reaction, RT-PCR)法对50例胃癌患者癌组织及癌旁组织中的ECT2蛋白及核酸进行检测, 分析其表达情况, 并探讨其与胃癌临床病理因素的相关性及临床意义.
本研究病例均取自徐州医学院附属医院普外科2014-04/2014-09的手术标本, 50例胃癌患者中男34例, 女16例, 年龄25-80岁, 中位年龄60岁. 组织学类型: 50例均为腺癌. TNM分期(UICC, 2010): Ⅰ期11例、Ⅱ期12例、Ⅲ期27例. 全部病例术后均经病理证实. 组织标本于切下后半小时内取材, 分别取癌组织和癌旁组织, 癌组织均取自肿块中央非坏死部位, 癌旁组织取自距肿块边缘5 cm以上. 标本分两部分, 其中一部分用4%甲醛溶液固定, 石蜡包埋, 切片机切成4 µm厚的连续石蜡切片备用; 另一部分液氮速冻后-80 ℃冰箱保存. 所有患者术前均未经化疗或放疗等抗癌治疗, 且临床病理资料均完整. ECT2兔抗人多克隆抗体(购自北京博奥森生物技术有限公司); 免疫组织化学试剂盒(SP法, 购自北京中杉金桥生物技术有限公司); 浓缩型DAB试剂盒(购自北京中杉金桥生物技术有限公司); RNA提取试剂(TRIzol)(购自美国Invitrogen公司); RT-PCR两步法试剂盒(购自北京天根生化科技有限公司); 2×Taq PCR Master Mix(购自北京天根生化科技有限公司).
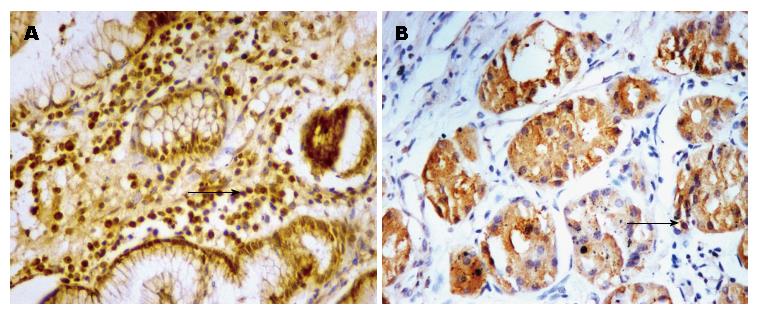
1.2.1 免疫组织化学S-P法检测: 所有组织标本为常规固定石蜡包埋, 4 µm厚切片, 经脱蜡、水化后采用三步法免疫组织化学法(S-P法)检测ECT2蛋白表达水平. 操作步骤如下: 柠檬酸盐缓冲液抗原修复, 3%H2O2室温孵育, 磷酸盐缓冲液冲洗, 滴加1:50稀释的ECT2兔抗人多克隆抗体, 4 ℃冰箱孵育过夜, DAB显色, 苏木素对比染色, 逐级脱水、透明、封片, 于显微镜下观察、摄片并分析. 以磷酸盐缓冲液替代一抗作为阴性对照. 阳性结果判定: ECT2免疫组织化学阳性结果多为细胞质内出现棕褐色颗粒或棕黄色颗粒. 免疫组织化学得分与已报道的文献相似[11-13], 为阳性着色细胞占细胞总数的百分比计分与染色强度计分的乘积. 阳性着色细胞数的百分比计分: <5%为0分, 5%-25%为1分, 26%-50%为2分, 51%-75%为3分, 76%-100%为4分. 染色强度计分: 无着色为0分, 浅棕黄色为1分, 棕黄色为2分, 棕褐色为3分. 两项结果相乘: 0-1分为阴性(-), 2-4分为弱阳性(1+), 5-8分为(2+), 9-12分为(3+), (2+-3+)为强阳性. 阴性及弱阳性定为阴性表达, 阳性及强阳性定为阳性表达.
1.2.2 RNA提取及RT-PCR检测mRNA: 采用TRIzol试剂按照说明书操作提取组织总RNA, 紫外分光光度计检测其浓度、纯度. 取总RNA 2 µg, 按照逆转录试剂盒说明书合成第一链cDNA. 内参照引物β-actin及ECT2引物由上海生工生物技术有限公司合成, 引物序列及长度(表1). PCR扩增条件: 总体积25 µL, 2×Taq PCR MasterMix 12.5 µL, 上下游引物(10 µmol/L)各1.0 µL, 模板cDNA 1 µL, 无核酶水9.5 µL, 94 ℃预变性3 min, 然后进行30个循环扩增: 94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 1 min. 72 ℃延伸反应5 min. 2%琼脂糖凝胶电泳, 溴化乙锭染色, 紫外灯下观察结果, 拍照. 根据以下标准判断结果: 285 bp处出现条带, 同时326 bp处出现条带即可判断该标本ECT2 mRNA表达阳性; 仅285 bp处出现条带则判断为ECT2 mRNA表达阴性.
| 引物名称 | 序列(5'-3') | 产物长度(bp) |
| ECT2 | 上游引物:GCCTTGCTTGTGAGGCCACCAA | 326 |
| 下游引物:TCCACTGAGCCGTGGGATGTCA | ||
| β-actin | 上游引物:GCCTTGCTTGTGAGGCCACCAA | 285 |
| 下游引物:TCCACTGAGCCGTGGGATGTCA |
统计学处理 运用SPSS16.0软件包进行统计学分析. 组间比较采用Pearson χ2检验或Fisher确切概率法; 两组间均数比较运用t检验, 数据采用mean±SE表示; 相关性分析采用非参数Spearman等级相关检验. P<0.05为差异有统计学意义.
胃癌患者癌组织中ECT2阳性表达率为76.0%(38/50), 癌旁组织中ECT2阳性表达率为36.0%(18/50), 癌组织中ECT2阳性表达率显著高于癌旁组织, 两组比较差异有统计学意义(χ2 = 16.234, P<0.01). ECT2在胃癌组织中阳性信号表现为棕黄色颗粒, 癌旁组织中阳性染色多呈淡黄色(图1).
胃癌组织中, ECT2蛋白表达与肿瘤分化程度、TNM分期及淋巴结转移密切相关, 差异有统计学意义(P<0.05), 而与患者的性别、年龄、肿瘤直径无明显相关, 差异无统计学意义(P>0.05)(表2).
| 临床病理因素 | n | ECT2蛋白表达 | P值 | |
| 阳性表达 | 阴性表达 | |||
| 性别 | 0.551 | |||
| 男 | 34 | 25(73.5) | 9(26.5) | |
| 女 | 16 | 13(81.2) | 3(18.8) | |
| 年龄(岁) | 0.508 | |||
| ≤60 | 25 | 18(72.0) | 7(28.0) | |
| >60 | 25 | 20(80.0) | 5(20.0) | |
| 肿瘤直径(cm) | 0.160 | |||
| <5 | 31 | 21(67.7) | 10(32.3) | |
| ≥5 | 19 | 17(89.5) | 2(10.5) | |
| 组织分化程度 | 0.030 | |||
| 中或高分化 | 13 | 7(53.8) | 6(46.2) | |
| 未或低分化 | 37 | 31(83.8) | 6(16.2) | |
| TNM分期 | 0.001 | |||
| Ⅰ/Ⅱ期 | 23 | 12(52.2) | 11(47.8) | |
| Ⅲ期 | 27 | 26(96.3) | 1(3.7) | |
| 淋巴结转移 | 0.030 | |||
| 无 | 13 | 6(46.2) | 7(53.8) | |
| 有 | 37 | 32(86.5) | 5(13.5) | |
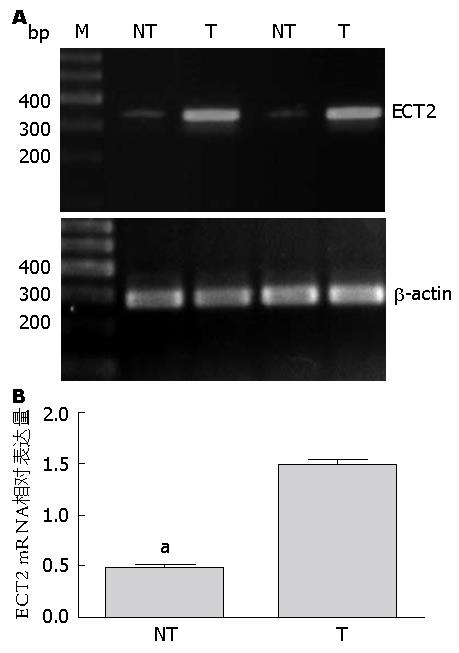
胃癌患者癌组织中ECT2 mRNA表达显著高于癌旁组织, 其中35例(70.0%)癌组织出现ECT2 mRNA特异性条带; 50例癌旁组织中, 20例(40.0%)可见特异性条带, 其余30例均未见条带. 两者差异有统计学意义(χ2 = 9.091, P<0.05). 胃癌组织及其相应的癌旁组织中ECT2/β-actin的相对灰度比值分别为1.475±0.047、0.467±0.034, 差异有统计学意义(P<0.05)(图2).
胃癌组织中, ECT2 mRNA表达与肿瘤分化程度、TNM分期及淋巴结转移显著相关, 差异有统计学意义(P<0.01), 而与患者的性别、年龄、肿瘤直径无明显相关, 差异无统计学意义(P>0.05)(表3).
| 临床病理因素 | n | ECT2mRNA表达 | P值 | |
| 阳性表达 | 阴性表达 | |||
| 性别 | 0.064 | |||
| 男 | 34 | 21(61.8) | 13(38.2) | |
| 女 | 16 | 14(87.5) | 2(12.5) | |
| 年龄(岁) | 0.538 | |||
| ≤60 | 25 | 16(64.0) | 9(36.0) | |
| >60 | 25 | 19(76.0) | 6(24.0) | |
| 肿瘤直径(cm) | 0.086 | |||
| <5 | 31 | 19(61.3) | 12(38.7) | |
| ≥5 | 19 | 16(84.2) | 3(15.8) | |
| 组织分化程度 | 0.004 | |||
| 中或高分化 | 13 | 5(38.5) | 5(61.5) | |
| 未或低分化 | 37 | 30(81.1) | 7(18.9) | |
| TNM分期 | 0.001 | |||
| Ⅰ/Ⅱ期 | 23 | 10(43.5) | 13(56.5) | |
| Ⅲ期 | 27 | 25(92.6) | 2(7.4) | |
| 淋巴结转移 | 0.001 | |||
| 无 | 13 | 4(30.8) | 9(69.2) | |
| 有 | 37 | 31(83.8) | 6(16.2) | |
ECT2最早由Miki等[14]在一次筛选小鼠NIH/3T3细胞中能够参与诱导转化的cDNA时意外发现的, 具有诱导细胞癌化的能力, 定位于人染色体3q26, 编码由883个氨基酸构成的蛋白质, 其分子量约为104 kDa. 他的C端是DH(Dbl homology)和PH(pleckstrin homology)两个结构域, PH结构域为具有催化活性的调节结构域, 而DH结构域为行使功能的结构域[15,16]; N端是一个三联BRCT结构域, 主要与细胞周期监督调控和DNA损伤修复有关[17,18]. ECT2是一种鸟嘌呤核苷酸解离交换因子(Rho guanine nucleotide exchange factors, Rho GEFs), 能催化结合状态GDP的解离并促进GTP对GDP的替换, 从而激活细胞信号转导通路的Ras相似物GTP酶(Rho GTPases)[19-24], Rho GTPases可通过各种信号途径影响肿瘤细胞的恶性转型、生长、侵袭、转移等各个方面[25-28].
Samuel等[29]利用RT-PCR技术检测发现ECT2 mRNA在胰腺癌细胞系及胰腺导管腺癌组织中高表达. Chen等[7]研究发现ECT2蛋白在肝癌细胞系和组织中均呈高表达, 利用小干扰RNA敲除ECT2后, 肝癌细胞的迁移、侵袭能力明显下降. Cheng等[30]发现ECT2 mRNA在神经胶质瘤中高表达, Kaplan-Meier分析显示ECT2 mRNA表达与患者的生存期呈负相关. 这些数据表明ECT2高表达在恶性肿瘤的发生发展过程中可能起重要作用. ECT2与胃癌生物学特性的关系国内外均未见报道. 本实验采用免疫组织化学法检测50例胃癌患者癌组织及相应的癌旁组织中ECT2蛋白表达, 发现50例胃癌患者组织切片中, ECT2的阳性表达率为76.0%(38/50), 提示胃癌组织中存在ECT2高表达现象. 同时, 我们采用RT-PCR法对50例胃癌患者癌组织及相应的癌旁组织中ECT2 mRNA进行检测, 证实在胃癌组织中ECT2 mRNA的表达水平同样显著增高. 相关分析显示, 胃癌组织中ECT2蛋白表达与ECT2 mRNA表达呈显著正相关. 由此可以说明ECT2不仅在转录水平, 而且在转录后水平均呈现表达上调, ECT2可以作为胃癌的一个分子标志物.
本研究还显示, ECT2蛋白与mRNA表达与胃癌分化程度相关, P<0.05, 且呈逐级递增趋势, 随着胃癌恶性程度增高, ECT2蛋白与mRNA阳性表达率明显升高, 提示ECT2可能参与肿瘤的分化过程. 在临床分期中, Ⅲ、Ⅳ期的ECT2蛋白及mRNA阳性表达率显著高于Ⅰ、Ⅱ期, 有淋巴结转移的胃癌患者中ECT2蛋白及mRNA阳性表达率显著高于无淋巴结转移的患者, 提示ECT2与胃癌的侵袭、转移密切相关. ECT2蛋白及mRNA表达与胃癌患者的性别、年龄、肿瘤直径无明显相关(P>0.05).
总之, ECT2蛋白与mRNA在胃癌组织中均呈高表达, 且与胃癌分化程度、TNM分期及淋巴结转移密切相关, 提示ECT2在胃癌的发生发展过程中起重要作用, 有望成为胃癌治疗的一个新靶点.
胃癌是全球癌症死亡的第二大常见原因, 严重威胁人类健康. 虽然近些年来胃癌的治疗方面有很大改善, 但是胃癌患者的5年生存率仍比较低, 这主要与胃癌复杂的生物学行为及高度恶性相关. 遗传和环境因素在胃癌发生和发展过程中起到了重要的作用, 癌基因的激活是肿瘤发生发展过程中的重要原因之一.
张小晋, 主任医师, 北京积水潭医院
近几年, 新型分子靶向药物在临床实践中取得了显著疗效, 实践表明了分子靶向治疗理论的正确性与可行性. 不断探索癌症的分子生物学发病机制已成为当前的研究热点, 本研究从胃癌发生的分子机制上为靶向药物的研发及临床应用提供数据支撑.
目前有关ECT2在胃癌组织中的表达及其相关的生物学和临床意义尚缺少系统研究, 本研究通过检测ECT2在胃癌组织及癌旁组织中的表达, 并分析其与胃癌临床病理因素的关系, 进一步探讨ECT2与胃癌发生发展的关系.
本研究发现, ECT2在胃癌组织中高表达, 且与胃癌分化程度、TNM分期及淋巴结转移密切相关, 提示ECT2在胃癌的发生发展过程中起重要作用, 有望成为胃癌治疗的一个新靶点. 有关ECT2在胃癌发病中的具体机制尚不清楚, 我们将会在未来的研究中进一步探讨.
本研究通过病例及数据分析发现, ECT2在胃癌中的高表达与胃癌分化程度、TNM分期及淋巴结转移密切相关, 为临床医生判断病情和预后提供帮助, 也可以作为其他肿瘤临床研究的参考.
鸟嘌呤核苷酸解离交换因子(Rho GEFs): 通过调节Rho家族蛋白的GDP/GTP交换, 从而使他们在有活性形式与无活性形式之间发生转化的一类调节蛋白.
本研究立意较新颖, 表达简介, 观点明确, 方法学较严谨, 为临床医生判断病情和预后有一定临床意义.
编辑: 郭鹏 电编: 闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Smyth EC, Cunningham D. Targeted therapy for gastric cancer. Curr Treat Options Oncol. 2012;13:377-389. [PubMed] [DOI] |
| 3. | Ueda T, Volinia S, Okumura H, Shimizu M, Taccioli C, Rossi S, Alder H, Liu CG, Oue N, Yasui W. Relation between microRNA expression and progression and prognosis of gastric cancer: a microRNA expression analysis. Lancet Oncol. 2010;11:136-146. [PubMed] [DOI] |
| 4. | Ruf C, Thomusch O, Goos M, Makowiec F, Illerhaus G, Ruf G. Impact of neoadjuvant chemotherapy with PELF-protocoll versus surgery alone in the treatment of advanced gastric carcinoma. BMC Surg. 2014;14:5. [PubMed] [DOI] |
| 5. | Nadauld LD, Ford JM. Molecular profiling of gastric cancer: toward personalized cancer medicine. J Clin Oncol. 2013;31:838-839. [PubMed] [DOI] |
| 6. | Hirata D, Yamabuki T, Miki D, Ito T, Tsuchiya E, Fujita M, Hosokawa M, Chayama K, Nakamura Y, Daigo Y. Involvement of epithelial cell transforming sequence-2 oncoantigen in lung and esophageal cancer progression. Clin Cancer Res. 2009;15:256-266. [PubMed] [DOI] |
| 7. | Chen J, Xia H, Zhang X, Karthik S, Pratap SV, Ooi LL, Hong W, Hui KM. ECT2 regulates the Rho/ERK signalling axis to promote early recurrence in human hepatocellular carcinoma. J Hepatol. 2015; Jan 21. [Epub ahead of print]. [PubMed] [DOI] |
| 8. | Zhang ML, Lu S, Zhou L, Zheng SS. Correlation between ECT2 gene expression and methylation change of ECT2 promoter region in pancreatic cancer. Hepatobiliary Pancreat Dis Int. 2008;7:533-538. [PubMed] |
| 9. | Huff LP, Decristo MJ, Trembath D, Kuan PF, Yim M, Liu J, Cook DR, Miller CR, Der CJ, Cox AD. The Role of Ect2 Nuclear RhoGEF Activity in Ovarian Cancer Cell Transformation. Genes Cancer. 2013;4:460-475. [PubMed] [DOI] |
| 10. | Iyoda M, Kasamatsu A, Ishigami T, Nakashima D, Endo-Sakamoto Y, Ogawara K, Shiiba M, Tanzawa H, Uzawa K. Epithelial cell transforming sequence 2 in human oral cancer. PLoS One. 2010;5:e14082. [PubMed] [DOI] |
| 11. | 李 一鑫, 张 楠, 陶 林, 杨 兰, 赵 瑾, 张 文杰. 胃癌患者VEGF、VEGFR2高表达的临床病理学意义及其在胃癌进展与生存预后中的作用. 世界华人消化杂志. 2014;22:4406-4414. |
| 12. | 张 楠, 李 一鑫, 陶 林, 杨 兰, 赵 瑾, 张 文杰. 胃癌患者IL-11和Survivin高表达的临床病理学意义及其在癌进展和生存预后中的作用. 世界华人消化杂志. 2015;23:373-380. |
| 13. | 赵 强, 张 志伟, 刘 重元, 肖 娟, 李 增波, 伍 石华, 吴 勇军, 杨 代水, 权 里平, 雷 明生. PKCα-Annexin A2-S100A10在胃癌组织中的表达及意义. 世界华人消化杂志. 2014;22:1793-1800. |
| 14. | Miki T, Smith CL, Long JE, Eva A, Fleming TP. Oncogene ect2 is related to regulators of small GTP-binding proteins. Nature. 1993;362:462-465. [PubMed] |
| 15. | Solski PA, Wilder RS, Rossman KL, Sondek J, Cox AD, Campbell SL, Der CJ. Requirement for C-terminal sequences in regulation of Ect2 guanine nucleotide exchange specificity and transformation. J Biol Chem. 2004;279:25226-25233. [PubMed] |
| 16. | Vanni C, Parodi A, Mancini P, Visco V, Ottaviano C, Torrisi MR, Eva A. Phosphorylation-independent membrane relocalization of ezrin following association with Dbl in vivo. Oncogene. 2004;23:4098-4106. [PubMed] |
| 17. | Li M, Bian C, Yu X. Poly(ADP-ribosyl)ation is recognized by ECT2 during mitosis. Cell Cycle. 2014;13:2944-2951. [PubMed] [DOI] |
| 18. | Sheng ZZ, Huang JF. [Functional site prediction of BRCT domain containing phosphate binding pocket]. Dongwuxue Yanjiu. 2011;32:509-514. [PubMed] [DOI] |
| 19. | Zou Y, Shao Z, Peng J, Li F, Gong D, Wang C, Zuo X, Zhang Z, Wu J, Shi Y. Crystal structure of triple-BRCT-domain of ECT2 and insights into the binding characteristics to CYK-4. FEBS Lett. 2014;588:2911-2920. [PubMed] [DOI] |
| 20. | Kim H, Guo F, Brahma S, Xing Y, Burkard ME. Centralspindlin assembly and 2 phosphorylations on MgcRacGAP by Polo-like kinase 1 initiate Ect2 binding in early cytokinesis. Cell Cycle. 2014;13:2952-2961. [PubMed] [DOI] |
| 21. | Hara T, Abe M, Inoue H, Yu LR, Veenstra TD, Kang YH, Lee KS, Miki T. Cytokinesis regulator ECT2 changes its conformation through phosphorylation at Thr-341 in G2/M phase. Oncogene. 2006;25:566-578. [PubMed] [DOI] |
| 22. | Greer ER, Chao AT, Bejsovec A. Pebble/ECT2 RhoGEF negatively regulates the Wingless/Wnt signaling pathway. Development. 2013;140:4937-4946. [PubMed] [DOI] |
| 23. | Cook DR, Rossman KL, Der CJ. Rho guanine nucleotide exchange factors: regulators of Rho GTPase activity in development and disease. Oncogene. 2014;33:4021-4035. [PubMed] [DOI] |
| 24. | Fortin SP, Ennis MJ, Schumacher CA, Zylstra-Diegel CR, Williams BO, Ross JT, Winkles JA, Loftus JC, Symons MH, Tran NL. Cdc42 and the guanine nucleotide exchange factors Ect2 and trio mediate Fn14-induced migration and invasion of glioblastoma cells. Mol Cancer Res. 2012;10:958-968. [PubMed] [DOI] |
| 25. | Duquette PM, Lamarche-Vane N. Rho GTPases in embryonic development. Small GTPases. 2014;5:8. [PubMed] [DOI] |
| 26. | Zegers MM, Friedl P. Rho GTPases in collective cell migration. Small GTPases. 2014;5:e28997. [PubMed] [DOI] |
| 27. | Matsuoka T, Yashiro M. Rho/ROCK signaling in motility and metastasis of gastric cancer. World J Gastroenterol. 2014;20:13756-13766. [PubMed] [DOI] |
| 28. | Knaus UG. Rho GTPase signaling in inflammation and transformation. Immunol Res. 2000;21:103-109. [PubMed] [DOI] |
| 29. | Samuel N, Sayad A, Wilson G, Lemire M, Brown KR, Muthuswamy L, Hudson TJ, Moffat J. Integrated genomic, transcriptomic, and RNA-interference analysis of genes in somatic copy number gains in pancreatic ductal adenocarcinoma. Pancreas. 2013;42:1016-1026. [PubMed] [DOI] |
| 30. | Cheng YS, Lin C, Cheng YP, Yu YL, Tang CT, Hueng DY. Epithelial cell transformation sequence 2 is a potential biomarker of unfavorable survival in human gliomas. Neurol India. 2014;62:406-409. [PubMed] [DOI] |