修回日期: 2015-02-23
接受日期: 2015-03-12
在线出版日期: 2015-05-08
目的: 观察桃红芪术软肝煎从(transforming growth factor beta, TGF-β)/Smad信号通路逆转上皮-间充质细胞转化(epithelial-mesenchymal transition, EMT)抗肝纤维化的作用.
方法: 取对数生长期的HepG2细胞进行试验, 将细胞分为7组: 空白组、TGF-β诱导EMT组、TGF-β+中药[低剂量组(peach stilbene low dose group, THQL)、中剂量组(peach stilbene middle dose group, THQM)、高剂量组(peach stilbene high dose group, THQH)]、TGF-β+扶正祛瘀胶囊组(Fuzheng Huayu recipe, FZHY组)、TGF-β+秋水仙碱组(colchicine group, QSXJ组), 采用免疫荧光和Western blot方法检测E-cadherin、Vimentin、Smad2、TGF-β R1表达情况, 并检测细胞上清液中的谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)、甲胎蛋白(alpha fetoprotein, AFP)表达情况.
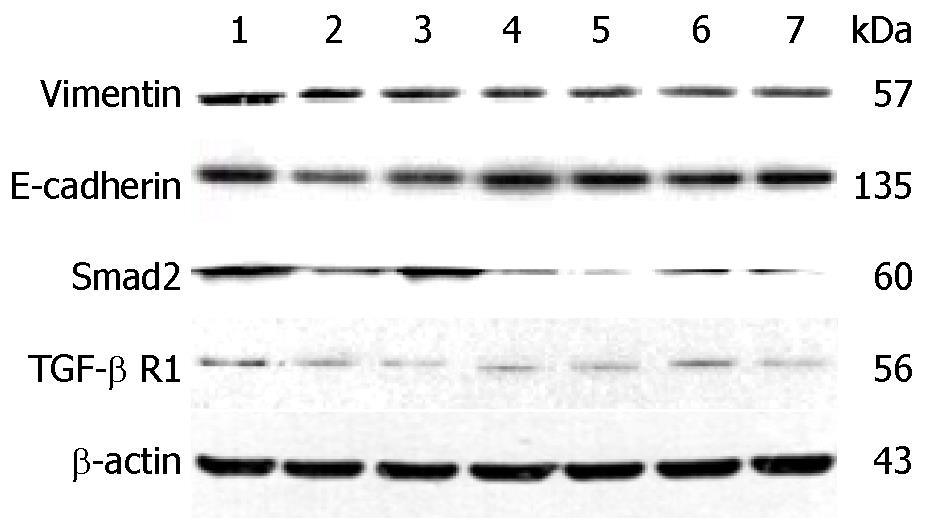
结果: 诱导组AFP诱导第3天浓度明显降低, 差异具有统计学意义(P<0.05); 用药干预后, 用药组ALT、AST水平均低于模型组, 差异具有统计学意义(P<0.05), THQL及TRQM的ALT水平均低于FZHY和QSXJ, 差异具有统计学意义(P<0.05), THQM及THQH的AST水平均低于FZHY和QSXJ, 差异具有统计学意义(P<0.05); 桃红芪术软肝煎可以改善HepG2细胞被诱导发生EMT的形态, 其中THQM组和THQH组形态改变较为明显; 桃红芪术软肝煎可以上调E-cadherin表达, 下调Smad2、TGF-β R1、Vimentin表达.
结论: 桃红芪术软肝煎可以通过作用于TGF-β/Smad信号通路逆转上皮-间质转化, 从而起到抗肝纤维化的作用.
核心提示: 本研究主要观察桃红芪术软肝煎从(transforming growth factor beta)/Smad信号通路逆转上皮-间充质细胞转化(epithelial-mesenchymal transition)从而抗肝纤维化的作用研究, 具有重大意义.
引文著录: 王靖思, 王逊, 刘玉琴, 陈兰羽, 朱昱翎, 顾蓓, 孙桂芝. 桃红芪术软肝煎基于TGF-β/Smad信号通路逆转上皮-间质转化抗肝纤维化作用. 世界华人消化杂志 2015; 23(13): 2036-2049
Revised: February 23, 2015
Accepted: March 12, 2015
Published online: May 8, 2015
AIM: To explore whether Taohong Qizhu Ruangan Jian (TQRJ) reverses epithelial-mesenchymal transition (EMT) and the underlying mechanism.
METHODS: HepG2 cells were divided into seven groups: a blank group, an EMT group, low-, medium- and high-dose TQRJ groups, a Fuzheng Huayu recipe group (FZHY group), and a colchicine group (QSXJ group). Immunofluorescence and Western blot were used to detect the expression of E-cadherin, Vimentin, Smad2, and transforming growth factor beta (TGF-β) R1. The levels of alanine aminotransferase (ALT), aspartate transaminase (AST), and alpha fetoprotein (AFP) in cell supernatants were also determined.
RESULTS: AFP concentration significantly decreased after 3 d in the EMT group (P < 0.05). After drug intervention, ALT and AST levels decreased significantly compared with the EMT group (P < 0.05). ALT levels were significantly lower in the low- and medium-dose TQRJ groups than in the FZHY and QSXJ groups (P < 0.05), and AST levels were significantly lower in the medium- and high-dose TQRJ groups than in the FZHY and QSXJ groups (P < 0.05). TQRJ could improve EMT, especially in the medium- and high-dose TQRJ groups. TQRJ could increase E-cadherin expression and reduce the expression of Smad2, TGF-β R1 and Vimentin.
CONCLUSION: TQRJ can reverse EMT possibly via the TGF-β/Smad signaling pathway and thus may has anti-liver fibrotic effects.
- Citation: Wang JS, Wang X, Liu YQ, Chen LY, Zhu YL, Gu B, Sun GZ. Taohong Qizhu Ruangan Jian reverses epithelial-mesenchymal transition via transforming growth factor beta/Smad signaling pathway. Shijie Huaren Xiaohua Zazhi 2015; 23(13): 2036-2049
- URL: https://www.wjgnet.com/1009-3079/full/v23/i13/2036.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i13.2036
肝纤维化是由针对肝脏慢性、持续损伤进行修复而引起的病理过程[1], 导致瘢痕组织形成, 正常组织结构的丧失和器官的衰竭. 肝纤维化和他的终末期表现-肝硬化是肝脏长期慢性炎症刺激的结果[2]. 研究发现肝纤维化甚至早期肝硬化是可以通过抑制纤维化反应来逆转的[3-4], 因此, 开展逆转肝纤维化及早期肝硬化的研究, 具有防止其向终末期肝硬化甚至肝癌进展的重大意义.
孙桂芝主任医师基于多年诊治肝癌并肝纤维化、肝硬化患者的经验, 研制出经验方"桃红芪术软肝煎", 临证诊治肝癌并肝硬化患者具有改善症状、防治并发症、延长生存期、提高生活治疗的作用. 本研究主要观察桃红芪术软肝煎通过作用于转化生长因子β(transforming growth factor beta, TGF-β)/Smad信号通路逆转上皮-间充质细胞转化(epithelial-mesenchymal transition, EMT)从而抗肝纤维化的作用研究.
人肝癌细胞株HepG2细胞株(由中国协和医科大学基础医学院细胞中心提供). Recombinant Human TGF-β1(购自R&D systems公司, 美国), Vimentin Rabbit mAb(购自Cell Signaling Technology公司, 美国), E-Cadherin Rabbit mAb(购自Cell Signaling Technology公司, 美国), Smad2 Rabbit mAb(购自Cell Signaling Technology公司, 美国), Anti-TGF-β Receptor Ⅰ抗体(购自abcam公司, 美国), FITC标记山羊抗兔IgG(购自中衫金桥), 抗荧光淬灭封片剂、免疫荧光封闭液、免疫染色一抗稀释液、免疫染色二抗稀释液、DAPI染色液、TritonX-100(购自碧云天生物技术研究所), RIPA裂解缓冲液、蛋白酶抑制剂混合物、过硫酸胺(APS)、TEMED、BCA法蛋白质定量试剂盒、预染色蛋白质分子量标准、5×SDS-PAGE Sample/Loading Buffer、4×分离胶缓冲液、4×浓缩胶缓冲液购自北京普利莱基因技术有限公司. 倒置突光显微镜(Olympus 1×51), 多聚赖氨酸防脱载玻片(北京中衫金桥), 盖玻片(无锡耐思生物科技有限公司), 蛋白电泳槽(Bio-Rad mini型), Nanodrop紫外分光光度仪(Thermo)(由中国医学科学院基础医学研究所中心实验室提供), 电泳仪(北京六一仪器厂DYY-6C型), 蛋白转膜仪(北京六一仪器厂), 自动X线胶片洗片机(购自上海申贝电影机械厂).
1.2.1 细胞培养: 人肝癌细胞株HepG2于含10%胎牛血清及1%NEAA的MEM-EBSS培养液中, 37 ℃, 50 mL/L CO2培养, 2-3 d用0.05%胰酶消化传代, 取对数生长期的细胞进行试验.
1.2.2 桃红芪术软肝煎含药血清制备: 70只SD大鼠, 体质量在200-220 g左右, 随机分为空白对照组、模型对照组、对照药物组(秋水仙碱组、扶正祛瘀胶囊组)、桃红芪术软肝煎组(低剂量组、中剂量组、高剂量组), 每组10只, 每组每天灌胃2次, 灌胃2 d, 第3天灌胃1次, 1 h后大鼠腹主动脉采血, 40 ℃离心, 3000 r/min, 离心5 min, 取上层血清, 分装, 保持与-80 ℃冰箱, 使用前于56 ℃水浴箱中灭活.
1.2.3 免疫发光法检测甲胎蛋白(α-fetoprotein, AFP)变化: 培养对数生长期的HepG2细胞, 使用胰酶消化液消化并计数, 重悬于含10%FBS和1%NEAA的MEM-EBSS培养基中, 制备成含1×105/L的单细胞悬液备用. 使用2块六孔板, 向每孔加入2 mL的单细胞悬液. 使用2块六孔板, 向每孔加入2 mL的单细胞悬液. 于50 mL/L CO2, 37 ℃培养箱继续培养, 过夜, 待细胞单层贴壁后, 分为7组, 分别为: 空白对照组(kongbai group, KB组)、模型组(moxing group, MX组)、桃红芪术低剂量组(peach stilbene low dose group, THQL组)、桃红芪术中剂量组(peach stilbene middle dose group, THQM组)、桃红芪术高剂量组(peach stilbene high dose group, THQH组)、扶正化瘀胶囊组(Fuzheng Huayu recipe group, FZHY组)、秋水仙碱组(colchicine group, QSXJ组). 待细胞铺满六孔板底部60%-70%, 向MX组、THQL组、THQM组、THQH组、FZHY组、QSXJ组6孔加入配置好的Recombinant Human TGF-β1溶液, 每孔2 μL. 每天放置在倒置显微镜下观察并换液, 留取细胞上清液, 使用免疫发光法检测AFP变化.
1.2.4 酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)法检测谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST): 分组后, 连续使用Recombinant Human TGF-β1诱导3 d, 使用酶联免疫吸附测定法检测ALT、AST变化.
1.2.5 桃红芪术软肝煎对HepG2细胞形态的影响: 分组后, 连续使用Recombinant Human TGF-β1诱导3 d, 向THQL、THQM、THQH、FZHY、QSXJ各孔相应加入配置好的含10%含药血清MEM-EBSS培养基. 加药24 h后, 将六孔板放置在倒置显微镜下观察并拍照.
1.2.6 免疫荧光检测E-cadherin、Vimentin、Smad2、TGF-β R1表达: 分组后, 连续使用Recombinant Human TGF-β1诱导3 d, 向THQL、THQM、THQH、FZHY、QSXJ各孔相应加入配置好的含10%含药血清MEM-EBSS培养基. 加药24 h后, 用移液器将各孔培养液轻轻吸出, 用适量PBS缓冲液洗1次; 固定: 每孔加入4%多聚甲醛, 固定10 min; 洗涤: 吸除多聚甲醛, 用PBS缓冲液洗涤3次, 每次洗涤5 min; 通透: 加入0.5%的TritonX-100溶液, 通透10 min, 使用PBS缓冲液洗涤3次, 每次洗涤5 min; 封闭: 加入免疫染色封闭液, 室温封闭1 h; 染一抗: 吸除封闭液, 加入免疫荧光染色一抗(Vimentin Rabbit mAb、E-Cadherin Rabbit mAb、Smad2 Rabbit mAb), 4 ℃过夜, 一抗的具体稀释倍数参照说明书; 洗涤: 吸除一抗, 使用PBS缓冲液洗涤3次, 10 min/次; 染二抗: 加入FITC标记山羊抗兔IgG, 37 ℃孵育箱中孵育30 min; 洗涤: 使用PBS缓冲液洗涤3次, 1 min/次; 染细胞核: 加入细胞核染色液(DAPI), 室温染色5 min; 洗涤: 吸除DAPI, 洗涤染色液3次, 5 min/次; 封片: 滴加适量抗荧光淬灭封片液; 使用倒置荧光显微镜拍照.
1.2.7 Western blot法检测E-cadherin、Vimentin、Smad2、TGF-β R1蛋白表达: 分组后, 连续使用Recombinant Human TGF-β1诱导3天, 向THQL组、THQM组、THQH组、FZHY组、QSXJ组各孔相应加入配置好的含10%含药血清MEM-EBSS培养基. 加药24 h后, 提取细胞总蛋白, BCA法测定细胞蛋白浓度, 配胶、电泳、转膜, 封闭后孵育一抗、二抗, 进行爆光、显影, 应用Quantity one软件进行分析.
统计学处理 数据采用SPSS18.0软件进行分析, 数据描述采用mean±SD, 多组间比较采用单因素方差分析, 用Dunnett T3法进行各组间的多重比较, 以P<0.05为差异有统计学意义.
诱导组AFP诱导第1天浓度与诱导前无明显差异(P>0.05)(表1), 诱导第3天浓度明显降低, 差异具有统计学意义(P<0.05), 加药24 h后浓度继续降低, 并且与诱导前相比差异具有统计学意义(P<0.05), 此外, 加药24 h后浓度与诱导第3天浓度差异具有统计学意义(P<0.05). ALT第3天浓度较诱导前明显升高, 差异具有统计学意义(P<0.05), 加药24 h后浓度较诱导第3天下降, 并且差异具有统计学意义(P<0.05). AST第3天浓度较诱导前明显升高, 差异具有统计学意义(P<0.05), 加药24 h后浓度较诱导第3天下降, 并且差异具有统计学意义(P<0.05). 模型组及用药组的ALT水平均高于空白组, 差异具有统计学意义(P<0.05); 用药干预后, 用药组ALT水平均低于模型组(表2), 差异具有统计学意义(P<0.05), THQL及TRQM的ALT水平均低于FZHY和QSXJ, 差异具有统计学意义(P<0.05). 模型组及用药组的AST水平均高于空白组, 差异具有统计学意义(P<0.05); 用药干预后, 用药组AST水平均低于模型组, 差异具有统计学意义(P<0.05), THQM及THQH的AST水平均低于FZHY和QSXJ, 差异具有统计学意义(P<0.05).
| 指标 | 0 d | 1 d | 3 d | 4 d |
| AFP(μg/L) | 508.27±37.50 | 469.75±14.12 | 136.54±15.70 | 63.43±8.47 |
| ALT(U/L) | 1.86±0.34 | - | 39.71±1.85 | 3.57±0.53 |
| AST(U/L) | 2.85±0.34 | - | 44.71±0.64 | 15.14±0.91 |
| 分组 | ALT | AST |
| KB组 | 1.86±0.90 | 2.86±0.90 |
| MX组 | 39.71±4.89 | 44.71±1.70 |
| THQL组 | 11.71±2.87 | 22.86±1.35 |
| THQM组 | 5.00±1.41 | 15.14±2.41 |
| THQH组 | 13.29±1.11 | 16.86±4.30 |
| FZHY组 | 18.43±2.82 | 22.57±2.82 |
| QSXJ组 | 13.28±2.30 | 22.71±2.43 |
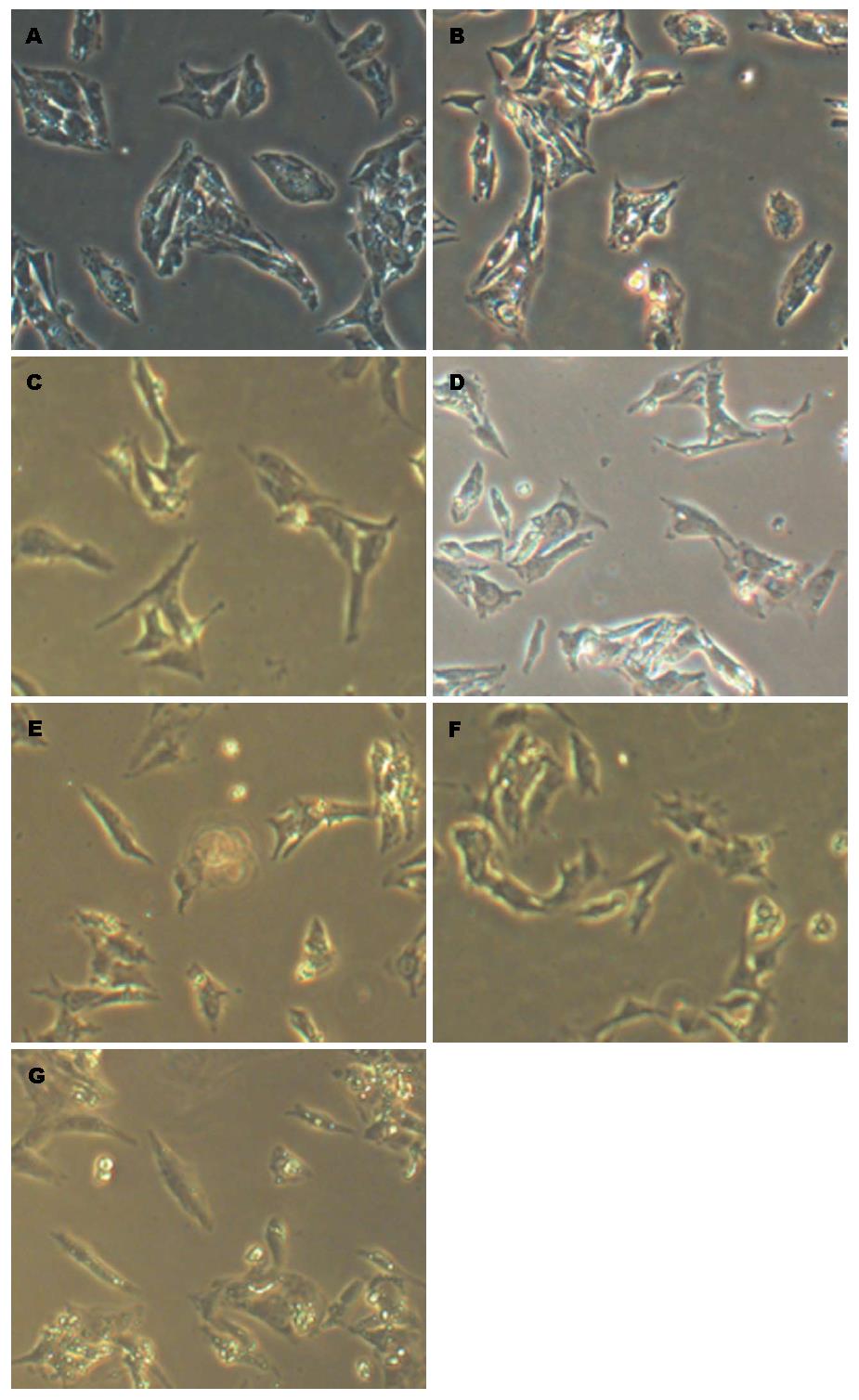
正常的HepG2细胞形态呈卵圆形或者多边形, 以贴壁叠堆状方式生长; 经过连续使用Recombinant Human TGF-β1诱导3 d后, 发生纤维化的HepG2细胞变化成长梭形, 出现黏连、弯曲、拉丝状; 加药干预后, 细胞变短, 黏连、拉丝、弯曲等纤维化现象好转, 其中THQM组和THQH组形态改变较为明显(图1).
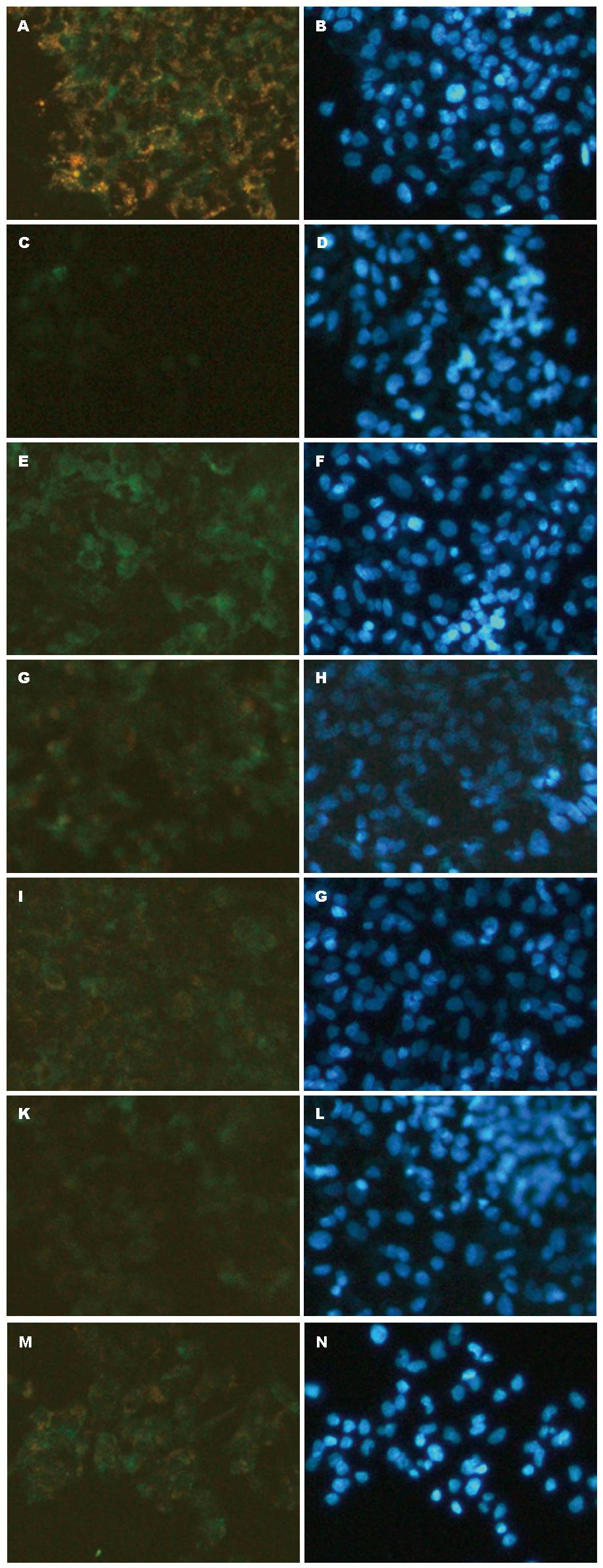
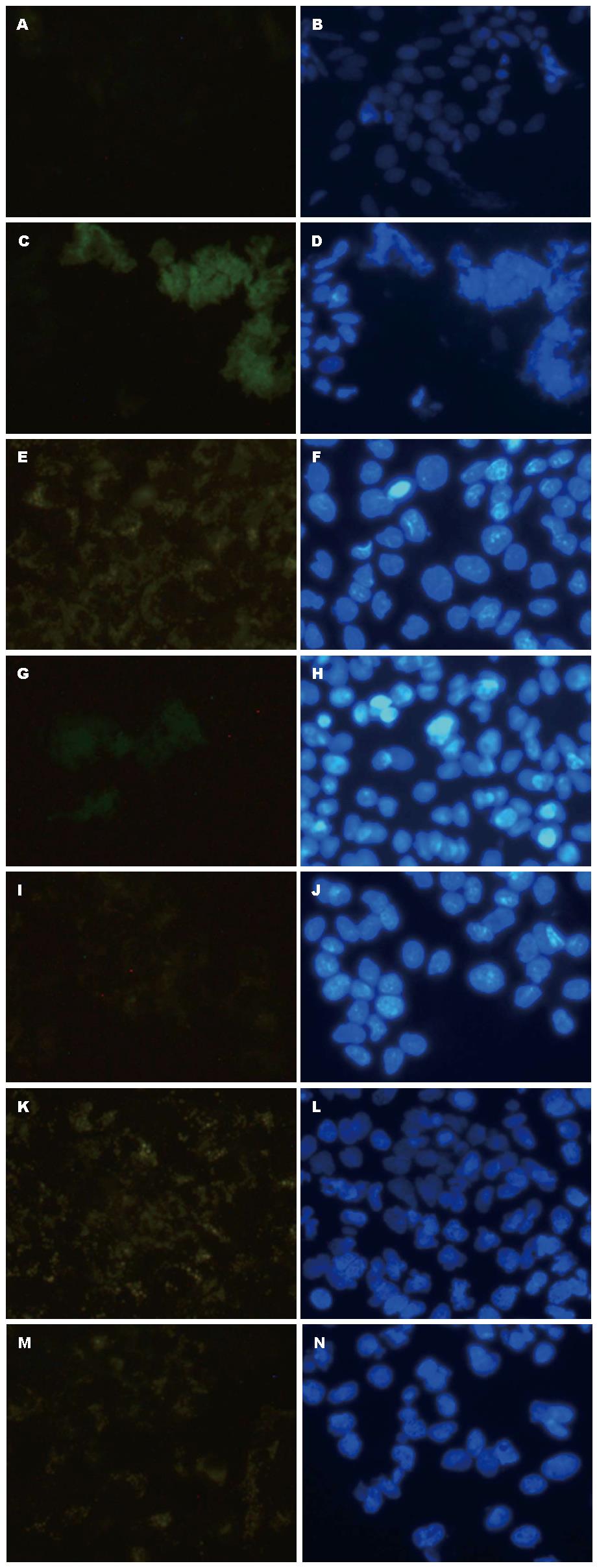
E-cadherin: E-cadherin主要表达于HepG2细胞胞浆及胞膜内, 绝大部分以细胞膜为主, 部分胞浆染色阳性, 模型组细胞E-cadherin表达较空白组下降; 而用药各组E-cadherin表达较模型组上调, 其中, 以THQL组、THQM组、THQH组、FZHY组表达较明显(图2).
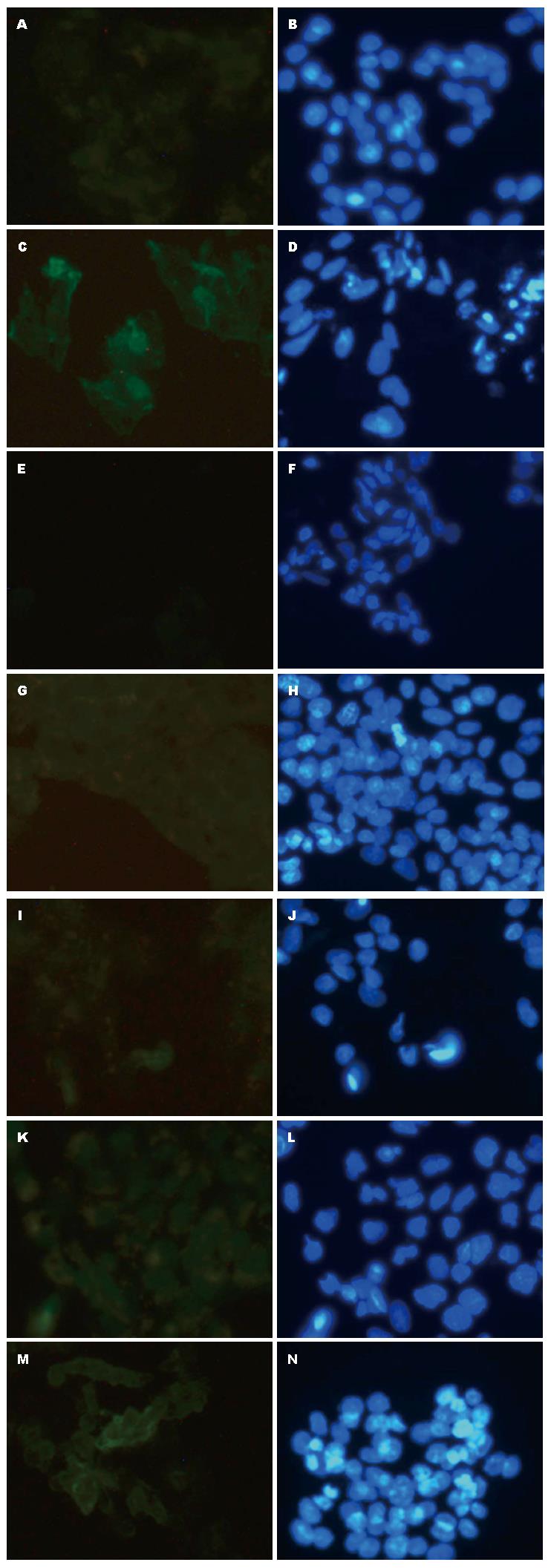
Smad2: Smad2主要表达于HepG2细胞核内, 模型组细胞Smad2表达较空白组明显; 而用药组THQL组、THQM组、THQH组、FZHY组表达较模型组下降(图3).
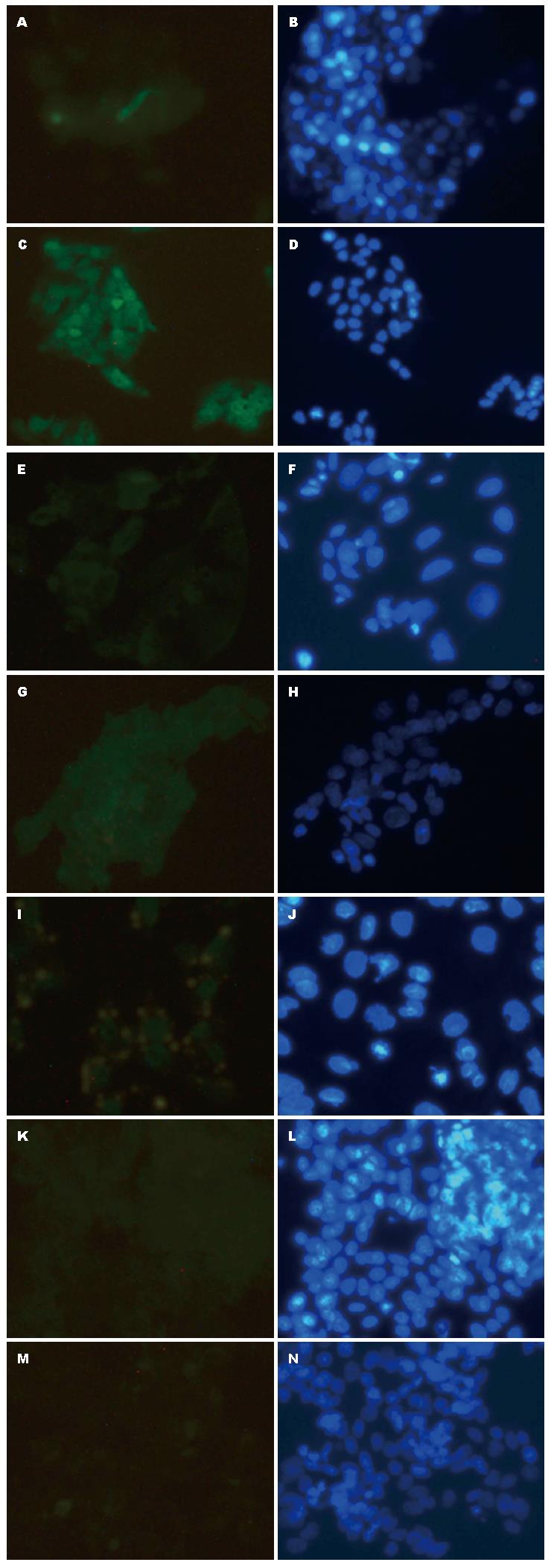
TGF-β R1: TGF-β R1主要表达于HepG2细胞胞浆及胞膜内, 绝大部分以细胞膜为主, 部分胞浆染色阳性, 模型组细胞TGF-β R1表达较空白组下降; 而用药THQL组、THQH组、FZHY组、QSXJ组TGF-β R1表达较模型组明显减弱(图4).
Vimentin: Vimentin主要表达于HepG2细胞胞浆内, 模型组细胞Vimentin表达较空白组明显; 而用药THQL组、THQM组、THQH组、FZHY组、QSXJ组TGF-β R1表达较模型组明显减弱(图5).
表3示MX组E-cadherin表达较KB组表达下降(P<0.05); THQM组、THQH组、FZHY组、QSXJ组E-cadherin表达较MX组表达升高(P<0.05)(图6), 用药各组组间比较无统计学意义. THQM组、THQH组、FZHY组、QXSJ组Smad2表达较MX组下调(P<0.05), 用药各组组间比较无统计学意义. MX组Vimentin、TGF-β R1表达较KB组表达上升(P<0.05)(图6); THQL组、THQM组、THQH组、FZHY组、QXSJ组Vimentin表达较MX组下降(P<0.05), THQL组、QXSJ组TGF-β R1表达较MX组下降(P<0.05), 用药各组组间比较无统计学意义.
| 分组 | E-cadherin | Smad2 | TGF-β R1 | Vimentin |
| KB组 | 0.566±0.064a | 0.539±0.290 | 0.134±0.019a | 0.154±0.095a |
| MX组 | 0.261±0.153 | 0.583±0.368 | 0.400±0.030 | 0.443±0.080 |
| THQL组 | 0.458±0.227 | 0.513±0.313 | 0.183±0.055a | 0.195±0.095a |
| THQM组 | 0.540±0.124a | 0.177±0.108a | 0.370±0.110 | 0.143±0.018a |
| THQH组 | 0.653±0.278a | 0.167±0.088a | 0.375±0.19 | 0.180±0.050a |
| FZHY组 | 0.485±0.128a | 0.223±0.067a | 0.293±0.064 | 0.226±0.072a |
| QSXJ组 | 0.494±0.097a | 0.183±0.063a | 0.198±0.167a | 0.161±0.046a |
EMT是Greenberg等[5]在1982年首次提出的概念, 他们在凝胶中培养的晶状体上皮细胞失去了极性, 转变成为具有伪足的间质样细胞. EMT是指上皮细胞在一些因素的作用下, 失去极性及细胞间紧密连接和黏附连接, 获得了浸润性和游走迁移能力, 变成具备间质细胞形态和特性的细胞[6]. 近年来, 研究发现[7,8]各种创伤和TGF-β引起的EMT是导致肝纤维化的重要因素, 同时EMT也是目前肝纤维化领域研究热点, 近期的研究[9]发现EMT过程正是纤维化发生发展中重要的参与者, EMT过程贯穿纤维化的过程, 而其逆过程MET能够改善纤维化的进展.
EMT以细胞黏附相关分子E-cadherin表达降低, 纤连蛋白(fibronectin)、Vimentin、Snail、Twist等间质标记蛋白的表达上调为主要标志[10]. E-cadherin[11,12]是一种上皮细胞的跨膜蛋白, 他在建立固定附着力, 维持细胞极性和上皮紧密度方面起着关键作用. EMT的发生涉及多个信号转导通路, 主要通路有TGF-β/Smad通路、Wnt/β-catenin通路、PI3K/AKT通路、Src通路及整合素通路等[13-15].
1978年, de Larco等[16]从培养小鼠肉瘤病毒细胞株的培养基中鉴定出肉瘤生长因子(sarcoma growth factor, SGF), 并且发现SGF具有细胞转化的特性, 因此称其为转化生长因子. TGF家族数目庞大, 他包括9个亚族共27类因子, 其中TGF-β是非常重要的亚类之一. TGF-β1是目前公认的EMT诱导剂[17], 他可以单独诱发并完成整个EMT的过程, 从而导致纤维化的发生发展, 因此被认为是目前最重要的致肝纤维化的细胞因子之一. TGF-β分子主要通过β-整合素信号传导通路诱导Smad分子依赖的细胞转录过程的发生, SMADS蛋白共有8种, 根据功能的不同可分为3大类: (1)受体调节型SMAD(R-SMAD): Smad1、Smad2、Smad3、Smad5、Smad8; (2)通用型SMAD(CO-SMAD): Smad4; (3)抑制型SMAD(I-SMAD): Smad6、Smad7[18,19]. 在这3类中, TGF-β R1直接磷酸化激活的是R-SMAD, 转导TGF-β信号的是Smad2、Smad3, 转导骨形态发生蛋白信号的是Smad1、Smad2、Smad5、Smad8. 吴雄健等[20]研究TGF-β1-Smad3-ILK信号转导通路与大鼠肝纤维化的关系, 发现ILK和TGF-β1-Smad3的表达可能与大鼠肝纤维化有联系. 李星霞等[21]研究木犀草素抑制肝纤维化进程中肝细胞上皮间质转化的作用, 发现TGF-β1、Vimentin表达减弱, E-cadherin表达增强, 认为木犀草素具有明显抗肝纤维化的作用, 其机制可能与木犀草素抑制肝细胞上皮间质转化作用有关. 胡代曦等[22]将空载体Ad-GFP以及表达Wnt3的腺病毒Ad-GFP-Wnt3转到小鼠肝前体细胞内, 发现其间质标志物Vimentin、N-cadherin和Twist表达上调, 说明Wnt3可以使小鼠肝前体细胞发生EMT, 认为其可能参与了肝纤维化的发生、发展. Yue等[23]发现肝细胞核因子4α(hepatocyte nuclear factor 4 alpha, HNF4α)可以抑制TGF-β诱导的肝星状细胞及肝细胞的EMT, 可以减轻大鼠的肝纤维化. Kaimori等[24]发现, 运用TGF-β刺激新鲜分离的肝星状细胞和肝祖细胞, 能够使EMT相关指标波形蛋白和1型胶原蛋白的表达上调而E-cadherin的表达下调.
导师孙桂芝主任医师基于多年诊治肝癌并肝纤维化、肝硬化患者的经验, 研制出经验方"桃红芪术软肝煎", 桃红芪术软肝煎由生黄芪、炒白术、太子参、桃仁、莪术等药物组成, 具有"益气活血, 软坚散结, 通络消积"之功, 孙桂芝认为肝癌的治疗重在"防", 包括"未病先防"和"既病防变"两个方面, "未病先防"即防止肝硬化向肝癌进展; "既病防变"即防治肝癌复发转移. 肝癌起病隐匿, 一经发现多已经是晚期, 肝硬化是肝癌最主要的独立危险因素. 因此, 如果能够有效地逆转肝纤维化, 防止其向肝硬化进展, 那么就有可能减少并控制肝癌的发生.
近年来研究[25]证实, 在人体许多器官中存在着成体干细胞, 而且这些干细胞在组织损伤修复和再生中起着极为重要的作用. 干细胞是一类具有自我更新和多向分化增殖潜能的原始细胞, 研究显示[26]肝损伤过程中, 干细胞参与了肝细胞再生和肝损伤修复的过程, 来源于骨髓、胚胎等的干细胞也具有向肝细胞分化的潜能, 因此从干细胞的角度探讨抗肝纤维化的途径具有可行性和重要性.
本研究选择低分化的HepG2作为肝脏干细胞的体外细胞模型, 加入重组TGF-β蛋白诱导, 作为肝纤维化体外模型[27], HepG2细胞是低分化的肝细胞, 具备已向肝细胞方向定向的肝脏干细胞的特点. 因此, 将其作为肝脏干细胞的模型, 在不同诱导环境下, 观察其向成纤维细胞分化的情况, 从而模拟肝纤维化发生的过程.
AFP是反映肝细胞增殖分化良好的指标之一[28-30], 是不成熟肝细胞合成分泌的一种蛋白质, 在细胞增殖分化的时期合成量多, 而在细胞分化成熟的时期合成量少. 本研究发现诱导组AFP诱导第3天浓度明显降低, 差异具有统计学意义(P<0.05), 说明低分化的肝细胞逐渐分化成熟, 加药24 h后浓度继续降低, 并且与诱导前相比具有统计学意义(P<0.05), 此外, 加药24 h后浓度与诱导第3天浓度也具有显著性差异(P<0.05), 说明桃红芪术软肝煎可以降低AFP的表达.
ALT第3天浓度较诱导前明显升高, 具有统计学意义(P<0.05), 加药24 h后浓度较诱导第3天下降, 并且差异具有统计学意义(P<0.05). AST第3天浓度较诱导前明显升高, 差异具有统计学意义(P<0.05), 加药24 h后浓度较诱导第3天下降, 并且差异具有统计学意义(P<0.05). 说明诱导后肝细胞向成纤维细胞方向分化, 并且开始分泌较高水平的ALT、AST; 加药24 h后, 模型组及用药组的ALT水平均高于空白组, 差异具有统计学意义(P<0.05); 用药干预后, 用药组ALT水平均低于模型组, 差异具有统计学意义(P<0.05), THQL及TRQM的ALT水平均低于FZHY和QSXJ, 差异具有统计学意义(P<0.05). 模型组及用药组的ALT水平均高于空白组, 差异具有统计学意义(P<0.05); 用药干预后, 用药组AST水平均低于模型组, 差异具有统计学意义(P<0.05), THQM及THQH的AST水平均低于FZHY和QSXJ, 差异具有统计学意义(P<0.05), 说明桃红芪术软肝煎可以降低ALT、AST的表达水平.
免疫荧光和Western blot检测发现THQL组、THQM组、THQH组可以上调E-cadherin表达水平, 降低Smad2、TGF-β R1、Vimentin的表达水平, 说明桃红芪术软肝煎可以从TGF-β/Smad信号通路通过逆转EMT防治肝纤维化进展, 并且较扶正化瘀胶囊和秋水仙碱具有较好的疗效.
我国是乙型肝炎大国, 同时肝癌发病率持续升高, 死亡率居第3位, 研究发现肝纤维化甚至早期肝硬化是可以通过抑制纤维化反应来逆转的, 因此, 开展逆转肝纤维化及早期肝硬化的研究, 具有防止其向终末期肝硬化甚至肝癌进展的重大意义. 本研究主要观察孙桂芝教授的经验方-桃红芪术软肝煎通过作用于转化生长因子-β(transforming growth factor beta, TGF-β)/Smad信号通路逆转上皮-间充质细胞转化(epithelial-mesenchymal transition, EMT)从而抗肝纤维化的作用研究.
鲁玉辉, 副教授, 福建中医药大学中医学院
研究发现各种创伤和TGF-β引起的EMT是导致肝纤维化的重要因素, 同时EMT也是目前肝纤维化领域研究热点; 如何改善肝纤维化的炎性微环境是目前亟待研究的问题.
李星霞等研究发现木犀草素抗肝纤维化的作用可能与其抑制肝细胞EMT的作用相关, 而更明确的作用机制有待进一步深入研究. 陈少隆等发现随着肝纤维化的进展EMT相关指标的表达逐渐增强, 给予BMP-7治疗后可以抑制EMT的发生.
本文从桃红芪术软肝煎对于体外肝纤维化细胞模型上皮-间充质转化从TGF-β/Smad信号通路调节从而抗肝纤维化的作用进行研究探讨, 具有创新性及科学性.
本文章对于孙桂芝教授的经验方-桃红芪术软肝煎进行抑制肝纤维化的基础实验研究, 具有一定的研究前景及临床意义.
EMT在肝纤维化形成中起着重要作用, TGF-β是最为重要的诱导分子, 本研究从TGF-β/Smad信号通路逆转上皮-间充质细胞转化探讨经验方桃红芪术软肝煎抗肝纤维化的作用机制, 研究方法和技术有一定的科学性和创新性, 实验对照设计较为合理, 实验证据充足, 科学结论较明确.
编辑: 郭鹏 电编: 都珍珍
| 1. | Anthony B, Allen JT, Li YS, McManus DP. Hepatic stellate cells and parasite-induced liver fibrosis. Parasit Vectors. 2010;3:60. [PubMed] [DOI] |
| 2. | Pellicoro A, Ramachandran P, Iredale JP Reversibility of liver fibrosis. Fibrogenesis Tissue Repair. 2012;5:S26. [PubMed] [DOI] |
| 3. | Schiff ER, Lee SS, Chao YC, Kew Yoon S, Bessone F, Wu SS, Kryczka W, Lurie Y, Gadano A, Kitis G. Long-term treatment with entecavir induces reversal of advanced fibrosis or cirrhosis in patients with chronic hepatitis B. Clin Gastroenterol Hepatol. 2011;9:274-276. [PubMed] [DOI] |
| 4. | Chang TT, Liaw YF, Wu SS, Schiff E, Han KH, Lai CL, Safadi R, Lee SS, Halota W, Goodman Z. Long-term entecavir therapy results in the reversal of fibrosis/cirrhosis and continued histological improvement in patients with chronic hepatitis B. Hepatology. 2010;52:886-893. [PubMed] [DOI] |
| 5. | Greenburg G, Hay ED. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells. J Cell Biol. 1982;95:333-339. [PubMed] |
| 6. | 邹 莎琳, 凌 光辉, 夏 运成, 袁 曙光, 彭 佑铭, 孙 林, 刘 伏友. EMT在腹膜纤维化中的作用及意义. 中国中西医结合肾病杂志. 2009;10:645-648. |
| 7. | Bi WR, Yang CQ, Shi Q. Transforming growth factor-β1 induced epithelial-mesenchymal transition in hepatic fibrosis. Hepatogastroenterology. 2012;59:1960-1963. [PubMed] [DOI] |
| 10. | 胡 彦建, 韩 明子, 胡 彦华. 上皮间质转化在原发性肝癌侵袭转移中的作用. 胃肠病学和肝病学杂志. 2014;23:117-120. |
| 11. | Nightingale J, Patel S, Suzuki N, Buxton R, Takagi KI, Suzuki J, Sumi Y, Imaizumi A, Mason RM, Zhang Z. Oncostatin M, a cytokine released by activated mononuclear cells, induces epithelial cell-myofibroblast transdifferentiation via Jak/Stat pathway activation. J Am Soc Nephrol. 2004;15:21-32. [PubMed] [DOI] |
| 12. | Vleminckx K, Kemler R. Cadherins and tissue formation: integrating adhesion and signaling. Bioessays. 1999;21:211-220. [PubMed] [DOI] |
| 15. | 成 志云, 彭 俊纯, 吕 颖慧. 上皮-间充质转化对肝纤维化作用的研究进展. 中国临床药理学与治疗学. 2013;18:928-936. |
| 16. | de Larco JE, Todaro GJ. Growth factors from murine sarcoma virus-transformed cells. Proc Natl Acad Sci U S A. 1978;75:4001-4005. [PubMed] |
| 17. | Roberts AB, Tian F, Byfield SD, Stuelten C, Ooshima A, Saika S, Flanders KC. Smad3 is key to TGF-beta-mediated epithelial-to-mesenchymal transition, fibrosis, tumor suppression and metastasis. Cytokine Growth Factor Rev. 2006;17:19-27. [PubMed] [DOI] |
| 23. | Yue HY, Yin C, Hou JL, Zeng X, Chen YX, Zhong W, Hu PF, Deng X, Tan YX, Zhang JP. Hepatocyte nuclear factor 4alpha attenuates hepatic fibrosis in rats. Gut. 2010;59:236-246. [PubMed] [DOI] |
| 24. | Kaimori A, Potter JJ, Choti M, Ding Z, Mezey E, Koteish AA. Histone deacetylase inhibition suppresses the transforming growth factor beta1-induced epithelial-to-mesenchymal transition in hepatocytes. Hepatology. 2010;52:1033-1045. [PubMed] [DOI] |
| 25. | Forbes S, Vig P, Poulsom R, Thomas H, Alison M. Hepatic stem cells. J Pathol. 2002;197:510-518. [PubMed] [DOI] |
| 27. | Wang QL, Yuan JL, Tao YY, Zhang Y, Liu P, Liu CH. Fuzheng Huayu recipe and vitamin E reverse renal interstitial fibrosis through counteracting TGF-beta1-induced epithelial-to-mesenchymal transition. J Ethnopharmacol. 2010;127:631-640. [PubMed] [DOI] |
| 28. | 车 媛梅, 张 一, 汪 泱. 人骨髓间充质干细胞向肝系细胞分化的实验研究. 国际流行病学传染病学杂志. 2006;33:150-156. |